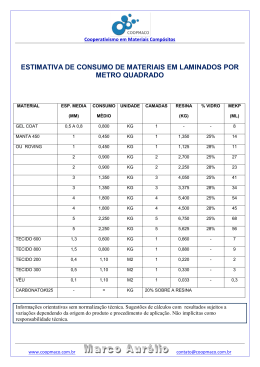
4º Q22 Esta prova contém 05 M A 23/10/08 questões. INSTRUÇÕES: Verifique se sua prova está completa. Preencha corretamente todos os dados solicitados no cabeçalho. Resoluções e respostas somente a tinta, azul ou preta. Utilize os espaços determinados para responder as perguntas, não ultrapassando seus limites. Evite rasuras e o uso de corretivos. Questões com rasuras ou corretivo não serão revisadas. Resoluções e respostas que estiverem a lápis não serão corrigidas. Boa prova! 01. [2,0 pontos] Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions. Assim, por exemplo, para o sal C+A–, dissolvido na água, a troca de cátions e ânions, com os íons da resina, pode ser representada por: Resina tipo I — Removedora de cátions Resina tipo II — Removedora de ânions No tratamento da água com as resinas de troca iônica, a água atravessa colunas de vidro ou plástico, preenchidas com a resina sob a forma de pequenas esferas. O líquido que sai da coluna é chamado de eluído. Considere a seguinte experiência, em que água, contendo cloreto de sódio e sulfato de cobre (II) dissolvidos, atravessa uma coluna com resina do tipo I. A seguir, o eluído, assim obtido, atravessa outra coluna, desta vez preenchida com resina do tipo II. Supondo que ambas as resinas tenham sido totalmente eficientes, indique: a) os íons presentes no eluído da coluna com resina do tipo I. (1,0 ponto) b) qual deve ser o pH do eluído da coluna com resina do tipo II (maior, menor ou igual a 7). Justifique. (1,0 ponto) 02. [2,0 pontos] Em água, o aminoácido alanina pode ser protonado, formando um cátion que será designado por ala+; pode ceder próton, formando um ânion designado por ala–. Dessa forma, os seguintes equilíbrios podem ser escritos: ala + H3O+ ala + H2O H2O + ala+ H3O+ + ala– A concentração relativa dessas espécies depende do pH da solução, como mostrado no gráfico. Quando [ala] = 0,08mol L–1, [ala+] = 0,02mol L–1 e [ala–] for desprezível, qual será a concentração hidrogeniônica na solução, em mol.L–1, aproximadamente? Justifique sua resposta. 03. [2,0 pontos] Abaixo temos um gráfico de auto-ionização da água: Um estudante mediu o pH da água recém-destilada, isenta de CO2 e a 50°C, encontrando o valor 6,6. Desconfiado de que o aparelho de medida estivesse com defeito, pois esperava o valor 7,0, consultou um colega que fez as seguintes afirmações: I. O seu valor (6,6) pode estar correto, pois 7,0 é o pH da água pura, porém a 25°C. II. A aplicação do Princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+. III. Na água, o pH é tanto menor quanto maior a concentração de H+. As afirmações do colega estão corretas ou erradas? Justifique cada uma delas. 04. [2,0 pontos] Considere uma solução aquosa diluída de dicromato de potássio, a 25°C. Dentre os equilíbrios que estão presentes nessa solução, destacam-se: Cr2O72- + H2O Íon dicromato 2 HCrO4- Constantes de Equilíbrio (25ºC) ..................... K1 = 2,0 x 10-2 HCrO4- H+ + CrO42- ................ Íon cromato K2 = 7,1 x 10-7 Cr2O72- + H2O 2 H+ + 2 CrO42- .......... K3 = ? H2O H+ + OH- ................... Kw = 1,0 x 10-14 a) Calcule o valor da constante de equilíbrio K3. (1,0 ponto) b) Essa solução de dicromato foi neutralizada. Para a solução neutra, qual é o valor numérico da relação [CrO42–]2/[Cr2O72–]? Mostre como obteve esse valor. (1,0 ponto) 05. [2,0 pontos] Forneça os dados solicitados na tabela abaixo. Considere soluções a 25ºC e Kw = 1x10-14. pH pOH [H+] mol/L [OH-] mol/L Solução 3 10-10 Ácida
Baixar