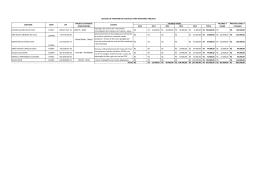
RONALDO BIONDO ENGENHARIA GENÉTICA DE Cupriavidus metallidurans CH34 PARA A BIORREMEDIAÇÃO DE EFLUENTES CONTENDO METAIS PESADOS RONALDO BIONDO ENGENHARIA GENÉTICA DE Cupriavidus metallidurans CH34 PARA A BIORREMEDIAÇÃO DE EFLUENTES CONTENDO METAIS PESADOS Tese apresentada ao Programa de Pósgraduação Interunidades em Biotecnologia EP/FMVZ/IPT/IB/ICB/Butantan da Universidade de São Paulo para obtenção do título de Doutor em Biotecnologia. São Paulo 2008 RONALDO BIONDO ENGENHARIA GENÉTICA DE Cupriavidus metallidurans CH34 PARA A BIORREMEDIAÇÃO DE EFLUENTES CONTENDO METAIS PESADOS Tese apresentada ao Programa de Pósgraduação Interunidades em Biotecnologia EP/FMVZ/IPT/IB/ICB/Butantan da Universidade de São Paulo para obtenção do título de Doutor em Biotecnologia. Área de Concentração: Biotecnologia Orientadora: Profa Dra Ana Clara G. Schenberg Co-orientadora: Profa Dra Elisabete José Vicente São Paulo 2008 DADOS DE CATALOGAÇÃO NA PUBLICAÇÃO (CIP) Serviço de Biblioteca e Informação Biomédica do Instituto de Ciências Biomédicas da Universidade de São Paulo reprodução não autorizada pelo autor Biondo, Ronaldo. Engenharia genética de Cupriavidus metallidurans CH34 para biorremediação de efluentes contendo metais pesados / Ronaldo Biondo. -- São Paulo, 2008. Orientadora: Ana Clara Guerrini Schenberg. Tese (Doutorado) – Universidade de São Paulo. Instituto de Ciências Biomédicas. Programa de Pós-Graduação Interunidades em Biotecnologia EP/FMVZ/IPT/IB/ICB/Butantan. Área de concentração: Biotecnologia. Linha de pesquisa: Genética de microrganismos e Biorremediação. Versão do título para o inglês: Genetic engineering of Cupriavidus metallidurans CH34 for bioremediation of heavy metals in wastewater. Descritores: 1. Engenharia genética 2. Efluentes 3. Metais pesados 4. Cupriavidus metallidurans CH34 I. Schenberg, Ana Clara Guerrini II.Universidade de São Paulo. Instituto de Ciências Biomédicas. Programa de Pós-Graduação em Biotecnologia. III. Título. ICB/SBIB205/2007 UNIVERSIDADE DE SÃO PAULO Programa de Pós-Graduação Interunidades em Biotecnologia Universidade de São Paulo, Instituto Butantan, Instituto de Pesquisas Tecnológicas _____________________________________________________________________________________________________ Candidato: Ronaldo Biondo Título da Tese: Engenharia genética de Cupriavidus metallidurans CH34 para a biorremediação de efluentes contendo metais pesados. Orientadora: Ana Clara Guerrini Schenberg A Comissão Julgadora dos trabalhos de Defesa da Tese de Doutorado, em sessão pública realizada a ................./................./................., considerou ( ) Aprovado ( ) Reprovado Examinador(a): Assinatura: .................................................................................... Nome: ............................................................................................ Instituição: ..................................................................................... Examinador(a): Assinatura: .................................................................................... Nome: ............................................................................................ Instituição: ..................................................................................... Examinador(a): Assinatura: .................................................................................... Nome: ............................................................................................ Instituição: ..................................................................................... Examinador(a): Assinatura: .................................................................................... Nome: ............................................................................................ Instituição: ..................................................................................... Presidente: Assinatura: .................................................................................... Nome: ............................................................................................ Instituição: ..................................................................................... Certificado da Comissão de Ética À Maria de Nazaré, Mãe Santíssima Pelo exemplo de sublime humildade e devoção, dedico honrosamente! AGRADECIMENTOS A Deus pela misericórdia; À Universidade de São Paulo pela oportunidade do exercício científico; À Companhia Vale do Rio Doce por financiar e incentivar a realização desse trabalho; À minha esposa Silvia que com companheirismo e luta passou por todos os momentos da nossa vida com honra e dignidade; Às professoras Dra Ana Clara Schenberg e Dra Elisabete José Vicente pela acolhida, orientação e confiança; À minha mãe Eunice pela luta da vida; Aos meus irmãos Reinaldo e Lige pelo apoio; Ao Dr. Victor de Lorenzo e ao Dr Luiz Angel Fernández, ambos do Centro Nacional de Biotecnologia de Madri, pela colaboração essencial nesse trabalho; Ao Prof. Dr. Robert Ivan Schumacker e à Adriana Matsuku, ambos do Instituto de Química da Universidade de São Paulo, pela colaboração nos experimentos de citometria de fluxo e análise dos dados; Ao Dr. Jorge Eduardo de Souza Sarkis pelas análises de metais pesados por espectrometria de plasma; À Profª Drª Marta Maria Antoniazzi e ao técnico Alexsander Seixas de Souza, ambos do Laboratório de Biologia Celular do Instituto Butantan, pela colaboração com o experimento de Microscopia Eletrônica; À Dra. Gabriela Ribeiro dos Santos pela colaboração na correção do texto e participação neste trabalho; À Dra. Andréa Balan e a doutoranda Cristiane de Souza pela colaboração nas análises de expressão protéica; Aos colegas do Laboratório de Genética de Microrganismos: Andréia, Claudionor, Cleide, Jéssica, Kazui, Maria Helena, Normandia, Oeber e Tatiana pelos momentos de descontração e companheirismo; Aos mestres da Universidade de São Paulo que ensinaram com competência e propriedade; Aos colegas de pós-graduação que são companheiros da construção de uma nova geração de pensadores e; Aos amigos que me amparam na jornada da vida. "O que hoje é provado não foi outrora mais do que imaginado." William Blake* * * BLAKE, William. O casamento do céu e do inferno. Trad. José Antônio Arantes. São Paulo: Iluminuras, 1987. RESUMO BIONDO, R. Engenharia genética de Cupriavidus metallidurans CH34 para biorremediação de efluentes contendo metais pesados. 2007. Tese (Doutorado em Biotecnologia) – Instituto de Ciências Biomédicas - Interunidades em Biotecnologia, Universidade de São Paulo, São Paulo, 2007. Este trabalho descreve a ancoragem de uma proteína sintética, quelante de metais, na superfície externa da bactéria Cupriavidus metallidurans CH34. Esta bactéria é altamente resistente e adaptada a ambientes contendo metais pesados e, por esse motivo, é considerada um agente de interesse em biorremediação. No presente trabalho, o gene da fitoquelatina sintética EC20sp, com estrutura análoga à fitoquelatina natural (Glu-Cis)nGli com n=20, foi sintetizado in vitro e fusionado ao βdomínio do sistema de secreção da protease da imunoglobulina A (IgA) de Neisseria gonorrhoeae, resultando numa proteína híbrida que foi capaz de se transportar à membrana externa bacteriana com sucesso. A ancoragem e a funcionalidade da proteína EC20sp-β-domínio foi demonstrada inicialmente em E. coli sob o controle do promotor plac. Em C. metallidurans CH34, o cassete codificante da proteína EC20sp-β-domínio foi colocado sob o comando de um novo promotor heterólogo que, por sua vez, promoveu forte expressão basal, potencializada por íons metálicos nesta bactéria. A linhagem recombinante, C. metallidurans/pCM2, apresentou capacidade de imobilizar Cd+2, Co+2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2 e Zn+2 do meio externo, em níveis significativamente superiores aos apresentados pela linhagem selvagem. Palavras-chave: Engenharia genética. Cupriavidus metallidurans Biorremediação. Efluentes. Metais pesados. Fitoquelatina sintética. CH34. ABSTRACT BIONDO, R. Genetic engineering of Cupriavidus metallidurans CH34 for bioremediation of heavy metals in wastewater. 2007. Thesis (Biotechnology) Instituto de Ciências Biomédicas - Interunidades em Biotecnologia, Universidade de São Paulo, São Paulo, 2007. This work describes the targeting of a synthetic metal-chelating protein to the cell surface of the heavy metal resistant Cupriavidus metallidurans CH34 bacterial strain. This bacterium is adapted to thrive in soils highly polluted with metal ions and, thus, has been considered a suitable candidate for bioremediation. For this purpose, an analog gene of the natural phytochelatin (Glu-Cys)nGly with n=20, EC20sp, was synthesized in vitro and fused to the autotransporter β-domain coding sequence of the IgA protease of Neisseria gonorrhoeae, which successfully targeted the hybrid protein towards the bacterial outer membrane. The translocation, surface display, and functionality of the EC20sp-β-domain protein were initially demonstrated in Escherichia coli upon insertion of the fused protein under control of the plac promoter. As for the C. metallidurans CH34 strain, the EC20sp-β-domain gene fusion was placed under the control of a new heterologous promoter which allowed strong levels of basal expression, that were even stronger in the presence of metal ions. The recombinant strain, C. metallidurans/pCM2, proved to have significantly enhanced ability for immobilizing Cd+2, Co+2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2 and Zn+2 ions from the external media as compared to the wild type. Key words: Genetic engineering. Cupriavidus metallidurans CH34. Bioremediation. Wastewater. Heavy metals. Synthetic phytochelatin. ABREVIATURAS Ag+ - prata ArsB – sistema de efluxo de arsenito As+3 - arsênio AsO4-3 - arsenito ATCC - American Type Culture Collection Au+3 - ouro Bi+3 - bismuto Cd+2 - cádmio CDF -facilitador de difusão de cátion CHR - sistema de efluxo de cromato chr - operon de resistência a cromato cnr - operon de resistência a níquel e cobalto C. metallidurans CH34 - Cupriavidus metallidurans CH34 Co+2 - cobalto cop - operon de resistência a cobre CrO4-2 - cromato ctxB - domínio B da toxina do cólera Cu+2 - cobre czc - operon de resistência a cádmio, zinco e cobalto DOE-USA - Departamento de Energia dos Estados Unidos DSMZ - Deutsche Sammlung Von Mikroorganismen und Zellkulturen EC - Fitoquelatina sintética EC20sp – Gene da fitoquelatina sintética com 20 resíduos de cisteína E. coli - Escherichia coli E-tag - epítopo Fe+2 - ferro Gd+3 - gadolínio GSH - glutationa Hg+2 - mercúrio HoxN - transporte específico de níquel IgA protease - protease da imunoglobulina A IPTG - isopropiltiogalactosídeo IS - elemento transponível Klenow - fragmento Klenow da DNA Polimerase I mer - operon de resistência a mercúrio MFS - superfamília de facilitadores de difusão de cátions MIT - sistema de transporte de magnésio Mn+2 - manganês Mo+2 - molibdênio MT - Metalotioneína NCBI - National Center for Biotechnology Information N. gonorrhoeae - Neisseria gonorrhoeae MS11 N. meningitidis - Neisseria meningitidis Ni+2 - níquel ONU - Organização das Nações Unidas PC - Fitoquelatina natural Pb+2 - chumbo P. putida - Pseudomonas putida pbr - operon de resistência a chumbo PIT - transportador de fosfato inorgânico pMOL28 - plasmídeo natural de C. metallidurans CH34 pMOL30 - plasmídeo natural de C. metallidurans CH34 RND - resistência, nodulação e divisão celular S. typhimurium - Salmonella typhimurium Sb+3 - antimônio Se0 - selênio metálico SeO4-3 - selenito sil - operon de resistência a prata SO4-2 - sulfato SOD - superóxido dismutase Tl+1 - tálio U+2 - urânio V+2 - vanádio X-Gal - 5-bromo-4-cloro-3-indol-β-D-galactopiranosídeo W+2 - tungstênio Zn+2 - zinco LISTA DE TABELAS Tabela 1: Íons de metais pesados, suas principais fontes poluidoras, efeitos no homem e potabilidade..................................................................................................................................... 27 Tabela 2: Principais classes de proteínas de transporte envolvidas na homeostase de metais pesados em C. metallidurans CH34............................................................................................... 33 Tabela 3: Linhagens bacterianas e plasmídeos utilizados neste trabalho..................................... 61 Tabela 4: Iniciadores de PCR utilizados nesse trabalho................................................................ 63 Tabela 5: Concentrações dos antibióticos utilizados para avaliação da MIC de C. metallidurans CH34.................................................................................................................... 70 Tabela 6: Resistência das linhagens de C. metallidurans CH34 provenientes das coleções ATCC e DSMZ frente a antibióticos................................................................................................ 87 Tabela 7: Comparação das resistências de C. metallidurans CH34 com os valores máximos de íons em efluentes, segundo o CONAMA........................................................................................ 88 Tabela 8: Proteínas escolhidas por análise proteômica por apresentarem forte intensidade na análise proteômica de C. metallidurans CH34................................................................................ 99 Tabela 9: Análise da clonagem dos diferentes promotores no vetor pCR-TOPO.......................... 100 Tabela 10: Análise da clonagem dos diferentes promotores no vetor pBBEGFP.......................... 102 Tabela 11: Mínima concentração Inibitória de C.metallidurans CH34 frente a íons de metais pesados descrita na literatura desde o seu isolamento.................................................................. 129 Tabela 12: Comparação da resistência de C. metallidurans CH34 a metais pesados com outros microrganismos isolados de ambientes contendo metais pesados................................................. 130 Tabela 13: Comparação da capacidade biorremediadora das linhagens recombinantes mostradas na literatura................................................................................................................... 145 LISTA DE FIGURAS Figura 1: Resumo das interferências mais freqüentes de íons metais tóxicos na célula microbiana....................................................................................................................................... 30 Figura 2: Desenho esquemático mostrando a célula bacteriana Gram-negativa e as diversas famílias de proteínas envolvidas no transporte de metais pesados................................................ 31 Figura 3: Inventário dos genes de resistência a metais pesados presentes nos quatro replicons de C. metallidurans CH34............................................................................................................... 37 Figura 4: Representação esquemática do operon czc de C. metallidurans CH34......................... 38 +2 +2 Figura 5: Representação esquemática dos sistemas de resistência a Zn e Cd em C. metallidurans CH34.................................................................................................................... 41 Figura 6: Representação esquemática do operon cnr de C. metallidurans CH34......................... 41 +2 Figura 7: Representação esquemática dos sistemas de resistência a Ni em C. metallidurans CH34..................................................................................................................... 43 +2 em Figura 8: Representação esquemática dos sistemas de resistência a Co C. metallidurans CH34..................................................................................................................... 44 Figura 9: Representação esquemática do operon chr do pMOL28 de C. metallidurans CH34...... 45 -2 Figura 10: Representação esquemática dos sistemas de resistência a CrO4 em C. metallidurans CH34.................................................................................................................... 46 Figura 11: Representação esquemática do operon pbr do pMOL30 de C. metallidurans CH34... 47 +2 Figura 12: Representação esquemática do sistema de resistência a Pb em C. metallidurans CH34.................................................................................................................... 48 Figura 13: Representação esquemática do operon mer do pMOL30 e pMOL28 de C. metallidurans CH34.................................................................................................................... 49 +2 Figura 14: Representação esquemática do sistema de resistência a Hg em C. metallidurans CH34.................................................................................................................... 50 Figura 15: Representação esquemática do operon cop do pMOL30 de C. metallidurans CH34... 51 +2 +1 Figura 16: Representação esquemática do sistema de resistência a Cu / Cu em C. metallidurans CH34.................................................................................................................... 52 Figura 17: A- Representação esquemática da secreção extracelular da IgA protease de N. gonorrhoeae MS11. B- Esquema representativo da construção genética visando a ancoragem da proteína CtxB utilizando o PS e β-domínio do sistema de secreção da IgA protease. C- Esquema representativo da ancoragem da proteína CtxB na membrana externa de Salmonella typhimurium.................................................................................................................. 56 Figura 18: A - Via biossintética da fitoquelatina natural (PC); B – Estrutura química da fitoquelatina sintética (EC)............................................................................................................... 58 Figura 19: Figura esquemática do plasmídeo pBBR1MCS............................................................ 64 Figura 20: Figura esquemática do plasmídeo pHEβ...................................................................... 65 Figura 21: Figura esquemática do plasmídeo pGEM-T Easy e do múltiplo sítio de clonagem...... 66 Figura 22: Figura esquemática do plasmídeo pCR2.1-TOPO e do múltiplo sítio de clonagem..... 67 Figura 23: Figura esquemática do plasmídeo pLG com o gene da EGFP clonado....................... 68 Figura 24: Figura esquemática do plasmídeo pBBEGFP............................................................... 68 Figura 25: Figura esquemática do plasmídeo pBB-panEGFP........................................................ 69 Figura 26: Curva de crescimento de C. metallidurans CH34 em meio TSM com diferentes pHs.. 88 Figura 27: Seqüência de nucleotídeos do sistema de secreção da IgA protease de N. gonorrhoeae presente no plasmídeo pHEβ................................................................................ 90 Figura 28: A - Gene sintético da fitoquelatina (EC20sp) construído por Bae et al. (2000) ladeados com sítios de BamH I e Hind III; B – Gene sintético EC20sp construído nesse trabalho com sítios EcoR V e Sal I................................................................................................................ 91 Figura 29: Perfil de migração de fragmentos de DNA após eletroforese em gel de agarose 0,7% corado com brometo de etídio. A- Gene sintético EC20sp amplificado por PCR; BPlasmídeo pGEMEC20sp digerido com EcoR V e Sal I.................................................................. 92 Figura 30: Esquema representativo da construção do plasmídeo pCM1....................................... 93 Figura 31: Perfil de migração de fragmentos de DNA da digestão do plasmídeo pCM1 após eletroforese em gel de agarose 0,7% corado com brometo de etídio............................................. 94 Figura 32: Seqüência de nucleotídeos e de aminoácidos da clonagem do gene EC20sp no plasmídeo pHEβ.............................................................................................................................. 95 Figura 33: Análise do perfil protéico por SDS-PAGE das linhagens de E. coli recombinantes...... 96 Figura 34: A - Western-blotting das diferentes frações das células após incubação com anticorpo anti-E-tag. B- Representação esquemática da ancoragem da EC20sp com a exposição do epítopo e da proteína EC20sp no meio externo........................................................ 96 Figura 35: Adsorção de íons cádmio pelas linhagens de E. coli utilizadas nesse trabalho, em +2 solução de água contendo 1 mM de Cd ....................................................................................... 97 Figura 36: Gel analítico 2-D de proteínas totais de C. metallidurans CH34 corado com coomassie........................................................................................................................................ 99 Figura 37: Perfil de migração de fragmentos de PCR dos promotores de C. metallidurans CH34 após eletroforese em gel de agarose 0,7% corado com brometo de etídio................................................................................................................................................ 100 Figura 38: Perfil de migração de fragmentos de DNA referentes aos promotores de C. metallidurans CH34 amplificados por PCR e clonados no vetor pCR2.1-TOPO após eletroforese em gel de agarose 0,7% corado com brometo de etídio............................................. 101 Figura 39: Esquema representativo da construção do plasmídeo pCMP1.................................... 102 Figura 40: Perfil de migração de fragmentos da digestão do plasmídeo pBBEGFP com os diferentes promotores após eletroforese em gel de agarose 1,2% corado com brometo de etídio................................................................................................................................................ 103 Figura 41: Perfil de fragmentos de DNA do promotor czcIp após eletroforese em gel de agarose 0,7% corado com brometo de etídio................................................................................................ 104 Figura 42: Esquema representativo da construção do plasmídeo pLEGFP................................... 105 Figura 43: Perfil de migração de fragmentos do plasmídeo pLEGFP digerido com VspI e XhoI após eletroforese em gel de agarose 0,7% corado com brometo de etídio.................................... 105 Figura 44: Visualização de células de C. metallidurans CH34 em microscópio de epifluorescência com aumento de 1000 vezes............................................................................... 106 Figura 45: A e C- gráficos de intensidade de fluorescência relativa após análise de 30000 eventos dos clones de C. metallidurans CH34/pBBEGFP (controle) e C. metallidurans CH34/pBB-panEGFP; B e D- distribuição celular característico de cada amostra, indicando apenas um tipo celular e E- gráfico em 3D comparando as amostras A e C quanto ao deslocamento de gráfico, indicando a intensidade de fluorescência.............................. 108 Figura 46: A: intensidade de fluorescência relativa medida através de citometria de fluxo em C. metallidurans CH34 carregando os diversos plasmídeos construídos nesse trabalho; B: intensidade de fluorescência relativa medida através de citometria de fluxo em E. coli carregando os diversos plasmídeos construídos nesse trabalho.................................................... 109 Figura 47: Perfil de migração de fragmentos do plasmídeo pTOPOANC digerido com NdeI e KpnI após eletroforese em gel de agarose 0,7% corado com brometo de etídio............................ 111 Figura 48: Esquema representativo da construção do plasmídeo pCM2....................................... 112 Figura 49: A: Plasmídeo pCM2 e tamanho dos fragmentos do cassete expressão-ancoragem da EC20sp; B: Perfil de migração de fragmentos da digestão do vetor pCM2 com diversas enzimas após eletroforese em gel de agarose 0,7% corado com brometo de etídio................................................................................................................................................ 113 Figura 50: Seqüência de nucleotídeos e de aminoácidos do plasmídeo pCM2............................. 114 Figura 51: Análise do perfil protéico por SDS-PAGE das linhagens de C. metallidurans recombinantes................................................................................................................................. 115 Figura 52: Western-blotting das diferentes frações das células de C. metallidurans após incubação com anticorpo anti-E-tag................................................................................................ 115 Figura 53: Porcentagem de cádmio residual em solução aquosa após incubação com as diferentes linhagens de C. metallidurans utilizadas nesse trabalho................................................ 116 Figura 54: Acúmulo de cádmio pelas linhagens de C.metallidurans utilizadas neste trabalho...... 117 Figura 55: Acúmulo de cobalto pelas linhagens de C.metallidurans utilizadas neste trabalho...... 118 Figura 56: Acúmulo de cobre pelas linhagens de C.metallidurans utilizadas neste trabalho......... 119 Figura 57: Acúmulo de mercúrio pelas linhagens de C.metallidurans utilizadas neste trabalho.... 119 Figura 58: Acúmulo de manganês pelas linhagens de C.metallidurans utilizadas neste trabalho. 120 Figura 59: Acúmulo de níquel pelas linhagens de C.metallidurans utilizadas neste trabalho........ 120 Figura 60: Acúmulo de zinco pelas linhagens de C.metallidurans utilizadas neste trabalho......... 121 Figura 61: Acúmulo de chumbo pelas linhagens de C.metallidurans utilizadas neste trabalho..... 122 Figura 62: Acúmulo de diferentes metais pela linhagem de C.metallidurans/pCM2 induzida........ 122 Figura 63: Acúmulo de metais pelas linhagens de C.metallidurans em soluções contendo múltiplos metais............................................................................................................................... 123 Figura 64: Eletromicrografia de transmissão de cortes histológicos de células de C. metallidurans CH34..................................................................................................................... 125 Figura 65: Curva de crescimento das linhagens de C. metallidurans CH34 em meio TSM. ......... 126 Figura 66: Estrutura do peptídeo sinal seqüenciado do plasmídeo pHEβ..................................... 131 Figura 67: Estrutura do epítopo E-tag seqüenciado do plasmídeo pHEβ...................................... 132 Figura 68: Comparação da seqüência do promotores utilizados nesse estudo............................. 139 SUMÁRIO 1 INTRODUÇÃO............................................................................................................................. 22 1.1 Relevância do projeto............................................................................................................. 22 2 REVISÃO BIBLIOGRÁFICA....................................................................................................... 24 2.1 Importância da água............................................................................................................... 24 2.2 Poluição das águas por metais pesados.............................................................................. 25 2.2.1 Metais pesados.................................................................................................................... 26 2.3 Tratamento de efluentes contendo metais pesados........................................................... 28 2.3.1 Fitorremediação................................................................................................................... 28 2.3.2 Biorremediação com microrganismos............................................................................... 29 2.4 Cupriavidus metallidurans CH34........................................................................................... 32 2.4.1 Genômica de C. metallidurans CH34................................................................................. 32 2.4.2 Metabolismo de C. metallidurans CH34............................................................................. 34 2.4.3 Mecanismos de resistência de C. metallidurans CH34.................................................... 35 2.4.4 Operon czc de C. metallidurans CH34............................................................................... 38 +2 +2 2.4.5 Resistência a cádmio (Cd ) e zinco (Zn ) em C. metallidurans CH34........................... 39 2.4.6 Operon cnr de C. metallidurans CH34............................................................................... 41 +2 2.4.7 Resistência a níquel (Ni ) em C. metallidurans CH34...................................................... +2 2.4.8 Resistência a cobalto (Co ) em C. metallidurans CH34.................................................. -2 2.4.9 Operon chr de resistência a cromato (CrO4 ) de C. metallidurans CH34....................... +2 2.4.10 Operon pbr de resistência a chumbo (Pb ) de C. metallidurans CH34........................ +2 2.4.11 Operon mer de resistência a mercúrio (Hg ) de C. metallidurans CH34..................... +2 +1 42 43 44 46 48 2.4.12 Operon cop de resistência a cobre (Cu /Cu ) de C. metallidurans CH34.................. 50 2.4.13 Outras resistências a metais pesados em C. metallidurans CH34............................... 53 2.5 Ancoragem de peptídeos em membranas de bactérias Gram-negativas.......................... 54 2.6 Peptídeos com afinidade a íons de metais pesados........................................................... 57 3 OBJETIVO................................................................................................................................... 59 4 MATERIAIS E MÉTODOS........................................................................................................... 61 4.1 Linhagens bacterianas e plasmídeos utilizados neste trabalho........................................ 61 4.2 Iniciadores de PCR utilizados nesse trabalho..................................................................... 63 4.3 Descrição dos Plasmídeos..................................................................................................... 64 4.3.1 pBBR1MCS........................................................................................................................... 64 4.3.2 pHEβ...................................................................................................................................... 64 ® 4.3.3 PGEM -T Easy System I...................................................................................................... ® ® 65 4.3.4 pCR 2.1-TOPO .................................................................................................................... 66 4.3.5 pLG........................................................................................................................................ 67 4.3.6 pBBEGFP.............................................................................................................................. 68 4.3.7 pBB-panEGFP...................................................................................................................... 69 4.4 Condições de cultivo das bactérias...................................................................................... 69 4.5 Resistência de C. metallidurans CH34 a antibióticos.......................................................... 70 4.6 Efeito do pH no crescimento de C. metallidurans CH34..................................................... 70 4.7 MIC de C. metallidurans CH34 frente a íons de metais pesados........................................ 71 4.8 Extração de DNA genômico de C. metallidurans CH34....................................................... 71 4.9 Extração e purificação de plasmídeos.................................................................................. 72 4.9.1 Máxi-preparação................................................................................................................... 72 4.9.2 Mini-preparação................................................................................................................... 73 4.10 Análise eletroforética de DNA em gel de agarose e purificação de fragmentos..................................................................................................................................... 73 4.11 Clivagem dos plasmídeos e fragmentos de DNA com enzimas de restrição................. 74 4.12 Preparação de células eletrocompetentes......................................................................... 74 4.13 Transformação de bactérias por eletroporação................................................................. 74 4.14 Construção do gene sintético da Fitoquelatina (EC20sp) sem o códon de terminação de síntese protéica........................................................................................................................ 75 4.15 Construção do cassete de ancoragem da EC20sp............................................................ 76 4.16 Análise da expressão do cassete de ancoragem da EC20sp........................................... 77 4.16.1 Caracterização do perfil protéico através de SDS-PAGE............................................... 77 4.16.2 Separação de membranas e Western-blotting................................................................ 78 4.16.3 Bioacúmulo de íons de metais pesados pelas linhagens expressando o cassete de ancoragem da EC20sp.................................................................................................................. 79 4.17 Amplificação e clonagem de regiões promotoras a partir do DNA total de C. metallidurans CH34.................................................................................................................. 80 4.18 Construção do plasmídeo pLEGFP..................................................................................... 81 4.19 Quantificação da expressão da proteína verde fluorescente em E. coli e C. metallidurans CH34 através de Citometria de Fluxo............................................................. 82 4.20 Construção do cassete de expressão-ancoragem da EC20sp......................................... 83 4.21 Análise das linhagens de C. metallidurans CH34 por Microscopia Eletrônica de Transmissão.................................................................................................................................. 84 5 RESULTADOS............................................................................................................................ 86 5.1 Caracterização fisiológica de C. metallidurans CH34......................................................... 86 5.1.1 Resistência a antibióticos................................................................................................... 86 5.1.2 Efeito do pH no crescimento de C. metallidurans CH34.................................................. 87 5.1.3 MIC de C. metallidurans CH34 frente a íons de metais pesados..................................... 88 5.2 Construção da bactéria C. metallidurans CH34 recombinante.......................................... 89 5.2.1 Seqϋenciamento do plasmídeo pHEβ................................................................................ 89 5.2.2 Construção do gene sintético da Fitoquelatina (EC20sp) sem o códon de terminação de síntese protéica................................................................................................... 91 5.2.3 Clonagem do gene EC20sp no plasmídeo pHEβ.............................................................. 92 5.3 Análise da expressão do cassete de ancoragem da EC20sp............................................. 95 5.3.1 Caracterização do perfil protéico através de SDS-PAGE e Western-blotting................ 95 +2 5.3.2 Bioacúmulo de íons Cd por E. coli com a proteína EC20sp ancorada na membrana externa............................................................................................................................................ 97 5.4 Escolha de promotores com expressão constitutiva em C. metallidurans CH34 para expressão do cassete de ancoragem da EC20sp...................................................................... 97 5.4.1 Obtenção de seqüências promotoras de C. metallidurans CH34 através de análise proteômica..................................................................................................................................... 98 5.4.2 Obtenção de seqüências promotoras conhecidas por expressar genes constitutivamente em C. metallidurans CH34............................................................................ 103 5.4.2.1 Obtenção do promotor czcIp........................................................................................... 103 5.4.2.2 Obtenção do promotor plac............................................................................................. 104 5.4.3 Obtenção do promotor pan de B. subtilis.......................................................................... 106 5.5 Análise da expressão de EGFP pelos diferentes promotores............................................ 106 5.6 Quantificação da expressão da proteína verde fluorescente através de citometria de fluxo................................................................................................................................................ 107 5.7 Construção do cassete de expressão-ancoragem da EC20sp........................................... 110 5.8 Análise da expressão do cassete de ancoragem da EC20sp em C. metallidurans CH34 114 5.8.1 Caracterização do perfil protéico através de SDS-PAGE e Western-blotting................ 114 5.8.2 Bioacúmulo de íons de metais pesados por C. metallidurans CH34 recombinante................................................................................................................................. 115 5.9 Caracterização das linhagens de C. metallidurans CH34 por Microscopia Eletrônica de Transmissão............................................................................................................................. 124 5.10 Avaliação do crescimento da linhagem C. metallidurans CH34 recombinante.............. 126 6 DISCUSSÃO................................................................................................................................ 127 6.1 Caracterização fisiológica de C. metallidurans CH34......................................................... 127 6.2 Construção da bactéria C. metallidurans CH34 recombinante.......................................... 131 6.2.1 Construção do cassete de ancoragem da EC20sp........................................................... 131 6.2.2 Análise da expressão do cassete de ancoragem da EC20sp.......................................... 133 6.2.3 Escolha de promotores com forte capacidade de expressão protéica em C. metallidurans CH34.................................................................................................................. 134 6.2.4 Análise da expressão de EGFP pelos diferentes promotores......................................... 135 6.2.5 Construção, análise do cassete de expressão-ancoragem da EC20sp em C. metallidurans CH34 e sua capacidade de otimizar a adsorção de metais pesados.......... 141 7 CONCLUSÕES............................................................................................................................ 152 8 CONSIDERAÇÕES FINAIS......................................................................................................... 153 REFERÊNCIAS BIBLIOGRÁFICAS............................................................................................... 155 ANEXO A – CONAMA – Das condições e padrões de lançamento de efluentes.................... 166 Introdução 22 1 INTRODUÇÃO Este trabalho faz parte de um projeto maior, que visa o desenvolvimento de novas estratégias microbiológicas para tratamento de efluentes contendo metais pesados, objeto de um convênio firmado entre a Vale (anteriormente Companhia Vale do Rio Doce) e o Centro de Pesquisas em Biotecnologia da Universidade de São Paulo. O presente subprojeto “Engenharia genética de Cupriavidus metallidurans CH34 para a biorremediação de efluentes contendo metais pesados” teve como principal objetivo a construção de uma bactéria recombinante com capacidade otimizada de biorremediação de metais, para ser utilizada em programas de tratamento de efluentes. A bactéria C. metallidurans CH34 foi escolhida, como material de partida, por possuir resistência natural a elevadas concentrações de diversos íons de metais pesados. Entretanto, o mecanismo de resistência de C. metallidurans consiste num sistema de efluxo dos cátions, que detoxifica o citoplasma da bactéria e não o ambiente e, portanto, não pode servir para a biorremediação. Assim, para que este microrganismo pudesse desenvolver plenamente o seu potencial biotecnológico, seria necessário submetê-lo a manipulações genéticas que lhe conferissem a capacidade de imobilizar íons de metais pesados na sua superfície celular. 1.1 Relevância do Projeto A água, como bem de consumo que tende a tornar-se escasso, tem papel fundamental na vida do homem e no equilíbrio da biodiversidade. Assim sendo, desenvolver metodologias para tratar efluentes contaminados é uma iniciativa indispensável para a sustentabilidade do planeta. A contaminação de efluentes por metais pesados é motivo de preocupação por promover severos distúrbios aos organismos e ecossistemas. A poluição do meio ambiente por metais tóxicos é decorrente, em sua maior parte, das atividades antropogênicas produtoras de resíduos que, via de regra, são descartados diretamente em ambientes aquáticos ou no solo, sem prévio tratamento, levando ao acúmulo de metais pesados e causando perdas econômicas, de biodiversidade, além de sérios riscos à saúde pública. Introdução 23 Portanto, a busca por processos remediadores que sejam economicamente viáveis e ecologicamente corretos tem se intensificado nos últimos anos e o uso de microrganismos para biorremediação se mostra vantajoso, principalmente pelos baixos custos, quando comparado às técnicas físico-químicas atualmente empregadas no tratamento de efluentes contendo metais. A proposta desse projeto foi de realizar a ancoragem de uma poderosa fitoquelatina quelante de metais, na membrana externa de C. metallidurans CH34, a fim de otimizar a sua capacidade de adsorver íons de metais pesados, com vistas à utilização desta bactéria para a biorremediação de efluentes de mineração. Revisão Bibliográfica 24 2 REVISÃO BIBLIOGRÁFICA 2.1 Importância da água “Há uma verdade fundamental que gostaria de enfatizar... o suprimento de água não cessa quando ela provém do poço da sabedoria humana”. Koichiro Matsuura (Diretor-Geral da UNESCO, Dia Mundial da água, 2000) “A água é o sangue do nosso planeta: ela é fundamental para a bioquímica de todos os organismos vivos” (SELBORNE, 2001). Popularmente existe uma falsa idéia de que os recursos hídricos são infinitos. Realmente, há muita água no planeta, mas apenas 3% dessa água é doce, dos quais 2% consistem de água congelada nas regiões polares e 1% distribuída desigualmente pela terra (MORAES; JORDÃO, 2002). A água é indispensável às atividades humanas, dentre as quais, o abastecimento doméstico e público, o uso agrícola e industrial e a produção de energia elétrica. Tais atividades, estreitamente associadas à elevação do nível de vida e ao crescimento populacional, passaram a exigir quantidades crescentes desse recurso natural. Se, por um lado, o desenvolvimento prescinde da disponibilidade de água, por outro lado, defronta-se com a limitação desse recurso, tornando-se relevante um planejamento racional de utilização e a sua integração na política de desenvolvimento econômico-social (VÖRÖSMARTY et al., 2000). O mundo tem testemunhado um crescimento demográfico sem precedentes; estima-se que a população mundial, que em 1999 era de 6 bilhões, chegue a 9,1 bilhões de pessoas em 2025, aumentando exponencialmente as projeções de demanda dos recursos hídricos (SELBORNE, 2001). Hoje, aproximadamente 74% da água doce é consumida pelo setor agrícola, 20% pela indústria e 6% pelo consumo doméstico. À medida que as populações e as atividades econômicas crescem, muitos países atingem rapidamente condições de escassez de água ou se defrontam com limites para o desenvolvimento. Ao mesmo tempo, crescem também os focos de deteriorização das águas pelo lançamento de esgotos, efluentes industriais e insumos agrícolas, que podem trazer graves conseqüências ambientais (MORAES; JORDÃO, 2002). O consumo da água é considerado seguro quando não causa prejuízo à saúde humana, estando livre de organismos patogênicos, assim como de substâncias potencialmente tóxicas. Estimativas da Organização das Nações Unidas Revisão Bibliográfica 25 (ONU) mostram que mais de 5 milhões de pessoas morrem anualmente com doenças causadas por água contaminada, incluindo 6000 crianças por dia; isto leva à ocupação de metade dos leitos hospitalares em todo o mundo (SELBORNE, 2001). Neste cenário, a necessidade de se tratar a água é premente e constitui uma grave questão de saúde pública, devido principalmente, à toxicidade dos compostos descartados, risco de acúmulo na cadeia alimentar e persistência na natureza (GAVRILESCU, 2004). 2.2 Poluição das águas por metais pesados Atividades industriais, de agricultura e esgotos domésticos são os principais responsáveis pela poluição do meio ambiente por metais tóxicos, mesmo levando-se em conta todos os outros tipos de contaminações juntas (NRIAGU; PACYNA, 1988). Além disso, os resíduos de metais pesados produzidos por esses segmentos têm sido indiscriminadamente descartados em corpos d`água ou dispostos no solo sem prévio tratamento (NIES, 1992). Exemplo disso são os sítios contaminados com metais pesados identificados pelo Departamento de Energia dos Estados Unidos (DOE-USA), com volume estimado de 200 milhões de metros cúbicos, dispostos sem tratamento em solos e efluentes, e com projeção de crescimento (PETERS, 1999). Especialmente preocupante é o fato de que, diferentemente de contaminantes orgânicos, que podem ser convertidos em derivados não-tóxicos por ação microbiana, os contaminantes metálicos persistem indefinidamente no meio ambiente. Na União Européia, a preocupação com os níveis de contaminação aliada à escassez de recursos hídricos forçou o aperfeiçoamento da legislação ambiental, limitando a descarga de contaminantes tóxicos de águas residuais, incluindo metais pesados, obrigando os diversos segmentos produtivos a aplicarem tecnologias de tratamento (REMOUDAKI et al., 2003). No Brasil, a legislação ambiental estabelece parâmetros físicos, químicos e microbiológicos de qualidade da água, a fim de regular o lançamento de efluentes Revisão Bibliográfica 26 em corpos receptores (Anexo A). No entanto, muitos cursos d’água desse país apresentam alto potencial mutagênico devido à presença de contaminantes tóxicos como metais pesados, descartados inadvertidamente (OHE et al., 2004). No âmbito global, não se tem o dimensionamento do total de descartes de metais pesados. No entanto, têm se verificado, cada vez mais, casos de perda de biodiversidade e contaminação de populações por metais pesados (LORENZO; KUENEN, 1999; ROANE; PEPPER, 2000a; ROUX et al., 2001). Além disso, atualmente, cresce assustadoramente o chamado “lixo tecnológico”, tais como televisores, celulares, pilhas e componentes de informática que acabam sendo descartados, como resultado da troca por modelos mais novos e sofisticados. O problema é que tais equipamentos contêm muitas substâncias perigosas e tóxicas, principalmente metais pesados, que, via de regra, atingem lençóis freáticos e solos, contaminando o ambiente e suscitando sérias preocupações sobre o manejo desta nova forma de lixo (BABU et al., 2007). 2.2.1 Metais pesados Várias definições de metais pesados podem ser encontradas na literatura; no entanto, há um consenso de que metais pesados sejam elementos químicos com densidade igual ou maior a 5 g/cm3 (NIES, 1999; PIVELI; KATO, 2005; ROANE; PEPPER, 2000a). Considerando-se essa definição, dos 92 elementos químicos de ocorrência natural, 21 são não metais, 16 são metais leves e o restante são metais pesados, dos quais, apenas 17 apresentam algum significado biológico para as células: ferro (Fe), molibdênio (Mo) e manganês (Mn) são importantes elementostraço com baixa toxicidade, enquanto zinco (Zn), níquel (Ni), cobre (Cu), vanádio (V), cobalto (Co), tungstênio (W) e crômio (Cr) são de moderada importância como elementos-traço, e apresentam toxicidade em concentrações pouco acima das fisiológicas. Por fim, arsênio (As), prata (Ag), antimônio (Sb), cádmio (Cd), mercúrio (Hg), chumbo (Pb) e urânio (U) devem ser considerados como elementos tóxicos (NIES, 1999). O potencial tóxico dos metais pesados ao organismo humano é diverso e está resumido na Tabela 1, que mostra as principais fontes poluidoras e os efeitos na saúde do homem. Devido à sua toxicidade e persistência na natureza, os níveis Revisão Bibliográfica 27 de metais pesados são controlados em efluentes, obrigando as fontes produtoras a tratar seus resíduos, o que abre perspectivas de desenvolvimento de novas tecnologias de tratamento. Tabela 1: Íons de metais pesados, principais fontes poluidoras, efeitos no homem e potabilidade*. Íon Principais Fontes Poluidoras Efeitos no homem Potabilidade Arsênio (As) Herbicidas, Inseticidas, Fungicidas, Mineração, Indústria de vidros, tintas e corantes. Câncer, Intoxicação e Morte (130 mg). 0,01 mg/L ** Efluentes industriais, Galvanoplastia, Produção de Pigmentos, Equipamentos eletrônicos, Lubrificantes, Acessórios fotográficos, Inseticidas e Combustíveis fósseis. Anemia, Retardamento do crescimento, Morte (9 gramas), Disfunção renal, Hipertensão, Arteriosclerose, Câncer e Doenças crônicas. 0,005 mg/L Chumbo (Pb) Efluentes industriais, Tabaco, Tintas, Tubulações, Metalurgia e Indústria de Eletrodeposição. Saturnismo, Tontura, Irritabilidade, Dor de cabeça, Perda de memória, Deficiências musculares, Inflamação gastrintestinal, Vômitos e Diarréias. 0,01 mg/L Cobalto (Co) Indústrias Química, Metalúrgica e de Óleo. Doenças pulmonares, Bócio, colapso cardíaco e hipotireoidismo. 0,05 mg/L Lesões no fígado e Intoxicação. 2,0 mg/L Efluentes industriais, Produção de alumínio e aço, Tintas, Pigmentos, Explosivos, Papel e Fotografia. Alergias, Câncer e Intoxicação. 0,05 mg/L Garimpos, Praguicidas, Produção de cloro, Desinfetantes, Pigmentos, Mineração, Esgotos, Produtos odontológicos, Farmacêuticos e Tintas. Morte (3-30 gramas), Vômitos, Dores abdominais, Diarréia, Osteoporose, Lesões cerebrais e renais, Alterações psicológicas e psicomotoras. 0,001mg/L Cádmio (Cd) Cobre (Cu) Crômio (Cr) Mercúrio (Pb) Níquel (Ni) Zinco (Zn) Cerâmica, Corrosão de tubulações, Esgotos domésticos, Algicidas, Fungicidas, Pesticidas, Mineração, Fundição e Refinamento de metais. Galvanoplastias, Mineração, Queima de combustíveis fósseis, Fundição de metal, Produção de ligas metálica e Fabricação de alimentos. Galvanoplastias, Mineração, Combustão de madeira, Incineração de resíduos, Esgotos domésticos e Produção de ferro e aço. Câncer, Dermatites, Alterações cardíacas e respiratórias. 0,025 mg/L Alterações respiratórias, gástricas e cardíacas. 5,0 mg/L *Baseado em Nies (1999) e Piveli e Kato (2005). **Ministério da Saúde - Portaria n. 518, de 25 de março de 2004. Revisão Bibliográfica 28 2.3 Tratamento de efluentes contendo metais pesados A busca por processos que utilizem “tecnologias limpas” vem crescendo nas últimas décadas devido, principalmente, ao aprimoramento de regras legislativas, que incentivam o desenvolvimento de procedimentos físico-químicos e biotecnológicos que contribuam para a minimização dos impactos causados pela liberação de metais pesados, uma vez que estes elementos contaminantes não são biodegradados na água ou solo. O tratamento clássico de efluentes contendo metais pesados envolve processos físico-químicos de precipitação, troca iônica, adsorção e extração por solventes. Geralmente processos subseqüentes, como sedimentação e filtração, são necessários para que a água tratada seja recuperada. Contudo, essas técnicas tradicionais são inadequadas para a descontaminação de grandes volumes de efluentes, devido à baixa eficiência operacional e aos elevados custos (GAVRILESCU, 2004; LLOYD; LOVLEY, 2001, REMOUDAKI et al., 2003). Métodos alternativos, como o emprego de microrganismos e plantas para a retirada de metais de águas de rios e aterros, apresentam baixos custos e alta eficiência e, portanto, são mais atrativos do que métodos físico-químicos (GADD, 1992; MACASKIE; DEAN, 1990; WATANABLE, 1997). O processo pelo qual organismos vivos, normalmente plantas e microrganismos, são utilizados para remover ou reduzir poluentes no ambiente é conhecido como biorremediação (GAYLARDE et al., 2005). 2.3.1 Fitorremediação A fitorremediação é definida como o uso de plantas para remover poluentes ambientais ou detoxificá-los a subprodutos menos perigosos. Esta técnica envolve o uso de plantas tolerantes ao poluente alvo e, no caso de metais pesados, aproveita a habilidade natural destas plantas em absorver e concentrar estes elementos em seus tecidos, especialmente raízes, a partir de ambientes aquáticos ou solos, imobilizando-os e, conseqüentemente, limitando a sua difusão no ambiente (DUSHENKOV et al., 1999; KRÄMER, 2005). Apesar dessa técnica apresentar baixos custos, apresenta limitações como: (i) baixos níveis de contaminantes não podem ser extraídos pelas plantas, (ii) Revisão Bibliográfica 29 plantas não crescem em ambientes com altos níveis de contaminação, (iii) é um processo remediador de longo prazo e (iv) há risco da planta entrar na cadeia alimentar (DINARDI et al., 2003; SURESH; RAVISHANKAR, 2004). Devido a essas limitações, o estudo de processos mais eficientes tem focado o uso de microrganismos que podem ser altamente resistentes aos contaminantes e realizar a biorremediação de forma viável e em curto prazo. 2.3.2 Biorremediação com microrganismos A biorremediação pode se dar através de microrganismos capazes de imobilizar metais pesados, por simples adsorção em sua superfície celular, promovendo sua precipitação, ou por processos de formação de complexos intracelulares (DIELS et al., 2002; VALLS; LORENZO, 2002). Uma considerável variedade de fungos, algas e bactérias tem sido estudada e utilizada como biosorvente para biorremediação de efluentes contendo metais pesados (GADD, 1992; MACASKIE; DEAN, 1990). Um exemplo disto é o biorreator denominado “Sistema Meander”, capaz de remover íons Pb+2, Cu+2, Zn+2, Mn+2, Ni+2, Fe+2 e Cd+2 de efluentes contaminados, com o uso de cianobactérias e algas, com alta eficiência (GADD; WHITE, 1993). A interação entre microrganismos e metais pesados vem ocorrendo desde o início da vida no planeta, há 4 bilhões de anos, o que permitiu a evolução de sistemas biológicos de resistência permitindo a sobrevivência em ambientes contendo elevadas concentrações de metais (SILVER; PHUNG, 2005; VALLS; LORENZO, 2002). Para apresentar toxicidade, os metais pesados precisam primeiramente entrar na célula microbiana. Para tanto, duas vias de entrada existem, uma inespecífica e outra de grande especificidade. A primeira ocorre através de um gradiente quimiosmótico da membrana citoplasmática (transporte passivo), e a segunda envolve hidrólise de ATP (transporte ativo) (NIES; SILVER, 1995). De maneira geral, as proteínas envolvidas no transporte passivo de íons são expressas constitutivamente pelas células, enquanto a expressão das proteínas de transporte ativo é regulada. Cátions de metais pesados divalentes, como Mn+2, Fe+2, Co+2, Ni+2, Cu+2 e Zn+2, são estruturalmente muito similares ao Mg+2, adentrando a célula Revisão Bibliográfica 30 passivamente, em bactérias Gram-negativas, pelo sistema de incorporação de magnésio (MIT). Ânions como cromato (CrO4-2), se assemelham ao sulfato (SO4-2), entrando na célula pela via de assimilação passiva de sulfato. O mesmo é válido para os ânions arsenito (AsO4-3), que são transportados passivamente pelo sistema de transporte de fosfato inorgânico (PIT) (NIES, 1999). A captação de íons pela célula microbiana através do transporte ativo é realizada principalmente por ATPases, no entanto, sistemas de transporte específicos como HoxN, para Ni+2 e Co+2, e MerT-MerP, do operon de resistência a mercúrio, também são utilizados pela célula (NIES, 1999). Uma vez dentro das células, os íons de metais pesados, em concentrações acima dos limites fisiológicos, causam diversos danos tais como, inibição da transcrição, da tradução, da divisão celular e da atividade enzimática (Figura 1). Lise da membrana celular Hg+2, Pb+2, Zn+2, Ni+2, Cu+2, Cd+2 Inibição da transcrição Hg+2 • DNA Danos ao DNA Hg+2, Pb+2, As+2, Cd+2 mRNA Inibição da atividade enzimática Hg+2, Pb+2, Cd+2, Cu+2, Cd+2 Proteína Inibição da tradução Hg+2, Pb+2, Cd+2 Inibição da divisão celular Hg+2, Pb+2, Ni+2, Cd+2 Figura 1: Resumo das interferências mais freqüentes de íons de metais tóxicos na célula microbiana; divisão celular e metabolismo são geralmente inibidos por metais pesados. Modificado de Roane e Pepper (2000a). A toxicidade dos metais pesados aliada à captação constante desses íons pelas células, forçou o desenvolvimento de sistemas de homeostase para proteção contra danos e manutenção da sobrevivência. Como os metais pesados não podem ser degradados, três mecanismos de resistência se estruturaram ao longo da evolução: Revisão Bibliográfica 31 (i) bombas de efluxo - segundo Silver e Phung (2005) sete tipos de bombas de efluxo são conhecidas: dois tipos de ATPases (P e ABC), três tipos de bombas quimiosmóticas (MFS - “major facilitator superfamily”, CDF - “cátion diffusion facilitator” e RND - “resistance-nodulation-cell division”) e 2 tipos de sistemas de transporte quimiosmótico específicos (CHR - “cromate efflux system” e ArsB “arsenite efflux system”) (Figura 2). Influxo Efluxo Figura 2: Desenho esquemático mostrando a célula bacteriana Gram-negativa e as diversas famílias de proteínas envolvidas no transporte de metais pesados. Influxo: MIT- sistema de transporte de metal, ATPase e ABC- transportadores dependentes de ATP, PIT+2 +2 transporte de fosfato inorgânico, HoxN- transporte específico de Ni e Co e +2 MerT/MerP- transporte específico de Hg . Efluxo: RND- resistência, nodulação e divisão celular, ATPase e ABC- transportadores dependentes de ATP, CDF- facilitador de difusão de cátion, MFS- superfamília de facilitadores de difusão de cátion, CHR- sistema de efluxo de cromato e ArsB- sistema de efluxo de arsenito. Basedo em Nies (1999) e Silver e Phung (2005). (ii) biossorção em moléculas ricas em grupamentos tióis (SH) – por este mecanismo, ocorre a imobilização do metal, prevenindo sua toxicidade. Essas moléculas podem ocorrer na superfície celular, como exopolímeros, ou ainda, como moléculas semelhantes à glutationa, presentes no interior da célula (ROANE; PEPPER, 2000a). (iii) mudança do estado de oxidação do íon - a alteração para um estado oxidativo menos tóxico pode ocorrer por redução, por metilação ou por formação de complexos que resultem na precipitação de sais de metais insolúveis. Revisão Bibliográfica 32 Devido a essa multiplicidade de mecanismos de resistência a íons de metais pesados, tornou-se possível a utilização desses microrganismos em estratégias de biorremediação de ambientes contendo metais pesados, pois possuem capacidade de colonizar tais ambientes e atuarem como poderosas ferramentas biotecnológicas em projetos de biorremediação. 2.4 Cupriavidus metallidurans CH34 Cupriavidus metallidurans CH34 é uma bactéria adaptada a ambientes contendo altas concentrações de metais e, de fato, viceja nesse tipo de ambiente (DIELS; MERGEAY, 1990). C. metallidurans CH34 (VANDAMME; COENYE, 2004) [anteriormente denominada Wautersia metallidurans CH34 (VANEECHOUTTE et al., 2004), Ralstonia metallidurans CH34 (GORIS et al., 2001), Ralstonia eutropha CH34 (YABUCCHI et al., 1995) e Alcaligenes eutrophus CH34 (MERGEAY et al., 1978)] é uma β-proteobactéria, Gram-negativa, não patogênica, capaz de crescer em elevadas concentrações de, pelo menos, treze diferentes íons de metais pesados (MONCHY et al., 2006a). Esta linhagem bacteriana foi isolada em sedimentos de tanques de decantação de zinco em Liège, Bélgica (MERGEAY et al., 1978; MERGEAY et al., 2003) e possui alta resistência a Ag+2, Bi+3, Cd+2, Co+2, CrO4-2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2, SeO4-3, Tl+1 e Zn+2, conferida por pelo menos 150 genes de resistência, presentes em seus quatro replicons: o cromossomo (3,9 Mb), o megaplasmídeo (2,6 Mb) e os dois plasmídeos pMOL30 (234 Kb) e pMOL28 (171Kb) (MERGEAY et al., 2003; MONCHY et al., 2006a; TAGHAVI et al., 1997). O genoma deste microrganismo foi inteiramente seqüenciado pelo Joint Genome Institute, Califórnia-USA, e os resultados estão disponíveis no banco de dados do National Center for Biotechnology Information (NCBI). 2.4.1 Genômica de C. metallidurans CH34 A análise genômica de C. metallidurans CH34 permitiu a identificação dos genes que codificam o seu repertório protéico. Foram identificadas 6985 proteínas, das quais, 4072 foram consideradas citoplasmáticas e 2913 transmembranares. Comparada a outros procariotos, C. metallidurans CH34 apresenta grande Revisão Bibliográfica 33 proporção de proteínas de membrana de todos os tipos topológicos (PAULSEN et al., 2000; VON ROZYCKI et al., 2005). Nesse microrganismo, foram identificadas 932 proteínas relacionadas ao transporte, sendo que 300 estão envolvidas no transporte de compostos inorgânicos, 400 no transporte de compostos orgânicos, 102 no transporte de macromoléculas e 130 no transporte de diversos compostos (VON ROZYCKI et al., 2005). O resumo das principais classes de proteínas de transporte envolvidas na homeostase de metais pesados em C. metallidurans CH34 é apresentado na Tabela 2, indicando que 94 proteínas interagem com especificidade a íons de metais; quantidade essa também, muito superior a de outros microrganismos em geral (VON ROZYCKI et al., 2005). Tabela 2: Principais classes de proteínas de transporte envolvidas na homeostase de metais pesados em C. metallidurans CH34*. Classe de proteínas Canais Iônicos Transportadores Secundários Transportadores primários Transportador auxiliar Transportadores específicos Total Transportador** substrato MIT OMF CDF ZIP RND PIT ArsB CHR ABC ATPases MFP Mg, Mn, Co, Ni, Fe, Al, Na Cátions de metais pesados Cd, Co, Zn Zn, Fe Íons de metais pesados Fosfato Arsenito Cromato Íons Mg, Co, Ni, Na, H, K, Ca, Cd, Cu, Zn, Ag Íons de metais pesados MerTP PbrT Hg Pb o n de membros em CH34 4 28 3 1 12 1 1 4 2 8 25 3 2 94 *Baseado em Von Rozycki et al. (2005) e Nies et al., (2006). **MIT – Transporte de íon metálico, OMF – Fator de membrana externa (porina), CDF- facilitador de difusão de cátion, ZIP – permease de zinco, RND – resistência, nodulação e divisão celular, PIT – transportador de fosfato inorgânico, ArsB – transportador de arsenito e antimônio, CHR – transportador de cromato, ABC e ATPase – transportadores dependentes de ATP, MFP – proteína de fusão em membrana e MerTP e PbrT – transportadores específicos de Hg+2 e Pb+2. A estruturação da rede de detoxificação que permitiu a alta resistência a íons metálicos em C. metallidurans CH34, deveu-se à transferência gênica horizontal e à atividade de elementos transponíveis (ISs) (TAGHAVI et al., 1997, Revisão Bibliográfica 34 VON ROZYCKI et al., 2005). O genoma da C. metallidurans CH34 é rico em ISs (48 ISs identificados), assim como em transposons da família Tn3 e Tn21 (DONG et al., 1992; MERGEAY et al., 2003; TAGHAVI et al., 1997; MONCHY et al., 2004). Outro sistema, que conferiu uma vantagem evolutiva a C. metallidurans CH34, é a existência do mecanismo parA e parB, pelo qual essa bactéria conserva os dois plasmídeos ricos em genes de resistência, pMOL30 e pMOL28, garantindo estabilidade segregacional e a sobrevivência em ambientes contendo metais (TAGHAVI et al., 1996; VON ROZYCKI et al., 2005). Por fim, a análise genômica permitiu a identificação de 17 possíveis proteínas com similaridade a fatores sigma. Em Escherichia coli, por exemplo, apenas sete fatores sigma estão disponíveis para a ligação com o núcleo da RNApolimerase e controle do início da transcrição nas diferentes fases da vida da célula. O alto número de fatores sigma indica que C. metallidurans CH34 deva possuir uma grande complexidade na regulação da expressão de suas proteínas (NIES, 2004). 2.4.2 Metabolismo de C. metallidurans CH34 C. metallidurans CH34 é uma bactéria mesofílica, quimiolitotrófica facultativa, capaz de crescer autotroficamente em meio mineral e em diferentes concentrações de H2, O2 e CO2. Apresenta crescimento heterotrófico em uma variedade de compostos orgânicos como gluconato, succinato, malato, lactato, piruvato, acetato, hexanoato, benzoato, formato, glicerol, n-butanol, n-propanol, fenol, histidina, treonina, triptofano, prolina, glicina, entre outros. No entanto, não é capaz de assimilar CO, CH4, glicose, frutose e outros açúcares; além disso, sob restrição de N2, acumula mais de 15% do seu peso em poli-3-hidroxibutanoato (PHB) (MERGEAY et al., 1985; STEINBǛCHEL et al., 1983). Análises genômicas mostraram que essa bactéria possui 41 sistemas de transporte específicos para carboidratos e 110 sistemas de transporte específicos para aminoácidos, sugerindo que o metabolismo de aminoácidos pode ser mais importante do que o de carboidratos para o crescimento heterotrófico (VON ROZYCKI et al., 2005). Revisão Bibliográfica 35 2.4.3 Mecanismos de resistência de C. metallidurans CH34 As concentrações de metais pesados no ambiente natural de C. metallidurans CH34 excedem em muito os valores considerados letais para a maioria dos microrganismos (VON ROZYCKI et al., 2005). Por exemplo, o tanque de decantação de zinco, onde esta bactéria foi isolada, continha 70 mM de Zn+2, 0,3 mM de Cd+2 e 1,5 mM de Cu+2 (MERGEAY et al., 1978). O fato dos sistemas de transporte de vários metais pesados serem mais estudados e caracterizados nessa bactéria do que em qualquer outra, confere a C. metallidurans CH34 a condição de organismo modelo para pesquisas de resistência a metais e homeostase (VON ROZYCKI et al., 2005; NIES et al., 2006). O inventário dos genes de resistência a metais pesados em C. metallidurans CH34 está resumido na Figura 3. O plasmídeo pMOL30 possui 5 operons de resistência a metais: (i) czc relacionado à resistência a Cd+2, Zn+2 e Co+2, (ii) pbr - relacionado à resistência a Pb+2, (iii) cop - relacionado à resistência a Cu+2, (iv) mer - relacionado à resistência a Hg+2, (v) sil - relacionado à resistência a Ag+. Além desses operons, este plasmídeo contém o gene de uma ATPase (czcP) e dois agrupamentos não funcionais (merRTP e cnrCBnccAnreB). O plasmídeo pMOL28 possui 3 operons de resistência a metais: (i) cnr relacionado à resistência a Co+2 e Ni+2, (ii) mer - relacionado à resistência a Hg+2 e (iii) chr - relacionado à resistência a CrO4-2. O megaplasmídeo, por sua vez, possui o gene de uma ATPase - zntA relacionada à resistência a Cd+2, Zn+2, Bi+2 e Tl+, um sistema RND de resistência a Ag+ e Cu+2, além de parte do operon cop de resistência a Cu+2. O cromossomo possui uma multiplicidade de genes de resistência a metais, tais como ATPases (CadA, CupA, ArsBC), sistemas RND (CzcCBA), CDF (DmeF e FieF), CHR e redutase de mercúrio. Até recentemente, se sabia que os operons de resistência a metais se expressavam devido à indução específica por determinado íon. No entanto, Monchy et al. (2007) sugeriram que em C. metallidurans CH34, além dessa resposta específica, há uma resposta múltipla dos vários operons, mesmo quando apenas um íon está presente, o que permite uma defesa celular mais ampla. Segundo Zoropogui et al. (2008), este tipo de resposta em C. metallidurans CH34 pode estar Revisão Bibliográfica 36 relacionada às condições ambientais onde um tipo de íon está associado a outro em ambientes contendo múltiplos metais. Além desses sistemas, podem existir em C. metallidurans CH34 outras formas de resistência, relacionadas com moléculas quelantes de metais como a glutationa e sideróforos que, no entanto, não estão exploradas (GILIS et al., 1998). Nos próximos itens deste trabalho, serão realizadas as descrições de cada operon de resistência a metais e, em seguida, o “estado da arte” dos mecanismos de resistência para cada íon de metal pesado em C. metallidurans CH34. Revisão Bibliográfica 37 Figura 3: Inventário dos genes de resistência a metais pesados presentes nos quatro replicons de C. metallidurans CH34. Coluna 1: localização do agrupamento gênico: pMOL30, pMOL28, cromossomo e megaplasmídeo; Coluna 2: genes envolvidos na resistência a íons de metais pesados: flechas verdes – RND, flechas laranjas – ATPases, flechas azuis – genes regulatórios, flechas brancas- genes desconhecidos, flechas marrom – CDF, flechas vermelhas: oxidase, flechas amarelas: redutase (merA) e transporte de cromato (ChrA); Coluna 3: Resistência aos íons de metais pesados codificados por cada grupamento gênico e Coluna 4: Família das proteínas envolvidas no efluxo de íons de metais pesados. Flechas indicam a direção da transcrição dos +2 +2 +2 +2 +2 +2 genes. *Genes que mostraram expressão quando induzidos por Ag , Cd , Co , Cu , Ni e Zn . Baseado em Borremans et al., 2001; Mergeay et al., 2003; Legatzki et al., 2003a; Munkelt et al., 2004; Von Rozycki et al., 2005; Nies et al., 2006; Monchy et al., 2006 a,b. Revisão Bibliográfica 38 2.4.4 Operon czc de C. metallidurans CH34 No plasmídeo pMOL30 de C. metallidurans CH34, há uma cópia do operon czc. Além disso, sete diferentes arranjos gênicos desse operon são encontrados no cromossomo, mas, apenas três mostraram ser funcionais (NIES et al., 2006) (Figura 3). Este operon é constituído pelos genes estruturais czcC, czcB e czcA, cujos produtos protéicos formam uma bomba de efluxo que transporta os íons Co+2, Zn+2 e Cd+2 para o exterior da célula. A montante dos genes czcCBA, encontram-se os genes czcN e czcI, que codificam proteínas com funções desconhecidas e, a jusante, uma região composta pelos genes czcD, czcR, czcS e czcE, que estão envolvidos na regulação do operon (Figura 4) (GROßE et al., 1999, 2004; NIES; BROWN, 1997). A jusante das regiões czcCBA e czcDRS, há um terminador de transcrição intrínseco (alça) envolvido no mecanismo de controle da expressão gênica desse operon (GROßE et al., 1999, 2004; VAN DER LELIE et al., 1997). Figura 4: Representação esquemática do operon czc de C. metallidurans CH34. Os promotores do operon são indicados por . A transcrição do operon czc está sob o comando das regiões promotoras czcNp, czcIp, czcCp, czcDp e czcEp. Em baixas concentrações de íons de metais, o promotor czcNp está inativo e ocorre um nível basal de expressão de czcCBA e czcDRSE, sob o comando dos promotores czcIp, czcCp, czcDp e czcEp (GROßE et al., 2004). Quando as concentrações de Co+2, Zn+2 ou Cd+2 atingem limites tóxicos à célula, a expressão da bomba de efluxo czcCBA é induzida a partir do promotor czcNp e, nesse caso, os promotores czcIp, czcCp e czcDp estão inativos. A indução da expressão de czcCBA por Co+2, Zn+2 e Cd+2 deve-se à atuação da proteína CzcR, que funciona como um ativador de transcrição, atuando unicamente na região promotora czcNp (GROßE et al., 2004). A atuação de CzcR é controlada pela histidina quinase CzcS e pela proteína CzcE, que, juntas, detectam metal no espaço periplasmático de C. metallidurans CH34. A função de CzcE é Revisão Bibliográfica 39 controlar a fosforilação de CzcS somente quando os níveis de metais atingem um limite crítico, dessa forma, permitindo que concentrações basais de íons essenciais sejam mantidas na célula e, acima desses limites a proteína sensora CzcS altera a conformação da proteína CzcR, induzindo a expressão da bomba de efluxo (ANTON et al., 1999; GROßE et al., 1999, 2004). Segundo Legatzki et al. (2003b), a bactéria C. metallidurans CH34 cultivada na ausência de metais mantêm 2.300 moléculas da proteína CzcA por célula. O cultivo desta bactéria na presença de Co+2 mostrou que o número de moléculas de CzcA passou para 5.700 moléculas por célula; quando o Zn+2 foi utilizado, a célula chegou a apresentar 23.400 moléculas da proteína CzcA e na presença de Cd+2 a célula apresentou 14.500 moléculas da proteína CzcA. A transcrição dos genes czcDRS está sob o comando do promotor czcDp, o qual está localizado a montante da alça de terminação e, devido a esse fato, quando os genes czcCBA estão sendo fortemente transcritos, a seqüência promotora czcDp está bloqueada, impedindo a expressão de czcDRS (VAN DER LELIE et al., 1997; NIES; BROWN, 1997). 2.4.5 Resistência a cádmio (Cd+2) e zinco (Zn+2) em C. metallidurans CH34 O Zn+2 é um elemento essencial tanto para células eucarióticas, quanto para as procarióticas, sendo um co-fator de muitas DNA e RNA polimerases; é essencial para atividade enzimática de muitas proteínas e, embora seja essencial em concentrações nanomolares, é tóxico em altas concentrações. O metal pesado Cd+2 não é um elemento essencial para células microbianas e, de fato, apresenta alta toxicidade em bactérias (NIES, 1992). C. metallidurans CH34 apresenta alta resistência a esses dois metais tóxicos devido à atuação de vários sistemas de efluxo, que garantem que a concentração citoplasmática não atinja valores que causem danos à célula (GROßE et al., 2004). Até o momento, sabe-se que há sete diferentes bombas de efluxo de Cd+2 e Zn+2 em C. metallidurans CH34: (i) uma CzcCBA, (ii) três facilitadores de difusão de cátion (CDF): CzcD, DmeF e FieF e (iii) três ATPases: CzcP, CadA e ZntA. Revisão Bibliográfica 40 Em C. metallidurans CH34, a bomba de efluxo CzcCBA e a proteína CzcD apresentam expressão constitutiva basal quando em baixa concentração de íons, no entanto, CzcCBA é fortemente expressa na presença de indutores. As proteínas DmeF e FieF, cujos genes estão localizados no cromossomo, são expressas constitutivamente nessa bactéria e realizam efluxo de um amplo espectro de íons divalentes, inclusive Cd+2 e Zn+2 (MUNKELT et al., 2004). A expressão dos genes das ATPases CadA e ZntA é controlada por repressores específicos, que, na presença de Zn+2 ou Cd+2, são deslocados do promotor permitindo que as ATPases sejam expressas, realizando o efluxo desses íons para o periplasma da célula (LEGATZKI et al., 2003a). O gene da ATPase czcP também tem como substratos os íons Zn+2 e Cd+2, no entanto ainda não se sabe o mecanismo de regulação, o qual pode estar envolvido com czcRS (MONCHY et al., 2006a). Dessa forma, quando a concentração de íons de metais pesados aumenta o suficiente para escapar dos sistemas de efluxo constitutivos, ocorre a indução da expressão de CzcCBA e das ATPases que bombeiam os íons do citoplasma e do periplasma para o meio exterior. Portanto, em baixas concentrações de íons Zn+2 e Cd+2, C. metallidurans CH34 regula sua homeostase com CzcCBA, CzcD, DmeF e FieF e, em altas concentrações, pelo aumento da expressão de CzcCBA, por CzcD, DmeF, FieF, CadA, ZntA e CzcP, que, juntos formam um eficaz sistema de efluxo desses íons (Figura 5). Apesar de CzcD ser uma bomba de efluxo com amplo espectro de íons, não promove o efluxo do íon Cd+2 (ANTON et al., 2004) que, por sua vez, é transportado com grande especificidade pela ATPase CadA. Além desses sistemas, também se tem relatado a capacidade de sideróforos em interagir com íons Cd+2, afetando a biodisponibilidade desse íon e protegendo a célula de sua toxicidade (GILIS et al., 1998). Revisão Bibliográfica 41 +2 +2 Figura 5: Representação esquemática dos sistemas de resistência a Zn e Cd em C. metallidurans CH34. A parte inferior da figura mostra os genes do operon czc, das ATPases, proteínas CDF e suas regiões promotoras (►). A localização desses genes nos replicons está indicada. A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pelos sistemas de transporte passivo e ativo. O bombeamento para o exterior da célula é feito pelo sistema de efluxo CzcCBA, por ATPases e pelas proteínas CDF. Ilustração baseada em Nies (2000), GroBe et al. (2004) e Silver e Phung, (2005). 2.4.6 Operon cnr de C. metallidurans CH34 O operon cnr de C. metallidurans CH34 está presente no plasmídeo pMOL28 e é constituído pelos genes estruturais cnrC, cnrB e cnrA, codificando proteínas que formam uma bomba de efluxo que transporta íons Co+2 e Ni+2 para o exterior da célula, apresentando alta homologia ao operon czc. A montante da região estrutural encontram-se os genes reguladores cnrY, cnrX e cnrH (GRASS et al., 2000; TIBAZARWA et al., 2000) (Figura 6). Figura 6: Representação esquemática do operon cnr de C. metallidurans CH34. Os promotores do operon são indicados por . Esse operon é expresso somente em altas concentrações de níquel e a transcrição é iniciada em duas regiões promotoras, cnrYp e cnrCp, resultando em Revisão Bibliográfica 42 dois transcritos tricistrônicos (cnrYXH, cnrCBA) e, talvez em um hexacistrônico (cnrYXHCBA) (GRASS et al., 2000; GRASS et al., 2005). A proteína CnrH é um fator sigma que confere especificidade à RNApolimerase em reconhecer as regiões promotoras cnrYp e cnrCp. A disponibilidade de CnrH na célula é controlada pelas proteínas CnrX e CnrY, que, juntas, formam um complexo que regula a expressão de cnrCBA. A proteína CnrX é um sensor periplasmático de Ni+2 que interage com a proteína de membrana CnrY, que é um fator anti-sigma de CnrH (GRASS et al., 2000; GRASS et al., 2005; NIES, 2004; TIBAZARWA et al., 2000). 2.4.7 Resistência a níquel (Ni+2) em C. metallidurans CH34 O Ni+2 é um elemento essencial para células em baixas concentrações, sendo co-fator de muitas enzimas como as hidrogenases, chaperonas, ureases e desidrogenases, no entanto, apresenta toxicidade em concentrações altas (NIES, 1999). C. metallidurans CH34 apresenta alta resistência a esse metal graças às bombas de efluxo CzcD, DmeF e FieF e CnrCBA (Figura 7). Em baixas concentrações de Ni+2, C. metallidurans CH34 realiza sua homeostase através das bombas CzcD, DmeF e FieF, de expressão constitutiva. Por outro lado, altas concentrações de Ni+2 são detectadas no espaço periplasmático pela proteína sensora de Ni+2 CnrX, fato este que altera a conformação do complexo protéico CnrX-CnrY, causando a liberação do fator sigma CnrH e, conseqüentemente, a indução da expressão da bomba de efluxo CnrCBA, que é capaz de realizar o efluxo desse íon tanto do citoplasma quanto do periplasma (GRASS et al., 2005). Revisão Bibliográfica 43 +2 Figura 7: Representação esquemática dos sistemas de resistência a Ni em C. metallidurans CH34. A parte inferior da figura mostra os genes do operon cnr, das proteínas CDF e suas regiões promotoras (►). A localização desses genes nos replicons está indicada. A parte superior da figura mostra a possível localização das proteínas codificadas pelo operon cnr na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pelos sistemas de transporte passivo e ativo. O bombeamento para o exterior da célula é feito pelo sistema de efluxo CnrCBA e pelas proteínas CDF. Ilustração baseada em Nies (2000), GroBe et al. (2004) e Silver e Phung, (2005). 2.4.8 Resistência a cobalto (Co+2) em C. metallidurans CH34 O Co+2 é um elemento essencial para células em baixas concentrações, sendo co-fator da vitamina B12 e hidratases, apresentando, no entanto, toxicidade quando presente em altas concentrações (NIES, 1999). Assim como para os íons Ni+2, Zn+2 e Cd+2, a resistência ao Co+2 em C. metallidurans CH34 também se deve ao efluxo realizado pelas bombas cnrCBA, czcCBA, CzcD, DmeF e FieF (Figura 8). As bombas de efluxo CzcD, DmeF e FieF desempenham um papel fundamental na homeostase desse íon em C. metallidurans CH34. Segundo Munkelt et al. (2004), a proteína DmeF é essencial para o efluxo de íons Co+2 citoplasmáticos, uma vez que as bombas CnrCBA e CzcCBA são capazes de realizar o efluxo desse íon apenas a partir do periplasma. Dessa forma, a concentração citoplasmática de íons Co+2 é regulada, por DmeF e, em menor proporção, por Fief e CzcD e, a partir do periplasma para o meio exterior através das bombas de efluxo codificadas nos operons czc e cnr. Revisão Bibliográfica 44 +2 Figura 8: Representação esquemática dos sistemas de resistência a Co em C. metallidurans CH34. A parte inferior da figura mostra os genes dos operons cnr (pMOL28) e czc (pMOL30 e cromossomo), das proteínas CDF e suas regiões promotoras (►). A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pelos sistemas de transporte passivo e ativo. O bombeamento periplasmático para o exterior da célula é feito pelas bombas de efluxo CnrCBA e CnrCBA. O bombeamento do citoplasma para o periplasma da célula é feito pelas proteínas CzcD, DmeF e FieF. Ilustração baseada em Nies (2000), GroBe et al. (2004) e Silver e Phung, (2005). 2.4.9 Operon chr de resistência a cromato (CrO4-2) em C. metallidurans CH34 Em microrganismos, o cromato é um elemento tóxico, pois induz a formação de radicais livres que interferem no metabolismo celular (NIES, 1999). A bactéria C. metallidurans CH34 apresenta resistência a cromato devido à atuação do operon chr. O cromato entra na célula pela via de assimilação de sulfato devido à semelhança entre os ânions SO4-2 e CrO4-2. Em altas concentrações de SO4-2, a entrada de cromato na célula é inibida, no entanto, quando existe restrição de sulfato e presença de cromato, a bactéria tende a aumentar o mecanismo de captação de sulfato, causando o aumento dos níveis de cromato no citoplasma. O operon chr está no plasmídeo pMOL28 de C. metallidurans CH34 e é constituído por seis genes de resistência. Além disso, no cromossomo da bactéria, encontram-se também os genes chrB2, chrA2 e chrF2 com grande homologia aos correlatos plasmidiais (Figura 9) (JUHNKE et al., 2002). Revisão Bibliográfica 45 Figura 9: Representação esquemática do operon chr do pMOL28 de C. metallidurans CH34. Os promotores do operon são indicados por . A regulação desse operon ainda não está totalmente elucidada e, pelo que se sabe, a transcrição se inicia em quatro regiões promotoras: chrIp, chrBp, chrAp e chrCp (Figura 9), sendo que o promotor chrAp é considerado constitutivo (JUHNKE et al., 2002). As proteínas de membrana interna ChrA e ChrB são, respectivamente, uma bomba de efluxo de cromato e um ativador de transcrição do operon chr plasmidial. Por sua vez, as proteínas ChrF e ChrI constituem repressores do operon chr, ligando-se na região operadora-promotora de chrBp. A proteína ChrC é uma superóxido dismutase (SOD), que protege as células da atividade de peróxido de hidrogênio e radicais aniônicos (O2-) gerados pelo cromato. ChrE é uma enzima que tem como função romper interações entre cromato e glutationa, permitindo o efluxo do íon para fora do citoplasma (JUHNKE et al., 2002; MERGEAY et al., 2003; ROUX; COVÉS, 2002). Em baixas concentrações de cromato, somente os genes cromossomais são expressos, embora não se conheça ainda o mecanismo de regulação. Nessa situação, o efluxo de CrO4-2 é realizado pela bomba ChrA2 e, em menor proporção, por ChrA1 expressa constitutivamente. Em altas concentrações de cromato, a proteína ChrB2 ativa o promotor chrBp do operon chr do pMOL28, liberando o repressor ChrF e ChrI, permitindo a expressão da bomba de efluxo ChrA1 e das proteínas ChrC e ChrE (Figura 10) (JUHNKE et al., 2002). Nessa situação, as proteínas ChrF1 e ChrI também são expressas e, no momento em que o citoplasma esteja detoxificado, se ligam novamente em chrBp, travando a expressão do operon chr plasmidial. Revisão Bibliográfica 46 -2 Figura 10: Representação esquemática dos sistemas de resistência a CrO4 em C. metallidurans CH34. A parte inferior da figura mostra os genes cromossomais e plasmidiais do operon chr e suas regiões promotoras (►). A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pelos sistemas de transporte passivo e ativo. O bombeamento citoplasmático para o exterior da célula é feito por ChrA, no entanto, não se sabe qual o mecanismo é responsável por transportar o íons para o exterior da célula. Ilustração baseada em Juhnke et al. (2002) e Nies e Silver, (1995). 2.4.10 Operon pbr de resistência a chumbo (Pb+2) de C. metallidurans CH34 O elemento chumbo não é essencial aos organismos vivos, sendo tóxico mesmo em baixas concentrações (NIES, 1999). Geralmente, a resistência bacteriana a esse íon é devida à atuação de ATPases, no entanto, em C. metallidurans CH34, foi encontrado o primeiro operon de resistência bacteriano específico para Pb+2 (BORREMANS et al., 2001; RENSING et al., 1998). Em C. metallidurans CH34, o operon pbr está presente no plasmídeo pMOL30 e é constituído por seis genes que promovem a resistência a chumbo (Figura 11). Revisão Bibliográfica 47 Figura 11: Representação esquemática do operon pbr do pMOL30 de C. metallidurans CH34. O promotor do operon é indicado por . A expressão desse operon é induzida na presença de Pb+2 a partir de um promotor-operador divergente, localizado entre os genes pbrA e pbrR. A proteína PbrT apresenta alta especificidade por Pb+2 e é responsável pela captura desse íon no espaço periplasmático e transporte para o citoplasma da bactéria. Essa captação específica está relacionada à redução de íons livre de Pb+2 no periplasma, os quais podem interagir com componentes de membrana e proteínas periplasmáticas causando danos celulares. A proteína PbrR é um repressor do operon pbr, controlando a expressão do operon a partir da região promotora-operadora divergente (BORREMANS et al., 2001; DIELS et al., 1989; NIES, 1999). A resistência a Pb+2 deve-se ao efluxo desse íon pela ATPase PbrA; no entanto, íons que escapam desse efluxo se ligam à proteína PbrD que funciona como uma chaperona para Pb+2. A proteína PbrB, que pertence a uma nova família de proteínas auxiliares de transporte de íons, promove a transferência de íon Pb+2 do periplasma para o exterior da bactéria, no entanto, é dependente da proteína PbrC, que realiza o processamento de PbrB, permitindo sua passagem ao espaço periplasmático (BORREMANS et al., 2001) (Figura 12). Portanto, na presença de íons Pb+2, o repressor PbrR é deslocado do promotor-operador, permitindo a expressão do operon pbr e conferindo a C. metallidurans CH34 alta resistência a esse íon tóxico. Revisão Bibliográfica 48 +2 Figura 12: Representação esquemática do sistema de resistência a Pb em C. metallidurans CH34. A parte inferior da figura mostra os genes do operon pbr, a região promotor-operador no pMOL30. As flechas indicam o sentido de transcrição dos genes. A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pela proteína PbrT. O bombeamento citoplasmático para o exterior da célula é feito por PbrA. Ilustração modificada de Borremans et al. (2001). 2.4.11 Operon mer de resistência a mercúrio (Hg+2) de C. metallidurans CH34 Assim como o chumbo, o mercúrio é um metal pesado altamente tóxico para os organismos em geral, e operons de resistência a Hg+2 são freqüentemente encontrados nos genomas microbianos (NIES, 1999; SILVER; PHUNG, 2005). O operon mer de C. metallidurans CH34 está presente no cromossomo e nos plasmídeos pMOL28 e pMOL30 (Figura 13). No plasmídeo pMOL30, o operon mer é composto pelos genes merR, merT, merP, merA, merD e merE; adicionalmente esse plasmídeo carrega também uma região com genes merPTR, que não são funcionais (MERGEAY et al., 2003). O operon mer do plasmídeo pMOL28 apresenta grande homologia e a mesma disposição dos genes do operon mer do plasmídeo pMOL30 (CHAMPIER et al., 2004; DIELS et al., 1985). cromossomo, o operon é composto pelos genes merR, merT, merP e merA. No Revisão Bibliográfica 49 Figura 13: Representação esquemática do operon mer do pMOL30 e pMOL28 de C. metallidurans CH34. O promotor do operon é indicado por . O mecanismo de resistência bacteriano a mercúrio resulta da redução de Hg+2 a mercúrio metálico (Hg0), que é um elemento volátil, capaz de se difundir passivamente para o exterior da célula (SILVER, PHUNG, 2005). O gene merP codifica uma proteína periplasmática (MerP), capaz de se ligar especificamente a íons Hg+2 e transportá-los à proteína de membrana MerT, que, por sua vez, transfere o íon Hg+2 diretamente à redutase de mercúrio MerA (Figura 14) (CHAMPIER et al., 2004; ROSSY et al., 2004). A regulação da expressão desse operon é realizada pelas proteínas MerR e MerD. MerD não se liga a DNA, mas interage com o complexo MerR-promotoroperador, sendo um co-regulador da indução do operon. Na falta de íons Hg+2, forma-se um complexo ternário entre MerR, MerD e a região do promotor-operador, reprimindo a expressão dos genes do operon. Na presença de Hg+2, MerR liga-se a esse íon e é deslocado da região do promotor-operador pela ação de MerD, o que permite a expressão dos genes do operon. No entanto, a falta do gene merD não impede a expressão dos genes de resistência desse operon (CHAMPIER et al., 2004). A proteína MerE, por sua vez, não tem função conhecida (SILVER, PHUNG, 2005). Revisão Bibliográfica 50 +2 Figura 14: Representação esquemática do sistema de resistência a Hg em C. metallidurans CH34. A parte inferior da figura mostra os genes do operon mer, a região promotoroperador (O/P) (pMOL28, pMOL30) e o operon da região cromossomal. As flechas em sentido contrário indicam o sentido de transcrição dos genes. A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pelas proteínas MerP/MerT. MerA reduz íons de +2 0 0 Hg a Hg utilizando NADPH. Hg é volátil e difunde-se para o meio exterior da célula. Ilustração baseada em Silver e Phung, (2005). 2.4.12 Operon cop de resistência a cobre (Cu+1/Cu+2) de C. metallidurans CH34 O cobre é um elemento essencial à vida em baixas concentrações e muito tóxico em altas concentrações (NIES, 1999; MONCHY et al., 2006b). Altas concentrações de cobre são freqüentemente encontradas em áreas industriais e em resíduos de mineração, ambientes esses comumente colonizados por C. metallidurans CH34 (DIELS; MERGEAY, 1990). Em C. metallidurans CH34, genes que codificam proteínas de resistência a íons cobre estão presentes no plasmídeo pMOL30, no cromossomo e no megaplasmídeo. O mecanismo exato da resistência ainda não é conhecido em sua Revisão Bibliográfica 51 integralidade, mas parte do mecanismo já foi elucidada (MERGEAY et al., 2003; MONCHY et al., 2006b; RENSING; GRASS, 2003). O operon cop presente no plasmídeo pMOL30 é composto por 19 genes altamente especializados na resposta a altas concentrações de cobre, possuindo genes envolvidos na detoxificação tanto periplasmática, quanto citoplasmática (Figura 15) (MONCHY et al., 2006b). Figura 15: Representação esquemática do operon cop do pMOL30 de C. metallidurans CH34. Os promotores do operon são indicados por . As proteínas codificadas pelos genes copV, copM, copN, copQ e copE não apresentam equivalentes nos bancos de dados existentes e nenhuma função possível pôde ser designada a elas. O gene copT apresenta grande homologia com o gene pbrT (do operon de Pb+2) e, provavelmente, está envolvido no transporte dos íons Cu+2/Cu+1 do periplasma para o citoplasma da bactéria (MONCHY et al., 2006b). O mecanismo básico de resistência a cobre, comum a várias bactérias, é composto pelos genes copSRcopABCD; os genes copS e copR codificam uma histidina quinase e um regulador de resposta, respectivamente, que controlam a expressão dos genes copABCD. A proteína periplasmática CopA tem como função oxidar íons Cu+1 para a espécie menos reativa, Cu+2. As proteínas CopB e CopC estão envolvidas na ligação de íons livres Cu+1/Cu+2 no periplasma. CopD forma um canal na membrana interna, permitindo o transporte de íons Cu+2 para o citoplasma (MONCHY et al., 2006b; RENSING; GRASS, 2003). As proteínas CopH, CopI, CopK, CopG e CopJ apresentam sítios de ligação de íons cobre e, provavelmente, ligam-se a íons livres no periplasma (CopH, CopK, CopI) e no citoplasma (CopG, CopJ), prevenindo a sua toxicidade. O principal mecanismo de detoxificação citoplasmática do operon cop é feito pela ATPase CopF, que é responsável pelo efluxo de íons Cu+1 para o periplasma e Revisão Bibliográfica 52 sua expressão é controlada por CopL, que é um repressor do tipo merR (MONCHY et al., 2006b). Além do operon cop, C. metallidurans CH34 apresenta o gene de uma ATPase de cobre no cromossomo (cupA), cuja expressão é regulada pela proteína repressora CupR, além disso, há também os genes da bomba de efluxo de cobre CusCBA, que realiza o efluxo dos íons periplasmáticos para o exterior da célula (Figura 16) (MERGEAY et al., 2003; RENSING; GRASS, 2003). O sistema de dois componentes CopRS monitora a concentração periplasmática dos íons cobre e controla a transcrição dos genes copABCD. Em altas concentrações citoplasmáticas, os íons de cobre se ligam aos repressores CopL e CupR, permitindo a expressão das ATPases CopF e CupA, que realizam o efluxo do cobre (MERGEAY et al., 2003). Figura 16: +2 +1 Representação esquemática do sistema de resistência a Cu /Cu em C. metallidurans CH34. A parte inferior da figura mostra os genes do operon cop (pMOL30, megaplasmídeo), da APTase cupA (cromossomo), do cusCBA (megaplasmídeo) e a região do promotor (►) conhecidos. A parte superior da figura mostra a possível localização das proteínas na parede celular. Íons de metal pesado (•) são transportados para dentro da célula pela proteína CopT. CopABCD formam o sistema de proteção periplasmática a íons cobre, cuja expressão é regulada por CopRS. CopJ e CopG pretejem o citoplasma do excesso de íons cobre. CopF e CupA realizam o efluxo de íons citoplasmáticos com gasto de ATP e são regulados por CopL e CupR, respectivamente. copV, copM, copN, copQ, copE, copK e copH ainda não apresentam função definida. Ilustração baseada em Monchy et al. (2006) e Rensing; Grass, (2003). Revisão Bibliográfica 53 2.4.13 Outras resistências a metais pesados em C. metallidurans CH34 Estão relatadas na literatura resistências de C. metallidurans CH34 a arsenito (AsO4-3), bismuto (Bi+3), gadolínio (Gd+3), ouro (Au+), prata (Ag+), selenito (SeO3-2), tálio (Tl+) e urânio (U+2), no entanto, a maioria dos mecanismos ainda não está totalmente elucidado. O que se sabe até o momento é que a resistência dessa bactéria ao íon Bi+3 está relacionada com o efluxo realizado pela ATPase ZntA (MONCHY et al., 2006a); quanto ao íon Ag+, a resistência é devida ao efluxo das bombas CzcCsilBC e CusCBA, e através da ATPase CupA (MERGEAY et al., 2003; LEDRICH et al., 2005). A resistência ao íon Tl+1, está relacionada com as ATPases CadA, ZntA e PbrA (MONCHY et al., 2006a; SILVER; PHUNG, 2005) e a resistência ao íon AsO4-3, apesar de não comprovada, é sugerida devido à presença do operon ars no cromossomo (MERGEAY et al., 2003). No caso dos íons Gd+3 e Au+, ambos de alto valor comercial, C. metallidurans CH34 é capaz de resistir a altas concentrações devido à precipitação intracelular desses íons, o que previne a sua toxicidade (ANDRÉS et al., 2000; REITH et al., 2006). Cabe ressaltar ainda que C. metallidurans CH34 foi capaz de precipitar 6 µM de Au+ por bactéria, mostrando ser uma boa lixiviadora para esse metal precioso, no entanto, essa capacidade ainda não está explorada em toda a sua extensão (REITH et al., 2006). Para o íon SeO3-2 o mecanismo de resistência foi elucidado e é realizado através da redução de SeO3-2 ao elemento selênio (Se0), altamente insolúvel e não tóxico, e a posterior ligação desse Se0 a uma L-metionina que se acumula no interior da célula (AVOSCAN et al., 2006; ROUX et al., 2001; SARRET et al., 2005). Devido a essa capacidade de bioacúmulo de Au+, Gd+3 e SeO3-2, C. metallidurans CH34 também é uma boa candidata em processos de recuperação desses elementos seja para fins de biorremediação, seja para projetos que visem recuperar esses elementos diretamente do seus locais de ocorrência. Recentemente, foi relatada também alta resistência de C. metallidurans CH34 a urânio, trazendo perspectivas de utilização dessa bactéria em projetos de remediação de radionuclídeos (AVOSCAN et al., 2007). Revisão Bibliográfica 54 Com exceção dos íons Au+, Gd+3 e SeO3-2, que são precipitados intracelularmente, a fantástica rede de proteção celular apresentada pela bactéria C. metallidurans CH34, detoxifica o seu citoplasma, mas não o ambiente (NIES, 2000). Portanto, essa bactéria naturalmente não está pronta para ser empregada em estratégias de biorremediação de ambientes contendo íons de metais pesados e precisou ser melhorada para este fim. Até o momento, a maior parte dos trabalhos de biorremediação de ambientes contaminados por metais pesados envolveu a manipulação genética de bactérias não adaptadas a locais que apresentam altas concentrações de metais pesados tóxicos. Há, portanto, um caminho não explorado para busca e melhoramento genético de agentes biológicos satisfatórios para biorremediação, que sejam resistentes a essas contaminações como é o caso de C. metallidurans CH34. Considerando que C. metallidurans CH34 coloniza ambientes contendo metais pesados, decidimos nesse trabalho, manipulá-la geneticamente com o objetivo de enriquecer sua superfície com peptídeos com grande capacidade de quelar metais, dando à linhagem recombinante dupla vantagem: se reproduzir nesses ambientes e ser um agente de biorremediação. 2.5 Ancoragem de peptídeos na superfície de bactérias Gram-negativas O uso de proteínas naturais de superfície como uma ferramenta para ancoragem de proteínas heterólogas (“cell surface display”) vem apresentando ampla aplicação nas diferentes áreas da ciência. Por meio desta estratégia, diversos peptídeos foram ancorados na superfície de diferentes bactérias com variadas finalidades como a produção de anticorpos, biocatalizadores, biorremediadores, entre outros (WERNÉRUS; STÅHL, 2004). No caso da biorremediação, recentemente a literatura tem mostrado que microrganismos recombinantes, cuja superfície celular foi enriquecida com proteínas quelantes de metais, apresentaram capacidade superior de adsorção de íons metálicos, quando comparados com as linhagens não recombinantes, constituindo, portanto, uma estratégia biotecnológica para desenvolvimento de agentes Revisão Bibliográfica 55 biorremediadores de grande potencial (BAE et al., 2000; BAE et al., 2001; KOTRBA et al., 1999; SOUSA et al., 1998; VALLS et al., 2000 a, b). Várias estratégias podem ser utilizadas para ancorar peptídeos na membrana externa de bactérias Gram-negativas: inserções de genes nas seqüências de subunidades celulares como flagelos e pili, assim como em seqüências codificadoras de proteínas de membrana externa ou, ainda, utilizando o mecanismo de secreção de proteínas autotransportadoras, como é o caso do sistema de secreção da protease da imunoglobulina A (IgA) da bactéria Neisseria gonorrhoeae (WERNÉRUS; STÅHL, 2004). O sistema natural de secreção da IgA protease de N. gonorrhoeae está representado na Figura 17A, e é composto de quatro domínios: (i) PS: peptídeo sinal, capaz de ser reconhecido pela maquinaria Sec (secreção), que realiza o transporte da proteína para o periplasma. Uma vez que a proteína esteja no periplasma, o peptídeo sinal sofre uma clivagem, liberando a pré-proteína; (ii) domínio da protease propriamente dita, uma das responsáveis pela patogênese de N. gonorrhoeae, (iii) domínio rico em α-hélices de função desconhecida e (iv) β-domínio capaz de formar um poro na membrana externa em forma de β-barril, responsável pela passagem e secreção da protease através da membrana externa (VEIGA et al., 2002). Uma vez na superfície bacteriana, a protease ganha a sua conformação ativa, clivando-se nos sítios a, b e c e se liberando do β-domínio. Os autores Klauser et al. (1990) foram os primeiros a adaptar o sistema natural de secreção da IgA protease de N. gonorrhoeae para a ancoragem de peptídeos na superfície de outras bactérias. Esses pesquisadores utilizaram partes do sistema de secreção da IgA protease para a ancoragem do domínio B da toxina da cólera (ctxB) na superfície celular de Salmonella typhimurium (CtxB). Para tanto, a seqüência gênica correspondente ao domínio ctxB foi clonada entre as seqüências codificadoras do peptídeo sinal (PS) e a do β-domínio do sistema de secreção da IgA protease de N. gonorrhoeae e, após a expressão da construção, estes autores verificaram que o peptídeo CtxB estava exposto na superfície celular do microrganismo (Figura 17 B e C). A partir de então, diferentes peptídeos foram ancorados na membrana externa de bactérias Gram-negativas (E. coli, C. metallidurans CH34, N. gonorrhoeae, N. meningitidis, S. typhimurium e P. putida) por intermédio desse sistema (WERNÉRUS; STÅHL, 2004). Revisão Bibliográfica 56 Considerando que Valls et al. (2000a) conseguiram realizar a ancoragem da metalotioneína de camundongo na membrana externa de C. metallidurans CH34, utilizando o sistema de secreção da IgA protease de N. gonorrhoeae, essa estratégia foi adotada no presente trabalho, como meio de enriquecer a superfície de C. metallidurans CH34 com peptídeos com superior capacidade de adsorver íons de metais pesados. A C B Figura 17: A- Representação esquemática do sistema de secreção da IgA protease de N. gonorrhoeae MS11. B- Esquema representativo da construção genética visando a ancoragem da proteína CtxB utilizando o PS e β-domínio do sistema de secreção da IgA protease. C- Esquema representativo da ancoragem da proteína CtxB na membrana externa de Salmonella typhimurium. Modificado de Pohlner et al. (1987) e Henderson et al. (1998). Revisão Bibliográfica 57 2.6 Peptídeos com afinidade por íons de metais pesados Os organismos, de modo geral, defendem-se da presença de íons de metais pesados através da síntese de peptídeos ricos em cisteína, tais como a glutationa (GSH), fitoquelatinas (PCs) ou de metalotioneínas (MTs). Esses peptídeos se ligam aos íons metálicos, seqüestrando-os sob uma forma biologicamente inativa (BAE et al., 2000; MEJÀRE; BÜLOW, 2001; RAUSER, 1995). Os aminoácidos constituintes desses peptídeos interagem com os íons através das suas extremidades carboxil e amino e dos diversos grupamentos laterais. Proteínas ou peptídeos ricos em cisteína e histidina apresentam forte interação com íons devido aos grupamentos tióis (SH) e amida (SÓVÁGÓ; İSZ, 2006). Diversos peptídeos com estas propriedades têm sido utilizados como adsorventes de íons de metais pesados em estratégias de biorremediação (KOTRBA et al., 1999; MEJÀRE; BÜLOW, 2001; SOUSA et al., 1998). Uma nova classe de peptídeos que adsorvem íons de metais foi proposta por Bae et al. (2000), cuja estratégia foi obter uma proteína análoga à fitoquelatina natural, ou seja, com a mesma seqüência de aminoácidos, no entanto, sem a utilização de rotas enzimáticas ou moléculas precursoras para sua expressão, como é o caso das PCs, mas sim, pela expressão de um único gene codificador da seqüência de interesse (Figura 18) (BAE; MEHRA, 1997; BAE et al.; 2001; MEJÁRE et al., 1998). Desta forma, Bae et al. (2000) construíram genes codificadores de seqüências protéicas que continham 8, 11 e 20 repetições de ácido glutâmico e cisteína, que denominaram de fitoquelatinas sintéticas (ECs). A proteína EC com 20 repetições de ácido glutâmico e cisteína na cadeia peptídica (EC20) apresentou afinidade por íons de metais pesados de forma análoga às PCs naturais e muito superior às metalotioneínas e outros peptídeos já descritos na literatura. A grande habilidade das ECs em ligar metal deve-se ao alto conteúdo de cisteína na cadeia polipeptídica. Revisão Bibliográfica 58 Tendo em vista estes resultados, optou-se no presente trabalho em ancorar a fitoquelatina sintética EC20 na membrana externa de C. metallidurans CH34. A B Figura 18: A - Via biossintética da fitoquelatina natural (PC): 1) ácido glutâmico e cisteína são ligados pela γ-glutamilcisteína sintetase (γ-ECS) no carboxi-terminal do radical; 2) Glicina é incorporada na porção carboxi-terminal da cisteína através da glutationa sintase (GS) e 3) através da fitoquelatina sintase (PC sintase) ocorre a elongação da cadeia onde n = 211, dependendo do organismo. B – Estrutura química da fitoquelatina sintética (EC) onde a ligação peptídica entre o ácido glutâmico e a cisteína é feita entre o carboxi e o aminoterminal do carbono assimétrico (n= número de repetições de ácido glutâmico e cisteína). O carbono assimétrico está assinalado em vermelho. Modificado de Bae et al., (2000) e Mejàre; Bülow, (2001). Objetivo 59 3 OBJETIVO Realizar o melhoramento genético da bactéria Cupriavidus metallidurans CH34 no sentido de otimizar sua capacidade de adsorver íons de metais pesados na sua superfície. Para tanto, a fitoquelatina sintética (EC20sp) será expressa e ancorada na superfície dessa bactéria, utilizando o peptídeo sinal e o domínio de ancoragem do sistema de secreção da IgA protease de N. gonorrhoeae. Para atingir o objetivo geral deste trabalho, foram realizadas as seguintes etapas: 1. Construção in vitro do gene sintético da fitoquelatina EC20 destituído do códon de terminação de tradução, originando o gene EC20sp; 2. Fusão do gene EC20sp entre as seqüências codificadoras do peptídeo sinal e do domínio de ancoragem do sistema de secreção da IgA protease de N. gonorrhoeae (cassete de ancoragem da EC20sp); originando o plasmídeo pECβ; 3. Remoção do fragmento 6His do plasmídeo pECβ, originando o plasmídeo pCM1; 4. Expressão (sob o comando do promotor plac) e ancoragem da EC20sp na membrana externa de E. coli. Comparação entre a bactéria recombinante e a bactéria original quanto à capacidade de adsorver íons cádmio (Cd+2); 5. Seleção de um promotor de expressão forte e constitutiva em C. metallidurans CH34, utilizando o gene repórter da proteína verde fluorescente (EGFP). 6. Clonagem do promotor pan a montante do cassete de ancoragem da EC20sp (cassete de expressão-ancoragem da EC20sp), originando o plasmídeo pCM2; Objetivo 60 7. Análise da expressão (sob o comando do promotor pan) e ancoragem da EC20sp na membrana externa de C. metallidurans CH34 portadora do plasmídeo pCM2; 8. Avaliação da capacidade de C. metallidurans/pCM2 em adsorver Cd+2, Co+2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2 e Zn+2, em comparação à linhagem original; 9. Avaliação do crescimento das diferentes linhagens. Materiais e Métodos 61 4 MATERIAIS E MÉTODOS 4.1 Linhagens bacterianas e plasmídeos utilizados nesse trabalho Tabela 3: Linhagens bacterianas e plasmídeos utilizados neste trabalho. Linhagens Genótipo Referência Escherichia coli DH5∝ F`/endA1 hsdR17(rK mK ) glnV44 thi-1 recA1 gyrA r (Nal ) relA1 ∆ (lacIZYA-argF) U169 deoR (φ80dlac∆(lacZ) M15 Escherichia coli UT5600 ∆ ompT proC leu-6 trpE38 entA C. metallidurans CH34 Selvagem, pMOL28, pMOL30 ATTC -43123 C. metallidurans CH34 Selvagem, pMOL28, pMOL30 DSMZ-2839 Plasmídeos Características Referência pBBR1MCS Amplo espectro para Gram-negativas, Cm , Mob , ® múltiplo sítio de clonagem do pBluescript II KS-lacZ Kovach et al., (1994) Cm , seqüência sinal e β-domínio do sistema de secreção da protease de imunoglobulina A (IgA) de N. gonorrhoeae Veiga et al., (2002) - + Sambrook e Russell (2001) Veiga et al., (1999) ® R + TM R pHEβ ® pGEM -T Easy System I ® pCR 2.1-TOPO ® R Vetor de clonagem comercial, lacZ, Ap R Promega R Vetor de clonagem comercial, lacZ, Ap , Kan TM Invitrogen pLG Gene da proteína verde fluorescente ® clonado no vetor pGEM -T Easy pBBEGFP Gene EGFP clonado no vetor pBBR1MCS Quadros (2007) pBB-panEGFP Seqüência do promotor pan clonada no vetor pBBEGFP Ribeiro-dosSantos (Pedido de Patente n° 018080019207) pLEGFP (EGFP) Fragmento plac-EGFP do plasmídeo pLG clonado no vetor pBBR1MCS Quadros (2007) Este trabalho pTOPOP1 Seqüência do promotor do gene de proteína transmembrana de C. metallidurans CH34 clonado ® ® no vetor pCR 2.1-TOPO Este trabalho pTOPOP2 Seqüência do promotor do gene de citocromo D1 de ® C. metallidurans CH34 clonado no vetor pCR 2.1® TOPO Este trabalho pTOPOP3 Seqüência do promotor do gene da óxido nítrico redutase de C. metallidurans CH34 clonado no vetor ® ® pCR 2.1-TOPO Este trabalho Materiais e Métodos 62 Plasmídeos Características Referência pTOPOP4 Seqüência do promotor do gene de proteína transmembrana de C. metallidurans CH34 clonado ® ® no vetor pCR 2.1-TOPO Este trabalho pTOPOP5 Seqüência do promotor do gene da subunidade 50S de proteína ribossomal L6 de C. metallidurans CH34 ® ® clonado no vetor pCR 2.1-TOPO Este trabalho pTOPOP6 Seqüência do promotor do gene da subunidade 50S de proteína ribossomal L10 de C. metallidurans ® ® CH34 clonado no vetor pCR 2.1-TOPO Este trabalho pTOPOP7 Seqüência do promotor do gene czcI de C. ® metallidurans CH34 clonado no vetor pCR 2.1® TOPO Este trabalho pCMP1 Seqüência do promotor do gene de proteína transmembrana de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP2 Seqüência do promotor do gene de citocromo D1 de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP3 Seqüência do promotor do gene da óxido nítrico redutase de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP4 Seqüência do promotor do gene proteína transmembrana de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP5 Seqüência do promotor do gene da subunidade 50S de proteína ribossomal L6 de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP6 Seqüência do promotor do gene da subunidade 50S de proteína ribossomal L10 de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pCMP7 Seqüência do promotor do gene czcI de C. metallidurans CH34 subclonado no vetor pBBEGFP Este trabalho pGEMEC20sp Gene da fitoquelatina sintética (EC20sp) clonado no ® vetor pGEM -T Easy Este trabalho pECβ Gene EC20sp clonado no vetor pHEβ Este trabalho pCM1 Plasmídeo pECβ com alterações Este trabalho pTOPOANC Cassete de ancoragem da EC20sp amplificado por ® PCR do vetor pCM1 e clonado no vetor pCR 2.1® TOPO Este trabalho pCM2 Continuação da Tabela 3. Subclonagem do cassete de ancoragem da EC20sp do vetor pTOPOANC no plasmídeo pan-EGFP Este trabalho Materiais e Métodos 63 4.2 Iniciadores de PCR utilizados nesse trabalho Tabela 4: Iniciadores de PCR utilizados nesse trabalho*. Nome ec-a ec-b Seqüência 5`tttgatatctaatggaatgtgaatgtgaatgtgaatgtgaat gtgaatgtgaatgtgagtgtgaatgtgagtgcgaatgcgaa 3` Anelamento (°C) 72 Finalidade Construção do gene sintético EC20sp. 5`tttgtcgacaccacattcacattcacattcacattcacattc acattcgcattcacattcgcattcgcattcgcactc3` Seqüenciamento de insertos clonados nos vetores ® ® pGEM -T Easy e pCR 2.1® TOPO . T7 5’taatacgactcactataggg3’ 55 Pbeta 5`cattctaggtattacacgagc 3` 46 PmrgA 5`ccgcggttcggtatcgaaagc3` 60 Seqüenciamento do promotor pan clonado no plasmídeo pBBEGFP. P1F P1R 5`cggagctcctgaatgaactcgacgaag3` 5` tcccatatggacatctccagcgcggc3` 70 Amplificação de promotor do gene de proteína transmembrana. P2F P2R 5`ttccatatgccatgatttcgctttc3` 5`cgagctcgtgtgggtcctgttgcc3` 65 P3F P3R 5`ttccatatgggtcaaaacaacctag3` 5`cgagctcgaaaggtgaccgccagca3` 63 Amplificação de promotor do gene da óxido nítrico redutase. P4F P4R 5`cggagctcatcggcaacgtggaattc3` 5`tcccatatgcaaacaaatcctctgtg3` 65 Amplificação de promotor do gene de proteína transmembrana. P5F P5R 5`ttccatatgggtgttatcttcccaac3` 5`cgagctcgaaggtcgagatccaggaaaccc3` 63 Amplificação de promotor do gene da proteína ribossomal L6. P6F P6R 5`ttccatatgggttaagctccaaaacg3` 5`cgagctcgtgacggcaatcacttgaccg3` 65 Amplificação de promotor do gene de proteína ribossomal L10. P7F P7R 5`ttccatatgtccttgggagactgtgcgg3` 5`cggagctctgcgggcaactccgcatac3` 70 PancF PancR 5’cccatatgaaatacctattgcc3’ 5’ccaagcttttagaaacgaatctg3’ 50 Seqüenciamento plasmídeo pHEβ. do Amplificação de promotor do gene de citocromo D1. Amplificação de promotor do gene da proteína CzcI. Amplificação do cassete de ancoragem da EC20sp do vetor pCM1 * Todos os iniciadores de PCR foram desenhados nesse trabalho, exceto T7 que é um iniciador comercial. Materiais e Métodos 64 4.3 Descrição dos Plasmídeos 4.3.1 pBBR1MCS O plasmídeo pBBR1MCS foi construído por Kovach et al. (1994), através da subclonagem do múltiplo sítio de clonagem do vetor pBluescript® II KS (Stratagene), no vetor pBBR1CM isolado de Bordetella bronchiseptica (Figura 19). Trata-se de um plasmídeo de amplo espectro de hospedeiros para bactérias Gram-negativas, de tamanho pequeno (4,7 Kb), médio número de cópias, mobilizável e que permite a seleção de células recombinantes usando 5-bromo-4-cloro-3-indol-β-D- galactopiranosídeo (X-Gal) e isopropiltiogalactosídeo (IPTG). A sua seqüência está disponível nos bancos de dados do NCBI e apresenta grande estabilidade em C. metallidurans CH34 (SCHNEIDER et al., 2000; SZPIRER et al., 2001). Cedido pelo Prof. Dr. José Gregório C. Gómez (ICB/USP). Figura 19: Figura esquemática do plasmídeo pBBR1MCS. CM: gene de resistência a cloranfenicol; MOB: gene de mobilização; REP: origem de replicação, MCS: múltiplo sítio de clonagem e plac: promotor do operon de lactose. 4.3.2 pHEβ O plasmídeo pHEβ foi construído por Veiga et al (2002) (Figura 20). A construção foi realizada utilizando a seqüência codificadora do peptídeo sinal (PS) da IgA protease de N. gonorrhoeae, uma seqüência codificando seis resíduos de Materiais e Métodos 65 histidina, a seqüência de um epítopo (E-tag) e a seqüência do β-domínio da IgA protease de N. gonorrhoeae, capaz de ancorar-se na membrana externa de bactérias Gram-negativas. O cassete de ancoragem encontra-se sob o comando do promotor plac de E. coli. Cedido pelo Dr. Luis Angel Fernández Herrero do Centro Nacional de Biotecnologia de Madri, Espanha. Figura 20: Figura esquemática do plasmídeo pHEβ. CM: gene de resistência a cloranfenicol; lacI: gene codificador do repressor do promotor plac; plac: promotor do operon da lactose; PS: seqüência do peptídeo sinal do sistema de secreção da IgA protease de N. gonorrhoeae; 6His: seqüência codificadora de seis resíduos de histidina; E-tag: epítopo e IgAβ: seqüência do β-domínio da via de secreção da IgA protease de N. gonorrhoeae. A seqüência completa desse plasmídeo não está disponível nos bancos de dados do NCBI, conhecendo-se apenas a seqüência da âncora IgAβ; portanto, foi necessário seqüênciar parte da construção utilizando o iniciador de PCR Pbeta. 4.3.3 pGEM®-T Easy System I O vetor comercial pGEM®-T Easy System I (Promega) (Figura 21) é um sistema conveniente para clonagem de produtos de PCR, apresentando alto número de cópias, múltiplos sítios de clonagem e permite rápida seleção de recombinantes usando X-Gal e IPTG. Materiais e Métodos 66 r Figura 21: Figura esquemática do plasmídeo pGEM-T Easy e do múltiplo sítio de clonagem. Amp : gene de resistência a ampicilina; ori: origem de replicação; T7: sítio de início de transcrição da T7 RNA polimerase; SP6: sítio de início de transcrição da SP6 RNA polimerase. Figura extraída do catálogo do produto. 4.3.4 pCR®2.1-TOPO® O vetor comercial pCR®2.1-TOPO® (InvitrogenTM) (Figura 22) é um sistema rápido de clonagem de produtos de PCR que evita a recircularização do vetor pela atividade da topoisomerase I, apresenta múltiplos sítios de clonagem e permite rápida seleção de recombinantes usando X-gal e IPTG. Materiais e Métodos 67 r Figura 22: Figura esquemática do plasmídeo pCR2.1-TOPO e do múltiplo sítio de clonagem. Amp : r gene de resistência a ampicilina; Kan : gene de resistência a canamicina; Puc ori: origem de replicação do plasmídeo PUC; f1 ori: origem de replicação de fago; plac: promotor do operon da lactose, T7: sítio de início de transcrição da T7 RNA polimerase. Figura extraída do catálogo do produto. 4.3.5 pLG A construção desse plasmídeo foi realizada em nosso laboratório através da amplificação do gene repórter da proteína verde fluorescente (EGFP), utilizando como molde o vetor comercial pEGFP-N1 (CLONTECH), e a subseqüente clonagem do gene no plasmídeo pGEM®-T Easy. Para que o gene EGFP fosse expresso pelo promotor plac, esse plasmídeo foi digerido com as enzimas de restrição NdeI, SacI e com a enzima Klenow (fragmento Klenow da DNA Polimerase I, Biolabs®) e recircularizado (Figura 23) (QUADROS, 2007). A observação da fluorescência da EGFP foi realizada em microscópio de epifluorescência Leica DMLB. Materiais e Métodos 68 r Figura 23: Figura esquemática do plasmídeo pLG com o gene da EGFP clonado. Amp : gene de resistência a ampicilina; ori: origem de replicação; T7: sítio de início de transcrição da T7 RNA polimerase; SP6: sítio de início de transcrição da SP6 RNA polimerase. 4.3.6 pBBEGFP A construção desse plasmídeo foi realizada em nosso laboratório através da subclonagem do gene da EGFP no vetor pBBR1MCS (Figura 24) (QUADROS, 2007). Este vetor permite analisar a expressão da EGFP sob o controle de seqüências promotoras variadas, permitindo a quantificação do repórter e avaliação da força de expressão dos promotores. Figura 24: Figura esquemática do plasmídeo pBBEGFP. CM: gene de resistência a cloranfenicol; MOB: gene de mobilização; REP: origem de replicação; MCS: múltiplo sítio de clonagem e EGFP: gene da proteína verde fluorescente. Materiais e Métodos 69 4.3.7 pBB-panEGFP A construção desse plasmídeo foi realizada em nosso laboratório através da amplificação por PCR da seqüência promotora do gene mrgA de Bacillus subitilis com modificações (pan), a partir do DNA genômico dessa bactéria, e sua posterior clonagem no plasmídeo pBBEGFP (Figura 25) (Ribeiro-dos-Santos, Pedido de Patente n° 018080019207). A seqüência do promotor f oi confirmada por seqüenciamento e a observação da fluorescência foi realizada em microscópio de epifluorescência Leica DMLB. Figura 25: Figura esquemática do plasmídeo pBB-panEGFP. CM: gene de resistência a cloranfenicol; MOB: gene de mobilização; REP: origem de replicação; EGFP: gene da proteína verde fluorescente e pan: promotor do gene mrgA de Bacillus subtilis modificado. 4.4 Condições de cultivo das bactérias As linhagens de C. metallidurans CH34 foram cultivadas sob condições aeróbias em caldo nutriente (CN) a 28 ºC, conforme especificado pela coleção de culturas, ou em meio mínimo TSM (6.06 g/L de Tris, 4.68 g/L de NaCl, 1.49 g/L de KCI, 1.07 g/L de NH4Cl, 0.43 g/L de Na2SO4, 0.2 g/L de MgCl2 x 6H20, 0.03 g/L de CaC12 x 2H20, 0.23 g/L de Na2HPO4 x 12H20, 0.005 g/L de Fe(III)(NH4) citrato, 2% de gluconato de sódio (SIGMA), 1 mL de solução de elementos traço SL7, segundo Mergeay et al. (1985). Materiais e Métodos 70 As linhagens de E. coli foram cultivadas sob condições aeróbias em meio LB (triptona 10 g/L, extrato de levedura 5 g/L, NaCl 10 g/L) a 37 ºC. A seleção de transformantes foi realizada com meios suplementados com 25 µg/mL de cloranfenicol (pBBR1MCS e derivados), 40 µg/mL de cloranfenicol (pHEβ e derivados) ou 100 µg/mL de ampicilina (pGEM-T Easy, pCR-TOPO e derivados). Todos os meios sólidos continham 2% de ágar e foram esterilizados por autoclavagem a 121 ºC, 1 atm por 15 min. 4.5 Resistência de C. metallidurans CH34 a antibióticos A Mínima Concentração Inibitória (MIC) de C. metallidurans CH34 (DSMZ e ATCC) frente a diferentes antibióticos foi realizada utilizando meio CN contendo concentrações crescentes dos antibióticos ampicilina, canamicina, tetraciclina, neomicina e cloranfenicol (Tabela 5). Os experimentos foram realizados em triplicata a 28 °C, 180 rpm por 24 horas. Tabela 5: Concentrações dos antibióticos utilizados para avaliação da MIC de C. metallidurans CH34. Antibióticos Concentrações (µg/mL) Ampicilina 100 a 6000 Canamicina 100 a 20000 Cloranfenicol 100 a 230 Neomicina 100 a 5000 Tetraciclina 100 a 200 4.6 Efeito do pH no crescimento de C. metallidurans CH34 Um pré-inóculo de 50 mL de C. metallidurans CH34 em meio TSM (pH 6,0) foi cultivado a 28 °C, 180 rpm até DO 600nm = 0,6. Um volume de 1 mL dessa cultura foi utilizado para inocular 100 mL de meio TSM com diferentes pHs (3.0 a 10.0) e cultivado a 28 °C, 180 rpm por 80 horas. A cada 4 h , uma amostra de 1 mL foi retirada e medida em espectrofotômetro (Micronal B582). O pH do meio foi calibrado Materiais e Métodos 71 utilizando pHmetro (Denver-Instrument) e soluções de NaOH 1 M ou HCl 1M. O experimento foi realizado em triplicata. 4.7 MIC de C. metallidurans CH34 frente a íons de metais pesados A MIC das linhagens de C. metallidurans CH34 e recombinantes frente a íons de metais pesados foi realizada segundo Monchy et al. (2006b) com alterações. Uma cultura de C. metallidurans CH34 crescida por 32 h, 28 °C, 180 rpm em 50 mL de meio TSM (pH 5,0) foi diluída 5 x 104 vezes e 20 µL dessa diluição foram semeados no mesmo meio contendo diferentes concentrações de sais de metais pesados. A contagem de células viáveis foi determinada após 4 dias de crescimento a 28 °C. O experimento foi realizado em triplicata. Todas as soluções de sais de metais foram preparadas em uma concentração de 1 M e esterilizadas por filtração em membrana com poros 0,22 µm (Sartorius). 4.8 Extração de DNA genômico de C. metallidurans CH34 O DNA total de C. metallidurans CH34 foi isolado conforme descrito por Kieser et al. (2000) com modificações. Um pré-inoculo da bactéria C. metallidurans CH34 foi cultivado por 18 h, 28 °C, 200 rpm em 5 mL de caldo nutriente. Essa cultura foi centrifugada por 10min, 4 °C , 8000 g e o sedimento foi ressuspendido em 5 mL de TS (Sacarose 25% e Tris-HCl pH 8.0 50mM) e novamente centrifugado por 10 min, 4 °C, 8000 g. O sedimento foi novamente res suspendido em 1 mL de TS e dispensado em 10 tubos eppendorf com 100 µL/tubo. Adicionaram-se em cada tubo 50 µL de TE (20 mM Tris-HCl pH 8,0, 20 mM EDTA pH 8,0), 50 µL de lisozima (50 mg/mL), 36 µL de EDTA 0.5 M e 10 µL de RNAse (10 mg/mL) e incubou-se a 37 °C por 1 hora. Em seguida adicionaram-se 500 µL de TE e 28 µL de SDS (20 %) por tubo, agitando-se suavemente por inversão até a obtenção de um lisado claro. Um volume de 0,8 mL de fenol:clorofórmio (1:1, v/v) foi adicionado à solução agitando-se suavemente e em seguida centrifugou-se por 10 min, 4 °C, 8000 g. A solução aquosa foi separada e submetida novamente à extração por fenol:clorofórmio. O mesmo procedimento foi realizado com clorofórmio: isoamílico (24:1) por 2 vezes. O DNA total foi precipitado por 1 h a -20 °C pela adi ção de 50 µL de acetato de amônia 3M pH 5,0 e 1,1 mL de etanol absoluto gelado. A solução foi centrifugada por 15 Materiais e Métodos 72 min, 10000 g, 4 °C e o precipitado foi lavado com e tanol (70 %) por 3 vezes e ressuspendido em água MQ. 4.9 Extração e purificação de plasmídeos A extração e a purificação de plasmídeos foram realizadas de acordo com Sambrook e Russell (2001). Para o isolamento de grandes quantidades de DNA para manipulação genética, foi utilizado o protocolo de máxi-preparação e, para análise em pequena escala, foi utilizado o protocolo de mini-preparação. 4.9.1 Máxi-preparação Um pré-inóculo bacteriano em 2 mL de meio de cultura, suplementado com o antibiótico adequado, foi crescido por 16 horas, 37°C e 180 rpm e em seguida vertido em 200 mL do mesmo meio e cultivado por 16 horas nas mesmas condições. A cultura foi centrifugada por 10 min a 4 °C e 6000 g. O precipitado foi ressuspendido em 4 mL de solução 1 (EDTA 0,5 M pH 8.0, Tris-HCl 0,5 M pH 8.0,dextrose 0,5 M) e mantido por 15 min em gelo. Em seguida 8,0 mL de solução 2 (NaOH 1,0 M, SDS 1 %) foram adicionados, e a mistura foi mantida por 10 min a temperatura ambiente. Adicionaram-se então, 6,0 mL de solução 3 (11,5 % de ácido acético glacial, 60 % acetato de potássio 5 M), agitando levemente e mantendo por 10 min em gelo. O material foi centrifugado por 15 min a 4 °C e 8000 g. O sobrenadante foi recuperado e o precipitado descartado. Adicionaram-se 12 mL de isopropanol, e manteve-se a solução por 10 min à temperatura ambiente. Novamente o material foi centrifugado por 15 min a 4 °C e 8000 g. O precipitado foi ressuspendido em 1 mL de água Milli-Q e tratado com 10 µL de RNAse (10 mg/mL) por 30 min a 37 °C. Adicionaram-se em seguida 500 µL de fenol tamponado e centrifugou-se por 5 min a 4 °C e 10000 g. Transferiu-se a porção aquosa para outro tubo e adicionaram-se 500 µL de fenol:clorofórmio (24:1, v/v) e novamente centrifugou-se por 5 min a 4 °C e 10000 g. Porções de 500 µL da fase superior foram transferidas para novos tubos e o DNA das amostras foi precipitado adicionando-se 50 µL de acetato de amônia e 1100 µL de etanol absoluto gelado (precipitação com etanol). Os tubos foram mantidos por 1 h a 4 °C e então Materiais e Métodos 73 centrifugados por 10 min a 4 °C e 10000 g. O precipitado foi recuperado e lavado com etanol (70 %) e em seguida ressuspendido em água Milli-Q. 4.9.2 Mini-preparação Um inóculo bacteriano em 4 mL de meio de cultura, suplementado com o antibiótico adequado, foi crescido por 16 horas, 37 °C e 180 rpm. Um volume de 2 mL dessa cultura foi centrifugado por 2 min a 8000 g. O precipitado foi ressuspendido em 300 µL de solução 1 (EDTA 0,5 M pH 8.0, Tris-HCl 0,5 M pH 8.0,dextrose 0,5 M) e em seguida 300 µL de solução 2 (NaOH 1,0 M, SDS 1 %) foram adicionados, e a mistura foi mantida por 5 min à temperatura ambiente. Adicionaram-se então, 300 µL de solução 3 (11,5 % de ácido acético glacial, 60 % acetato de potássio 5 M), agitando levemente e mantendo por 10 min em gelo. O material foi centrifugado por 15 min a 4 °C e 10000 g. O sobrenadante foi recuperado e o precipitado descartado. Adicionaram-se 10 µL de RNAse (10 mg/mL) e incubou-se por 30 min a 37 °C. Em seguida adicionaram-se 750 µL de clorofórmio:álcool isoamílico (24:1, v/v) e novamente centrifugou-se por 2 min a 4°C e 10000 g. A fase aquosa foi recuperada e adicionaram-se 600 µL de isopropanol incubando por 30 min à temperatura ambiente e então centrifugou-se por 15 min a 4°C e 10000 g. O precipitado foi lavado com etanol (70%) e em seguida ressuspendido em água Milli-Q. 4.10 Análise eletroforética de DNA em gel de agarose e purificação de fragmentos A análise e a separação de fragmentos de DNA foi realizada em géis de agarose 0,7 % ou 1,0% contendo 0,5 µg/mL de brometo de etídio, submetido a 80 V por 2 horas em tampão de corrida TBE (Tris 89 mM, ácido bórico 89 mM, EDTA 20 mM pH 8,0). A quantificação do DNA presente nas amostras foi realizada por comparação por intensidade da fluorescência da amostra com aquela exibida por λDNA de concentração conhecida e marcador molecular DNA Ladder 100 pb e 1000 pb (Fermentas®). Para isolar um fragmento de DNA a partir do gel de agarose, após a eletroforese, cortou-se diretamente desse gel a banda referente ao fragmento alvo Materiais e Métodos 74 sob visualização de luz ultravioleta (UV) e o DNA foi isolado utilizando Kit de eluição Wizard SV Gel and PCR Clean-Up System (Promega). 4.11 Clivagem dos plasmídeos e fragmentos de DNA com enzimas de restrição A digestão dos plasmídeos com enzimas de restrição foi realizada seguindo as instruções do fabricante. Todas as enzimas de restrição utilizadas foram da marca Fermentas®. 4.12 Preparação de células eletrocompetentes Células eletrocompetentes de C. metallidurans CH34 foram preparadas conforme Taghavi et al. (1994). Células de C. metallidurans CH34 foram cultivadas por 16 horas, a 30 ºC e 180 rpm em 5mL de SOB (triptona 20 g/L, extrato de levedura 5 g/L, NaCl 0,5 g/L, 10 mL KCl 250 mM). Em seguida essa cultura foi vertida em 500 mL de meio SOB e cultivada a 30ºC sob agitação (180 rpm) até uma DO600ηm de 0,8. As células foram coletadas e lavadas duas vezes com água gelada Milli-Q contendo 10 % (v/v) de glicerol. Em seguida as células foram concentradas em 1 mL de glicerol a 10% (v/v), aliquotadas em 40µL e estocadas a -70 ºC. Células eletrocompetentes de E.coli DH5α foram preparadas conforme Sambrook e Russell (2001). Células de E.coli DH5α ou E. coli UT5600 foram cultivadas por 16 horas, a 37 ºC e 180 rpm em 5 mL de LB. Em seguida a cultura foi vertida em 500 mL de meio LB e cultivada a 37ºC sob agitação (180 rpm) até uma DO600ηm de 0,5. As células foram coletadas por centrifugação e lavadas duas vezes com água gelada Milli-Q contendo 10% (v/v) de glicerol. Em seguida as células foram concentradas em 1 mL de glicerol a 10% (v/v), aliquotadas em 40 µL e estocadas a -70 ºC. 4.13 Transformação de bactérias por eletroporação A eletroporação das linhagens de E.coli e de C. metallidurans CH34 foi realizada utilizando cubetas de 1,0 mL e Bio-Rad Gene Pulser com os seguintes ajustes: voltagem de 2500 V, 2000 ohms de resistência e 25 µF de capacitância. Foram utilizados 100 ηg de vetor ou 2 µL de cada mistura de ligação para cada 40 Materiais e Métodos 75 µL de células competentes. Após a eletroporação, as células foram ressuspendidas em 1mL de meio SOC, incubadas por 1 h, 180 rpm a 28 ºC, se C. metallidurans CH34 e a 37 ºC, se E. coli. Em seguida as células foram semeadas em meios seletivos, que permitissem a identificação dos clones transformantes. 4.14 Construção do gene sintético da Fitoquelatina sem o códon de terminação de síntese protéica (EC20sp) O gene sintético codificando a EC20sp foi preparado baseado em Bae et al. (2000) com modificações. Dois oligonucleotídeos, ec-a e ec-b, foram misturados e submetidos a uma reação de PCR. O PCR foi realizado com 2 µL de ec-a (10pM), 2 µL de ec-b (10 pM), 0,4µL de dNTPs (25 mM cada), 1,5 µL de MgCl2 (50 mM), 5 µL tampão Taq 10X e 2 U de Taq DNA polimerase (Invitrogen®) em um volume final de 50 µL. A reação foi transferida para um Termociclador (MJ-Research PTC-200) e a amplificação foi realizada com 30 ciclos de 96 ºC por 90 segundos, 72 ºC por 120 segundos, seguido por um período de extensão de 10 min a 72 ºC. A reação foi analisada em gel de agarose submetido à eletroforese e o fragmento amplificado foi quantificado através de comparação com marcador de DNA 100 pb e λDNA (100 ηg). Esse fragmento foi clonado no vetor pGEM®-T Easy. A quantidade de produto de PCR utilizada nesta clonagem foi calculada pela Equação I. A mistura de ligação foi realizada com 50 ηg de produto amplificado, 50 ηg de vetor pGEM®-T Easy, 5 µL de tampão da T4 DNA ligase, 3 U de T4 DNA ligase para um volume final de 10 µL. As reações foram mantidas por 16 horas a 4 ºC e 2 µL foram utilizados para eletroporar células eletrocompetentes de E. coli DH5α. Eq I: ηg vetor x tamanho do inserto (Kb) x 3 inserto = ηg de inserto Tamanho do vetor (Kb) vetor Os transformantes foram selecionados em meio LB suplementado com 100 µg/mL de ampicilina, 0,2 mg/mL de X-Gal e 0,08 mg/mL de IPTG. Colônias brancas tiveram o DNA plasmidial isolado e clivados com as enzimas EcoRV e SalI. Após eletroforese, os perfis de migração dos fragmentos foram analisados e aqueles clones que apresentaram insertos foram seqüenciados utilizando o iniciador de PCR Materiais e Métodos 76 T7 (Promega). Todas as reações de seqüenciamento foram realizadas no Departamento de Genoma Humano do Instituto de Biociências da USP. 4.15 Construção do cassete de ancoragem da EC20sp A construção do cassete de ancoragem da EC20sp foi realizada utilizando o plasmídeo pHEβ. Este plasmídeo foi digerido com as enzimas de restrição EcoRI e SalI por 16 h a 37 °C e o DNA recuperado por precipita ção com etanol. O plasmídeo pGEMEC20sp foi submetido a uma digestão dupla com as mesmas enzimas de restrição, EcoRI e Sal I, por 16 horas a 37 °C e o fragmento corresponden te ao gene EC20sp recuperado por eluição de gel de agarose. O plasmídeo digerido e o fragmento EC20sp foram quantificados em gel de agarose e usados em uma mistura de ligação. Foram utilizados 50 ηg do gene EC20sp e 100 ηg do vetor pHEβ, 1 µL tampão da T4 DNA ligase, 3 U de T4 DNA ligase em um volume final de 10 µL. Células eletrocompetentes de E. coli foram eletroporadas com 2 µL da mistura de ligação e plaqueadas em meio seletivo. O DNA plasmidial de 50 transformantes obtidos foi isolado e submetido à análise de restrição, utilizando as enzimas BglI, EcoRI, EcoRV, SalI e SpeI. A análise dos perfis de migração dos fragmentos em gel de agarose foi realizada e o vetor construído foi chamado pECβ. O plasmídeo pECβ foi digerido com a enzima BglI e o DNA recuperado por precipitação por etanol. Em seguida esse DNA foi tratado com a enzima Klenow, para produzir extremidades abruptas, e novamente precipitado com etanol. O DNA foi digerido com a enzima de restrição EcoRV por 16 h a 37 °C e o fragmento referente ao plasmídeo foi isolado por eluição de gel de agarose. A recircularização do plasmídeo foi realizada utilizando 200 ηg de plasmídeo, 1 µL de tampão da T4 DNA ligase, 3 U de T4 DNA ligase em um volume final de 10 µL. A reação foi mantida por 16 horas a 4 ºC e 2 µL foram utilizados para eletroporar células de E. coli DH5α eletrocompetentes. Para confirmar a seqüência correta, o cassete de ancoragem foi seqüenciado utilizando o oligonucleotídeo Pbeta. Materiais e Métodos 77 4.16 Análise da expressão do cassete de ancoragem da EC20sp 4.16.1 Caracterização do perfil protéico através de SDS-PAGE A caracterização do perfil protéico das células foi realizada por eletroforese em gel de poliacrilamida na presença de duodecil sulfato de sódio (SDS-PAGE), em sistema descontínuo, a partir do protocolo descrito por Studier (1973) com alterações. As linhagens de E. coli foram cultivadas em 5 mL de meio LB a 37°C, 180 rpm até DO600nm de 0,5 e em seguida induzidas com 0,08 mg/mL de IPTG por 3 h nas mesmas condições, e por fim centrifugadas a 10000 g, 4 °C por 10 min. As linhagens de C. metallidurans CH34 foram cultivadas em 5 mL de meio CN a 28 °C, 180 rpm até DO600nm de 1,0 e em seguida centrifugadas a 10000 g, 4 °C por 10 min. O sedimento de cada amostra foi diluído em tampão de amostra (240 mM TRIS pH 6.8, 0,8% SDS, 200 mM 2-mercaptoetanol, 40% glicerol, 0,02% azul de bromofenol) e fervido por 7 min a 100 °C, para a desnaturação d as proteínas. As soluções utilizadas na preparação do gel de poliacrilamida foram: • Solução A: 30% de acrilamida (p/v) e 0,5% de bisacrilamida (p/v) em água destilada, armazenada a 4°C em frasco âmbar. • Solução B: Tris-HCl 1,5 M pH 8.8 • Solução C: 28,5% de acrilamida (p/v) e 1,5% de bisacrilamida (p/v) em água destilada, armazenada a 4°C em frasco âmbar. • Solução D: Tris-HCl 0,5 M pH 6.8 O gel de separação (12,5%) foi preparado com 3,12 mL de solução A, 2,0 mL de solução B, 2,28 mL de H2O, 74 µL SDS 10%, 74 µL persulfato de amônio 10% (PSA) e 5 µL de TEMED e o gel de empilhamento com 0,58 mL de solução C, 0,44 mL de solução D, 2,28 mL de H2O, 34 µL SDS 10%, 34 µL PSA 10% e 5 µL de TEMED. A eletroforese foi realizada a 120 mA até que as proteínas atingissem o final do gel de separação. Após a corrida eletroforética, o gel foi imerso em corante para proteínas por 1 h (1 mg/mL de Comassie Blue em etanol, 10% de ácido acético) e em seguida descorado em água fervente. Materiais e Métodos 78 4.16.2 Separação de membranas e Western –blotting A separação de membranas foi realizada conforme Veiga et al. (1999) com modificações. As linhagens de E. coli foram cultivadas em 10 mL de meio LB contendo 2% de glicose a 30ºC, 180 rpm até atingir uma DO600 igual a 0,5. As células foram coletadas por centrifugação a 5000 g por 5 min e ressuspendidas em 10 mL de meio LB contendo 0,08 mg/mL de IPTG e cultivadas por 3 h a 30ºC e 180 rpm. As linhagens de C. metallidurans CH34 foram cultivadas em CN até DO600 igual a 1,0. As células de cada experimento foram coletadas por centrifugação a 5000 g por 5 min e o sedimento ressuspendido em 5 mL de tampão fosfato de sódio pH 6,8 (NaH2PO4 x H2O) e lisadas por sonicação utilizando seis pulsos de 30 s. Células não rompidas foram removidas por centrifugação a 5000 g por 5 min e o sobrenadante foi centrifugado por 1 h, 30000rpm, 4°C para recupe rar a fração de proteínas de membrana. Esse sobrenadante foi considerado a fração solúvel. O sedimento foi ressuspendido em 1 mL de tampão fosfato de sódio contendo 1,5% de Triton X-100 e incubado por 30 min a 4°C. A solução foi centrifu gada por 30 min em 55000rpm, 4°C e o sobrenadante foi considerado a fração de me mbrana interna e o sedimento a fração de membrana externa. 50 µL de tampão de amostra foi adicionado nas diferentes frações e fervidas por 7 min a 100 °C, p ara a desnaturação das proteínas e em seguida submetidas a eletroforese em gel de poliacrilamida. Os fragmentos protéicos do gel foram transferidos para uma membrana de nitrocelulose (HybondTM-C Extra -Amersham Biosciences) usando sistema de transferência molhada (Bio-Rad). A membrana foi incubada por 16 h e 4°C com solução bloqueadora (PBS; 0,05% Tween 20; 5% leite em pó) e submetida a três lavagens de 5 min cada, com 50 mL de PBS contendo 0,05% Tween 20. Para detecção da proteína foi utilizado 1µg/mL de anticorpo anti-E-tag (Amersham Biosciences) em solução bloqueadora (PBS; 0,05% Tween 20; 5% leite em pó) por 90 min à temperatura ambiente, sob moderada agitação. Novamente a membrana foi submetida a três lavagens de 5 min cada, com 50 mL de PBS contendo 0,05% Tween 20. Adicionou-se o anticorpo secundário anti-mouse IgG peroxidase (Sigma) na concentração de 0,03 U/mL incubando a membrana por 90 min. O excesso de anticorpo foi retirado com novo ciclo de lavagens com PBS contendo 0,05% Tween. Um filme (Kodak-RX) foi utilizado para evidenciar as proteínas que interagiram com o anticorpo, e submetido à lavagem com solução cromógena à temperatura Materiais e Métodos 79 ambiente. A revelação foi interrompida quando apareceram as bandas e o filme lavado com água destilada. 4.16.3 Bioacúmulo de íons de metais pesados pelas linhagens expressando o cassete de ancoragem da EC20sp A determinação do acúmulo de metal pelas linhagens bacterianas foi realizada de acordo com Hernández et al. (1998) com algumas modificações. As linhagens de E. coli foram cultivadas em 20 mL de meio LB suplementado com 2% glicose até atingir DO600 igual a 0,5. As células foram coletadas por centrifugação e ressuspendidas no mesmo meio contendo 0,08 mg/mL de IPTG e cultivadas a 28°C e 180 rpm até atingir DO600 1,5. As linhagens de C. metallidurans foram cultivadas em 200 mL de meio TSM contendo ou não Cd+2 (50 µM), a 28 °C e 180 rpm até atingir DO600 igual a 1,0. As células de cada experimento foram centrifugadas a 10.000 g, 4 °C por 10 min. O sedimento foi ressuspe ndido em 2 mL de solução salina e dividido em duas alíquotas de 1 mL em tubo eppendorf. O material celular foi novamente centrifugado a 10000 g, 4 °C por 10 m in. O sedimento de um tubo foi seco em centrífuga do tipo “Speed Vac” (Savant SVC-100H) e pesado enquanto o sedimento do outro tubo foi ressuspendido em 10 mL de água Milli-Q contendo Cd+2 (100 µM e 1000 µM). As linhagens de E. coli foram incubadas por 2 h enquanto as linhagens de C. metallidurans foram incubadas por 2, 6, 12 ou 24 h, todas sob agitação de 180 rpm a 28 °C. Após o tempo de incuba ção, as células foram coletadas por centrifugação e a quantidade de metal pesado no sobrenadante foi medida através de espectrofotometria de emissão atômica (ICP-AES) no Instituto de Química da Universidade de São Paulo. Todos os experimentos foram realizados em duplicata. Após definido o melhor tempo de incubação em solução contendo metal pesado, as linhagens de C. metallidurans CH34 foram cultivadas nas mesmas condições anteriores na presença ou ausência de metais pesados. Em cada cultura foi adicionado apenas uma espécie de metal na concentração de 300 µM para Cd+2, Co+2, Mn+2 e Zn+2, 128 µM para Ni+2, 1 µM para Hg+2 e 100 µM para Cu+2 e Pb+2. Em uma cultura foi adicionado todos os íons de metais na concentração de 10 µM. Após atingir DO600 igual a 1,0, o sedimento dessas culturas foi coletado por centrifugação e incubado com soluções aquosas dos metais por 24 h na concentração de 1000 µM Materiais e Métodos 80 para Cd+2, Co+2, Cu+2, Mn+2, Ni+2 e Zn+2 e Pb+2 e 50 µM para Hg+2. Células advindas de cada experimento foram semeadas em ágar nutriente antes e depois do tratamento com metais para avaliação da viabilidade celular. O sedimento advindo da cultura contendo todos os íons de metais foi incubado em solução contendo Cd+2, Co+2, Mn+2, Zn+2, Ni+2, Hg+2, Cu+2 e Pb+2 na concentração de 100 µM. Após 24 h de incubação, as células foram coletadas por centrifugação e a quantidade de metal foi medida na massa microbiana (digerida com ácido nítrico 70% (v,v), por 16 h) através de espectrometria de massas de alta resolução com fonte de plasma indutivamente ativado (ICP-MS) no Instituto de Pesquisas Energéticas e Nucleares (IPEN). Todos os experimentos foram realizados em duplicata. 4.17 Amplificação e clonagem de regiões promotoras a partir do DNA total de C. metallidurans CH34 A amplificação por PCR das regiões promotoras de C. metallidurans CH34 foi realizada utilizando DNA total dessa bactéria (item 4.8). O PCR foi realizado com 150 ηg de DNA genômico, 2µL de cada primer (10pM), 0,4µL de dNTPs (25mM cada), 1,5µL de MgCl2 (50mM), 5 µL tampão Taq 10X e 2 U de Taq DNA polimerase (Invitrogen®) em um volume final de 50µL. A reação foi transferida para um Termociclador (MJ-Research PTC-200) e a amplificação foi realizada com 30 ciclos de 96 ºC por 90 segundos, 2 min na temperatura de anelamento de cada par de iniciadores (Tabela 4) e 90 segundos a 72 ºC, seguido por um período de extensão de 10 min a 72 ºC. Os produtos de PCR foram analisados em gel de agarose submetido à eletroforese e os fragmentos amplificados foram quantificados através de comparação com marcador de DNA 100pb e λDNA (100 ηg). Esses fragmentos foram clonados no vetor pCR®2.1-TOPO® conforme catálogo do produto. A mistura de ligação foi realizada com 50 ηg de produto amplificado, 10 ηg de vetor pCR®2.1TOPO®, 50 mM de NaCl e 2,5 mM de MgCl2 para um volume final de 6 µL. As reações foram mantidas por 5 min à temperatura ambiente e 2 µL foram utilizados para transformar células eletrocompetentes de E. coli DH5α. Os transformantes foram selecionados em meio LB suplementado com 100 µg/mL de ampicilina, 0,2 mg/mL de X-Gal e 0,08 mg/mL de IPTG. Cinco colônias brancas obtidas em cada transformação tiveram o DNA plasmidial isolado e clivado Materiais e Métodos 81 com as enzimas NdeI e SacI. O perfil de migração dos fragmentos foi analisado em gel de agarose submetido à eletroforese. As regiões promotoras clonadas no vetor pCR®2.1-TOPO® foram subclonadas no plasmídeo pBBEGFP. Para tanto, o isolamento de cada promotor foi realizado através da digestão dos plasmídeos pTOPOP1 a pTOPOP7 com as enzimas de restrição NdeI e SacI e, após corrida eletroforética em gel de agarose, os fragmentos referentes a cada promotor foram eluídos do gel. O vetor pBBEGFP também foi digerido com as mesmas enzimas, NdeI e SacI, e utilizado para ligar a cada promotor. A mistura de ligação foi realizada com 50 ηg de DNA de cada promotor, 100 ηg de vetor pBBEGFP digerido, 1 µL tampão da T4 DNA ligase, 3 U de T4 DNA ligase em um volume final de 10 µL. Células eletrocompetentes de E. coli foram eletroporadas com 2 µL da mistura de ligação e plaqueadas em meio seletivo. Cinco colônias resistentes a cloranfenicol em cada transformação tiveram o DNA plasmidial isolado e digerido com as enzimas NdeI e SacI. O perfil de migração dos fragmentos em gel de agarose submetido à eletroforese foi analisado. 4.18 Construção do plasmídeo pLEGFP A construção do plasmídeo pLEGFP foi realizada através da digestão do plasmídeo pLG com as enzimas de restrição VspI e XhoI, que liberou um fragmento de 950 pb referente ao plac-EGFP, o qual foi eluído de gel de agarose após corrida eletroforética. O vetor pBBR1MCS também foi digerido com as mesmas enzimas, VspI e XhoI, e utilizado em uma mistura de ligação com o fragmento plac-EGFP. A mistura de ligação foi realizada com 50 ηg de DNA de cada promotor, 100 ηg de vetor pBBR1MCS, 1 µL tampão da T4 DNA ligase, 3 U de T4 DNA ligase em um volume final de 10 µL. Células eletrocompetentes de E. coli foram eletroporadas com 2 µL da mistura de ligação e plaqueadas em meio seletivo. Cinco colônias resistentes a cloranfenicol tiveram o DNA plasmidial isolado e digerido com as enzimas VspI e XhoI. O perfil de migração dos fragmentos em gel de agarose submetido à eletroforese foi analisado. Materiais e Métodos 82 4.19 Quantificação da expressão da proteína verde fluorescente em E. coli e C. metallidurans CH34 através de citometria de fluxo Os plasmídeos pBBR1MCS, pBBEGFP, pCMP1, pCMP2, pCMP3, pCMP4, pCMP5, pCMP6, pCMP7, pLEGFP e pBB-panEGFP foram utilizados para transformar células de C. metallidurans CH34 por eletroporação. Foram utilizados 100 ηg de cada plasmídeo em cada transformação. A expressão da EGFP sob o controle de cada região promotora foi primeiramente observada em lâmina em microscópio de epifluorescência Leica DMLB e, posteriormente, quantificada em citômetro de fluxo (Citômetro Beckman Coulter Cytomics FC500MPL) em células recombinantes de E. coli e C. metallidurans CH34 na fase exponencial de crescimento (DO600 = 1,2) na presença ou ausência de íons de metais pesados. Células de E. coli e C. metallidurans CH34 carregando os plasmídeos pBBR1MCS, pBBEGFP foram utilizadas como controle do experimento. Células de C. metallidurans CH34 carregando as construções pCMP1 a pCMP7 foram cultivadas em meio TSM até DO=1,2 e em seguida, foram adicionados às culturas íons Ni+2 (1 mM), Zn+2 (1 mM) ou Cu+2 (0,5 mM) e incubadas por 3 h a 28 °C e 180 rpm. Células de C. metallidurans CH34 carregando a construção pBB-panEGFP foram cultivadas na presença ou ausência de apenas um tipo de íon de metal pesado na concentração de 1mM de Co+2, Zn+2, Ni+2, Fe+2, Cd+2, Cu+2, Mn+2 ou Pb+2. Para Hg+2 a concentração utilizada foi de 1 µM. Células de E. coli carregando a construção pBB-panEGFP foram cultivadas em meio LB contendo 1 mM de Fe+2 ou 1 mM de Mn+2. Células de E. coli e C. metallidurans CH34 carregando o vetor pLEGFP foram cultivadas em meio LB contendo 1% de glicose ou 0,08 mg/mL de IPTG. Um volume de 1 mL de células foi coletado em cada tratamento e centrifugado por 2 min a 10000 g. O sedimento foi lavado com tampão PBS (9 mg/mL de NaCl, 0,32 mg/mL de NaH2PO4, 1,09 mg/mL de Na2HPO4, pH 7.0,) e após nova centrifugação foi ressuspendido em 1 mL de solução de PBS contendo 3,7% de paraformaldeído. Foram analisados 30 000 eventos para células de E. coli e 50 000 eventos para células de C. metallidurans CH34. A leitura da fluorescência da EGFP foi Materiais e Métodos 83 realizada com feixe de laser em 489 ηm de comprimento de onda e a leitura da emissão foi realizada a 509 ηm. A quantificação foi estimada pela intensidade média de fluorescência por célula em cada linhagem. 4.20 Construção do cassete de expressão-ancoragem da EC20sp A construção do cassete de expressão-ancoragem da EC20sp foi realizada utilizando o plasmídeo pCM1 como molde para amplificação do cassete de ancoragem. O PCR foi realizado utilizando 150 ηg do plasmídeo pCM1, 2 µL de PancR (10 pM), 2 µL de PancF (10 pM), 0,4 µL de dNTPs (25 mM cada), 1,5 µL de MgCl2 (50 mM), 5 µL tampão Taq 10X e 2 U de Taq DNA polimerase (Invitrogen®) em um volume final de 50 µL. A reação foi transferida para um Termociclador (MJResearch PTC-200) e a amplificação foi realizada com 30 ciclos de 96 ºC por 90 segundos, 2 min na temperatura de anelamento e 90 segundos a 72 ºC, seguido por um período de extensão de 10 min a 72 ºC. O produto de PCR foi analisado em gel de agarose submetido à eletroforese e quantificado através de comparação com marcador de DNA 100pb e λDNA (100 ηg). Esse fragmento foi clonado no vetor pCR®2.1-TOPO® conforme catálogo do produto. A mistura de ligação foi realizada com 50 ηg de produto amplificado, 10 ηg de vetor pCR®2.1-TOPO®, 50 mM de NaCl e 2,5 mM de MgCl2 para um volume final de 6 µL. As reações foram mantidas por 5 min à temperatura ambiente e 2 µL foram utilizados para transformar células eletrocompetentes de E. coli DH5α. Os transformantes foram selecionados em meio LB suplementado com 100 µg/mL de ampicilina, 0,2 mg/mL de X-Gal e 0,08 mg/mL de IPTG. Cinco colônias brancas tiveram o DNA plasmidial isolado e clivado com a enzima EcoRI. O perfil de migração dos fragmentos no gel foi analisado após eletroforese. O vetor construído foi chamado pTOPOANC. O isolamento do cassete de ancoragem foi realizado através da digestão do vetor pTOPOANC com as enzimas de restrição NdeI e KpnI e subseqüente eluição desse fragmento do gel de agarose após eletroforese. O vetor pan-EGFP também foi digerido com as mesmas enzimas, NdeI e KpnI, para a retirada do gene EGFP e isolado por eluição. A mistura de ligação foi realizada com 50 ηg de DNA do vetor pan-EGFP, 100 ηg do cassete de ancoragem, 1 µL tampão da T4 DNA ligase, 3 U de T4 DNA Materiais e Métodos 84 ligase em um volume final de 10 µL. Células eletrocompetentes de E. coli foram eletroporadas com 2 µL da mistura de ligação e plaqueadas em meio seletivo. Cinco transformantes resistentes a cloranfenicol tiveram o DNA plasmidial isolado e clivado com a enzimas SacI, NdeI, SalI, HindIII e KpnI. Duplas digestões foram realizadas com NdeI e HindIII, SacI e SalI e também uma digestão tripla com SacI, NdeI e HindIII. O perfil de migração dos fragmentos no gel após eletroforese. O vetor construído foi chamado pCM2. 4.21 Análise das linhagens de C. metallidurans CH34 por Microscopia Eletrônica de Transmissão Células de C. metallidurans CH34 e C. metallidurans CH34/pCM2 foram cultivadas em meio TSM contendo ou não 100 µM de Pb+2, até atingir DO600nm 1.0 e, em seguida, centrifugadas a 6000 g por 2 min. O sedimento bacteriano de cada linhagem foi incubado em 2 mL de água MilliQ contendo 1 mM de Hg+2 durante 24 h, a 28 °C e 180 rpm. Novamente, a solução foi centrif ugada a 6000 g por 2 min e o sedimento bacteriano foi submetido a procedimentos para preparo de cortes histológicos, seguindo as seguintes etapas: • Fixação: o sedimento bacteriano de cada cultura foi incubado por 2 h em glutaraldeído 2% em solução tampão cacodilato de sódio. Em seguida, o sedimento foi incubado com tetraóxido de ósmio (OsO4) 2% em solução tampão cacodilato de sódio. Por fim, o sedimento foi incubado em solução aquosa contendo 0,5% de uranila e 10,56% de sacarose por 16 h. • Desidratação: o sedimento bacteriano foi desidratado por meio de sucessivas lavagens com álcool. A primeira lavagem foi realizada por 2 vezes em álcool 70% por 10 min; a segunda lavagem foi realizada por 2 vezes em álcool 95% por 10 min; a terceira lavagem foi realizada por 4 vezes em álcool absoluto por 10 min. Por fim, o sedimento foi tratado por 2 vezes com óxido de propileno por 10 min. • Inclusão: uma mistura de resina de inclusão e óxido de propileno 1:1 (v,v) foi incubada por 16 h e, em seguida, foi adicionada uma porção de resina de inclusão pura e a mistura final foi incubada durante 6 h. O sedimento bacteriano foi homogeneizado com esta resina e incubado por 48 h a 72 ºC para polimerização. Os blocos de resina contendo os sedimentos bacterianos foram submetidos a cortes histológicos em ultramicrotomo (Leica Ultracut R) com espessura de 70 ηm. Materiais e Métodos 85 Os cortes histológicos foram fixados em grides de ouro de 200 mesh. A contrastação das estruturas celulares foi realizada pela incubação dos grides contendo os cortes histológicos por 5 min em solução de citrato de chumbo, seguida de nova incubação por 5 min em solução de acetato de uranila. Uma duplicata de cada amostra foi fixada em grides de cobre sem o tratamento de contrastação. A observação dos cortes histológicos foi realizada em Microscópio Eletrônico de Transmissão (LEO 906E) no Laboratório de Biologia Celular do Instituto Butantan. Resultados 86 5 RESULTADOS 5.1 Caracterização fisiológica de C. metallidurans CH34 5.1.1 Resistência a antibióticos Para realizar a manipulação genética em C. metallidurans CH34, foi necessário inicialmente conhecer a sua resistência a antibióticos. Foram avaliadas duas linhagens de C. metallidurans CH34, adquiridas das coleções de cultura DSMZ e ATCC. Como se pode observar pelos resultados da Tabela 6, houve uma grande discrepância entre as resistências das duas linhagens. As duas linhagens cresceram em meio de cultura contendo 5000 µg/mL de neomicina e concentrações maiores não foram avaliadas por não permitir a seleção de transformantes nessa concentração. Quando o antibiótico utilizado foi canamicina, a linhagem DSMZ cresceu em meio contendo 20.000 µg/mL, no entanto, a linhagem ATCC apresentou MIC em meio contendo 1500 µg/mL desse antibiótico. Para o antibiótico ampicilina, verificou-se que a linhagem ATCC apresentou MIC de 1000 µg/mL enquanto a linhagem DSMZ apresentou MIC de 6000 µg/mL. Por fim, foram examinadas as resistências aos antibióticos tetraciclina e cloranfenicol. Os resultados mostraram que a MIC para tetraciclina da linhagem ATCC foi de 100 µg/mL e de 200 µg/mL para da linhagem DSMZ. Para cloranfenicol, os valores das MICs foram 230 µg/mL para a linhagem ATCC e 170 µg/mL para a linhagem DSMZ. Devido à maior sensibilidade aos antibióticos mostrada pela linhagem C. metallidurans CH34 da coleção ATCC, os experimentos subseqüentes desse trabalho utilizaram esta linhagem. Resultados 87 Tabela 6: Resistência das linhagens de C. metallidurans CH34 provenientes das coleções ATCC e DSMZ frente a diferentes antibióticos. Antibiótico C. metallidurans CH34- MIC (µg/mL) ATCC DSMZ Ampicilina 1000 6000 Canamicina 1500 >20000 Tetraciclina 100 200 Neomicina >5000 >5000 Cloranfenicol 230 170 5.1.2 Efeito do pH no crescimento de C. metallidurans CH34 C. metallidurans CH34 foi cultivada em meio TSM com pH entre 3.0 e 10.0, a fim de estabelecer o pH ótimo de crescimento dessa bactéria. Na Figura 26, podese observar que o crescimento da massa microbiana de C. metallidurans CH34 em meio TSM com pH 4.0, 5.0 e 6.0 apresentou menores fases lag em comparação aos outros pHs e, com fase exponencial de crescimento se iniciando em 20 h de cultivo e se estendo até 32 h em pH 5.0 e até 36 h em pH 4.0 e 6.0. O crescimento ótimo dessa bactéria ocorreu em meio com pH 5.0, atingindo máximo valor de densidade ótica (DO), ou seja, máximo número de células em suspensão (1,4 x 109/mL), com tempo de geração (g) de 6,8 h e com velocidade máxima de crescimento (µmáx) de 0,45 h-1. O cultivo de C. metallidurans CH34 em meio com pHs 3.0, 7.0 e 8.0 mostrou uma maior fase lag e diminuição na concentração final da massa bacteriana. Nos meio com pHs 9.0 e 10.0 não se detectou crescimento bacteriano. Devido a esses resultados, todos os experimentos subseqüentes foram realizados em meio TSM com pH 5,0. Resultados 88 1,8 1,2 pH 3,0 DO600 nm pH 4,0 pH 5,0 pH 6,0 pH 7,0 pH 8,0 0,6 pH 9,0 pH 10,0 0,0 0 4 8 12 16 20 24 28 32 36 40 44 48 52 56 72 76 80 Tempo (h) Figura 26: Curva de crescimento de C. metallidurans CH34 em meio TSM com diferentes pHs. DO600 nm: densidade ótica medida em comprimento de onda de 600 nanômetros. Cada ponto representa a média de uma triplicata e seu desvio padrão. 5.1.3 MIC de C. metallidurans CH34 frente a íons de metais pesados Para estabelecer um perfil de resistência numa mesma condição de cultivo, foi avaliada a mínima concentração inibitória de C. metallidurans CH34 frente a diferentes metais pesados e os resultados estão apresentados na Tabela 7, em comparação com os valores máximos permitidos pelo Conama. Tabela 7: Comparação das resistências de C. metallidurans CH34 com os valores máximos de íons em efluentes, segundo o CONAMA. Íon de metal pesado MIC CH34 Conama (Anexo A) Razão MIC/Conama (mM) (mM) +2 3,0 0,002 1500 +2 0,8 0,016 50 Cd Cu -2 CrO 4 0,2 0,01 20 +2 0,006 0,00005 120 +2 Hg Mn 60,0 0,03 2000 +2 3,5 0,034 103 +2 3,0 0,002 1500 Ni Pb -2 SeO 3 1,0 0,004 250 +2 15,0 0,08 187 +2 9,0 - - Zn Co Resultados 89 Os resultados desse experimento mostraram, de fato, altas resistências dessa linhagem a Cd+2, Co+2, Cu+2, CrO-24, Hg+2, Mn+2, Ni+2, Pb+2, SeO-23 e Zn+2. Quando se compara a resistência dessa bactéria com os níveis máximos de metais permitidos em efluentes, segundo o Conama, verifica-se que ela é muito superior para todos os metais, chegando a ser até 2000 vezes mais resistente, no caso do Mn+2. 5.2 Construção da bactéria C. metallidurans CH34 recombinante 5.2.1 Seqüenciamento do plasmídeo pHEβ O primeiro passo para a construção do clone recombinante de C. metallidurans CH34 com a fitoquelatina ancorada na sua superfície, foi conhecer a seqüência exata do sistema de secreção da IgA protease, codificada no plasmídeo pHEβ. A seqüência completa desse fragmento está apresentada na Figura 27. Analisando os dados de seqüenciamento, logo após o sítio de restrição da enzima XbaI, identificamos a seqüência gênica do peptídeo sinal, constituída por 51 nucleotídeos. Identificamos também uma região, entre os sítios BglI e SalI, que tem sido utilizada para a clonagem de genes codificadores de proteínas que se desejam ancorar e, a jusante dessa região, foi identificada a seqüência codificadora do epítopo E-tag, constituída por 36 nucleotídeos. Por fim, a seqüência codificadora da região do β-domínio do sistema de secreção da IgA protease foi identificada e conferiu com aquela obtida por Pohlner (1987) e Klauser et al., (1990). Uma vez conhecida a seqüência gênica, o mapa de restrição foi estudado, o que permitiu iniciar a construção do gene codificador da fitoquelatina sintética a ser clonado nesse fragmento gênico. Resultados 90 Figura 27: Seqüência de nucleotídeos do sistema de secreção da IgA protease de N. gonorrhoeae presente no plasmídeo pHEβ. Sítios de clivagem das enzimas de restrição XbaI, BglI, EcoRI e SalI e o códon de início de tradução (atg) estão em negrito. Seqüência de aminoácidos são referentes a: peptídeo sinal (vermelho); epítopo E-tag (azul) e βdomínio da IgA protease (preto). Resultados 91 5.2.2 Construção in vitro do gene sintético da Fitoquelatina destituído do códon de terminação de tradução (EC20sp) Uma vez que o gene sintético EC20sp deveria ser clonado sob a forma de uma fusão gênica, entre a seqüência codificadora do peptídeo sinal e a do domínio de ancoragem da IgA protease (β-domínio), foi necessário construí-lo sem o códon de terminação de síntese protéica. Esse gene sintético foi obtido a partir de uma reação de PCR com dois oligonucleotídeos que se hibridizam (Figura 28). Figura 28: A - Gene sintético da fitoquelatina (EC20) construído por Bae et al. (2000) ladeados com sítios de BamH I e Hind III. Retângulos mostram o códon de início de tradução (ATG) e término de tradução (TAA) codificados em cada oligonucleotídeo; B – Gene sintético EC20sp construído nesse trabalho com sítios EcoR V e Sal I (143 pb). Dois nucleotídeos (TA) foram adicionados para que o fragmento estivesse em fase de leitura nas subseqüentes etapas de clonagens. Seqüência de aminoácidos codificados pelo gene construído é mostrada. GAA e GAG = ácido glutâmico (E). TGT e TGC = Cisteína (C). O produto de PCR foi analisado por eletroforese em gel de agarose e mostrou um fragmento de DNA entre 100 e 200 pb, correspondendo ao tamanho esperado para o gene EC20sp (143 pb) (Figura 29A). O gene EC20sp foi clonado no vetor pGEM-T Easy e o plasmídeo resultante foi empregado para transformar células de E. coli DH5α e os clones transformantes foram analisados. Foram obtidas 21 colônias brancas resistentes a ampicilina. O DNA plasmidial desses transformantes foi isolado e analisado quanto à presença do gene EC20sp. Os plasmídeos transformantes foram analisados através de eletroforese em gel de agarose, após a digestão com as enzimas de restrição EcoRV e SalI. Dos 21 transformantes analisados, 15 apresentaram um fragmento de Resultados 92 3018 pb, correspondente ao tamanho do vetor original e outro fragmento com um tamanho de 143 pb, correspondente ao gene EC20sp, confirmando a clonagem (Figura 29B). O plasmídeo com o inserto foi chamado pGEMEC20sp. A B Figura 29: Perfil de migração de fragmentos de DNA após eletroforese em gel de agarose 0,7% corado com brometo de etídio. A- Gene sintético EC20sp amplificado por PCR, 1Marcador molecular de 100 pb e 2- gene EC20sp (143pb) e B- 1- Marcador molecular de 1Kb, 2- Marcador molecular de 100 pb e 3- Plasmídeo pGEMEC20sp digerido com EcoR V e Sal I. Para verificar se a seqüência clonada no vetor pGEM-T Easy não continha mutações, alterações na seqüência ou anelamento incorreto, o vetor construído, pGEMEC20sp, foi seqüenciado utilizando o iniciador T7. Sete clones foram seqüenciados e três deles apresentaram a seqüência correta do gene EC20sp. Uma vez obtido o gene EC20sp, iniciou-se a sua clonagem no vetor pHEβ. 5.2.3 Clonagem do gene EC20sp no plasmídeo pHEβ O gene sintético EC20sp foi isolado do plasmídeo pGEMEC20sp através de digestão com as enzimas EcoRI e SalI e, a seguir, clonado no plasmídeo pHEβ digerido com as mesmas enzimas (Figura 30). Resultados 93 EcoRI SalI EcoRI SalI BglI Klenow EcoRV Figura 30: Esquema representativo da construção do plasmídeo pCM1. Resultados 94 A mistura de ligação desses fragmentos resultou, após a transformação em células de E. coli DH5α, em 295 transformantes, dos quais 50 foram analisados. O plasmídeo pHEβ não possui sítio de restrição EcoRV, enquanto o gene EC20sp possui, fato esse que permitiu a distinção de dois clones recombinantes que foram digeridos por essa enzima, confirmando a presença do inserto. Esse novo vetor foi chamado pECβ. Para remover a região 6His do plasmídeo pECβ e manter a fase de leitura da construção, este plasmídeo foi digerido com a enzima BglI, tratado com Klenow, digerido com a enzima EcoRV e recircularizado utilizando DNA ligase. Após a transformação em células de E. coli DH5α, foram obtidos 816 transformantes, dos quais 20 foram analisados. O DNA plasmidial de cada transformante foi submetido à clivagem com as enzimas BglI, EcoRI, SpeI, EcoRV e mostrou não apresentar nenhum desses sítios de restrição, sendo no entanto, digerido com as enzimas SalI/XbaI, o que liberou um fragmento de aproximadamente 200 pb correspondente à fusão do peptídeo sinal com o gene EC20sp (Figura 31) Esse vetor foi chamado de pCM1 e a seqüência peptídeo sinal-EC20sp-Etag-β-domínio foi chamada de cassete de ancoragem. A seqüência nucleotídica dessa construção foi confirmada por seqüenciamento (Figura 32). Figura 31: Perfil de migração de fragmentos de DNA da digestão do plasmídeo pCM1 após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- Marcador molecular de 1Kb, 2-Marcador molecular de 100 pb, 3- pHEβ não digerido, 4- pCM1/BglI, 5- pCM1/EcoRI, 6- pCM1/SpeI, 7- pCM1/EcoRV e 8- pCM1/SalI/XbaI. Resultados 95 Figura 32: Seqüência de nucleotídeos e de aminoácidos da clonagem do gene EC20sp no plasmídeo pHEβ. Em amarelo está indicada a seqüência da proteína EC20sp. C – ácido glutâmico e E – cisteína. 5.3 Análise da expressão do cassete de ancoragem da EC20sp 5.3.1 Caracterização do perfil protéico através de SDS-PAGE e Westernblotting A expressão do cassete de ancoragem da EC20sp foi examinada através da indução do promotor plac. Para tanto, foi utilizada a linhagem de E. coli UT5600 não transformada e transformada com os plasmídeos pHEβ e pCM1, comparando-se o perfil protéico de cada linhagem por SDS-PAGE. Pela análise do perfil de proteínas totais, foi possível verificar que as linhagens E. coli UT5600/pHEβ e E. coli UT5600/pCM1 apresentaram uma banda adicional, de aproximadamente 50 KDa, quando comparadas à linhagem não transformada, comprovando a expressão do cassete de ancoragem construído anteriormente (Figura 33). Resultados 96 Figura 33: Análise do perfil protéico por SDS-PAGE. 1- marcador, 2- E. coli UT5600, 3- E. coli UT5600/pHEβ e 4 E. coli UT5600/pCM1. Com o intuito de investigar a ancoragem da EC20sp na membrana externa da bactéria, as células foram separadas em fração solúvel, membrana interna e membrana externa e verificada a presença da proteína heteróloga, utilizando como repórter a seqüência peptídica do epítopo E-tag, o qual é reconhecido pelo anticorpo anti-E-tag. Pode-se observar na Figura 34A, que somente na fração de membrana externa das linhagens UT5600/pHEβ e UT5600/pCM1, detectou-se a presença do Etag, enquanto a fração solúvel e a fração de membrana interna não apresentaram nenhuma banda reconhecida pelo anticorpo. A B Figura 34: A - Western-blotting das diferentes frações das células após incubação com anticorpo anti-E-tag. 1- UT5600, 2- UT5600/pHEβ, 3- UT5600/pCM1, Fr- fração solúvel, MI membrana interna e ME- membrana externa. B- Representação esquemática da ancoragem da EC20sp com a exposição do epítopo e da proteína EC20sp no meio externo. Baseado em Veiga et al. (1999). Resultados 97 5.3.2 Bioacúmulo de Cd+2 por E. coli com a proteína EC20sp ancorada na membrana externa O estudo de bioacúmulo de íons Cd+2, pelas linhagens de E. coli, mostrou que a presença da EC20sp ancorada na membrana externa da bactéria foi capaz de aumentar a capacidade de adsorção desse íon em comparação com as outras linhagens (Figura 35). Enquanto a linhagem de E coli UT5600 adsorveu 17% do cádmio da solução, a linhagem UT5600/pCM1 adsorveu 32%, ou seja, 89% a mais que a primeira, em 2 h de incubação das células com a solução contendo 1 mM de CdCl2. Em termos de peso seco de células, a linhagem com a EC20sp ancorada na membrana foi capaz de adsorver 5 µg de Cd+2/mg de peso seco, enquanto a mesma linhagem sem plasmídeo adsorveu apenas 2,5 µg de Cd+2/mg de peso seco, ou seja, a proteína EC20sp aumentou em 100% a capacidade da célula em se ligar a Cd+2. Figura 35: Adsorção de cádmio pelas linhagens de E. coli utilizadas nesse trabalho, em solução de +2 água contendo 1 mM de Cd . 5.4 Escolha de promotores com expressão constitutiva em C. metallidurans CH34 para a expressão do cassete de ancoragem da EC20sp A expressão constitutiva do cassete de ancoragem da EC20sp em C. metallidurans CH34 é um elemento crucial da estratégia para a utilização dessa bactéria como agente biorremediador em larga escala, em que não haja necessidade do uso de indutores. Resultados 98 Para avaliar a capacidade de expressão gênica promovida por cada seqüência promotora utilizada nesse trabalho, utilizou-se o plasmídeo pBBEGFP, construído no nosso laboratório, o qual apresenta o gene repórter da proteína verde fluorescente (EGFP). A escolha de seqüências promotoras para a expressão do gene repórter foi realizada de três modos: (i) utilizando os dados da análise proteômica de C. metallidurans CH34, realizada por Noël-Georis et al. (2004); (ii) utilizando seqüências promotoras conhecidas por expressar genes constitutivamente em C. metallidurans CH34 e (iii) utilizando do promotor pan. 5.4.1 Obtenção de seqüências promotoras de C. metallidurans CH34 através de análise proteômica O estudo proteômico de C. metallidurans CH34 cultivada em meio TSM contendo íons de metais pesados permitiu a identificação de proteínas com grande expressão (NOËL-GEORIS et al., 2004) (Figura 36), das quais 6 foram eleitas como canditadas a possuírem promotores com forte expressão. As proteínas escolhidas foram : P1 - proteína de membrana 1; P2 - citocromo D1; P3 óxido nítrico redutase; P4 - proteína de membrana 2; P5 - proteína ribossomal L6 e P6 – proteína ribossomal L10 (Tabela 8). Resultados 99 Figura 36: Gel analítico 2-D de proteínas totais de C. metallidurans CH34 corado com coomassie. As flechas em vermelho indicam as proteínas escolhidas com altos níveis de expressão. Figura modificada a partir de Noël-Georis et al, (2004). Tabela 8: Proteínas escolhidas por análise proteômica por apresentarem forte intensidade na análise proteômica de C. metallidurans CH34. Nome proteína tamanho intensidade Homologia categoria (KDa) P1 S31 26,3 +++ Proteína transmembrana Degradação protéica P2 S193 9,7 ++++++ Citocromo Transporte de elétrons P3 S265 18,2 ++++ óxido nítrico redutase Proteção celular P4 S271 11,5 +++++ Proteína transmembrana Função desconhecida P5 S315 18,9 ++++++ Síntese protéica P6 S322 17,1 +++++ subunidade 50S da proteína ribossomal L6 subunidade 50S da proteína ribossomal L10 Síntese protéica Resultados 100 Após a escolha dessas proteínas, as seqüências de DNA que as codificam foram localizadas no genoma de C. metallidurans CH34 e as suas regiões promotoras foram identificadas. Para obter os promotores, foram desenhados iniciadores de PCR com sítio de restrição que permitiu a fusão exata da seqüência do promotor com o códon ATG do gene da EGFP. Os iniciadores de PCR foram desenhados com os sítios de restrição SacI e NdeI. Esses iniciadores foram utilizados para amplificar as seis diferentes regiões promotoras a partir do DNA total de C. metallidurans CH34 (Figura 37A). Figura 37: Perfil de migração de fragmentos de PCR dos promotores de C. metallidurans CH34 após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- marcador molecular de 100 pb; 2- PCR do promotor P1; 3 - PCR do promotor P2; 4- PCR do promotor P3, 5- PCR do promotor P4; 6- PCR do promotor P5 e 7- PCR do promotor P6. Os produtos de PCR de cada promotor foram clonados no vetor de clonagem pCR2.1-TOPO. O número de transformantes de cada clonagem é mostrado na Tabela 9. Tabela 9: Análise da clonagem dos diferentes promotores no vetor pCR-TOPO. P1 P2 P3 P4 P5 P6 n° transformantes 143 93 95 81 113 133 n° colônias brancas 10 83 44 35 99 38 n° transformantes analisados 5 5 5 5 5 5 n° clones 5 4 5 3 5 5 Resultados 101 Foram analisados cinco transformantes de cada clonagem e a presença do inserto foi confirmada após a digestão com enzimas de restrição NdeI e SacI. Na Figura 38, é possível observar um fragmento de 4,2 Kb, referente ao vetor pCRTOPO e, outro fragmento referente a cada seqüência promotora, confirmando a clonagem. Os plasmídeos construídos foram chamados pTOPOP1 a pTOPOP6. Figura 38: Perfil de migração de fragmentos de DNA referentes aos promotores de C. metallidurans CH34 amplificados por PCR e clonados no vetor pCR2.1-TOPO após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- marcador molecular de 1 Kb; 2marcador molecular de 100 pb; 3- plasmídeo pTOPOP1; 4- plasmídeo pTOPOP2, 5plasmídeo pTOPOP3; 6- plasmídeo pTOPOP4; 7- plasmídeo pTOPOP5 e 8- plasmídeo pTOPOP6. Todos os plasmídeos construídos foram digeridos com NdeI e SacI. Todas as seis seqüências promotoras clonadas no vetor pCR2.1-TOPO foram subclonadas no vetor pBBEGFP, para que a expressão da EGFP pudesse ser medida, permitindo a escolha de um promotor que estivesse expressando o gene repórter. Para tanto, os seis plasmídeos construídos (pTOPOP1 a pTOPOP6) foram digeridos com as enzimas NdeI e SacI e os fragmentos correspondentes às seqüências promotoras foram isolados. O vetor pBBEGFP também foi digerido com as mesmas enzimas e ligado a cada um dos promotores (Figura 39). Resultados 102 NdeI SacI NdeI SacI Figura 39: Esquema representativo da construção do plasmídeo pCMP1. Os plasmídeos pCMP2 a pCMP6 foram construídos da mesma maneira. A transformação de células de E. coli com as misturas de ligação dos seis promotores com o vetor pBBEGFP permitiu a obtenção de transformantes resistentes a cloranfenicol em todas as transformações (Tabela 10). Tabela 10: Análise da clonagem dos diferentes promotores no vetor pBBEGFP. P1 P2 P3 P4 P5 P6 n° transformantes 10 24 36 28 8 17 n° transformantes analisados 5 5 5 5 5 5 n° clones 1 2 5 3 2 5 Resultados 103 O DNA plasmidial de cinco transformantes de cada construção foi extraído e, após digestão com enzimas NdeI e SacI, foi possível observar plasmídeos apresentando duas bandas em gel de agarose submetido a eletroforese, uma referente ao tamanho do plasmídeo original (5,5 Kb) e outra referente a cada promotor, confirmando a clonagem (Figura 40). Os vetores construídos foram chamados pCMP1 a pCMP6. Figura 40: Perfil de fragmentos da digestão do plasmídeo pBBEGFP com os diferentes promotores após eletroforese em gel de agarose 1,2% corado com brometo de etídio. 1- Marcador molecular de 1 Kb; 2- Marcador molecular de 100 pb; 3- plasmídeo pCMP1; 4plasmídeo pCMP2, 5- plasmídeo pCMP3; 6- plasmídeo pCMP4; 7- plasmídeo pCMP5 e 8- plasmídeo pCMP6. Todos os plasmídeos construídos foram digeridos com NdeI e SacI. 5.4.2 Obtenção das seqüências promotoras conhecidas por expressar genes constitutivamente em C. metallidurans CH34 5.4.2.1 Obtenção do promotor czcIp A seqüência promotora czcIp foi amplificada a partir do DNA total de C. metallidurans CH34 e chamada de promotor P7 (Figura 41A). Esta seqüência promotora foi clonada no vetor pCR-TOPO que foi usado para transformar células de E. coli DH5α. Foram obtidos 85 transformantes resistentes a ampicilina, dos quais cinco tiveram seu DNA plasmidial analisado. O DNA plasmidial de todos os transformantes analisados apresentaram duas bandas, uma referente ao vetor Resultados 104 original (3900 pb) e outra referente ao promotor (314 pb) (Figura 41B). O novo plasmídeo foi chamado pTOPOP7. Esse promotor foi isolado do vetor pTOPOP7 através de digestão com enzimas de restrição NdeI e BamHI e subclonado no plasmídeo pBBEGFP para avaliar a capacidade de expressar o gene EGFP. Foram obtidos 19 transformantes resistentes a cloranfenicol. O DNA plasmidial de oito transformantes mostrou duas bandas quando digeridos com as enzimas NdeI e BamHI, uma referente ao plasmídeo original (5,5 Kb) e outra referente ao inserto (314 pb), confirmando a construção do plasmídeo pCMP7 (Figura 41C). A B C 314 pb Figura 41: Perfil de migração de fragmentos de DNA do promotor czcIp após eletroforese em gel de agarose 0,7% corado com brometo de etídio. A- Marcador molecular de 100 pb e P7promotor P7 amplificado por PCR a partir do DNA total de C. metallidurans CH34; B- 1Marcador molecular de 1 Kb; 2- Marcador molecular de 100 pb; 3- plasmídeo pTOPOP7 digerido com NdeI e BamHI; C- Marcador molecular de 1 Kb; 2- Marcador molecular de 100 pb, 3- plasmídeo pCMP7 digerido com NdeI e BamHI. 5.4.2.2 Obtenção do promotor plac O plasmídeo pLG, construído no nosso laboratório, expressa o gene da proteína verde fluorescente (EGFP) sob o controle do promotor plac. O fragmento de DNA contendo o promotor plac e o gene da EGFP foi isolado do plasmídeo pLG através de digestão com as enzimas VspI e XhoI e clonado no vetor pBBR1MCS, também digerido com as mesmas enzimas (Figura 42). Após eletroporação em células de E. coli, foram obtidos 11 transformantes resistentes a cloranfenicol, dos quais 5 foram analisados. Após a digestão do DNA plasmidial desses transformantes com VspI e XhoI, observou-se que quatro deles apresentaram duas bandas: uma referente ao tamanho do vetor original (4700 pb) e, outra referente ao tamanho do Resultados 105 inserto (950 pb), confirmando a clonagem (Figura 43). Esse vetor foi chamado pLEGFP. VspI XhoI VspI XhoI Figura 42: Esquema representativo da construção do plasmídeo pLEGFP. Figura 43: Perfil de migração de fragmentos do plasmídeo pLEGFP digerido com VspI e XhoI após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- Marcador molecular de 1 Kb; 2- plasmídeo pLEGFP digerido com VspI e XhoI. Resultados 106 5.4.3 Obtenção da seqüência do promotor pan de B. subtilis O plasmídeo pBB-panEGFP, construído no nosso laboratório, possui a seqüência promotora do gene mrgA de B. subtilis modificada, controlando a expressão do gene EGFP, e foi avaliado quanto à sua expressão em C. metallidurans CH34. 5.5 Análise da expressão de EGFP pelos diferentes promotores Após a construção dos nove plasmídeos portadores de diferentes seqüências promotoras a montante do gene da EGFP em E. coli, células de C. metallidurans CH34 foram utilizadas como hospedeiras para cada um dos plasmídeos construídos. Tanto C. metallidurans CH34, quanto E. coli carregando esses vetores, foram analisadas em microscópio de epifluorescência, o que permitiu observar células com fluorescência verde das duas bactérias, portadoras de algumas das construções (Figura 44). A B Figura 44: Visualização de células de C. metallidurans CH34 em microscópio de epifluorêscencia com aumento de 1000 vezes. A - Células de C. metallidurans CH34/pBBR1MCS e B – Células de C. metallidurans CH34/pBB-panEGFP No entanto, não foi possível detectar, por esse método, a expressão da EGFP para todas as construções e, portanto, a detecção e quantificação foram realizadas por um método mais sensível: a citometria de fluxo. Resultados 107 5.6 Quantificação da expressão da proteína verde fluorescente através de citometria de fluxo Todas as construções tanto em E. coli, quanto em C. metallidurans CH34, foram analisadas por citometria de fluxo. Amostras de culturas de cada bactéria foram retiradas na fase exponencial de crescimento e a intensidade de fluorescência para cada construção foi calculada pela mediana da intensidade relativa de cada população celular. Na Figura 45 (A e C), pode-se observar que a mediana da intensidade de fluorescência relativa em C. metallidurans CH34/pBBEGFP (controle) foi de 50,48 para a população de células analisadas enquanto esse valor foi de 3586,64 em C. metallidurans CH34/pBB-panEGFP cultivada na presença de Cd+2. O valor do controle foi considerado como basal e foi subtraído de todos os experimentos. Ainda na Figura 45 (B e D), podemos observar o gráfico de distribuição celular que avalia o tamanho das células (FS) versus a complexidade celular (SS). Esses gráficos revelam que a expressão do gene da EGFP não alterou o tamanho celular da população analisada, nem tampouco modificou a complexidade das células, pois ambas apresentaram a mesma distribuição celular. A Figura 44E mostra comparativamente o deslocamento do gráfico de intensidade de fluorescência obtida nas células sem expressão da EGFP (controle) em relação às células expressando EGFP (C. metallidurans CH34/pBB-panEGFP). A quantificação da expressão da EGFP sob o controle de cada um dos nove diferentes promotores, para as duas bactérias, foi realizada e os valores foram plotados em gráficos para comparação da capacidade de cada promotor (Figura 46). Resultados 108 A B 3586,64 D C E Figura 45: A e C- gráficos de intensidade de fluorescência relativa após análise de 30000 eventos dos clones de C. metallidurans/pBBEGFP (controle) e C. metallidurans/pBB-panEGFP; B e D- distribuição celular característico de cada amostra, indicando apenas um tipo celular e E- gráfico em 3D comparando as amostras A e C quanto ao deslocamento da intensidade de fluorescência. FL1- fluorescência, SS- “side scatter” e FS- “forward scatter”. Resultados 109 A B Figura 46: A: intensidade de fluorescência relativa medida através de citometria de fluxo em C. metallidurans CH34 carregando os diversos plasmídeos construídos nesse trabalho. Foram empregados meios com e sem metais pesados; B: intensidade de fluorescência relativa medida através de citometria de fluxo em E. coli carregando os diversos plasmídeos construídos nesse trabalho. Resultados 110 Em C. metallidurans CH34 a expressão do gene repórter pelos promotores P1 a P7 foi medida em células cultivadas em meio contendo ou não metais pesados. Entretanto, baixas intensidades de fluorescência foram detectadas nessa bactéria quando esses promotores foram avaliados, mesmo na presença de íons de metais. Na bactéria E. coli esses promotores não mostraram nenhuma indução da expressão da EGFP. A expressão do gene da EGFP pelo promotor plac em C. metallidurans CH34 também mostrou níveis baixos de intensidade de fluorescência (61,9), além disso, se mostrou inalterada tanto na presença de glicose, quanto na de IPTG. Em E. coli, o promotor plac produziu o maior nível de expressão da EGFP nessa bactéria. Na presença de IPTG, a expressão da EGFP foi de aproximadamente 6,5 vezes maior àquela obtida na presença de glicose (1%) e 14 vezes superior à expressão desse mesmo gene em C. metallidurans CH34. A expressão do gene da EGFP pelo promotor pan se mostrou muito forte em C. metallidurans CH34, além disso, a presença de íons de metais pesados aumentou os níveis de expressão, chegando ao máximo de intensidade de fluorescência relativa quando a bactéria C. metallidurans CH34 foi cultivada em presença de Cd+2 (3536,16). A expressão heteróloga da EGFP pelo promotor pan em C. metallidurans CH34 cultivada sem metais, mostrou ser 24 vezes maior quando comparada ao plac e, na presença de Cd+2 no meio de cultivo, a intensidade de fluorescência foi aproximadamente 55 vezes superior ao plac nessa bactéria. Em E. coli, a expressão da EGFP pelo promotor pan foi muito menor do que aquela observada em C. metallidurans CH34. A média da intensidade de fluorescência em E. coli, mesmo na presença de íons metálicos, foi 3 vezes ou 7,5 vezes menor que em C. metallidurans CH34 cultivada na ausência ou presença de Cd+2, respectivamente. Com base nestes resultados, decidimos empregar o promotor pan para a expressão do cassete de ancoragem em C. metallidurans CH34. 5.7 Construção do cassete de expressão-ancoragem da EC20sp Para expressar o cassete de ancoragem da EC20sp em C. metallidurans CH34 utilizando o promotor pan, primeiramente foi necessário realizar uma Resultados 111 amplificação por PCR desse cassete. O PCR foi realizado utilizando o plasmídeo pCM1 como DNA molde e o produto amplificado foi clonado no vetor pCR 2.1TOPO. A mistura de ligação do produto de PCR com o vetor foi utilizada para transformar células de E. coli DH5α, produzindo 17 colônias resistentes a ampicilina, sendo 10 colônias brancas e 7 azuis. O DNA plasmidial de cada uma das 10 colônias brancas foi extraído e a presença do inserto foi confirmada após análise de restrição com as enzimas NdeI e KpnI. Na Figura 47, observa-se a presença de uma banda correspondente ao tamanho do vetor original (3900 pb) e outra ao cassete de ancoragem (1580 pb), confirmando a clonagem. Este novo plasmídeo foi chamado pTOPOANC. Figura 47: Perfil de migração de fragmentos do plasmídeo pTOPOANC digerido com NdeI e KpnI após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- Marcador molecular de 1 Kb; 2- plasmídeo TOPOANC digerido com NdeI e KpnI. No passo seguinte, o cassete de ancoragem foi isolado do vetor pTOPOANC através de digestão com as enzimas de restrição NdeI e KpnI e, subclonado no vetor pBB-panEGFP, também digerido com as mesmas enzimas (Figura 48). Resultados 112 PCR * NdeI KpnI NdeI KpnI Figura 48: Esquema representativo da construção do plasmídeo pCM2. A mistura de ligação do cassete de ancoragem com o plasmídeo pBB-panEGFP foi utilizada para transformar células de E. coli DH5α. Foram obtidos 12 transformantes resistentes a cloranfenicol, dos quais cinco foram analisados. A clonagem do cassete de ancoragem a jusante do promotor pan, foi confirmada pela Resultados 113 análise de restrição (Figura 49B). O novo plasmídeo construído foi chamado pCM2 e o fragmento pan-PS-EC20sp-E-tag-β-domínio foi chamado de cassete de expressão-ancoragem da EC20sp. Os sítios únicos de restrição das enzimas NdeI, SalI, HindIII e KpnI foram confirmados, produzindo somente uma banda de 6,7 Kb referente ao tamanho do plasmídeo pCM2. A digestão de pCM2 com SacI permite que o cassete de expressão-ancoragem da EC20sp seja liberado, o que foi confirmado pela análise eletroforética em gel de agarose. Digestões duplas de pCM2 com SalI/HindIII; SalI/SacI e NdeI/HindIII e uma tripla digestão com NdeI/HindIII/ SacI permitiram confirmar a presença de cada fragmento na construção realizada (Figura 49). A B Figura 49: A: Plasmídeo pCM2 e tamanho dos fragmentos do cassete expressão-ancoragem da EC20sp; B: Perfil de migração de fragmentos da digestão do vetor pCM2 com diversas enzimas após eletroforese em gel de agarose 0,7% corado com brometo de etídio. 1- marcador molecular de 1 Kb; 2- pCM2/NdeI; 3- pCM2/SalI; 4- pCM2/SacI; 5pCM2/HindIII; 6- pCM2/KpnI; 7- pCM2/SalI/HindIII; 8- pCM2/SalI/SacI; 9pCM2/NdeI/HindIII e 10- pCM2/ NdeI/HindIII/ SacI. Por fim, a construção gênica foi confirmada por seqüenciamento como se pode observar na Figura 50. Resultados 114 Figura 50: Seqüência de nucleotídeos e de aminoácidos do plasmídeo pCM2. As regiões operador/-35/-10/rbs do promotor pan estão destacadas nos retângulos amarelos. As seqüências nucleotídicas e de aminoácidos do peptídeo sinal, do gene EC20sp, do Etag e início do β-domínio são mostradas. 5.8 Análise da expressão do cassete de ancoragem da EC20sp em C. metallidurans CH34 5.8.1 Caracterização do perfil protéico através de SDS-PAGE e Westernblotting A expressão do cassete de ancoragem da EC20sp sob o comando do promotor pan foi avaliada nas linhagens de C. metallidurans CH34 não transformada e transformada com os plasmídeos pBBR1MCS e pCM2, através da comparação do perfil protéico de cada linhagem por SDS-PAGE. Pela análise do perfil de proteínas totais, foi possível verificar que a linhagem C. metallidurans/pCM2 apresentou uma banda adicional, de aproximadamente 50 KDa, quando comparadas às linhagens não transformada e C. metallidurans/pBBR1MCS, comprovando a expressão do cassete de ancoragem (Figura 51). Para avaliar se a proteína estava, de fato, sendo ancorada na membrana externa de C. metallidurans CH34, as frações de membrana das linhagens transformada e não transformada foram isoladas e a presença da proteína de fusão foi verificada através de Western-blotting contra o epítopo E-tag. Os resultados mostraram que apenas na fração de membrana externa foi detectada a presença do E-tag, indicando que, de fato, a proteína estava ligada na membrana externa da bactéria (Figura 52). Resultados 115 Figura 51: Análise do perfil protéico por SDS-PAGE. 1- marcador, 2- C. metallidurans CH34, 3C. metallidurans/pBBR1MCS e 4- C. metallidurans/pCM2. Figura 52: Western-blotting das diferentes frações das células após incubação com anticorpo anti-Etag. 1- C. metallidurans CH34, 2- C. metallidurans CH34/pBBR1MCS, 3- C. metallidurans CH34/pCM2, Fr- fração solúvel, MI - membrana interna e ME- membrana externa. 5.8.2 Bioacúmulo de íons de metais pesados por C. metallidurans CH34 recombinante Para verificar a funcionalidade da ancoragem da EC20sp na superfície de C. metallidurans CH34, foram realizados inicialmente experimentos para avaliar a adsorção de Cd+2 e o melhor tempo de incubação para otimizar a ligação do metal à Resultados 116 bactéria. Para tanto, 10 mL de água MilliQ contendo diferentes concentrações do metal foram incubadas com uma mesma massa microbiana pré-cultivada e alíquotas foram retiradas em diferentes tempos. Os resultados mostraram que, quando se utilizou 100 µM de Cd+2 em solução, a remoção deste íon na presença de C. metallidurans/pCM2 (26 mg de peso seco) foi de, aproximadamente, 80% em 24 h de incubação, mostrando a superior capacidade de tirar o metal de solução em comparação às linhagens controle do experimento (Figura 53A). Na presença de 1000 µM de Cd+2, a linhagem recombinante também apresentou melhor desempenho em comparação às outras linhagens. Além disso, nesse experimento verificamos que células de C. metallidurans/pCM2 pré-cultivadas na presença de cádmio apresentaram um aumento na capacidade de remoção de metal, devido à indução da expressão do cassete de ancoragem da EC20sp pelo promotor pan, como já verificado nos experimentos de citometria (Figura 53B). Figura 53: Porcentagem de cádmio residual em solução aquosa ao longo da incubação com as +2 diferentes linhagens de C. metallidurans utilizadas nesse trabalho. A- 100 µM de Cd e B: +2 1000 µM de Cd . Resultados 117 A partir deste experimento, foi possível definir o melhor tempo de incubação da bactéria com a solução contendo o metal pesado. No entanto, por esse método, apesar de se verificar a diminuição da concentração do cádmio na solução ao longo do tempo de incubação com a massa microbiana, a quantificação do cádmio adsorvido pela massa microbiana estava sendo estimada apenas indiretamente. Para vencer essa limitação, os experimentos seguintes foram realizados de forma a quantificar o metal diretamente na massa microbiana de cada linhagem após 24 de incubação em solução contendo 1000 µM de cada metal isoladamente e, no caso do Hg+2, o experimento foi realizado com 50 µM. Verificou-se também a viabilidade celular depois de 24 h de incubação com água contendo cada metal e, em todos os casos, a viabilidade foi de 100%. Os resultados da quantificação do cádmio na massa microbiana da linhagem de C. metallidurans/pCM2 pré-cultivada na presença de Cd+2 mostraram que esta ligou 17,6 µM de Cd+2/mg de peso seco de célula em 24 h de incubação, 59% superior em relação à linhagem selvagem e 40% superior em relação à mesma linhagem sem indução (Figura 54). Além disso, verificou-se que as células induzidas com Cd+2 foram capazes de adsorver esse metal enquanto cresciam (controle induzido, tempo 0). Figura 54: Adsorção de cádmio pelas diferentes linhagens de C.metallidurans. A quantidade de +2 cádmio ligada às células é indicada em micromoles de Cd por miligrama de peso seco de células. Resultados 118 A partir desses resultados, outros metais foram empregados nas mesmas condições para avaliar o perfil de adsorção das diferentes linhagens de C. metallidurans. A quantificação do cobalto na massa microbiana mostrou que a linhagem de C. metallidurans/pCM2 induzida apresentou 5,1 µM de Co+2/mg de peso seco de célula, não diferindo significativamente da mesma linhagem sem indução, sendo no entanto, 13% superior à linhagem controle (Figura 55). Figura 55: Adsorção de cobalto pelas diferentes linhagens de C.metallidurans. A quantidade de +2 cobalto ligada às células é indicada em micromoles de Co por miligrama de peso seco de células. Quando o cobre foi quantificado na massa microbiana, verificou-se que a linhagem de C. metallidurans/pCM2 induzida apresentou maior capacidade de ligação ao metal em relação às outras, assim como para Cd+2 e Co+2. Enquanto a linhagem de C. metallidurans/pCM2 induzida ligou 42,65 µM de Cu+2/mg de peso seco de célula, a linhagem controle ligou 24,29 µM de Cu+2/mg de peso seco de célula, sendo a primeira 76% superior à segunda (Figura 56). Além disso, observamos que as células de C. metallidurans/pCM2 pré-cultivadas na presença de Cu+2 ligaram uma quantidade significativa desse metal enquanto cresciam e que isso não impediu que a massa microbiana fosse capaz de ligar mais metal a partir de uma solução mais concentrada durante o período de incubação. Resultados 119 Figura 56: Adsorção de cobre pelas diferentes linhagens de C. metallidurans.. A quantidade de cobre +2 ligada às células é indicada em micromoles de Cu por miligrama de peso seco de células. Para o Hg+2, cuja concentração utilizada neste experimento foi de 50 µM, os resultados mostraram que, após 24 h, a linhagem C. metallidurans/pCM2 cultivada sem indução ligou 0,1 µM de Hg+2/mg de peso seco de célula, sendo este resultado 100% superior em relação às linhagens controle ou induzida (Figura 57). Figura 57: Adsorção de mercúrio pelas diferentes linhagens de C.metallidurans. A quantidade de +2 mercúrio ligada às células é indicada em micromoles de Hg por miligrama de peso seco de células. Resultados 120 Quando a quantificação foi realizada na massa microbiana incubada com +2 Mn , verificou-se que a linhagem C. metallidurans/pCM2 induzida apresentou 31% de aumento na capacidade de ligação desse íon em relação à linhagem controle, chegando a ligar 6,2 µM de Mn+2/mg de peso seco de célula (Figura 58). Figura 58: Adsorção de manganês pelas diferentes linhagens de C.metallidurans. A quantidade de +2 manganês ligada às células é indicada em micromoles de Mn por miligrama de peso seco de células. A quantificação de Ni+2 na massa microbiana mostrou que a linhagem C. metallidurans/pCM2 induzida foi 45% superior à linhagem controle e 31% superior à mesma linhagem sem indução (Figura 59). Figura 59: Adsorção de níquel pelas diferentes linhagens de C.metallidurans. A quantidade de níquel +2 ligada às células é indicada em micromoles de Ni por miligrama de peso seco de células. Resultados 121 Para o zinco, verificou-se que a massa microbiana da linhagem C. metallidurans/pCM2 pré-cultivada na presença desse metal foi capaz de ligar 51,07 µM de Zn+2/mg de peso seco de célula após 24 h de incubação com água contendo 1000 µM de Zn+2. Neste caso, foi verificado também que as células préinduzidas já haviam ligado uma grande quantidade desse íon durante o crescimento celular. Este resultado é 219% superior à linhagem controle. Figura 60: Adsorção de zinco pelas diferentes linhagens de C.metallidurans. A quantidade de zinco +2 ligada às células é indicada em micromoles de Zn por miligrama de peso seco de células. Com o Pb+2, os resultados mostraram que a linhagem C. metallidurans/pCM2 induzida foi capaz de ligar 54,75 µM de Pb+2/mg de peso seco de célula,ou seja, 210% superior à capacidade de ligação desse metal observada na linhagem controle. Também neste caso, verificamos que a quantidade desse metal adsorvido na massa das células pré-cultivadas foi grande, o que indica a afinidade desse íon pela bactéria contendo a EC20sp (Figura 61). Resultados 122 Figura 61: Adsorção de chumbo pelas diferentes linhagens de C.metallidurans. A quantidade de +2 chumbo ligada às células é indicada em micromoles de Pb por miligrama de peso seco de células. Exceto para o Hg+2, a linhagem que apresentou melhor desempenho na ligação a todos os metais analisados foi a C. metallidurans/pCM2 pré-cultivada na presença dos respectivos íons metálicos. No entanto, a capacidade de ligação dessa linhagem variou para cada metal, em termos de quantidade de metal e, para uma comparação mais exata, colocamos no mesmo gráfico apenas o valor de adsorção de C. metallidurans/pCM2 induzido (Figura 62). Nota-se que há uma preferência de ligação por alguns metais, indicando que há uma escala de afinidade da EC20sp. Figura 62: Adsorção de diferentes metais pela linhagem de C.metallidurans/pCM2 induzida. A quantidade de metal ligada às células é indicada em micromoles de metal por miligrama de peso seco de células. Resultados 123 Por fim, foi avaliada também a capacidade das linhagens em ligar metais a partir de soluções aquosas contendo misturas de metais. Para tanto, todos os metais utilizados nesse trabalho foram adicionados na mesma concentração (100 µM) em solução aquosa e incubados por 24 h com a massa microbiana de cada linhagem sendo a seguir medida a quantidade de metal ligado à célula. Os resultados comprovaram que o perfil de ligação a metais foi alterado pela presença da EC20sp na superfície de C. metallidurans comparada à linhagem controle. A linhagem controle C. metallidurans/pBBR1MCS apresentou a seguinte afinidade pelos metais: Cu>Cd>Pb>Zn>Ni>Co>Mn>Hg e a linhagem C. metallidurans/pCM2 induzida mostrou ligar íons com a afinidade: Zn>Pb>Cd>Cu>Ni>Mn>Co>Hg (Figura 63). Além disso, nota-se que a escala de afinidade da linhagem C. metallidurans/pCM2 sem indução manteve-se a mesma que a mesma linhagem induzida, mostrando a consistência do resultado, com a exceção do Zn. Estes resultados também apresentaram concordância com aqueles onde só um tipo de metal foi avaliado por vez, ou seja, a preferência de ligação tanto em misturas quanto na presença de apenas um tipo de metal manteve-se nas linhagens de C. metallidurans, com exceção do Zn+2 e Pb+2. Figura 63: Adsorção de metais pelas linhagens de C.metallidurans em solução contendo múltiplos metais A quantidade de metal ligada às células é indicada em micromoles de metal por miligrama de peso seco de células. Resultados 124 5.9 Caracterização das linhagens de C. metallidurans CH34 por Microscopia Eletrônica de Transmissão Para determinar a presença e a localização do metal ligado à célula bacteriana utilizou-se a técnica de Microscopia Eletrônica de Transmissão (MET). Para tanto, as linhagens de C. metallidurans CH34 e C. metallidurans CH34/pCM2, cultivadas na presença ou ausência de Pb+2, foram incubadas em água MilliQ contendo Pb+2. Para visualização das estruturas celulares da bactéria por MET, geralmente há necessidade de tratamento de contrastação com citrato de chumbo e acetato de uranila. Neste experimento utilizamos células com este tratamento e células sem contrastação, uma vez que o Pb+2 já deveria estar ligado na massa microbiana incubada com água MilliQ contendo este metal. Os resultados mostraram que nas células com tratamento de contrastação não foi possível distinguir o Pb+2 advindo do tratamento inicial daquele advindo da solução aquosa. No entanto, nas células sem o tratamento de contrastação, foi possível distinguir agregados de partículas de Pb+2 ligados na superfície da bactéria. A análise por microscopia mostrou que a linhagem selvagem de C. metallidurans CH34 foi capaz de ligar Pb+2 de uma solução aquosa (Figura 64 A e B), o que está em concordância com os resultados obtidos por ICP-MS, que detectou a presença de Pb+2 ligada na massa bacteriana. Além disso, através da MET, observamos com clareza que o Pb+2 ligou-se, principalmente, na membrana externa da bactéria. Ao compararmos este resultado com aquele obtido com a linhagem recombinante C. metallidurans CH34/pCM2 (Figura 64 C e D), fica evidente que há um aumento significante na concentração do Pb+2 ligado na membrana externa da bactéria, mostrando que, de fato, a presença da EC20sp otimizou a capacidade biorremediadora da linhagem recombinante, reafirmando os resultados obtidos por ICP-MS. Resultados 125 A C Figura 64: B D Eletromicrografia de transmissão de cortes histológicos de células de C. metallidurans CH34. A - C. metallidurans CH34 cultivada em meio TSM e incubada com água MilliQ; B - C. metallidurans CH34 cultivada em meio TSM e +2 incubada com água MilliQ contendo Pb ; C - C. metallidurans CH34/pCM2 cultivada em meio TSM e incubada com água MilliQ e D - C. metallidurans CH34/pCM2 +2 +2 cultivada em meio TSM contendo Pb e incubada com água MilliQ contendo Pb . A visualização das células foi realizada com aumento de 46.000 vezes. Setas indicam a +2 presença de agregados do elemento Pb ligados na membrana externa bacteriana. Resultados 126 5.10 Avaliação recombinante do crescimento da linhagem C. metallidurans CH34 Para verificar o comportamento da linhagem C. metallidurans CH34/pCM2 em relação à linhagem selvagem, foram realizadas curvas de crescimento em meio TSM (Figura 65). Figura 65: Curvas de crescimento das linhagens de C. metallidurans CH34 em meio TSM. DO600: densidade ótica medida em comprimento de onda de 600 nanômetros. Cada ponto representa a média de uma triplicata e seu desvio padrão. Como se pode observar na Figura 65, a linhagem C. metallidurans CH34/pCM2 apresentou uma ligeira diminuição na velocidade de crescimento em relação à não recombinante durante a fase logarítmica, com µmáx a 0,41 h-1, enquanto a linhagem selvagem apresentou µmáx de 0,49 h-1. Entretanto, em 36 horas de cultivo, a massa microbiana final das linhagens atingiu os mesmos valores. Cabe ressaltar que as linhagens recombinantes foram cultivadas na presença de antibiótico, o que representa um gasto energético maior para o crescimento em relação à linhagem não recombinante. Discussão 127 6 DISCUSSÃO 6.1 Caracterização fisiológica de C. metallidurans CH34 Os experimentos de resistência de C. metallidurans CH34 frente a antibióticos foram realizados com ampicilina, canamicina, cloranfenicol, neomicina e tetraciclina, uma vez que os vetores disponíveis no laboratório para a transformação genética dessa bactéria apresentavam genes de resistência a esses agentes antimicrobianos. Inicialmente, tínhamos no laboratório duas linhagens de C. metallidurans CH34 em princípio iguais, uma proveniente da coleção de cultura alemã DSMZ (Deutsche Sammlung Von Mikroorganismen und Zellkulturen) e outra, da coleção de cultura americana ATCC (American Type Culture Collection). No entanto, apesar de ambas terem apresentado altas resistências aos antibióticos, verificaram-se grandes diferenças entre elas. A literatura mostra que C. metallidurans CH34 possui resistência a vários antibióticos, no entanto, os valores que encontramos não apresentaram concordância (SIDDIQUI et al., 1988). Nesse trabalho, constatou-se que as duas linhagens de C. metallidurans CH34 resistiram a altas concentrações de ampicilina, canamicina e neomicina. A análise genômica dessa bactéria identificou 91 proteínas relacionadas à resistência a drogas e compostos tóxicos, que podem ter afinidade por esses antibióticos, inibindo sua ação (D`COSTA et al., 2006; NIKAIDO; ZGURSKAYA, 1999; VON ROZICKI et al., 2005). Para os antibióticos tetraciclina e cloranfenicol, a bactéria mostrou maior sensibilidade, o que permitiu a escolha de um vetor adequado à seleção de transformantes. Novamente, recorrendo ao estudo genômico de C. metallidurans CH34, verificamos que apenas duas proteínas são relacionadas à resistência a cloranfenicol nesta bactéria, o que pode explicar a menor resistência a esse antibiótico em relação àqueles analisados anteriormente (VON ROZICKI et al., 2005). A diferença de resistência das duas linhagens pode estar relacionada a fatores que reconhecidamente ocorrem em C. metallidurans CH34, como a ativação de transposons em temperaturas maiores de 37 °C, qu e pode ter disseminado genes de resistência no genoma da bactéria da coleção DSMZ, ou ainda pela obtenção de Discussão 128 novos genes no ambiente, pois essa bactéria é reconhecidamente uma boa aceptora de genes exógenos (TAGHAVI et al., 1997). Por apresentar maior sensibilidade à maioria dos antibióticos, a linhagem ATCC foi aquela utilizada nos experimentos subseqüentes desse trabalho. O segundo passo da caracterização fisiológica de C. metallidurans CH34 foi verificar o pH ótimo de crescimento dessa bactéria, uma vez que esse dado não estava disponível na literatura. O meio de cultura indicado para avaliar o crescimento de C. metallidurans CH34 é o meio TSM, que tem sido usado extensivamente para avaliar a resistência dessa bactéria frente a íons de metais pesados, pois não complexa e não promove a precipitação desses íons, como ocorre geralmente com os meios ricos. Entretanto, nem todos os experimentos com TSM foram realizados contemplando o pH ótimo de crescimento de C. metallidurans CH34, o que resultou em grandes variações nos valores de resistência citados na literatura até hoje (Tabela 11). Dessa forma, o meio TSM foi utilizado em diferentes valores de pH para cultivar C. metallidurans CH34. Verificamos que o crescimento ótimo dessa bactéria ocorreu em meio de pH 5.0, atingindo máxima densidade celular no menor tempo de cultivo, parâmetro esse extremamente importante para utilização em processos de biorremediação, pois permite obter a maior massa microbiana para remoção de íons de metais em efluentes. Os ambientes naturais de ocorrência de C. metallidurans CH34 apresentam valores de pH entre 5.0 e 6.0 (DIELS; MERGEAY, 1990) e os resultados obtidos nesse trabalho mostram que nesses pHs essa bactéria apresentou, de fato, os maiores níveis de crescimento. Discussão 129 Tabela 11: Mínima concentração inibitória de C.metallidurans CH34 frente a íons de metais pesados em meio TSM, descritos na literatura desde o seu isolamento. Íon 1978 1985 2 1987 3 1989 4 1990 5 1991 6 2001 7 2002 8 2004 Cd +2 6,0 2,5 5,0 2,5 4,0 1,5 Co +2 5,0 20,0 25,0 20,0 10,0 6,0 Cu +2 5,0 2,0 3,0 -2 CrO Hg Ni 0,6 4 +2 Mn 5,0 0,7 2005 10 2006 11 3,2 1,2 0,5 SeO +2 2008 12 3,0 9,0 0,35 0,8 0,2 0,05 0,006 60,0 2,5 2,5 +2 -2 Zn 0,2 9 +2 +2 Pb 1 1 6,0 2,5 8,0 4,0 3,5 0,4 1 6,0 3 20,0 12,0 2 25,0 12,0 1,0 14,0 3 4,5 4 3,0 5 6,4 15,0 6 Mergeay et al., 1978; Mergeay et al., 1985; Nies et al., 1987; Diels et al., 1989; Nies et al., 1990; Dressler et al., 1991 e Mergeay, 1991; 7Roux et al., 2001 e Borremans et al., 2001; 8Juhnke et al., 2002; 9 Munkelt et al. 2004; 10Ledrich et al., 2005 e Grass et al., 2005; 11Monchy et al., 2006a e 12Este trabalho. Dentre os vários fatores envolvidos na disponibilidade de metais em solução, o pH é provavelmente o mais importante, pois determina a sua solubilidade, bem como os processos de adsorção e, conseqüentemente, a capacidade de biorremediação de um sistema. Além disso, a adsorção de metais pesados por superfícies bacterianas, é geralmente regulada pelo pH do meio (BOEKHOLD et al., 1993; BRALLIER et al., 1996; FEIN et al., 2001; JOHN; LEVENTHAL, 1995). Cada íon de metal pesado apresenta uma particular cinética de adsorção em determinados valores de pH; enquanto íons de zinco e cádmio são abundantes em meios com pH entre 5.0 e 6.5, baixas concentrações desses íons são encontrados em meio com pH 8.0, além disso, precipitação em sólidos insolúveis ocorre em meio com pH maior que 6.0 para os íons Pb+2, Zn+2, Cd+2 e Cu+2 (FEIN et al., 2001; JOHN; LEVENTHAL, 1995). Portanto, o cultivo de C. metallidurans CH34 em TSM com pH 5,0 contendo íons de metais pesados, além de permitir o maior crescimento da bactéria, também permite a maior disponibilidade desses íons em solução e, por esse motivo, a caracterização da resistência de C. metallidurans CH34 frente a íons de metais pesados foi realizada nessa condição de cultivo. Os resultados mostraram que C. metallidurans CH34 é altamente resistente a uma ampla gama de metais pesados, mesmo quando o meio apresenta uma maior disponibilidade de íons como ocorreu na condição de cultivo realizada. Quando se compara a resistência de C. metallidurans CH34 com a de outras bactérias isoladas de ambientes contendo metais pesados, verifica-se que, de Discussão 130 fato, essa bactéria apresenta um amplo espectro de resistências, muitas vezes superior àquelas bactérias que possuem resistências específicas (Tabela 12). Tabela 12: Comparação da resistência de C. metallidurans CH34 a metais pesados com outros microrganismos isolados de ambientes contendo metais pesados. +2 C. metallidurans CH34 Pseudomonas H1 Bacillus H9 MIC Cd 3,0 mM 2,0 mM 2,5 mM Proveniência ATCC Solo contendo metais pesados Solo contendo metais pesados Referência Este trabalho Roane et al., 2001. ATCC Efluente contendo metais pesados Efluente contendo metais pesados Este trabalho Hassen et al, 1998 ATCC Efluente contendo metais pesados DSM Este trabalho Hassen et al, 1998 Roane et al., 2001. +2 C. metallidurans CH34 Pseudomonas aeruginosa Bacillus thuringiensis MIC Co 9,0 mM 0,4 mM 0,05 mM Hassen et al, 1998 +2 C. metallidurans CH34 Bacillus thuringiensis Thiobacillus ferrooxidans C. metallidurans CH34 Pseudomonas aeruginosa Bacillus thuringiensis MIC Cu 0,8 mM 0,5 mM 0,6 mM -2 MIC CrO 4 0,2 mM 1,2 mM 1,0 mM Boyer et al., 1998 ATCC Efluente contendo metais pesados Efluente contendo metais pesados Este trabalho Hassen et al, 1998 ATCC Efluente contendo metais pesados Efluente contendo metais pesados Este trabalho Hassen et al, 1998 Hassen et al, 1998 +2 C. metallidurans CH34 Pseudomonas aeruginosa Bacillus thuringiensis MIC Hg 0,006 mM 0,08 mM 0,06 mM Hassen et al, 1998 +2 C. metallidurans CH34 E. coli C. metallidurans CH34 Aspergillus niger MIC Mn 60,0 mM 20 mM +2 MIC Ni 3,5 mM 6,0 mM ATCC não informado ATCC Solo contendo metais pesados Este trabalho Nies, 1999 Este trabalho Magyarosy et al., 2002 +2 C. metallidurans CH34 Pseudomonas aeruginosa MIC Pb 3,0 mM 2,4 mM ATCC Efluente hospitalar Este trabalho Chang et al., 1997 -3 C. metallidurans CH34 Pseudoalteromonas C. metallidurans CH34 Pseudomonas aeruginosa Bacillus thuringiensis MIC SeO 4 1,0 mM 0,085 mM +2 MIC Zn 15,0 mM 1,5 mM 0,5 mM ATCC Fonte termal oceânica ATCC Efluente contendo metais pesados Efluente contendo metais pesados Este trabalho Rathgeber et al., 2002 Este trabalho Hassen et al, 1998 Hassen et al, 1998 Discussão 131 Esses resultados permitiram avaliar a real capacidade de C. metallidurans CH34 em resistir a diferentes íons de metais numa mesma condição de cultivo, demonstrando que, de fato, essa bactéria é uma excelente candidata para ser empregada em processos de biorremediação de efluentes que contenham metais pesados, como aqueles produzidos por vários segmentos da indústria e mineração, desde que ela possa adsorver íons eficientemente, capacidade essa que lhe foi conferida através de manipulação genética realizada neste trabalho. 6.2 Construção da bactéria C. metallidurans CH34 recombinante 6.2.1 Construção do cassete de ancoragem da EC20sp O seqüenciamento do plasmídeo pHEβ permitiu identificar os componentes do sistema de secreção da IgA protease, assim como estabelecer os sítios de clivagem de enzimas de restrição mais adequados para a sua manipulação genética. A primeira seqüência identificada foi a seqüência codificadora do peptídeo sinal, constituída por 51 nucleotídeos, a qual codifica uma seqüência de aminoácidos com estrutura típica de reconhecimento pela maquinaria de secreção (Sec) de bactérias Gram-negativas. Essa seqüência peptídica apresenta uma região amino-terminal (N) composta por resíduos de aminoácidos polares (N), uma região central (H), contendo predominantemente resíduos de aminoácidos hidrofóbicos e alanina e uma região carboxi-terminal polar, que codifica o sinal de reconhecimento de peptidases no espaço periplasmático (C) (Figura 66) (PALMER et al., 2005; PUGSLEY, 1993). Esse peptídeo tem como função sinalizar o transporte da proteína através da membrana citoplasmática. Figura 66: Estrutura do peptídeo sinal seqüenciado do plasmídeo pHEβ. N – aminoácidos polares, H – aminoácidos hidrofóbicos e alanina e C – sítio de clivagem por peptidases. Discussão 132 Outra seqüência identificada foi aquela que codifica o epítopo E-tag, constituída de 36 nucleotídeos (Figura 67); esta seqüência codifica um peptídeo de12 aminoácidos que é reconhecido pelo anticorpo anti-E-tag e funciona como repórter da ancoragem na membrana externa (VALLS et al., 2000 a,b; VEIGA et al., 1999). Figura 67: Estrutura do epítopo E-tag seqüenciado do plasmídeo pHEβ. A construção genética para a ancoragem de uma proteína na membrana, utilizando o sistema de secreção codificado no vetor pHEβ, requer que o gene dessa proteína, fusionado entre o peptídeo sinal e o domínio de ancoragem, não contenha códons de parada de leitura, a fim de que a fusão gênica seja traduzida com todos os componentes em uma única fusão protéica. Para tanto, foram desenhados dois oligonucleotídeos que se hibridizam, formando a seqüência gênica EC20sp e, além disso, para preservar a fase de leitura do sistema de secreção, adicionaram-se dois nucleotídeos na extremidade 3` do gene. O gene foi amplificado por PCR e, para que pudesse ser manipulado, foi clonado no vetor pGEM-T Easy. Uma vez que o gene EC20sp apresenta grande repetição de códons codificadores de cisteína-ácido glutâmico na sua seqüência, existia a possibilidade de anelamento dos oligonucleotídeos em diferentes regiões durante a reação de PCR. Para verificar se a seqüência clonada não continha mutações, alterações na seqüência ou anelamento incorreto, o plasmídeo construído foi seqüenciado e clones com a seqüência correta do gene foram identificados. Uma vez obtido o gene EC20sp, iniciou-se a sua clonagem no vetor pHEβ. O gene sintético EC20sp foi clonado no plasmídeo pHEβ, e a região 6His foi retirada do plasmídeo para não interferir na capacidade de ligação da EC20sp, pois resíduos de histidina também são utilizados para ligar metais. Novamente, a construção foi seqüenciada e verificamos que o cassete de ancoragem apresentou a seqüência correta, conforme a estratégia inicialmente traçada. Esse novo plasmídeo foi denominado pCM1. Discussão 133 6.2.2 Análise da expressão do cassete de ancoragem da EC20sp Uma vez construído o plasmídeo pCM1, foi possível analisar a expressão do cassete de ancoragem da EC20sp, sob o controle do promotor plac, para verificar a funcionalidade da construção. Para tanto, a linhagem utilizada nesse experimento foi E. coli UT5600, que é recomendada por Veiga et al. (1999) por apresentar reduzida quebra proteolítica de proteínas heterólogas. A seqüência do β-domínio do sistema de secreção da IgA protease codifica uma proteína de 45,2 KDa (VEIGA et al., 2002) e o gene EC20sp codifica uma proteína de 4,5 KDa, que, fundidas, formam uma proteína híbrida de aproximadamente 50 KDa. A comparação do perfil protéico, por SDS-PAGE, da linhagem não transformada e da linhagem transformada com o plasmídeo pCM1, permitiu verificar a presença de uma banda adicional exatamente desse tamanho, confirmando que a expressão do cassete de ancoragem estava correta e funcional. O passo seguinte consistiu em verificar se, de fato, a proteína expressa estaria sendo direcionada para a membrana externa. Para tanto, foi realizado um experimento de Western-blotting contra o epítopo E-tag, nas diferentes frações de membrana da bactéria. Verificamos que, somente na fração de membrana externa, pôde ser detectada a proteína expressa, demonstrando que a proteína heteróloga está sendo produzida e que o sistema de secreção está sendo funcional, possibilitando a ancoragem da proteína EC20sp na membrana externa da bactéria. Esse resultado está de acordo com aqueles obtidos por Veiga et al. (2002), ao utilizar essa via de secreção para ancoragem de peptídeos ricos em histidina. Uma vez que a EC20sp estava sendo produzida e ligada na membrana externa da bactéria, analisamos indiretamente a sua capacidade de ligar metais através da diminuição da concentração de Cd+2 em solução na presença da bactéria. Os resultados mostraram que a linhagem com a EC20sp ancorada na sua superfície diminuiu 89% a mais a concentração do Cd+2 em solução em relação à linhagem sem EC20sp, confirmando que a ancoragem dessa proteína ligadora de metal é uma estratégia eficaz para melhorar a capacidade da célula em ligar íons de metais pesados. Roane e Pepper (2000b) mostraram que a bactéria Arthrobacter D9, isolada de solo contendo metal pesado, foi capaz de remover 22% do cádmio de uma solução após 48 h de incubação. Se compararmos estes resultados àqueles que Discussão 134 obtivemos com a linhagem UT5600/pCM1, fica clara a superior capacidade da linhagem recombinante construída nesse trabalho, mesmo considerando que a expressão do cassete de ancoragem foi realizada através da indução do promotor plac. Uma vez verificada a funcionalidade da construção em E. coli, buscou-se então um promotor que apresentasse uma forte expressão do cassete de ancoragem da EC20sp em C. metallidurans CH34 sem a necessidade de uso de indutores de modo a permitir um aumento na capacidade de remoção do metal. 6.2.3 Escolha de promotores com forte capacidade de expressão protéica em C. metallidurans CH34 A busca por promotores que expressem altos níveis de proteínas em microrganismos sem a necessidade do uso de indutores é de grande interesse para sua utilização em grande escala, pois evita a necessidade de adição de substâncias, como o IPTG, que poderiam inviabilizar economicamente o processo, além de ser mais amigável ao meio ambiente por não liberar produtos sintéticos (SRINIVASAN et al., 2002). Para ultrapassar essa limitação, buscou-se por promotores que fossem capazes de expressar fortemente o cassete de ancoragem da EC20sp em C. metallidurans CH34 sem nenhum tipo de indução exógena. O plasmídeo utilizado nessa etapa do trabalho foi o pBBEGFP, construído no nosso laboratório, porque permite a clonagem de seqüências promotoras a montante do gene repórter EGFP, que codifica uma proteína com grande estabilidade, de pequeno tamanho e de fácil detecção, além de não requerer substrato exógeno (ERRAMPALLI et al., 1999). Este plasmídeo é derivado do vetor pBBR1MCS, que é de amplo espectro para bactérias Gram-negativas, com grande estabilidade em C. metallidurans CH34, e, além disso, permite seleção por cloranfenicol, antibiótico ao qual C. metallidurans CH34 é sensível. Optou-se por três diferentes estratégias para a obtenção do promotor. A primeira foi utilizar a análise proteômica de C. metallidurans CH34, recentemente realizada por Noël-Georis et al. (2004), na qual se identificaram proteínas fortemente expressa. A partir desse estudo proteômico, foi possível identificar as seqüências de DNA codificadoras destas proteínas e, conseqüentemente, as suas regiões promotoras. Discussão 135 Seis seqüências promotoras foram escolhidas e amplificadas a partir do DNA total de C. metallidurans CH34 e clonadas com sucesso a montante do gene da EGFP no vetor pBBEGFP, para que a expressão do gene repórter pudesse ser medida. A segunda estratégia foi avaliar a expressão de promotores conhecidos por expressar genes constitutivamente em C. metallidurans CH34. Nesse caso, dois promotores foram escolhidos: czcI e plac. Segundo Große et al. (2004), o promotor do gene czcI, presente no operon czc de C. metallidurans CH34, deve ser o responsável pela expressão constitutiva da bomba de efluxo CzcCBA, e por esta razão esse promotor foi escolhido no presente trabalho. Por sua vez, o promotor plac, do operon da lactose de E.coli, é reconhecidamente constitutivo em C. metallidurans CH34 (NIES; SILVER, 1989; NIES et al., 1989; LEGATZKI et al., 2003a) e, conseqüentemente, esse promotor também foi escolhido como alvo do estudo. No primeiro caso, a seqüência promotora czcIp foi amplificada a partir do DNA total de C. metallidurans CH34 e clonada a montante do gene da EGFP no plasmídeo pBBEGFP. No segundo caso, o fragmento plac-EGFP do plasmídeo pLG, foi clonado no vetor pBBR1MCS para transformar células de C. metallidurans CH34. A terceira estratégia foi verificar a expressão do gene da EGFP sob o controle do promotor pan de B. subtilis, uma vez que já se havia detectado forte expressão em E.coli, em outro trabalho do nosso laboratório. Em B. subtilis, esse promotor é reprimido pelos íons Mn+2 ou Fe+2, através da atuação do repressor PerR, que se liga na região operadora do promotor, inibindo a expressão do gene mrgA. A proteína codificada por mrgA está relacionada ao regulon de resposta de estresse oxidativo e de limitação de íons nessa bactéria (BSAT et al., 1998; FUANGTHONG et al., 2002). 6.2.4 Análise da expressão de EGFP pelos diferentes promotores A detecção de fluorescência nas bactérias C. metallidurans CH34 e E. coli, portadoras das diferentes construções, foi primeiramente realizada em microscópio de epifluorescência e possibilitou observar células com fluorescência verde nas duas bactérias em algumas construções; no entanto, em outras não se observou fluorescência. Segundo Patterson et al. (1997), pelo menos 10 000 moléculas de Discussão 136 GFP são necessárias no citoplasma da célula para detecção por microscopia de fluorescência e, conseqüentemente, sua detecção e quantificação devem ser realizadas por métodos mais sensíveis, como a citometria de fluxo, que permite detectar fluorescência abaixo dos limites da microscopia. A citometria de fluxo é uma técnica que mede e analisa simultânea e individualmente, as múltiplas características de uma partícula ou células suspensas, nas quais incide um foco de luz (laser), permitindo a detecção das suas características através de um leitor óptico ligado a um computador. Dentre os parâmetros possíveis de serem medidos por citometria de fluxo, estão o tamanho, a granulosidade, a complexidade interna e a fluorescência das células (RIESEBERG et al., 2001). Devido à necessidade de quantificar e comparar os níveis de fluorescência nas diferentes construções, todas foram analisadas por essa técnica, tanto em C. metallidurans CH34, quanto em E. coli. Dois parâmetros da análise por citometria foram avaliados: a intensidade de fluorescência, que permitiu analisar a capacidade de cada promotor em expressar o gene repórter, e a distribuição celular de cada linhagem analisada, possibilitando avaliar se a presença da proteína heteróloga, assim como a sua concentração, alteravam as características celulares. Os resultados mostraram que a distribuição celular das diferentes populações bacterianas foi homogênea, ou seja, não foi alterada pela presença da EGFP, mesmo naquelas linhagens que superexpressaram essa proteína, indicando que sua presença não ocasionou danos celulares que comprometessem a estrutura celular microbiana. Da mesma forma, Tombolini et al. (1997) não constataram alterações celulares em Pseudomonas fluorescens A506, quando mediram a expressão da GFP por citometria, sugerindo que essa proteína não possui propriedades tóxicas a essa bactéria. Diferentemente dos resultados de distribuição celular, as medidas de fluorescência nas células variaram consideravelmente, dependendo do promotor utilizado. No caso dos promotores P1 a P6, escolhidos por análise proteômica, os níveis de fluorescência mostraram-se baixos em C. metallidurans CH34, enquanto em E. coli não se verificou nenhuma fluorescência, e por essa razão, esses promotores foram considerados fracos para expressar o cassete de ancoragem da EC20sp. Discussão 137 A regulação da expressão de proteínas pelas células em geral, é controlada por diversos fatores, podendo ocorrer em nível de transcrição e pós-transcricional, tradução e pós-traducional, assim como dependente de estímulos ambientais (NOËL-GEORIS et al., 2004). Apesar de termos identificado proteínas com forte expressão em C. metallidurans CH34, não se conhecia em que nível de regulação celular aquelas proteínas eram produzidas, nem a sua estabilidade, nem tampouco em qual concentração eram necessárias à célula. Assim, por exemplo, o promotor P6, responsável pela expressão do gene da proteína ribossomal L10, não comprovou ser um promotor forte nas nossas condições, muito embora devido à estabilidade do RNAmensageiro, à estabilidade protéica ou ainda à eficiência de tradução, a expressão da proteína ribossomal L10 seja alta em C. metallidurans CH34. Como foram escolhidos promotores que controlam genes relacionados a proteínas essenciais à célula, de fato, deve haver algum nível de controle de expressão protéica, não dependente apenas da força de expressão dos promotores analisados. Quanto aos promotores constitutivos em C. metallidurans CH34, czcIp (P7) e plac, foi possível detectar a expressão da EGFP, porém, em pequenas intensidades e, por isso, também os consideramos promotores fracos para nossa finalidade. O promotor do gene czcI do operon czc de C. metallidurans CH34 mostrou uma intensidade de fluorescência de 21,86, quando a bactéria foi cultivada na presença de íons metálicos. Große et al. (2004) presumiram que esse promotor fosse o responsável pela expressão constitutiva da bomba de efluxo CzcCBA. No entanto, nossos resultados mostram que esse promotor é induzido por metais e não constitutivo, pois o cultivo da bactéria sem metais não mostrou nenhuma expressão da EGFP. Esse resultado indica que, provavelmente, outro promotor do operon czc deva ser o responsável pela manutenção basal da expressão da bomba de efluxo CzcCBA e não czcIp. Em E coli, não se verificou a expressão de EGFP por esse promotor. O promotor plac mostrou expressar EGFP nas duas bactérias analisadas. Em C. metallidurans CH34, a média da intensidade de fluorescência relativa foi de 61,9, tanto na presença de glicose quanto na de IPTG no meio de cultivo. Esse resultado reafirma a expressão constitutiva relatada na literatura em C. metallidurans CH34 (NIES; SILVER, 1989; NIES et al., 1989; LEGATZKI et al., 2003a). O genoma Discussão 138 dessa bactéria mostra que existem quatro reguladores do tipo-lacI, no entanto, não se verificou atuação no plac nesse trabalho. O componente central da regulação transcricional em bactéria é a RNApolimerase, que ganha especificidade por seqüências promotoras ao se ligar a determinados fatores sigma (σ). Segundo NIES (2004), muitos σ de C. metallidurans CH34 são similares aos σ de E. coli, o que pode explicar a capacidade de reconhecimento da seqüência consenso do promotor do plac, expressando o gene repórter. Como esperado, em E. coli, a expressão da EGFP sob o controle do plac foi reprimida na presença de glicose e induzida na presença de IPTG. Na presença do indutor, o repressor do plac (lacI), é convertido em uma forma inativa, o que permite a ligação da RNApolimerase na região promotora/operadora do promotor, iniciando o processo de transcrição gênica do gene repórter. Dessa forma, na presença de IPTG, a expressão da EGFP foi 6,5 vezes maior àquela medida na presença de glicose. Comparando a força de expressão do plac em E. coli e em C. metallidurans CH34, verifica-se que, a primeira, é 14 vezes superior à segunda, na presença de IPTG. Contrastando com os resultados anteriores, o promotor pan promoveu forte expressão basal do gene da EGFP em C. metallidurans CH34 e, além disso, na presença de íons metálicos esta expressão foi ainda aumentada. A expressão heteróloga da EGFP pelo promotor pan em C. metallidurans CH34 cultivada sem metais, mostrou ser 24 vezes maior quando comparada ao plac nessa bactéria. Na presença de íons Cd+2, a intensidade de fluorescência foi de, aproximadamente, 55 vezes superior ao promotor plac. A presença dos diferentes íons de metais no meio de cultivo de C. metallidurans CH34 aumentou os níveis de expressão da EGFP, indicando que algum mecanismo de indução deve estar ocorrendo. O alinhamento das seqüências dos promotores induzidos por metais em C. metallidurans CH34 com o promotor pan permitiu verificar que a região -10 desse promotor tem grande similaridade com a mesma região dos promotores czcN e cnrY (Figura 68). Quanto ao plac e pbrA, nota-se que há duas bases de discrepância nessa região e três bases quando se compara com o promotor merR. Discussão 139 Figura 68: Comparação da seqüência do promotores utilizados nesse estudo. pan, promotor do gene mrgA de B. subtilis; czcN, promotor do operon czc de C. metallidurans CH34; cnrY, promotor do operon cnr de C. metallidurans CH34; plac, promotor do operon de lactose de E. coli; pbrA, promotor do operon pbr de C. metallidurans CH34 e merR, promotor do operon mer de C. metallidurans CH34. Em vermelho estão representados os nucleotídeos idênticos ao promotor pan e, em preto, aqueles discrepantes. As regiões -35 desses promotores, entretanto, apresentam maiores discrepâncias. É possível que o aumento da expressão da EGFP pelo pan em C. metallidurans CH34 na presença de metais seja devido à afinidade dos indutores dos operons dessa bactéria, pela seqüência consenso de pan. Segundo Lewin et al. (2001), a região -35 de um promotor tem como função servir como sinal de reconhecimento para a ligação da RNA-polimerase, enquanto a região -10 permite o desenrolamento da fita de DNA para o início de transcrição. Além disso, a distância entre essas regiões é crucial para a adequada ligação da RNA-polimerase. O promotor czcN do operon de resistência a Cd+2, Co+2 e Zn+2 apresentou grande homologia com o promotor pan nas regiões -10 e -35 e, além disso, a mesmo número de bases entre elas. Na presença desses mesmos íons, foram detectados os maiores níveis de fluorescência em C. metallidurans CH34, sugerindo que o ativador transcricional do operon czc, que age no promotor czcN na presença de íons, também deve reconheçer o promotor pan, induzindo a expressão da EGFP. No caso do promotor cnrY, do operon de resistência a Ni+2 e Co+2, apesar de haver também uma grande homologia nas regiões -10 e -35, há uma maior distância entre essas regiões (LIESEGANG et al., 1993). Esse promotor é reconhecido pela holoenzima, devido à especificidade do fator sigma CnrH, que deve estar atuando em pan, aumentando a expressão da EGFP. Os resultados Discussão 140 mostraram que, na presença de Ni+2, a expressão não aumentou como no caso do czc, provavelmente em decorrência da maior discrepância na seqüência promotora. O promotor pbrA do operon de resistência a chumbo de C. metallidurans CH34 também apresentou similaridade ao promotor pan, fato este que sugere que a presença de chumbo favoreceu o aumento da expressão da EGFP. Quanto ao promotor de mercúrio, verifica-se grande discrepância na seqüência do promotor, e, provavelmente devido a isto não ocorreu nenhuma indução da expressão dos níveis basais da EGFP pelo pan. Na presença de Fe+2 e Mn+2, também se verificou aumento na expressão da EGFP. Em B. subtilis, esses íons se ligam na proteína repressora PerR, reprimindo a expressão do gene mrgA. Contrariamente, neste trabalho verificou-se que não ocorreu repressão na presença desses íons em C. metallidurans CH34, apesar dessa bactéria apresentar em seu genoma proteínas homólogas da família PerR. Em E. coli, o promotor pan se mostrou constitutivo e, além disso, não ocorreu a regulação do promotor na presença de Mn+2, apesar dessa bactéria apresentar também no seu genoma proteínas da família PerR. Na presença de Fe+2, ocorreu uma pequena diminuição nos níveis de expressão da EGFP, indicando que pode haver algum regulador com baixa especificidade por pan. Esse resultado permitiu também a obtenção de um promotor forte com expressão constitutiva nessa bactéria, abrindo perspectivas inéditas de utilização para expressão de genes heterólogos em E. coli. Por outro lado, os resultados mostram que a força de expressão do promotor pan é quatro vezes superior em C. metallidurans CH34, na presença de Cd+2, em comparação com o mesmo promotor em E. coli sob indução. A expressão da EGFP nas bactérias Burkholderia cepacia e Bartonella henselae, sob o controle do promotor induzido por arabinose e de outro, constitutivo, respectivamente, foi medida por citometria de fluxo e a intensidade máxima de fluorescência medida nesses trabalhos (LEFEBRE; VALVANO, 2002; LEE; FALKOW, 1998), atingiu a metade daquela observada em C. metallidurans/panEGFP cultivada em meio contendo Cd+2. A comparação com os dados de literatura nos leva a considerar o promotor pan como um promotor extremamente forte em C. metallidurans CH34 e, conseqüentemente, esse promotor foi eleito para a expressão do cassete de ancoragem nessa bactéria, sendo o primeiro promotor heterólogo de forte expressão a ser utilizado em C. metallidurans CH34. Além disso, esses resultados abrem um caminho de investigação científica no sentido de testar Discussão 141 promotores que são regulados em uma determinada espécie, para avaliação em outra espécie, com o objetivo de buscar promotores de interesse biotecnológico. 6.2.5 Construção, análise do cassete de expressão-ancoragem da EC20sp em C. metallidurans CH34 e sua capacidade de otimizar a adsorção de metais pesados O primeiro passo para a construção genética com o objetivo de expressar o cassete de ancoragem da EC20sp em C. metallidurans CH34, sob o comando do promotor pan, foi amplificar esse cassete de ancoragem a partir do plasmídeo pCM1, que se mostrou funcional em E. coli sob o comando do promotor plac. Foram desenhados iniciadores de PCR que permitiram a amplificação do fragmento gênico correspondente à fusão gênica “peptídeo sinal-EC20sp-E-tag-β-domínio”, de tal forma que este cassete fosse fusionado de forma precisa a jusante do promotor pan, presente no vetor pBB-panEGFP. Assim, a ligação entre o cassete de ancoragem e o promotor pôde ser realizada com sucesso e a nova construção, chamada cassete de expressão-ancoragem da EC20sp, foi confirmada por seqüenciamento. Uma vez construído o plasmídeo pCM2, foi possível analisar a expressão do cassete de ancoragem da EC20sp, sob o controle do promotor pan em C. metallidurans CH34. Dessa forma, células dessa bactéria foram transformadas com o plasmídeo pCM2 e a primeira análise consistiu em verificar a expressão do cassete de ancoragem por meio de SDS-PAGE. Como já mencionado anteriormente, a proteína codificada pela fusão da EC20sp com o β-domínio tem o tamanho de 50 KDa e, quando foi comparado o perfil protéico da linhagem não transformada com a linhagem portadora do plasmídeo pCM2, verificou-se a presença de uma banda adicional com exatamente este tamanho na linhagem transformante, confirmando que a expressão do cassete de ancoragem estava ocorrendo. Para verificar se, de fato, a proteína expressa estaria sendo direcionada para a membrana externa, foi realizado um Western-blotting contra o epítopo E-tag, nas diferentes frações de membrana da bactéria. Somente na fração de membrana externa foi detectada a proteína de interesse, demonstração cabal de que a proteína heteróloga estava sendo produzida e que o sistema de secreção estava funcional, possibilitando a ancoragem da proteína EC20sp na superfície de C. metallidurans CH34. Cabe ressaltar que em outro projeto do nosso grupo de pesquisa foram Discussão 142 produzidos anticorpos específicos contra EC20sp, que também reconheceram a proteína EC20sp na membrana externa de C. metallidurans CH34/pCM2 em experimentos de Western-blotting (Carolina Parada, comunicação pessoal). Uma vez que a EC20sp estava sendo produzida e ligada na membrana externa da bactéria, foi possível analisar a capacidade da nova bactéria em ligar metais. Para tanto, o primeiro experimento objetivou verificar o melhor tempo de incubação entre uma determinada massa microbiana em uma solução contendo uma concentração de Cd+2 conhecida, de forma a estabelecer uma cinética de adsorção para esse íon. Quando a concentração de Cd+2 utilizada no experimento foi de 100 µM, os resultados mostraram que, após C. metallidurans/pCM2, a solução a incubação com a linhagem apresentava 50% menos Cd+2 quando comparada à linhagem controle C. metallidurans/pBBR1MCS. No experimento seguinte, foi utilizada a mesma linhagem transgênica C. metallidurans/pCM2, porém pré-cultivada na presença de Cd+2, para verificar se haveria aumento na capacidade de ligação deste metal pesado. Novamente, observou-se que a linhagem C. metallidurans/pCM2 apresentou melhor capacidade de ligação ao metal e, além disso, quando induzida, a mesma linhagem mostrou-se capaz de adsorver maior quantidade do metal. Em suma, verificou-se que a presença da EC20sp na superfície bacteriana diminui a concentração do cádmio residual em solução, comprovando ser, de fato, uma proteína que liga este metal eficientemente. A linhagem C. metallidurans/pCM2 expressa altos níveis basais dessa proteína, fato este que representa um grande avanço para uma linhagem biorremediadora, pois dispensa a necessidade de indutores e constitui uma novidade biotecnológica na área. Além disso, a mesma linhagem pré-cultivada na presença do próprio metal apresenta aumento da capacidade de biorremediar a solução com cádmio devido ao acréscimo da expressão do cassete de ancoragem que, conseqüentemente, aumentou a quantidade de EC20sp disponível na superfície bacteriana. O desaparecimento do cádmio em solução, após a incubação com a massa microbiana, consiste apenas numa medida indireta de que as bactérias estão adsorvendo o cádmio. Decidiu-se então, medir a quantidade de metal ligada diretamente na massa microbiana por entender que, de fato, a capacidade de biorremediação das linhagens é referente à quantidade de metal ligada às células e Discussão 143 não aquela medida pela diminuição do metal em solução, devido às interferências próprias do experimento como a ligação de metal às paredes dos tubos, diferenças de pipetagem, entre outros artefatos experimentais (ROANE; PEPPER, 2000a). Conseqüentemente, os experimentos seguintes do trabalho foram realizados por incubação da linhagem transgênica C. metallidurans/pCM2 em presença dos metais Cd+2, Co+2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2 e Zn+2, que foram quantificados diretamente na massa microbiana ao final do período de incubação. Para todos os metais analisados, com exceção do Hg+2, foi verificado que a linhagem C. metallidurans/pCM2 cultivada na presença de metais apresentou maior capacidade de ligar metal em relação à mesma linhagem cultivada na ausência de metais, assim como também em relação à linhagem controle (sem EC20sp). O précultivo de C. metallidurans/pCM2 com os diversos metais, de fato, aumentou a expressão do cassete de ancoragem e o potencial biorremediador da linhagem, fato este que está de acordo com aqueles anteriormente observados nos experimentos de citometria, onde a presença de metal aumentou a expressão da EGFP sob o controle do promotor pan. O metal pesado Cd+2 é considerado extremamente perigoso devido à sua toxicidade e à grande utilização pela indústria, o que acarreta a produção de um volume considerável de resíduos que são lançados no meio ambiente. Por estas razões, a maioria dos estudos tem contemplado avaliar o potencial biorremediador dos diversos sistemas frente a este metal em relação aos outros metais (Haq et al., 1999). Quando comparamos a capacidade da linhagem C. metallidurans/pCM2, construída no nosso trabalho, com outros microrganismos recombinantes descritos na literatura até agora, quanto à ligação ao Cd+2, verificamos que, o nosso resultado foi muito superior aos demais (Tabela 13). No entanto, há pontos relevantes que devem ser ressaltados: (i) os demais sistemas foram testados em meios de cultura, o que não é adequado, pois geralmente quelam os metais da solução, ou ainda os precipitam em forma de sais insolúveis indisponibilizando o íon para ligar na superfície bacteriana, principalmente, em soluções cujo pH é maior que 6,0 (ROANE; PEPPER, 2000a); (ii) os demais sistemas, salvo os trabalhos de Valls et al. (2000 a e b), utilizaram a bactéria E. coli que não é considerada um agente Discussão 144 adequado de biorremediação pelas suas características de patogenicidade e baixa resistência a metais; (iii) todos os sistemas construídos até agora foram expressos a partir de promotores induzidos como o plac, T7 (promotor do fago T7) e Pm (promotor do operon de metabolismo de tolueno de P. putida, induzido por 3-metilbenzoato), o que representa uma limitação ao uso em grande escala, enquanto a linhagem C. metallidurans/pCM2 dispensa indução e, por fim, (iv) os diversos trabalhos não foram conduzidos nas mesmas condições de cultivo, tais como temperatura, agitação, tempo de incubação, número de cópias dos plasmídeos por célula e concentração de metal, o que dificulta a comparação dos resultados, mesmo quando a quantificação dos íons foi realizada diretamente na massa microbiana. Ressaltados esses pontos, é possível considerar que a linhagem C. metallidurans/pCM2 construída neste trabalho é um excelente agente de biorremediação para Cd+2, pois, além de ser altamente resistente e colonizar ambientes contendo este metal, mostrou também acumular este íon durante o crescimento da linhagem em presença deste íon (condições de indução do promotor) (Figura 54). Este fato que abre perspectivas de utilizar o próprio efluente contendo metal como meio de cultivo dessa bactéria, proporcionando uma concomitante biorremediação durante o crescimento celular. O conjunto dos nossos resultados, mostrados aqui, permite afirmar que a expressão e ancoragem da EC20sp na superfície de C. metallidurans é uma estratégia adequada para otimizar a capacidade desta bactéria em ligar Cd+2, o que também abre oportunidades para uso deste sistema em outras bactérias Gramnegativas que tenham potencial biorremediador. Discussão 145 Tabela 13: Comparação da capacidade biorremediadora de cádmio das linhagens recombinantes descritas na literatura com a linhagem construída no presente trabalho. *LamB: porina de maltose; OmpA: proteína A de membrana externa; Bioacúmulo +2 ηmol Cd mg peso seco Microrganismo Promotor Âncora* E. coli plac LamB E. coli plac LamB Peptídeo ** Meio de cultivo, [ ] inicial de metal , e tempo de incubação Ref Recombinante Controle MT 30 2,0 MJS 20 µM 4h Sousa et al., 1998 6 His 8,0 2,5 MJS 30 µM 3,5 h Kotrba et al., 1999 4 Cis 9,5 E. coli plac OmpA 36 His 32 10,3 Sol. Salina 0,44 µM 24 h Xu, Lee, 1999 E. coli plac OmpA EC20 60 4 LB 100 µM 16 h Bae et al., 2000 Pm IgA Protease MT 28 10 MJS 300 µM - Valls et al., 2000b MT 42 14 Pm IgA Protease MJS 300 µM 18 h Valls et al., 2000a T7 pili 6 His 656,25 276 LB 20 µM 2h Saffar et al., 2007 pan IgA Protease EC20sp 17.600 11.100 H2O MilliQ 1000 µM 24 h Este trabalho P. putida C. metallidurans E. coli C. metallidurans **MT: metalotioneína; His: resíduos de histidina; Cis: resíduos de cisteína Por outro lado, este trabalho mostrou-se inovador quanto à investigação do potencial de ligação do íon Co+2 a uma linhagem bacteriana contendo a EC20sp na superfície, além disso, poucos trabalhos de biorremediação de Co+2 por bactérias têm sido relatados na literatura. Em nenhum dos trabalhos citados na Tabela 13, esse íon foi avaliado frente às linhagens recombinantes. No entanto, há relatos de Discussão 146 que a bactéria Streptomyces noursei foi capaz de ligar 20,4 µM de Co+2/mg de peso seco de células, ou seja, quatro vezes superior à linhagem C. metallidurans/pCM2 frente a este íon (MATTUSCHKA; STRAUBE, 1993). Os resultados de ligação de Co+2 mostraram que a linhagem recombinante C. metallidurans/pCM2 apresentou uma melhora de 13% na capacidade de ligar este metal em relação à linhagem sem EC20sp, indicando que esse íon não deve apresentar grande afinidade pela fitoquelatina. Para o Cu+2, foi verificado que a presença da EC20sp na superfície da linhagem C. metallidurans/pCM2 foi essencial para aumentar a sua capacidade de biorremediação em 76%, quando comparado ao controle (C. metallidurans/pBBR1MCS), chegando a ligar 42,65 µM de Cu+2/mg de peso seco de células em 24 h. Hassen et al. (1998) mostraram que a bactéria P. aeruginosa selvagem foi capaz de adsorver 28,35 µM de Cu+2/mg de peso seco de células após três dias de cultivo em meio rico contendo 500 µM de Cu+2, ou seja, 50% menos que a bactéria construída no presente trabalho. Diferentemente do Co+2, o Cu+2 tem sido alvo de trabalhos de biorremediação, exemplo disso, é o trabalho de Souza et al. (1998) no qual uma linhagem recombinante de E. coli com a metalotioneína ancorada na sua superfície adsorveu Cu+2, chegando a ligar 6,5 ηM de Cu+2/mg de peso seco de células contra 1,2 ηM de Cu+2/mg de peso seco de células na linhagem selvagem. Portanto, esses resultados mostram que ainda há um grande espaço para melhorar linhagens que possam biorremediar este íon. A grande capacidade de C. metallidurans/pCM2 em ligar cobre a torna uma excelente candidata a agente de biorremediação de ambientes contendo este metal. O principal mecanismo de resistência a Hg+2 em C. metallidurans é a produção da redutase MerA, a qual reduz Hg+2 a mercúrio metálico Hg0, que é volátil e difunde-se para fora da célula. Desta forma, a bactéria se proteje dos efeitos tóxicos desse íon, embora, não seja capaz de biorremediar o ambiente. Quando se examinou a capacidade da linhagem C. metallidurans/pCM2 em adsorver Hg+2, notou-se que a melhor situação ocorreu quando a massa microbiana utilizada não foi cultivada na presença deste metal, e neste caso ligou 100% a mais desse metal em relação às outras linhagens. O operon de mercúrio não é ativado por sistemas de indução, o que ocorre é que a presença desse íon desloca o repressor permitindo a expressão do operon mer. Além disso, como o promotor desse operon não apresenta similaridade com o promotor pan, a linhagem Discussão 147 C. metallidurans/pCM2 pré-cultivada na presença de Hg+2 não deveria mesmo estimular a expressão do cassete de ancoragem da EC20sp. Por outro lado, o précultivo com Hg+2, estimula a forte expressão de MerA e, conseqüentemente, a maior volatilização desse íon, protegendo a linhagem dos seus efeitos tóxicos. Por estas razões, a capacidade de bioacúmulo da linhagem C. metallidurans/pCM2 cultivada com Hg+2 permaneceu nos mesmos níveis em relação à linhagem controle. Uma linhagem recombinante de E.coli com a EC20 ancorada na superfície através da proteína OmpA mostrou ligar 19 ηM de Hg+2/mg de peso seco de células (Bae et al., 2001) enquanto a linhagem C. metallidurans/pCM2 ligou 100 ηM de Hg+2/mg de peso seco de células, ou seja, 5 vezes superior à primeira, mostrando que apesar da ligação desse metal ter sido pequena, em termos de quantidade, a linhagem construída neste trabalho ainda representa uma alternativa viável. Outras bactérias não recombinantes, como B. thuringiensis e P. aeruginosa mostraram adsorver Hg+2 em concentrações maiores que aquelas observadas em C. metallidurans/pCM2 (HASSEN et al., 1998). No entanto, estas bactérias não apresentam o espectro de resistências de C. metallidurans e, portanto, apresentam limitações quando a biorremediação deve ser realizada em efluentes contendo mistura de metais em níveis tóxicos. O Mn+2 é o segundo metal mais abundante do planeta e, apesar de sua baixa toxicidade, sua presença em efluentes é indesejável, pois altera o pH do efluente (Mn+2 + 0,5 O2 + H2O → MnO2 + 2H+), dá o gosto metálico à água, além de ser altamente oxidável, formando precipitados que escurecem as correntes de água e entopem tubulações (HALLBERG; JOHNSON, 2005). Apesar disso, poucos trabalhos de biorremediação tem enfocado o Mn+2. Assim como para o Co+2, este trabalho é inovador no que se refere à capacidade de uma linhagem recombinante em biorremediar Mn+2. Os resultados obtidos neste trabalho mostraram que a linhagem C. metallidurans/pCM2 induzida apresentou uma melhora de 31% em relação à linhagem sem EC20sp, mostrando que esta proteína apresentou afinidade por este íon. O acúmulo de manganês por C. metallidurans/pCM2, apesar de ser menor em termos de quantidade em relação aos outros íons, mostra que esta linhagem apresenta potencial de recuperação desse íon a partir de efluentes. O manganês existe naturalmente nos estados oxidativos Mn+2 e Mn+4 e é reconhecidamente um bom aceptor de elétrons no Discussão 148 metabolismo bacteriano (Nies, 1999), o que leva, em geral, à formação de precipitados em solução. Desta forma, a recuperação deste íon ligado na biomassa microbiana ainda não tem sido mostrada na literatura, mas somente através de precipitação. Exemplo disso, é o uso de consórcios microbianos em reatores para a remoção de Mn+2 por precipitação ((HALLBERG; JOHNSON, 2005), o que mostra que a linhagem C. metallidurans/pCM2, de fato, é uma novidade no que se refere à remoção desse íon diretamente pela massa microbiana. O Ni+2, que é um elemento de grande interesse industrial, também foi avaliado quanto à capacidade de se ligar nas linhagens construídas neste trabalho. A linhagem C. metallidurans/pCM2 induzida aumentou em 45% a ligação a este metal quando comparada ao controle. Muitas espécies de bactérias selvagens têm sido avaliadas quanto à capacidade de adsorver Ni+2 na massa microbiana, no entanto, nenhuma melhorada por engenharia genética. Exemplo disso é a bactéria Streptomyces noursei que ligou 13,63 µM de Ni+2/mg de peso seco de células em sua biomassa, contra 8,46 µM de Ni+2/mg de peso seco de células de C. metallidurans recombinante (MATTUSCHKA; STRAUBE, 1993). Para o Zn+2, a linhagem C. metallidurans/pCM2 induzida mostrou ser muito superior ao controle. De fato, para este íon houve um aumento de 219% na adsorção, chegando a ligar 51,07 µM de Zn+2/mg de peso seco de células. Comparada à Streptomyces noursei, nossa linhagem foi duas vezes superior na adsorção deste íon (MATTUSCHKA; STRAUBE, 1993). Quando se compara à linhagem E. coli recombinante, que possui a metalotioneína na superfície, a qual ligou 4 ηM de Zn+2/mg de peso seco de células contra 1,5 ηM de Zn+2/mg de peso seco de células da mesma linhagem sem metalotioneína (SOUSA et al., 1998), notase que o resultado é muito inferior ao da linhagem construída no presente trabalho. Fica evidente que a EC20sp apresentou grande afinidade por Zn+2 e, além disso, os resultados mostraram que o crescimento da massa microbiana précultivada na presença de Zn+2 foi capaz de ligar grande quantidade desse metal, abrindo perspectivas de biorremediar efluentes através do cultivo do agente biorremediador no próprio efluente a ser tratado, o que confere grande vantagem ao processo. O melhor resultado foi obtido frente ao Pb+2: a linhagem C. metallidurans/pCM2 chegou a adsorver 54,75 µM de Pb+2/mg de peso seco de Discussão 149 células, o que representa um aumento de 210% na capacidade de ligar íons Pb+2, em relação ao controle. O chumbo é um elemento extremamente tóxico e a busca por agentes biorremediadores para este íon tem sido alvo de diversos estudos com linhagens selvagens de bactérias como Pseudomonas e Streptomyces (CHANG et al., 1997; MATTUSCHKA; STRAUBE, 1993), no entanto, faltam na literatura estudos mais recentes e com linhagens melhoradas geneticamente. Para cada metal testado isoladamente, verificamos que a linhagem C. metallidurans/pCM2 induzida apresentou diferentes níveis de capacidade de ligação. Isto se deve a vários motivos, a saber: (i) cada íon metálico proporciona um determinado nível de indução do promotor pan e, conseqüentemente, interfere na quantidade de EC20sp presente na superfície da bactéria; (ii) a própria EC20sp apresenta diferentes afinidades pelos diferentes metais, o que também leva à ligação a um determinado íon, em detrimento de outro. Quando comparamos somente os resultados obtidos na melhor situação de biorremediação, ou seja, quando a linhagem C. metallidurans/pCM2 induzida foi utilizada (Figura 62), verificamos que houve, de fato, uma preferência de ligação aos diferentes metais. Satofuka et al. (2001), mostraram que peptídeos de fitoquelatina sintética contendo sete resíduos de cisteína (EC7) ligaram Cd+2, Cu+2, Hg+2, Ni+2, Pb+2 e Zn+2 com diferentes afinidades, comprovando definitivamente que há uma escala de afinidade pelos resíduos de cisteína. Efluentes industriais e de mineração possuem comumente uma mistura de metais, podendo haver a prevalência de um determinado metal. Como os primeiros experimentos deste trabalho foram realizados para estabelecer a capacidade de adsorção de cada metal isoladamente, realizou-se também a avaliação da capacidade de ligação em soluções contendo misturas desses metais. Os resultados mostraram que novamente a linhagem C. metallidurans/pCM2 cultivada na presença de metais foi capaz de atingir os maiores níveis de adsorção de íons. Além disso, verificou-se que a capacidade de adsorção apresentou o mesmo perfil de afinidade observado quando o metal foi usado isoladamente, exceto para Zn+2 e Pb+2, quando houve inversão na afinidade de ligação à massa microbiana. Assim, reforçaram-se os resultados de que a EC20sp apresentou a seguinte espectro de afinidade: Zn~Pb>Cd>Cu>Ni>Mn>Co>Hg. Quando estes resultados são comparados aos resultados obtidos com bactéria controle Discussão 150 C. metallidurans/pBBR1MCS, fica patente que a presença da EC20sp alterou completamente a capacidade de ligação a cada metal. A fim de comprovar, definitivamente, a ligação do metal na célula bacteriana, bem como, localizar onde estava ocorrendo esta ligação, decidimos analisar as células por microscopia de transmissão eletrônica (MET). O emprego da MET é bastante difundido no estudo de materiais biológicos, pois permite a definição de imagens intracelulares, fornecendo informações sobre alterações de impossível visualização na microscopia de luz. Desta forma, pudemos verificar comparativamente que células incubadas com Pb+2 foram capazes de ligar este metal, principalmente, na membrana externa da bactéria e, que a linhagem transgênica C. metallidurans/pCM2 apresentou-se recoberta por uma densa camada deste metal quando comparada à linhagem selvagem. Utilizando a mesma metodologia, Liedrich et al. (2005) mostraram que C. metallidurans CH34 foi capaz de ligar íons Ag+2 na membrana externa, comprovando o potencial biorremediador deste microrganismo. O conjunto desses resultados confirma que a linhagem C. metallidurans/pCM2 construída neste trabalho apresenta, de fato, um aumento na capacidade de biorremediar soluções contendo metais, seja a partir de efluentes contendo apenas uma espécie de metal, seja em efluentes contendo vários metais. Vale ressaltar ainda que, em todos os experimentos, a viabilidade celular não foi alterada durante os experimentos de adsorção, comprovando que os mecanismos de resistência de C. metallidurans CH34 estavam ativos, protegendo as células do efeito tóxico dos metais. Além disso, o crescimento celular das linhagens recombinantes não apresentou significativa diminuição que comprometesse a produção de biomassa para biorremediação. Assim, a linhagem transgênica C. metallidurans/pCM2 pode ser considerada como um agente eficiente de biorremediação de ambientes contendo metais, principalmente quando a biomassa é cultivada na presença de metais. Além disso, o metal adsorvido pode ser recuperado, fato este que confere também a essa linhagem a capacidade de ser uma lixiviadora de metais. A partir desse trabalho, torna-se possível estabelecer uma cinética de ligação a metais, de tal forma a utilizar um volume de células de C. metallidurans/pCM2 conhecido para adsorver uma determinada quantidade de Discussão 151 metal em solução, com o objetivo de limpar o efluente e enquadrá-lo nos padrões de emissão de metais determinados pela legislação. O objetivo principal do trabalho, qual seja de otimizar a capacidade de biorremediação de C. metallidurans CH34, foi atingido, indicando que a estratégia de ancorar proteínas quelantes de metais na superfície bacteriana é viável e contribui para o desenvolvimento de ferramentas biotecnológicas úteis para a preservação do meio ambiente, em particular de um recurso natural tão precioso quanto a água doce. Conclusões 152 7 CONCLUSÕES • C. metallidurans CH34 possui resistências a diversos antibióticos; • C. metallidurans CH34 apresenta alta resistência a diversos metais pesados; • Comprovada a construção do gene da fitoquelatina sintética com 20 resíduos de cisteína, EC20sp; • Comprovada a construção do cassete de ancoragem da EC20sp; • Comprovada a ancoragem da EC20sp na membrana externa de E. coli; • A bactéria E. coli expressando EC20sp na membrana externa apresentou adsorção de Cd+2 superior à bactéria não recombinante; • De todos os promotores analisados, o mais eficiente para C. metallidurans CH34 foi o promotor pan; • Comprovada a construção do cassete de expressão-ancoragem da EC20sp; • Comprovada a ancoragem da EC20sp na membrana externa de C. metallidurans CH34; • A bactéria C. metallidurans CH34 expressando EC20sp na membrana externa mostrou ter superior capacidade de ligar Cd+2, Co+2, Cu+2, Hg+2, Mn+2, Ni+2, Pb+2 e Zn+2 em relação à bactéria não recombinante; • Comprovada a localização do metal pesado na membrana externa de C. metallidurans CH34/pCM2; • A bactéria C. metallidurans CH34 expressando EC20sp não apresentou alterações quanto à capacidade de crescimento; • C. metallidurans CH34 expressando EC20sp pode ser empregada em processos de biorremediação de efluentes contendo metais pesados. Considerações Finais 153 8 CONSIDERAÇÕES FINAIS Neste trabalho, foi construída por manipulação genética a bactéria C. metallidurans/pCM2 com capacidade de biorremediar soluções contendo íons de metais pesados devido à presença da proteína quelante de metais EC20sp, ancorada na sua superfície celular. A expressão do cassete de ancoragem da EC20sp em C. metallidurans foi realizada pelo promotor pan, que apresentou altos níveis de expressão protéica nesta bactéria, o que é vantajoso para um agente de biorremediação, pois não há necessidade de uso de indutores artificiais para o seu funcionamento. No entanto, o plasmídeo contendo a construção gênica precisa ser mantido sob pressão seletiva, o que representa uma limitação para uso em grande escala. Portanto, há a necessidade de estabilizar essa informação genética no cromossomo da bactéria, de tal forma que, possamos vencer essa limitação e, de fato, empregá-la em processos de biorremediação em escala industrial. Para tanto, enviamos uma proposta de continuidade deste trabalho à Vale com o objetivo de estabilizar no genoma da bactéria C. metallidurans o sistema de expressãoancoragem da EC20sp e, posteriormente, utilizar essa linhagem estável para uso em biorreatores, para os testes em escala piloto, tanto com efluentes artificiais, quanto com aqueles reais, ou seja, produzidos pela atividade mineradora da Vale. A proposta foi avaliada pela empresa e aprovada. Outro aspecto a salientar diz respeito à contenção deste OGM na natureza. Para tanto, há outro projeto nesse convênio, desenvolvendo sistemas suicidas que poderão permitir que após realizar a sua incumbência biorremediadora, a bactéria no final do processo se suicide devido à expressão de uma nuclease que destrói o DNA microbiano, evitando a sua disseminação no meio ambiente. Considerando-se todos estes aspectos, o presente trabalho traz uma contribuição inovadora no Brasil, desenvolvendo geneticamente um microrganismo com potencial de realizar biorremediação de metais em efluentes, engajando-se na busca por processos eficientes e amigáveis ao meio ambiente, no sentido de buscar a diminuição dos rejeitos de metais que são produzidos em milhões de toneladas anualmente, e colaborar de forma objetiva na preservação dos recursos hídricos do planeta. Por fim, vale ressaltar que os resultados deste trabalho produziram dois pedidos de patente protocolados no Instituto Nacional de Propriedade Industrial Considerações Finais 154 (INPI): (i) uma patente referente à proteção e direito de uso, tanto das seqüências gênicas construídas neste trabalho, quanto da linhagem recombinante biorremediadora (Biondo, R.; Ribeiro-dos-Santos, G.; Vicente, E.J.; Schenberg, A.C.G. Pedido de Patente n° 018080019208); (ii) uma segunda patente, em colaboração com outro projeto deste convênio USP-VALE, referente à proteção e uso do promotor pan construído e testado com sucesso em C. metallidurans CH34 e E. coli (Ribeiro-dos-Santos, G, Biondo, R.; Quadros, O.F.; Vicente, E.J.; Schenberg, A.C.G. Pedido de Patente n° 018080019207). Referências Bibliográficas 155 2 REFERÊNCIAS BIBLIOGRÁFICAS ANDRÉS, Y.; THOUAND, G.; BOUALAM, M.; MERGEAY, M. Factors influencing the biosorption of gadolinium by micro-organisms and its mobilization from sand. Appl. Microbiol. Biotechnol., v 54, p. 262-267, 2000. ANTON, A.; GROßE, C.; REIßMANN, J.; PRIBYL, T.; NIES, D.H. CzcD is a heavy metal íon transporter involved in regulation of heavy metal resistance in Ralstonia sp. strain CH34. J. Bacteriol., v. 181, n. 22, p. 6876-6881, 1999. ANTON, A.; WELTROWSKI, A.; HANEY, C.J.; FRANKE, S.; GRASS, G.; RENSING, C.; NIES, D.H. Characteristics of zinc transport by two bacterial cation diffusion facilitators from Ralstonia metallidurans CH34 and Escherichia coli. J. Bacteriol., v 186, n. 22, p. 7499-7507, 2004. AVOSCAN, L.; COLLINS, R.; CARRIERE, M.; GOUGET, B.; COVÈS, J. Seleno-methionine is the predominant organic form of selenium in Cupriavidus metallidurans CH34 exposed to selenite and selenate. Appl. Environ. Microbiol., v. 72, n. 9, p. 6414-6416, 2006. AVOSCAN, L.; UNTEREINER, G.; DEGROUARD, J.; CARRIERE, M.; GOUGET B. Uranium and selenium resistance in Cupriavidus Metallidurans CH34. Toxicol. Lett., v. 172, n. 1, p. S157, 2007. BABU, B.R.; PARANDE, A.K.; BASHA, C.A. Electrical and electronic waste: a global environmental problem. Waste Manage. Res., v. 25, p. 307–318, 2007. BAE, W.; MEHRA, R.K. Metal-binding characteristics of a phytochelatins analog (GluCys)2Gly. J. Inorg. Biochem., v. 68, p. 201-210, 1997. BAE, W.; CHEN, W.; MULCHANDANI, A.; MEHRA R. Enhanced bioaccumulation of heavy metals by bacterial cells displaying synthetic phytochelatins. Biotechnol. Bioeng., v. 70, p. 518-524, 2000. BAE, W.; MEHRA, R.K.; MULCHANDANI, A.; CHEN, W. Genetic engineering of Escherichia coli for enhanced uptake and bioaccumulation of mercury. Appl. Environ. Microbiol., v. 67, n. 11, p. 5335-5338, 2001. BOEKHOLD, A.E.; TEMMINGHOFF, E.J.M.; VAN DER ZEE, S.E.A.T.M. Influence of electrolyte composition and pH on cadmium sorption by an acid sandy soil. J. Soil. Sci., v. 44, p. 85–96, 1993. BORREMANS, B.; HOBMAN, J.L.; PROVOOST, A.; BROWN, N.L.; VAN-DER-LELIE, D. Cloning and functional analysis of the pbr lead resistance determinant of Ralstonia metallidurans CH34. J. Bacteriol., v. 183, n. 19, p. 5651-5658, 2001. BOYER, A.; MAGNIN, J.P.; OZIL, P. Copper ion removal by Thiobacillus ferrooxidans biomass. Biotechnol. Lett., v. 20, n. 2, p. 187-190, 1998. 2 De acordo com: ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS. NBR 6023: Informação e documentação: referências: elaboração. Rio de Janeiro, 2002. NATIONAL LIBRARY OF MEDICINE. List of journal indexed in Index Medicus. 2006. Available from: http://www.ncbi.nlm.nih.gov/entrez; http://www.nlm.nih.gov/tsd/serial/lji.html. Referências Bibliográficas 156 BRALLIER, S.; HARRISON, R.B.; HENRY, C.L.; DONGSEN, X. Liming effects on availability of Cd, Cu, Ni and Zn in a soil amended with sewage sludge 16 years previously. Water, Air Soil Pollut., v. 86, p. 195–206, 1996. BSAT, N.; HERBIG, A.; CASILLAS-MARTINEZ, L.; SETLOW, P.; HELMANN, J.D. Bacillus subtilis contains multiple Fur homologues: identification of the iron uptake (Fur) and peroxide regulon (PerR) repressors. Mol. Microbiol., v. 29, n. 1, p. 189-198, 1998. CHAMPIER, L.; DUARTE, V.; MICHAUD-SORET, I.; COVÈS, J. Characterization of the MerD protein from Ralstonia metallidurans CH34: a possible role in bacterial mercury resistance by switching off the induction of the mer operon. Mol. Microbiol., v. 52, n. 5, 1475-1485, 2004. CHANG, J.O.; LAW, R.; CHANG, C.C. Biosorption of lead, copper and cadmium by biomass of Pseudomonas aeruginosa PU21. Water Res., v. 31, p. 1651-1658, 1997. D`COSTA, V.M.; MCGRANN, K.M.; HUGHES, D.W.; WRIGHT, G.D. Sampling the antibiotic resistome. Science, v. 311, p. 374-377, 2006. DIELS, M.F.; MERGEAY, M.; NIES, D. Mercury transposons from plasmids governing multiple resistance to heavy metals in Alcaligenes eutrophus CH34. Arch. Int. Physiol. Biochim., v. 93, p. B27-28, 1985. DIELS, L.; SADOUK, A.; MERGEAY, M. Large plasmids governing multiple resistances to heavy metals: a genetic approach. Toxicol. Environ. Chem., v.23, p. 79-89, 1989. DIELS, L.; MERGEAY, M. DNA probe-mediated detection of resistant bacteria from soils hightly polluted by heavy metals. Appl. Environ. Microbiol., v. 56, n. 5, p. 1485-1491, 1990. DIELS, L.; VAN DER LELIE, D.; BASTIAENS, L. New developments in treatment of heavy metal contamined soil. Rev. Environ. Sci. Biotechnol., v. 1, p. 75-82, 2002. DINARDI, A.L.; FORMAGI, V.M.; CONEGLIAN, C.M.R.; DE-BRITO, N.N.; SOBRINHO, G.D.; PELEGRINI, R. Fitorremediação. In: FÓRUM DE ESTUDOS CONTÁBEIS, 3., 2003, Rio Claro. “Disponível em:” <http://www.ceset.unicamp.br/lte/Artigos/3fec2407.pdf>. Acesso em 15 nov. 2007. DONG, Q.; SADOUK, A.; VAN-DER-LELIE, D.; TAGHAVI, S.; FERHAT, A.; NUYTEN, J.M.; BORREMANS, B.; MERGEAY, M.; TOUSSAINT, A. Cloning and sequencing of IS1086, an Alcaligenes eutrophus insertion element to IS30 and IS4351. J. Bacteriol., v. 174, n. 24, p. 8133-8138, 1992. DRESSLER, C.; KÜES, U.; NIES, D.H.; FRIEDRICH, B. Determinants encoding resistance to several heavy metals in newly isolated copper-resistant bacteria. Appl. Environ. Microbiol., v. 57, n. 11, p. 3079-3085, 1991. DUSHENKOV, S.; MIKHEEV, A.; PROKRNEVSKY, A.; RUCHKO, M.; SOROCHINSKY, B. Phytoremediation of radiocesium-contamined soil in vicinity of Chernobyl, Ukraine. Environ. Sci. Technol., v. 33, p. 469-475, 1999. ERRAMPALLI, D.; LEUNG, K.; CASSIDY, M.B.; KOSTRZYNSKA, M.; BLEARS, M.; LEE, H.; TREVORS, J.T. Applications of the green fluorescent protein as a molecular marker in environmental microorganisms. J. Microbiol. Methods, v. 35, p. 187-199, 1999. Referências Bibliográficas 157 FEIN, J.B.; MARTIN, A.M.; WIGHTMAN, P.G. Metal adsorption onto bacterial surfaces: Development of a predictive approach. Geochim. Cosmochim. Acta, v. 65, n. 23, p. 4267– 4273, 2001. FUANGTHONG, M.; HERBIG, A.F.; BSAT, N.; HELMANN, J.D. Regulation of the Bacillus subtilis fur and perR genes by PerR: not all members of the PerR regulon are peroxide inducible. J. Bacteriol., v. 184, n. 12, p. 3276-3286, 2002. GADD, G.M. Microbial control of heavy metal pollution. In: FRY, J.C.; GADD, G.M.; HERBERT, R.A.; JONES, C.W.; WATSON-CRIK, I.A. Microbial control of pollution. Cambridge: Cambridge University Press,1992. GADD, G.M.; WHITE, C. Microbial treatment of metal pollution- a working biotechnology? Trends Biotechnol., v. 11, p. 353-359, 1993. GAVRILESCU, M. Removal of heavy metals from environment by biosorption. Eng. Life Sci., v. 4, n. 3, p. 219-232, 2004. GAYLARDE, C.C.; BELLINASO, M.L.; MANFIO, G.P. Biorremediação: aspectos biológicos e técnicos da biorremediação de xenobióticos. Biotecnolog. Cienc. Desenvolv., v. 34, p. 3643, 2005. GILIS, A.; CORBISIER, P.; BAEYENS, W.; TAGHAVI, S.; MERGEAY, M.; VAN-DER-LELIE. Effect of the siderophore alcaligin E on the bioavailability of Cd to Alcaligenes eutrophus CH34. J. Ind. Microbiol. Biotechnol., v. 20, p. 61-68, 1998. GORIS, J., DE VOS, P., COENYE, T., HOSTE, B., JANSSENS, D., BRIM, H., DIELS, L., MERGEAY, M., KERSTERS, K.; VANDAMME, P. Classification of metal-resistant bacteria from industrial biotopes as Ralstonia campinensis sp. nov., Ralstonia metallidurans sp. nov. and Ralstonia basilensis Steinle et al., 1998 emend. Int. J. Syst. Evol. Microbiol., v. 51,p. 1773- 1782, 2001. GRASS, G.; GROßE, C.; NIES, D.H. Regulation of the cobalt and nickel resistance determinant from Ralstonia sp. strain CH34. J. Bacteriol., v. 182, n. 5, p. 1390-1398, 2000. GRASS, G.; FRICKE, B.; NIES, D.H. Control of a periplasmic nickel efflux pump by periplasmic nickel concentrations. Biometals, v.18, p. 437-448, 2005. GROßE, C.; GRASS, G.; ANTON, A.; FRANKE, S.; SANTOS, A.N.; LAWLEY, B.; BROWN, N.L.; NIES, D.H. Transcriptional organization of the czc heavy-metal homeostasis determinant from Alcaligenes eutrophus. J. Bacteriol., v. 181, n. 8, p. 2385-93, 1999. GROßE, C.; ANTON, A.; HOFFMANN, T.; FRANKE, S.; SCHLEUDER, G.; NIES, D.H. Identification of a regulatory pathway that controls the heavy-metal resistance system Czc via promoter czcNp in Ralstonia metallidurans. Arch. Microbiol., v. 182, n. 2-3, p. 109-18, 2004. HALLBERG, K.B.; JOHNSON, D.B. Biological manganese removal from acid mine drainage in constructed wetlands and prototype bioreactors. Sci. Total Environ., v. 338, p. 115-124, 2005. HASSEN, A.; SAIDI, N.; CHERIF, M.; BOUDABOUS, A. Effects of heavy metals on Pseudomonas aeruginosa and Bacillus thrungiensis. Bioresour. Technol., v. 65, 73-82, 1998. Referências Bibliográficas 158 HAQ R, ZAIDI SK, SHAKOORI AR. Cadmium resistant Enterobacter cloacae and Klebsiella sp. isolated from industrial effluents and their possible role in cadmium detoxification. World J. Microbiol. Biotechnol., v. 15, p. 283– 290, 1999. HENDERSON, I.R.; NAVARRO-GARCIA, F.; NATARO, J.P. The great escape: structure and function of the autotransporter proteins. Trends Microbiol., v. 6, n. 9, p. 370-378, 1998. HERNÁNDEZ, A.; MELLADO, R.P.; MARTÍNEZ, J.L. Metal accumulation and Vanadiuminduced multidrug resistance by environmental isolates of Escherichia hermannii and Enterobacter cloacae. Appl. Environ. Microbiol., v. 64, n. 11, p. 4317-4320, 1998. JOHN, D.A.; LEVENTHAL, J.S. Bioavailability of metals. In: DU BRAY, E.A. (Ed). Preliminary compilation of descriptive geoenvironmental mineral deposit models: U.S. geological survey open-file report. 1995. “Disponível em:” <http://pubs.usgs.gov/of/1995/ofr95-0831/CHAP2.pdf>. Acesso em: 23 set. 2007. JUHNKE, S.; PEITZSCH, N.; HÜBENER, N.; GROßE, C.; NIES, D.H. New genes involved in chromate resistance in Ralstonia metallidurans strain CH34. Arch. Microbiol., v. 179, p. 1525, 2002. KIESER, T.; BIBB, M.J.; BUTTNER, M.J.; CHATER, K.F.; HOPWOOD, D.A. Practical Streptomyces Genetics. Norwich England: John Innes Centre, 2000. p.162-167. KLAUSER, T.; POHLNER, J.; MEYER, T.F. Extracellular transport of cholera toxin B subunit using Neisseria IgA protease β-domain: conformation dependent outer membrane translocation. EMBO J., v. 9, p. 1991-1999, 1990. KOTRBA, P.; DOLCKOVÁ, L.; LORENZO, V.; RUML, T. Enhanced bioaccumulation of heavy metal ions by bacterial cells due to surface display of short metal binding peptides. Appl. Environ. Microbiol., v. 65, p. 1092-1098, 1999. KOVACH, M.E.; PHILLIPS, R.W.; ELZER, P.H.; ROOP, R.M.; PETERSON, K.M. pBBR1MCS: a broad-host-range cloning vector. Biotechniques, v. 16, n. 5, p. 800, 1994. KRÄMER, U. Phytoremediation: novel approaches to cleaning up polluted soils. Curr. Opin. Biotechnol., v. 16, p. 133-141, 2005. LEE, A.; FALKOW, S. Constitutive and Inducible Green Fluorescent Protein expression in Bartonella henselae. Infect. Immun., v. 66, n. 8, p. 3964-3967, 1998. LEDRICH, M.L.; STEMMLER, S.; LAVAL-GILLY, P.; FOUCAUD, L.; FALLA, J. Precipitation of silver-thiosulfate complex and immobilization of silver by Cupriavidus metallidurans CH34. Biometals, v.18, p. 643-650, 2005. LEFEBRE, M.D.; VALVANO, M.A. Construction and evaluation of plasmid vectors optimized for constitutive and regulated gene expression in Burkholderia cepacia complex isolates. Appl. Environ. Microbiol., v.68, n. 12, p. 5956-5964, 2002. LEGATZKI, A.; GRASS, G.; ANTON, A.; RENSING, C.; NIES. D.H. Interplay of the Czc system and two P-type ATPases in conferring metal resistance to Ralstonia metallidurans. J. Bacteriol., v. 185, n. 15, p. 4354-4361, 2003a. LEGATZKI, A.; FRANKE, S.; LUCKE, S.; HOFFMANN, T.; ANTON, A.; NEUMANN, D.; NIES, D.H. First step towards a quantitative model describing Czc-mediated heavy metal resistance in Ralstonia metallidurans. Biodegradation., v. 14, n. 2, p. 153-68, 2003b. Referências Bibliográficas 159 LEWIN, B. Genes VII. Tradução de Henrique Ferreira et al. Porto Alegre: Artmed Editora, 2001. LIESEGANG, H.; LEMKE, K.; SIDDIQUI, R.A.; SCHLEGEL, H,G. Characterization of the inducible nickel and cobalt resistance determinant cnr from pMOL28 of Alcaligenes eutrophus CH34. J. Bacteriol., v. 175, n. 3, p.767-778,1993. LLOYD, F.; LOVLEY, D.R. Microbial detoxification of metals and radionuclides. Curr. Opin. Biotechnol., v. 12, p. 248-253, 2001. LORENZO, V.; KUENEN, G. Scientific basis for the bioremediation of the toxic spill of the Aznalcóllar mine: combining bacteria and plants to address an intractable kind of pollution. Environ. Microbiol., v. 1, n. 3, p. 275-278, 1999. MACASKIE, L.E.; DEAN, C.R. Metal sequestering biochemical. In: VOLESKY, B. (Ed.). Biosorption of heavy metals. Boca Raton: CRC Press, 1990. MAGYAROSY, A.; LAIDLAW, R.D.; KILAAS, R.; ECHER, C.; CLARK, D.S.; KEASLING, J.D. Nickel accumulation and nickel oxalate precipitation by Aspergillus niger. Appl. Microbiol. Biotechnol., v. 59, p. 382–388, 2002. NPAP MATTUSCHKA, B.; STRAUBE, G. Biosorption of metals by a waste biomass. J. Chem. Technol. Biotechnol, v. 58, p. 57-63, 1993. MEJÁRE, M.; LJUNG, S.; BÜLOW, L. Selection of cadmium specific hexapeptides and their expression as OmpA fusion proteins in Escherichia coli. Protein. Eng., v. 11, n. 6, p. 489494, 1998. MEJÁRE, M.; BÜLOW, L. Metal-binding proteins and peptides in bioremediation and phytoremediation of heavy metals. Trends Biotechnol., v. 19, n. 2, p. 67-73, 2001. MERGEAY, M.; HOUBA, C.; GERITS, J. Extrachromosomal inheritance controlling resistance to cadmium, cobalt, copper and zinc ions: evidence from curing in a Pseudomonas. Arch. Int. Physiol. Biochim., v. 86, p. 440-442, 1978. MERGEAY, M.; NIES, D.; SCHELEGEL, H.G.; GERITS, J.; CHARLES, P.; VAN GIJSEGEM, F. Alcaligenes eutrophus CH34 is a facultative chemolithotroph with plasmid-bound resistance to heavy metals. J. Bacteriol., v. 162, p. 328-334, 1985. MERGEAY, M. Towards an understanding of the genetics of bacterial metal resistance. Trends Biotechnol., v. 9, p. 17-24, 1991. MERGEAY, M.; MONCHY, S.; VALLAEYS, T.; AUQUIER, A.; BENOTMANE, A.; BERTIN, P.; TAGHAVI, S.; DUNN, J.; VAN-DER-LELIE, D.; WATTIEZ, R. Ralstonia metallidurans, a bacterium specifically adapted to toxic metals: towards a catalogue of metal-responsive genes. FEMS Microbiol. Rev., v. 27, p. 385-410, 2003. MONCHY, S.; VAN-DER-LELIE, D.; MCCORKLE, S.; TAGHAVI, S.; DUNN, J.; MERGEAY, M. The four replicons of Ralstonia metallidurans CH34 revealed by IS reassembly. In: CROSSROADS OF MICROBIOLOGY AND INFORMATICS, 2004, Brussels. Abstracts book of the symposium… Belgium, 2004, p14. Referências Bibliográficas 160 MONCHY, S.; VALLAEYS, T.; BOSSUS, A.; MERGEAY, M. Metal transport ATPase genes from Cupriavidus metallidurans CH34: a transcriptomic approach. Int. J. Environ. Anal. Chem., v. 86, n. 9, p. 677-692, 2006a. MONCHY, S.; BENOTMANE, M.; WATTIEZ, R.; VAN AELST, S.; AUQUIER, V.; BORREMANS, B.; MERGEAY, M.; TAGHAVI, S.; VAN-DER-LELIE, D.; VALLAEYS, T. Transcriptomic and proteomic analyses of the pMOL30-encoded copper resistance in Cupriavidus metallidurans strain CH34. Microbiology, v. 152, p. 1765-1776, 2006b. MONCHY, S.; BENOTMANE, M.A.; JANSSEN, P.; VALLAEYS, T.; TAGHAVI, S.; VAN-DERLELIE, D.; MERGEAY, M. Plasmids pMOL28 and pMOL30 of Cupriavidus metallidurans are specialized in the maximal viable response to heavy metal. J. Bacteriol., v. 189, n. 20, p. 7417-7425, 2007. MORAES, D.S.L.; JORDÃO, B.Q. Degradação de recursos hídricos e seus efeitos sobre a saúde humana. Rev. Saúde Pública, v. 36, n. 3, p. 370-374, 2002. MUNKELT, D.; GRASS, G,; NIES, D.H. The chromosomally encoded cation diffusion facilitator proteins DmeF and FieF from Wautersia metallidurans CH34 are transporters of broad metal specificity. J. Bacteriol., v. 186, n. 23, p. 8036-8043, 2004. NIAGRU, J.O.; PACYNA, J.M. Quantitative assessment of worldwide contamination of air, water and soils by trace metals. Nature, v. 333, p. 134-139, 1988. NIES, D.; MERGEAY, M.; FRIEDRICH, B.; SCHLEGEL, HG. Cloning of plasmid genes encoding resistance to cadmium, zinc, and cobalt in Alcaligenes eutrophus CH34. J. Bacteriol., v.169, n.10, p. 4865-4868, 1987. NIES, D.H.; SILVER, S. Plasmid-determined inducible efflux is responsible for resistance to cadmium, zinc and cobalt in Alcaligenes eutrophus. J. Bacteriol., v. 171, n. 2, p. 896-900, 1989. NIES, D.H.; NIES, A.; CHU, L.; SILVER, S. Expression and nucleotide sequence of a plasmid-determined divalente cation efflux system from Alcaligenes eutrophus. Proc. Natl. Acad. Sci. USA, v.86, p. 7351-7355, 1989. NIES, A.; NIES, D.H.; SILVER, S. Nucleotide sequence and expression of a plasmidencoded chromate resistance determinant from Alcaligenes eutrophus. J. Biol. Chem., v. 265, n. 10, p. 5648-5653, 1990. NIES, D.H. Resistance to cadmium, cobalt, zinc and nickel in microbes. Plasmid, v. 27, p. 17-28, 1992. NIES, D.H.; SILVER, S. Ion efflux system involved in bacterial metal resistances. J. Ind. Microbiol., v. 14, p.186-199, 1995. NIES, D.; BROWN, N.L. Two-component systems in the regulation of heavy metal resistance. In: SILVER, S.; WALDEN, W. Metal ions in gene regulation. London: Chapman & Hall, 1997. chapter 5. NIES, D.H. Microbial heavy-metal resistance. Appl. Microbiol. Biotechnol., v. 51, p. 730750, 1999. NIES, D.H. Heavy metal-resistant bacteria as extremophiles: molecular physiology and biotechnological use of Ralstonia sp. CH34. Extremophiles, v. 4, p. 77-82, 2000. Referências Bibliográficas 161 NIES, D.H. Incidence and function of sigma factors in Ralstonia metallidurans and other bacteria. Arch. Microbiol., v. 181, p. 255-268, 2004. NIES, D.H.; REHBEIN, G.; HOFFMANN, T.; BAUMANN, C.; GROSSE, C. Paralogs of genes encoding metal resistance proteins in Cupriavidus metallidurans strain CH34. J. Mol. Microbiol. Biotechnol., v. 11, p. 82-93, 2006. NIKAIDO, H.; ZGURSKAYA, H.I. Antibiotic efflux mechanisms. Curr. Opin. Infect. Dis., v. 12, n. 6, p. 529-536, 1999. NOËL-GEORIS, I.; VALLAEYS, T.; CHAUVAUX, R.; MONCHY, S.; FALMAGNE, P.; MERGEAY, M.; WATTIEZ, R. Global analysis of the Ralstonia metallidurans proteome: prelude for the large-scale study of heavy metal response. Proteomics, v. 4, p. 151-179, 2004. OHE, T.; WATANABE, T.; WAKABAYASHI, K. Mutagens in surface waters: a review. Mutat. Res., v. 567, p. 109-149, 2004. PALMER; T.; SARGENT, F.; BERKS, B.C. Export of complex cofactor-containing proteins by the bacterial Tat pathway. Trends Microbiol., v. 13, n. 4, p. 175-180, 2005. PATTERSON, G.H.; KNOBEL, S.M.;. SHARIF, W.D.; KAIN, S.R.; PISTON, D.W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J., v. 73, p. 2782-2790, 1997. PAULSEN, I.T.; NGUYEN, L.; SLIWINSKI, M.K.; RABUS, R.; SAIER JUNIOR, M.H. Microbial genome analyses: comparative transport capabilities in eighteen prokaryotes. J. Mol. Biol., v. 301, p. 75–100, 2000. PETERS, R.W. Chelant extraction of heavy metals from contaminated soils. J. Hazard Mater., v. 66, p. 151–210, 1999. PIVELI, R.P.; KATO, M.T. Ferro, Manganês e Metais Pesados em Águas. In: _____. Qualidade das águas e poluição: aspectos físicos-químicos. São Paulo: ABES, 2005. p. 173-187. POHLNER, J.; HALTER, R.; BEYREUTHER, K.; MEYER, T. Gene structure and extracellular secretion of Neisseria gonorrhoeae IgA protease. Nature, v. 325, p. 458-462, 1987. PUGSLEY, A.P. The complete general secretory pathway in Gram-negative bacteria. Microbiol. Rev., v. 57, n. 1, p. 50-108, 1993. QUADROS, O.F. Construção de um sistema biológico para a detecção de íons de mercúrio em bactérias Gram-negativas. 78 f. Dissertação (Mestrado em Biotecnologia) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2007. RATHGEBER, C.; Yurkova, N.; Stackebrandt, E.; Beatty, J.T.; Yurkov, V. Isolation of Tellurite- and Selenite-Resistant Bacteria from Hydrothermal Vents of the Juan de Fuca Ridge in the Pacific Ocean. Appl. Environ. Microbiol., v. 68, n. 9, p. 4613–4622, 2002. RAUSER, W.E. Phytochelatins and related peptides. Plant. Physiol., v. 109, p. 1141-1149, 1995. Referências Bibliográficas 162 REITH, F.; ROGERS, S.L.; MCPHAIL, D.C.; WEBB, D. Biomineralization of gold: biofilms on bacterioform gold. Science, v. 313, p. 233-236, 2006. REMOUDAKI, E.; HATZIKIOSEYIAN, A.; KOUSI, P.; TSEZOS, M. The mechanism of metals precipitation by biologically generated alkalinity in biofilm reactors. Water Res., v. 37, p. 3843-3854, 2003. RENSING, C.; SUN, Y.; MITRA, B.; ROSEN, BP. Pb(II)-translocating P-type ATPase. J. Biol. Chem., v. 273, p. 32614-32617, 1998. RENSING, C.; GRASS, G. Escherichia coli mechanism of cooper homeostasis in a changing environment. FEMS Microbiol. Rev., v. 27, p. 197-213, 2003. RIESEBERG, M.; KASPER, C.; REARDON, K.R.; SCHEPER, T. Flow cytometry in biotechnology. Appl. Microbiol. Biotechnol., v. 56, p. 350-360, 2001. ROANE, T,M.; PEPPER, I.L. Microorganisms and metal pollutants. In: MAIER, R.M.; PEPPER, I.L.; GERBA, C. Environmental Microbiology. San Diego: Academic Press, 2000a. chapter 17. ROANE, T.M.; PEPPER, I.L. Microbial responses to environmentally toxic cadmium. Microbiol. Ecol., v. 38, p. 358– 64, 2000b. ROANE, T,M.; JOSEPHSON, K.L.; PEPPER, I.L. Dual-bioaugmentation strategy to enhance remediation of cocontamined soil. Appl. Environ. Microbiol., v. 67, n. 7, p. 3208-3215, 2001. ROSSY, E.; SÉNÈQUE, O.; LASCOUX, D.; LEMAIRE, D,; CROUZY, S.; DELANGLE, P.; COVÈS, J. Is the cytoplasmic loop of MerT, the mercuric ion transport protein, involved in mercury transfer to the mercuric reductase? FEBS Lett., v. 575, n. 1-3, p. 86-90, 2004. ROUX, M.; SARRET, G.; PIGNOT-PAINTRAND, I.; FONTECAVE, M.; COVES, J. Mobilization of selenite by Ralstonia metallidurans CH34. Appl. Environ. Microbiol., v. 67, n. 2, p. 769-773, 2001. ROUX, M.; COVÉS, J. The iron-containing superoxide dismutase of Ralstonia metallidurans CH34. FEMS Microbiol. Lett., v. 210, p. 129-133, 2002. SAFFAR, B.; YAKHCHALI, B.; ARBADI, M. Development of a bacterial surface display of hexahistidine peptide using CS3 pili for bioaccumulation of heavy metals. Curr. Microbiol., v. 55, p. 273-277, 2007. SAMBROOK, J.; RUSSELL, D.W. Molecular cloning: A Laboratory Manual. New York: Cold Spring Harbor Press, 2001. SARRET, G.; AVOSCAN, L.; CARRIÈRE, M,; COLLINS, R.; GEOFFROY, N.; CARROT, F.; COVÈS, J.; GOUGET, B. Chemical forms of selenium in the metal-resistant bacterium Ralstonia metallidurans CH34 exposed to selenite and selenate. Appl. Environ. Microbiol., v. 71, n. 5, p. 2331-2337, 2005. SATOFUKA, H.; FUKUI, T.; TAKAGI, M.; ATOMI, H.; IMANAKA, T. Metal-binding properties of phytochelatin-related peptides. J. Inorg. Biochem., v. 86, p. 595-602, 2001. Referências Bibliográficas 163 SCHNEIDER, D.; FAURE, D.; NOIRCLERC-SAVOYE, M.; BARRIÈRE, A.; COURSANGE, E.; BLOT, M. A broad-Host-Range Plasmid for Isolating Mobile Genetic Elements in GramNegative Bacteria. Plasmid, v. 44, p. 201-207, 2000. SELBORNE, L. A Ética do Uso da Água Doce: um levantamento. Brasília: UNESCO, 2001. 80p. SIDDIQUI, R.A.; SCHELEGEL, H.G.; MEYER, M. Inducible and constitutive expression of pMOL28-encoded nickel resistance in Alcaligenes eutrophus N9A. J. Bacteriol., v.170, n. 9, p. 4188-4193, 1988. SILVER, S.; PHUNG, L.T. A bacterial view of the periodic table: genes and proteins for toxic inorganic ions. J. Ind. Microbiol. Biotechnol., v. 32, n. 11-12, p. 587-605, 2005. SOUSA, C.; KOTRBA, P.; RUML, T.; CEBOLLA, A.; LORENZO, V. Metalloadsorption by Escherichia coli cells displaying yeast and mammalian metallothioneins anchored to the outer membrane protein LamB. J. Bacteriol., v. 180, p. 2280-2284, 1998. SÓVÁGÓ, I.; İSZ, K. Metal ion selectivity of oligopeptides. Dalton Trans., v.32, p. 38413854, 2006. SRINIVASAN, S.; BARNARD, G.C,; GERNGROSS, T.U. A novel high-cell-density protein expression system based on Ralstonia eutropha. Appl. Environ. Microbiol., v. 68, n. 12,p. 5925-5932, 2002. STEINBǛCHEL, A.; KUHN, M.; NIEDRIG, M.; SCHLEGEL, H.G. Fermentation enzymes in strictly aerobic bacteria: comparative studies on strains of the genus Alcaligenes and on Nocardia opaca and Xanthobacter autotrophicus. J. Gen. Microbiol., v. 129, p. 2825-2835, 1983. STUDIER, F.W. Analysis of bacteriophage T4 early RNAs and proteins on slab gels. J. Mol. Biol., v. 79, p. 237-248, 1973. SURESH, B.; RAVISHANKAR, G.A. Phytoremediation – a novel and promiing approach for environmental clean-up. Crit. Rev. Biotechnol., v. 24, n. 2-3, p. 97-124, 2004. SZPIRER, C.Y; FAELEN , M.; COUTURIER, M. Mobilization function of the pBHR1 plasmid, a derivative of broad-host-range plasmid pBBR1. J. Bacteriol., v. 183, n. 6, p. 2101-2110, 2001. TAGHAVI, S.; VAN-DER-LELIE, D.; MERGEAY, M. Electroporation of Alcaligenes eutrophus with (mega) plasmids and genomic DNA fragments. Appl. Environ. Microbiol., v. 60, n. 10, p. 3585-3591, 1994. TAGHAVI, S.; PROVOOST, A.; MERGEAY, M.; VAN-DER-LELIE, D. Identification of a partition and replication region in the Alcaligenes eutrophus megaplasmid pMOL28. Mol. Gen. Genet., v. 250, p. 169-179, 1996. TAGHAVI, S.; MERGEAY, M.; NIES, D.; VAN-DER-LELIE, D. Alcaligenes eutrophus as a model system for bacterial interactions with heavy metals in the environment. Res. Microbiol., v. 148, n. 6, p. 536-551, 1997. TIBAZARWA, C.; WUERTZ, S.; MERGEAY, M.; WYNS, L.; VAN-DER-LELIE, D. Regulation of the cnr cobalt and nickel resistance determinant of Ralstonia eutropha (Alcaligenes eutrophus) CH34. J. Bacteriol., v. 182, n. 5, p. 1399-1409, 2000. Referências Bibliográficas 164 TOMBOLINI, R.; UNGE, A.; DAVEY, M.E.; BRUIJN, F.J.; JANSSON, J.K. Flow cytometric and microscopic analysis of GFP-tagged Pseudomonas fluorescens bacteria. FEMS Microbiol. Ecol., v. 22, p. 17-28, 1997. VALLS, M.; ATRIAN, S.; LORENZO, V.; FERNANDÉZ, L.A. Engineering a mouse metallothionein on the cell surface of Ralstonia eutropha CH34 for immobilization of heavy metals in soil. Nat. Biotechnol., v. 18, p. 661-665, 2000a. VALLS, M.; LORENZO, V.; GONZÀLEZ-DUARTE, R.; ATRIAN, S. Engineering outermembrane proteins in Pseudomonas putida for enhance heavy-metal bioadsorption. J. Inorg. Biochem., v. 79, p. 219-223, 2000b. VALLS, M.; LORENZO, V. Exploiting the genetic and biochemical capacities of bacteria for the remediation of heavy metal pollution. FEMS Microbiol. Rev., v. 26, p. 327-338, 2002. VANDAMME, P.; COENYE, T. Taxonomy of the genus Cupriavidus: a tale of lost and found. Int. J. Syst. Evol. Microbiol., v. 54, n. 6, p. 2285-9, 2004. VAN DER LELIE, D.; SCHWUCHOW, T.; SCHWIDETZKY, U.; WUERTZ, S.; BAEYENS, W.; MERGEAY, M.; NIES, D.H. Two component regulatory system involved in transcriptional control of heavy metal homeostasis in Alcaligenes eutrophus. Mol. Microbiol., v. 23, p. 493503, 1997. VANEECHOUTTE, M.; KAMPFER, P.; DE BAERE, T.; FALSEN, E.; VERSCHRAEGEN, G. Wautersia gen. nov., a novel genus accommodating the phylogenetic lineage including Ralstonia eutropha and related species, and proposal of Ralstonia [Pseudomonas] syzygii (Roberts et al.1990) comb. nov. Int. J. Syst. Evol. Microbiol., v. 54, n. 2, p. 317-27, 2004. VEIGA, E.; LORENZO, V.; FERNANDEZ, L.A. Probing secretion and translocation of a betaautotransporter using a reporter single-chain Fv as a cognate passenger domain. Mol. Microbiol., v. 33, p. 1232-1243, 1999. VEIGA, E.; SUGAWARA, E.; NIKAIDO, H.; LORENZO, V.; FERNÁNDEZ, L.A. Export of autotransported proteins proceeds through an oligomeric ring shaped by C-terminal domains. EMBO. J., v. 21, n. 9, p. 2122-2131, 2002. VON ROZYCKI, T.; NIES, D.H.; SAIER JUNIOR, H.M. Genomic analyses of transport proteins in Ralstonia metallidurans. Comp. Funct. Genomics, v. 6, p. 17-56, 2005. VÖRÖSMARTY, C.J.; GREEN, P.; SALISBURY, J.; LAMMERS, R.B. Global water resources: vulnerability from climate change and population growth. Science, v. 289, p. 284288, 2000. XU, Z.; LEE, SY. Display of Polyhistidine peptides on the Escherichia coli cell surface by using outer membrane protein C as an anchoring motif. Appl. Environ. Microbiol., v. 65, p. 5142-5147, 1999. WATANABLE, M.E. Phytoremediation on the brink of commercialization. Environ. Sci. Technol., v. 31, p. 182-186, 1997. WERNÉRUS, H.; STÅHL, S. Biotechnological applications for surface-engineered bacteria. Biotechnol. Appl. Biochem., v. 40, p. 209-228, 2004. Referências Bibliográficas 165 YABUUCHI, E.; KOSAKO, Y.; YANO, I.; HOTTA, H.; NISHIUCHI, Y. Transfer of two Burkholderia and an Alcaligenes species to Ralstonia gen. Nov.: Proposal of Ralstonia pickettii (Ralston, Palleroni and Doudoroff 1973) comb. Nov., Ralstonia solanacearum (Smith 1896) comb. Nov. and Ralstonia eutropha (Davis 1969) comb. Nov. Microbiol. Immunol., v. 39, n. 11, p.897-904, 1995. ZOROPOGUI, A.; GAMBARELLI, S.; COVÈS, J. CzcE from Cupriavidus metallidurans CH34 is a copper-binding protein. Biochem. Biophys. Res. Commun., v. 365, p. 735-739, 2008. Anexo 166 Anexo A CONSELHO NACIONAL DO MEIO AMBIENTE RESOLUÇÃO N. 357, DE 17 DE MARÇO DE 2005 CAPÍTULO IV DAS CONDIÇÕES E PADRÕES DE LANÇAMENTO DE EFLUENTES Art. 24. Os efluentes de qualquer fonte poluidora somente poderão ser lançados, direta ou indiretamente, nos corpos de água, após o devido tratamento e desde que obedeçam às condições, padrões e exigências dispostos nesta Resolução e em outras normas aplicáveis. Parágrafo único. O órgão ambiental competente poderá, a qualquer momento: I - acrescentar outras condições e padrões, ou torná-los mais restritivos, tendo em vista as condições locais, mediante fundamentação técnica; e II - exigir a melhor tecnologia disponível para o tratamento dos efluentes, compatível com as condições do respectivo curso de água superficial, mediante fundamentação técnica. Art. 25. É vedado o lançamento e a autorização de lançamento de efluentes em desacordo com as condições e padrões estabelecidos nesta Resolução. Parágrafo único. O órgão ambiental competente poderá, excepcionalmente, autorizar o lançamento de efluente acima das condições e padrões estabelecidos no art. 34, desta Resolução, desde que observados os seguintes requisitos: I - comprovação de relevante interesse público, devidamente motivado; II - atendimento ao enquadramento e às metas intermediárias e finais, progressivas e obrigatórias; III - realização de Estudo de Impacto Ambiental - EIA, às expensas do empreendedor responsável pelo lançamento; IV - estabelecimento de tratamento e exigências para este lançamento; e V - fixação de prazo máximo para o lançamento excepcional. Anexo 167 Art. 26. Os órgãos ambientais federal, estaduais e municipais, no âmbito de sua competência, deverão, por meio de norma específica ou no licenciamento da atividade ou empreendimento, estabelecer a carga poluidora máxima para o lançamento de substâncias passíveis de estarem presentes ou serem formadas nos processos produtivos, listadas ou não no art. 34, desta Resolução, de modo a não comprometer as metas progressivas obrigatórias, intermediárias e final, estabelecidas pelo enquadramento para o corpo de água. § 1º No caso de empreendimento de significativo impacto, o órgão ambiental competente exigirá, nos processos de licenciamento ou de sua renovação, a apresentação de estudo de capacidade de suporte de carga do corpo de água receptor. § 2º O estudo de capacidade de suporte deve considerar, no mínimo, a diferença entre os padrões estabelecidos pela classe e as concentrações existentes no trecho desde a montante, estimando a concentração após a zona de mistura. § 3º Sob pena de nulidade da licença expedida, o empreendedor, no processo de licenciamento, informará ao órgão ambiental as substâncias, entre aquelas previstas nesta Resolução para padrões de qualidade de água, que poderão estar contidas no seu efluente. § 4º O disposto no § 1º aplica-se também às substâncias não contempladas nesta Resolução, exceto se o empreendedor não tinha condições de saber de sua existência nos seus efluentes. Art. 27. É vedado, nos efluentes, o lançamento dos Poluentes Orgânicos Persistentes-POPs mencionados na Convenção de Estocolmo, ratificada pelo Decreto Legislativo n. 204, de 7 de maio de 2004. Parágrafo único. Nos processos onde possa ocorrer a formação de dioxinas e furanos deverá ser utilizada a melhor tecnologia disponível para a sua redução, até a completa eliminação. Art. 28. Os efluentes não poderão conferir ao corpo de água características em desacordo com as metas obrigatórias progressivas, intermediárias e final, do seu enquadramento. § 1º As metas obrigatórias serão estabelecidas mediante parâmetros. Anexo 168 § 2º Para os parâmetros não incluídos nas metas obrigatórias, os padrões de qualidade a serem obedecidos são os que constam na classe na qual o corpo receptor estiver enquadrado. § 3º Na ausência de metas intermediárias progressivas obrigatórias, devem ser obedecidos os padrões de qualidade da classe em que o corpo receptor estiver enquadrado. Art. 29. A disposição de efluentes no solo, mesmo tratados, não poderá causar poluição ou contaminação das águas. Art. 30. No controle das condições de lançamento, é vedada, para fins de diluição antes do seu lançamento, a mistura de efluentes com águas de melhor qualidade, tais como as águas de abastecimento, do mar e de sistemas abertos de refrigeração sem recirculação. Art. 31. Na hipótese de fonte de poluição geradora de diferentes efluentes ou lançamentos individualizados, os limites constantes desta Resolução aplicar-se-ão a cada um deles ou ao conjunto após a mistura, a critério do órgão ambiental competente. Art. 32. Nas águas de classe especial é vedado o lançamento de efluentes ou disposição de resíduos domésticos, agropecuários, de aqüicultura, industriais e de quaisquer outras fontes poluentes, mesmo que tratados. § 1º Nas demais classes de água, o lançamento de efluentes deverá, simultaneamente: I - atender às condições e padrões de lançamento de efluentes; II - não ocasionar a ultrapassagem das condições e padrões de qualidade de água, estabelecidos para as respectivas classes, nas condições da vazão de referência; e III - atender a outras exigências aplicáveis. § 2º No corpo de água em processo de recuperação, o lançamento de efluentes observará as metas progressivas obrigatórias, intermediárias e final. Anexo 169 Art. 33. Na zona de mistura de efluentes, o órgão ambiental competente poderá autorizar, levando em conta o tipo de substância, valores em desacordo com os estabelecidos para a respectiva classe de enquadramento, desde que não comprometam os usos previstos para o corpo de água. Parágrafo único. A extensão e as concentrações de substâncias na zona de mistura deverão ser objeto de estudo, nos termos determinados pelo órgão ambiental competente, às expensas do empreendedor responsável pelo lançamento. Art. 34. Os efluentes de qualquer fonte poluidora somente poderão ser lançados, direta ou indiretamente, nos corpos de água desde que obedeçam as condições e padrões previstos neste artigo, resguardadas outras exigências cabíveis: § 1º O efluente não deverá causar ou possuir potencial para causar efeitos tóxicos aos organismos aquáticos no corpo receptor, de acordo com os critérios de toxicidade estabelecidos pelo órgão ambiental competente. § 2º Os critérios de toxicidade previstos no § 1º devem se basear em resultados de ensaios ecotoxicológicos padronizados, utilizando organismos aquáticos, e realizados no efluente. § 3º Nos corpos de água em que as condições e padrões de qualidade previstos nesta Resolução não incluam restrições de toxicidade a organismos aquáticos, não se aplicam os parágrafos anteriores. § 4º Condições de lançamento de efluentes: I - pH entre 5 a 9; II - temperatura: inferior a 40ºC, sendo que a variação de temperatura do corpo receptor não deverá exceder a 3ºC na zona de mistura; III - materiais sedimentáveis: até 1 mL/L em teste de 1 hora em cone Imhoff. Para o lançamento em lagos e lagoas, cuja velocidade de circulação seja praticamente nula, os materiais sedimentáveis deverão estar virtualmente ausentes; IV - regime de lançamento com vazão máxima de até 1,5 vezes a vazão média do período de atividade diária do agente poluidor, exceto nos casos permitidos pela autoridade competente; V - óleos e graxas: 1 - óleos minerais: até 20mg/L; 2- óleos vegetais e gorduras animais: até 50mg/L; e Anexo 170 VI - ausência de materiais flutuantes. § 5º Padrões de lançamento de efluentes: Art. 35. Sem prejuízo do disposto no inciso I, do § 1º do art. 24, desta Resolução, o órgão ambiental competente poderá, quando a vazão do corpo de água estiver abaixo da vazão de referência, estabelecer restrições e medidas adicionais, de caráter excepcional e temporário, aos lançamentos de efluentes que possam, dentre outras conseqüências: I - acarretar efeitos tóxicos agudos em organismos aquáticos; ou II - inviabilizar o abastecimento das populações. Art. 36. Além dos requisitos previstos nesta Resolução e em outras normas aplicáveis, os efluentes provenientes de serviços de saúde e estabelecimentos nos quais haja despejos infectados com microorganismos patogênicos, só poderão ser lançados após tratamento especial. Art. 37. Para o lançamento de efluentes tratados no leito seco de corpos de água intermitentes, o órgão ambiental competente definirá, ouvido o órgão gestor de recursos hídricos, condições especiais.
Download