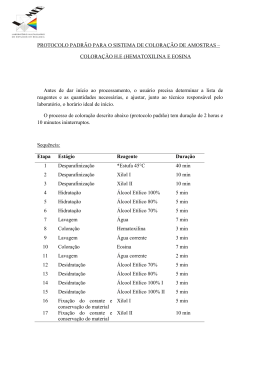
Técnicas de preparação e estudo de lâminas citológicas • Métodos de ensino em Biologia Celular e dos Tecidos: estudo das estruturas e processos celulares; • Microscopias de luz (ML) e eletrônica (ME) – permitem o reconhecimento da célula como um componente dinâmico e participante do metabolismo corporal; • Ferramentas utilizadas: • lâminas com colorações histológicas e histoquímicas ML; • Telas de cobre contrastadas por metais pesados - ME (de transmissão, de varredura, etc.) Técnicas de preparação e estudo de lâminas citológicas Microscópio de Transmissão Luz e Microscópio Eletrônico de Unidades de medida usadas: O aumento total do objeto observado é calculado multiplicando-se os valores do aumento da objetiva e da ocular. Portanto: Preparo de lâminas ----- líquidos de montagem; Geralmente contêm elementos ou substâncias que conferem as propriedades de: - Colorir esporos e outras estruturas do patógeno e/ou células e estruturas do tecido do hospedeiro = melhor clareza na visualização ao microscópio. - Fixar a peça ou estrutura a ser observada. - Impedir o dessecamento da preparação e preservar integridade estrutural, por tempo mais ou menos longo. Preparação Tecidual 1. Coleta do tecido do animal 2. Corte do tecido em pedaços 3. Fixação 4. Desidratação 7. Montagem a. em lâminas de vidro para MO. b. em grades metálicas para MET. 6. Obtenção de cortes a. com navalha metálica para MO. b. com lâmina de vidro ou de www.bioaula.com.br diamante para MET. 5. Inclusão a. em parafina para Microscopia Óptica (MO). b. em resinas para Microscopia Eletrônica de Transmissão (MET). Técnicas de Preparação de Lâminas Preparação do material que se deseja observar à microscopia = etapas de confecção: 1º - Coleta do Material -Partes dos órgãos ou tecidos são retiradas – bisturi, pinça ou lâmina de barbear – extremamente finos (máx. 4 mm) 2º - Fixação • objetivo: insolubilizar as proteínas dos tecidos; • procedimentos físicos (congelamento) ou químicos (+ utilizados) • agentes fixadores + comuns: • formol 10% • líquido de Bouin: formaldeído, ácido acético, ácido pícrico) • ambos fixam as proteínas evitando sua degradação 1. Coleta do espécime 2. Fixação: • Evita a destruição das células por suas próprias enzimas, ou por bactérias. • Insolubiliza as proteínas dos tecidos. • Formaldeído 4-10% em solução tamponada (pH 7,4). 2. Fixação: • Fragmentos com 5 mm de espessura • Tempo de fixação variável dependendo do tamanho do fragmento e do fixador. Técnicas de Preparação de Lâminas 3º - Processamento • objetivo: preparar o material para ser analisado em microscópio ótico. • etapas rigorosamente seqüenciais e obrigatórias, na grande maioria das técnicas, e uma etapa mal executada acarretará em material de má qualidade para análise. 3.1 - Desidratação • Objetivo: retirada de água da peça --- substâncias inclusoras são insolúveis em água; • Utilização de alcoóis etílicos graduados em tempos adequados: • (70 - 80 - 90 - 100%) - evitar a retração pronunciada do tecido ocasionando lesões estruturais da célula de caráter irreversível. O volume de álcool deverá ser 10 a 20 vezes maior que o volume da peça. • 2 min em cada graduação. 3. Desidratação • Tem como finalidade retirar água dos tecidos. • Consiste em banhos de concentrações crescentes de etanol: 70%, 80%, 90%, 2x 100%. 4. Diafanização ou Clareamento • Objetivo: retirada do álcool da peça (as substâncias inclusoras dissolvem-se mal no álcool) --torná-la transparente; • O etanol é substituído por um líquido miscível com o meio de inclusão (xilol). • Os tecidos embebidos em xilol tornam-se translúcidos, razão porque essa etapa é denominada diafanização ou clareamento. • 3.3 - Inclusão (Impregnação) • Objetivo: eliminar completamente o xilol contido no material e a total penetração da parafina nos vazios deixados pela água e gordura, antes existentes no tecido. • preparar o material para os cortes, removendo o clarificante (xilol) e endurecendo-o suficientemente e dando-lhe a consistência adequada para que possa ser cortado. • Procedimento para Inclusão – Tecido: passado em duas trocas de parafina para assegurar a substituição de todo o agente clarificador pela parafina; – Parafina: temperatura de 56 a 60º C (parafina fundida) --- bloco de tecido: imerso na parafina fundida (em estufa) durante o tempo necessário para a completa impregnação. – Blocos retirados da estufa e deixados à temperatura ambiente --parafina endureça; – Bloco de parafina com o tecido: retirado da fôrma e conduzido ao corte. 5. Inclusão ou Impregnação: • Estufa a 60ºC: parafina ocupa os espaços antes ocupados pelo xilol. • Obtenção dos blocos de parafina. www.bioaula.com.br 4º - Microtomia • obtenção de cortes de material incluído em parafina o mais delgado possível --- observação aos microscópios óticos; • Utiliza-se o micrótomo: aparelho cuja regulagem medida em micrômetros (MO) --- obtenção do corte na espessura desejada; • duas peças principais: o suporte ou mandril (onde é fixada a peça a cortar) e a navalha; • espessura mais utilizada em microscopia óptica é de 4 a 6 micrômetros • Após esta etapa = cortes coletados em lâminas de vidro. 6. Microtomia: • Cortes de 5 m de espessura. www.bioaula.com.br Micrótomo www.bioaula.com.br Cortes Histológicos www.bioaula.com.br 5º - Colagem do Corte à Lâmina • Na superfície de uma lâmina --- um ponto de aderência (normalmente com albumina de ovo) --- corte parafinado se adere; • Antes --- corte colocado em banho-maria --- dobras provocadas pelo corte no tecido desapareçam Cortes em Banho-Maria: • Colocação dos cortes em lâminas de vidro. www.bioaula.com.br Lâmina contendo cortes sem coloração: www.bioaula.com.br 7. Coloração: • • • • Coloração rotineira H-E. Hematoxilina (básica). Eosina (ácida). Núcleo é ácido e o citoplasma relativamente básico. • Hidratação, Coloração, Desidratação e Clarificação. www.bioaula.com.br Colorações As colorações foram desenvolvidas para visualizar componentes das células e dos tecidos que na maioria são incolores • Corantes que diferenciam ácidos de bases. - formam ligações salinas com radicais ionizáveis presentes nos tecidos. • Corantes que diferenciam componentes fibrosos da matriz extracelular. • Sais metálicos que precipitam nos tecidos formando depósitos de metal (ex: tecido nervoso). www.bioaula.com.br Colorações • Baseadas no princípio ácido-base – A hematoxilina é uma base, cora componentes ácidos da célula em uma cor azulada – núcleo (DNA e RNA) – A eosina é um ácido que cora componentes básicos (proteínas citoplasmáticas) da célula em róseo. www.bioaula.com.br Reação e corantes histológicos comuns C O L O R A Ç Õ E S REAGENTES RESULTADOS Hematoxilina (base) Azul: núcleo; regiões ácidas do citoplasma: matriz da cartilagem. Eosina (ácido) Rosa: regiões básicas do citoplasma; fibras de colágeno. Tricrômico de Masson Azul-escuro: núcleos. Vermelho: músculo; queratina; citoplasma. Azul-claro: mucinógeno, colágeno. Orceína, corante para fibras elásticas Castanho: fibras elásticas. Weigert, corante para fibras elásticas Azul: fibras elásticas. Coloração com prata Preto: fibras reticulares. Hematoxilina férrica Preto: estrias dos músculos, núcleos e hemácias. Ácido periódico de Schiff Magenta: glicogênio e moléculas ricas em carboidratos. Corantes Wright e Giemsa Usados para a coloração diferencial das células do sangue. Rosa: hemácias, grânulos dos eosinófilos. Púrpura: núcleos dos leucócitos, grânulos dos basófilos. Azul: citoplasma dos monócitos e linfócitos. www.bioaula.com.br Hematoxilina-Eosina www.bioaula.com.br Tricrômico de Masson www.bioaula.com.br Resorcina-Fucsina de Weigert www.bioaula.com.br 8. Montagem: • Uso de lamínulas. • Meio de montagem: resinas (Entellan) ou bálsamo do Canadá. www.bioaula.com.br 7º - Montagem • Após corte corado ---- novamente desidratado (a retirada da água objetiva aumentar a sobrevida do preparado); • concentrações crescentes de álcool etílico. • Corte é banhado em xilol; • Montado em um meio solúvel em xilol = meio de montagem ((para os cortes de parafina é usado o Bálsamo de Canadá) • Coloca-se uma gota do meio de montagem em cima do corte já fixado; • coloca-se a lamínula sobre o corte imerso no meio de montagem --comprime-se com firmeza evitando formação de bolhas de ar; • Lâmina Pronta para observação!!!!!
Baixar