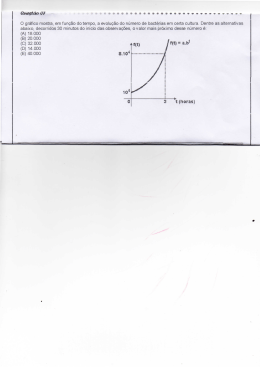
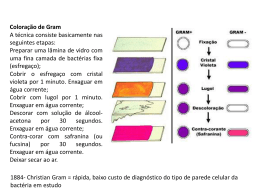
Centro Universitário Fundação Santo André Faculdade de Filosofia, Ciências e Letras CURSO: CIÊNCIAS BIOLÓGICAS MICROBIOLOGIA Atividades Práticas 4º ANO NOME: Nº: Profa. Dra. Márcia Zorello Laporta 2007 4º Sumário Parte A Normas de segurança no laboratório de Microbiologia ...................................................................... 2 Atividade 1 – Técnica da Coloração de Gram ................................................................................... 3 Atividade 2 – Coloração de Cápsula ................................................................................................ 6 Atividade 3 – Coloração de Esporos ................................................................................................ 8 Atividade 4 – Coloração de BAAR (Método de Zielh-Neelsen) ............................................................ 10 Atividade 5 – Coloração de Espiroqueta........................................................................................... 12 Atividade 6 – Estudo de microrganismos ......................................................................................... 15 1 NORMAS DE SEGURANÇA NO LABORATÓRIO DE MICROBIOLOGIA As aulas práticas no laboratório de microbiologia têm como objetivos possibilitar ao aluno a aprendizagem das técnicas comumente utilizadas, o desenvolvimento da capacidade de formular hipóteses e interpretar resultados e possibilitar o conhecimento e a utilização de normas de segurança exigidas neste tipo de laboratório. Nessas aulas, são utilizadas uma grande variedade de bactérias, algumas potencialmente patogênicas para o homem, principalmente quando em meios de cultura. Portanto, é essencial seguir as normas de segurança estabelecidas para um laboratório de microbiologia, a fim de se evitar contaminação dos estudantes, professores e funcionários. 1. Use sempre avental dentro do laboratório. Não o utilize fora do laboratório. 2. Mantenha cabelos longos sempre presos. 3. Desinfete a bancada de trabalho no início e término de cada aula prática. Para essa finalidade, utiliza-se álcool 70%. Com este procedimento, os microrganismos que poderiam contaminar a área de trabalho são removidos. 4. Lava as mãos ao entrar e sair do laboratório e sempre que suspeitar de contaminação. 5. Não coma, beba, fume, aplique cosméticos, mexa em lentes de contato ou coloque objetos (lápis, dedo etc) na boca, procedimentos eficientes de autocontaminação. 6. Tenha cuidado ao utilizar o bico de gás. Ao acender, verifique se não existem substâncias inflamáveis por perto. Ao término da aula, desligue corretamente o gás. 7. Flambe alças, agulhas e pinças antes e após o uso. A correta flambagem dos materiais evita a formação de aerossóis, um dos meios mais eficientes de contaminação. 8. Não utilize pipeta sem a devida proteção de algodão. Isso evita que você seja contaminado se estiver pipetando uma cultura bacteriana em meio líquido. 9. Não coloque materiais contaminados (pipetas, lâminas etc.) sobre a bancada. Estes materiais devem ser colocados em recipientes apropriados que serão dispostos em cada bancada. 10. Siga as normas de uso dos aparelhos. O microscópio é um instrumento de trabalho valioso e deve ser manipulado cuidadosamente. 11. Avise ao professor, imediatamente, caso ocorra qualquer tipo de contaminação ou outro tipo de acidente. 12. Lembre-se que você é responsável pelo material que receber. 2 ATIVIDADE 1 TÉCNICA DA COLORAÇÃO DE GRAM INTRODUÇÃO A coloração de Gram é uma das principais técnicas utilizadas para a visualização microscópica da forma e dos arranjos dos diferentes tipos de bactérias. Considerado um método diferencial, permite classificar as bactérias em Gram positivas ou Gram negativas, de acordo com as propriedades tintoriais da célula bacteriana. OBJETIVOS Aprender a realizar a coloração de Gram e compreender porque determinadas bactérias se comportam como Gram positivas ou Gram negativas. MATERIAL • material retirado da boca • iogurte • fermento Fleischmann (fermento biológico) ou fungo Saccharomyces cerevisiae • culturas bacterianas em caldo e em ágar nutriente • lâminas de vidro • alça de inoculação • cotonetes • reagentes para a coloração de Gram (violeta de genciana, lugol, álcool 95°, fucsina ou safranina) • recipiente para a coloração de Gram PROCEDIMENTO 1 Preparo dos esfregaços Para material em meio líquido (iogurte, fermento em água, cultura bacteriana em caldo). • Com auxílio da alça de inoculação previamente esterilizada, colocar 2 - 3 alíquotas da amostra em uma lâmina de vidro. • Espalhar bem sobre a superfície da lâmina, fazendo movimentos circulares. Deixar secar ao ar. • Flambar a alça na chama do bico de gás antes de recolocá-la em seu lugar. Para material em meio sólido (culturas bacterianas em placa) • Com auxílio da alça de inoculação, previamente esterilizada, colocar uma gota de solução salina na superfície de uma lâmina de vidro. • Flambar a alça, deixar esfriar e coletar uma alíquota da cultura bacteriana. • Misturar na gota de solução salina, fazendo uma suspensão homogênea. Deixar secar ao ar. • Flambar a alça na chama do bico de gás antes de recolocá-la em seu lugar. Para material retirado da boca • Friccionar a superfície da mucosa oral com um cotonete estéril. Fazer um esfregaço com o material coletado, na superfície de uma lâmina de vidro, com movimentos circulares. Deixar secar ao ar. 2 Fixação dos Esfregaços • Após a secagem, fixar os esfregaços, passando as lâminas cerca de 3 vezes sobre a chama do bico de gás. • Deixar esfriar e corar. 3 Coloração de Gram 3 • Colocar a lâmina no recipiente para a coloração de Gram. • Cobrir o esfregaço com solução de violeta de genciana. Aguardar 1 minuto e desprezar o corante no recipiente. • Cobrir com lugol, aguardar 1 minuto, e desprezar o corante no recipiente. • Inclinar a lâmina, gotejar álcool etílico a 95% até que não haja desprendimento de corante. Lavar a lâmina rapidamente em água corrente. • Cobrir com fucsina ou safranina. Aguardar 30 segundos e lavar a lâmina. Secar com papel toalha sem esfregar a lâmina. • Observar ao microscópio em menor aumento e, a seguir, colocar 1 gota de óleo mineral na lâmina e focalizar com objetiva de imersão. • Desenhar as bactérias observadas considerando o tipo de coloração (Gram + ou -), a forma e o arranjo das células. • Após o uso, a objetiva de imersão deve ser limpa com papel absorvente. RESULTADOS • Desenhe o que você observou iogurte cultura bacteriana em placa fermento cultura bacteriana em caldo material retirado da boca • Complete o quadro a seguir. Material iogurte Morfologia Arranjo Gram fermento cultura em caldo cultura em placa material da boca 4 DISCUSSÃO 1. Complete o quadro a seguir, descrevendo o que ocorre na coloração de Gram. Bacté ria Solução cristal violeta Gram + Gram - lugol álcool fucsina 2. Como você explica o comportamento das bactérias G + e G - na coloração de Gram? 3. As bactérias do gênero Mycobacterium não se coram pelo método de Gram. Qual seria uma explicação para esse fato? 4. Sabe-se que se ocorrer um aquecimento exagerado no momento da fixação do material, as bactérias G+ passam a se comportar como G-. Qual seria uma explicação para esse fato? 5. Em geral, os corantes básicos como violeta de genciana, safranina e fucsina, não penetram em células vivas. Qual a relação entre esta informação e as etapas que você seguiu para realizar a coloração de Gram? 6. Sabe-se que quando em culturas velhas, bactérias G+ podem se comportar como G –. Você acha que bactérias G – na mesma situação poderiam se comportar como G+? Justifique. 5 ATIVIDADE 2 COLORAÇÃO DE CÁPSULA INTRODUÇÃO Certas bactérias Gram + e Gram - produzem cápsula, camada viscosa, externa à parede celular. Essa estrutura não constitui caráter morfológico permanente, aparecendo somente sob certas condições de cultura. A cápsula constitui um dos antígenos de superfície das bactérias e é geralmente formada por polissacarídeos e mais raramente por proteínas. A cápsula pode ser visualizada por coloração negativa onde estruturas que não são coradas, são visualizadas contra um fundo escuro. OBJETIVOS Aprender a realizar a coloração para cápsula e compreender o princípio dessa técnica. MATERIAL • • • • • • culturas recentes de bactérias vermelho congo 25 mg/mL ácido hidroclorídrico 0,15 mol/L-1 fucsina de Ziehl-Neelsen lâminas de vidro alça de inoculação PROCEDIMENTO (Método de White modificado) • Colocar 1 a 2 gotas de vermelho congo na extremidade de uma lâmina de vidro. • Coletar uma alçada da cultura bacteriana e misturar no vermelho congo. • Com auxílio de outra lâmina de vidro, espalhar a mistura por toda a lâmina, formando uma película fina. • Aquecer à chama fracamente para secar. • Cobrir o material com ácido hidroclorídrico. • Retirar o excesso do ácido, e aquecer rapidamente, passando a lâmina sobre a chama. • Cobrir o material com fucsina de Ziehl-Neelsen por 10 a 15 segundos. • Retirar o excesso de corante e secar delicadamente com papel toalha. • Observar ao microscópio. RESULTADO Desenhe o observado e coloque legendas. Cultura A Cultura B 6 DISCUSSÃO 1. Por que a técnica é denominada coloração negativa? 2. Qual a forma das bactérias em A? E em B? 3. Se eu fizer coloração para cápsula o que posso dizer sobre o Gram da bactéria? 7 ATIVIDADE 3 COLORAÇÃO DE ESPOROS (COLORAÇÃO DE SCHAEFFER-FULTON) INTRODUÇÃO O esporo ou endósporo bacteriano é uma célula de parede espessa formada no interior de algumas bactérias. É muito resistente ao calor, à dessecação e outros agentes químicos e físicos, sendo capaz de permanecer em estado latente por longos períodos e, em seguida, germinar, dando origem a uma nova célula vegetativa. O esporo é formado por vários envoltórios. O primeiro, mais externo, fino, formado por proteínas, é denominado exospório. Abaixo do exospório fica a capa do esporo, formada por várias camadas de proteínas ricas em ligações de dissulfetos, resposáveis pela resistência do esporo a agentes químicos e físicos. Mais internamente fica o córtex do esporo, formado por camadas de peptidioglicano. Abaixo do córtex localiza-se o protoplasto ou núcleo do esporo formado pela parede celular, citoplasma, material genético etc, provenientes da célula vegetativa. Os esporos são difíceis de serem corados pois os corantes geralmente não atravessam a parede do esporo a não ser que seja utilizado o calor, como na coloração de Schaeffer-Fulton. OBJETIVOS Aprender a realizar a coloração de esporos e compreender o princípio dessa técnica. MATERIAL • • • • • • cultura bacteriana em meio sólido cultura de solo em meio líquido e sólido verde malaquita safranina lâminas de vidro alça de inoculação PROCEDIMENTO (método de Wirtz-Conklin) • Preparar esfregaços em lâmina das culturas bacterianas. • Secar ao ar e fixar pelo calor. • Corar a quente, com solução aquosa de verde malaquita, aquecendo até a emissão de vapores, durante 6 minutos. • Lavar suavemente em água corrente. • Corar com safranina, por 30 segundos. • Lavar suavemente em água corrente. • Secar ao ar e observar ao microscópio. RESULTADO Desenhe o observado com legendas. Cultura bacteriana em meio sólido Cultura de solo 8 DISCUSSÃO 1. Em qual cor é visto o esporo? E a célula vegetativa? Explique como isso ocorre. 2. Por que essa coloração é feita a quente? 3. A célula vegetativa retém o verde malaquita após a 1ª lavagem com água? E o esporo? 4. Qual a função da safranina? 5. Qual a razão de utilizarmos cultura de solo? 6. Qual a diferença básica entre uma célula vegetativa e um endósporo? 9 ATIVIDADE 4 COLORAÇÃO DE BACTÉRIAS ÁLCOOL ÁCIDO RESISTENTES (MÉTODO DE ZIEHLNEELSEN) INTRODUÇÃO Esta coloração permite a visualização de um grupo restrito de bactérias que possuem uma parede celular constituída de lipídeos complexos (ácidos graxos – ácidos micólicos - e ceras) em grande concentração, provavelmente responsáveis pela propriedade de resistência ao álcool – ácido. Quando os lipídeos são removidos pelo éter, perde-se esta propriedade. Assim, durante a coloração, a fucsina se fixa firmemente a esses lipídeos, não sendo removida durante a lavagem com álcool – ácido. OBJETIVOS Aprender a realizar a coloração de esporos e compreender o princípio dessa técnica MATERIAL • • • • • • • • BCG (bacilo de Calmette e Guerin) Mycobacterium bovis material retirado da boca fucsina de Ziehl-Neelsen álcool-ácido clorídrico azul de metileno lâminas de vidro alça de inoculação cotonete estéril PROCEDIMENTO • • • • • • • Preparar esfregaços dos materiais em lâmina de vidro, secar ao ar e fixar pelo calor. Cobrir o esfregaço com fucsina de Ziehl-Neelsen e aquecer em chama até a emissão de vapores. O aquecimento não deve ser muito drástico, a ponto de ferver o corante, mas apenas até ligeira emissão de vapores. A partir disto, iniciar a contagem de cinco minutos. Lavar a lâmina em água, suavemente. Cobrir com álcool-ácido clorídrico, por um minuto. Lavar a lâmina com água. Cobrir o esfregaço com azul-de-metileno, durante um minuto. Lavar a lâmina com água, secar e observar ao microscópio com a objetiva de imersão. 10 RESULTADO Desenhe o observado e coloque legendas. BCG Material retirado da boca DISCUSSÃO 1. Complete os espaços no quadro a seguir. Soluções em ordem de aplicação 1 Fucsina de Ziehl 2 Álcool - ácido clorídrico Reação e aspectos da bactéria BAAR BNAAR Bactérias coradas em _______ Bactérias coradas em _______ A fucsina ______________ nos componentes da parede celular e o álcoolácido____________________ A fucsina ______________ nos componentes da parede celular e o álcoolácido____________________ A célula fica_______________ A célula fica_______________ 3 Azul de metileno A célula é visualizada em__________porque______ A célula é visualizada em_________porque______ 2. As colorações podem ser classificadas em: a) Simples, qundo ocorre a aplicação de um único corante que cora a célula inteira; b) Diferencial, quando utiliza uma combinação de corantes, o que permite observar diferenças químicas entre as bactérias; c) Estrutural, quando cora apenas uma parte da célula, o que possibilita diferenciá-la das demais. Como você classificaria a coloração de Ziehl-Neelsen de acordo com as informações acima? Justifique. 11 ATIVIDADE 5 OBSERVAÇÃO DE ESPIROQUETAS INTRODUÇÃO As espiroquetas são bactérias espiraladas, delgadas e flexíveis. Amplamente distribuídas na natureza, muitas são encontradas na cavidade oral humana e algumas podem causar doenças como a sífilis, a leptospirose e a doença de Lyme. Esses microrganismos podem ser observados ao microscópio em preparações a fresco ou pela técnica de Fontana-Tribondeaux, em que sais de prata impregnam a superfície da bactéria tornando-a mais espessa. Espirilos e espiroquetas tem pouca afinidade pelos corantes comumente empregados e coram-se fracamente. Quando tratados com sais de prata, as espiroquetas podem ser visualizadas em marrom-escuro ou negro contra um fundo castanho-amarelado. MATERIAL • • • • • • • • • • • material retirado da boca material retirado do aquário cultura em ágar semi-sólido (Proteus sp.) solução fixadora álcool absoluto mordente (solução de tanino) solução de nitrato de prata amoniacal água destilada lâminas de vidro cotonete estéril alça de inoculação PROCEDIMENTO 1. Coloração pela técnica de Fontana-Tribondeaux • • • • • • • • • • Fazer um esfregaço com material retirado da mucosa bucal em uma lâmina e secar ao ar (não fixar pelo calor ). Com auxílio da alça de inoculação, preparar um esfregaço da cultura bacteriana em meio semi-sólido. Cobrir o material com solução fixadora, durante 30 seguntos. Desprezar, cobrir novamente com a solução fixadora, durante 30 segundos. Cobrir o material com álcool absoluto, desprezar o excesso e deixar evaporar. Cobrir o material com solução de tanino (mordente) e aquecer a lâmina até a emissão de vapores, durante 30 segundos. Lavar em água destilada. Cobrir o material com solução de nitrato de prata amoniacal, durante 10 a 15 segundos. A seguir, aquecer ligeiramente a lâmina, até o desprendimento de vapores, por 30 segundos (a preparação deve adquire a cor marrom). Lavar em água destilada. Secar delicadamente com papel-filtro. Observar com objetiva de imersão. 12 2. Preparação a fresco • • Colocar 1 a 2 gotas de água de aquário em uma lâmina e cubrir com lamínula. Observar com objetiva de imersão. RESULTADO • Desenhar o observado com legendas. Material da boca Material retirado de aquário Cultura bacteriana em meio semi-sólido 13 DISCUSSÃO 1. Qual o princípio da coloração para espiroquetas? 2. Qual o objetivo da preparação à fresco de espirilos? 3. Após ter realizado as atividades de coloração das bactérias, monte uma tabela com os seguintes dados: - nome da coloração; - microorganismo utilizado; - corantes utilizados; - tipo de coloração (considere as informações da atividade 4). 14 ATIVIDADE 6 ESTUDO DOS MICRORGANISMOS INTRODUÇÃO Microrganismos podem ser encontrados no solo, água, no interior e nas superfícies dos seres vivos. Nesta atividade, você deverá elaborar um procedimento que permita pesquisar microrganismos presentes em diversos hábitats microbianos. OBJETIVO Possibilitar ao aluno a oprtunidade de elaborar um procedimento que permita estudar microrganismos presentes em diversos materiais. MATERIAL 4 placas com ágar nutriente 1 frasco com 100mL de solução salina 30g de terra de jardim 1 cotonete estéril PROCEDIMENTO (Considere o material disponível e o que foi abordado nas aulas anteriores para detalhar o procedimento a ser seguido nessa aula) RESULTADOS Anote os resultados obtidos e explique-os. 15
Baixar