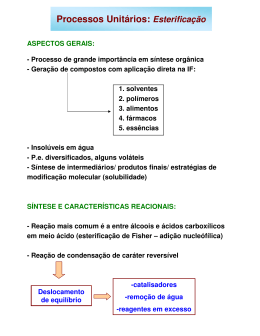
1º Ciclo Enologia Química Orgânica I TRABALHO PRÁTICO Nº2 SÍNTESE DE ÉSTERES COM AROMA INTRODUÇÃO Os ésteres são compostos extremamente comuns. Por exemplo, os óleos vegetais, como o azeite, são misturas de diversos ésteres derivados de ácidos carboxílicos de cadeia longa. Muitos destes compostos apresentam um odor muito característico, muitas vezes agradável, utilizados sendo, na portanto, indústria largamente alimentar como aromatizantes artificiais. Na tabela I, estão representados vários ésteres encontrados em diversos aromas. Tabela I - Ésteres encontrados em alguns aromas O Acetato de benzilo Ph O Pêssego O Butanoato de etilo Ananás O O Acetato de isoamilo Acetato de propilo Banana O O Pêra O O Butanoato de metilo Maçã O O Propanoato de isobutilo O Rum 1 1º Ciclo Enologia Química Orgânica I Os ácidos carboxílicos (RCOOH) são ácidos fracos que se ionizam ligeiramente em água. As constantes de ionização, Ka, são geralmente da ordem de 10-5. A sua solubilidade em água depende, essencialmente, do tamanho do grupo R. Quanto maior for o nº de carbonos de R menor será a sua solubilidade em água. Só os ácidos com menos de 4 carbonos são muito solúveis em água. Embora sejam ácidos fracos, reagem bem com bases fortes (Ex NaOH) com formação de sais muito solúveis em água. O benzoato de sódio é um conservante usado em algumas bebidas. O O - OH + O Na NaOH Ácido benzóico + + H 2O benzoato de sódio O modo mais simples, e antigo, de preparar um éster é por reacção de um ácido carboxílico com um álcool, havendo libertação de uma molécula de H2O. O R1 Ácido OH + R2 OH Álcool O H+ R1 OR2 + H2O Esterificação Éster Esta reacção é designada por esterificação de Fisher em honra a Emil Fisher, um químico alemão dos finais do século XIX. Esta reacção é reversível e lenta, sendo o valor da sua constante de equilíbrio próximo da unidade, o que significa que quando se atinge o equilíbrio ainda estão presentes quantidades apreciáveis dos reagentes. A velocidade da reacção pode ser muito acelerada adicionando uma pequena quantidade de um ácido forte. Porém, a adição de um catalisador não altera a posição do equilíbrio, apenas permite atingi-lo mais rapidamente. O rendimento da reacção pode, contudo, ser melhorado de duas maneiras diferentes (ambas se baseiam no princípio de Le Châtelier): ou utilizar um largo excesso de um dos reagentes, normalmente o álcool (o mais barato) ou retirar a água à medida que ela se vai formando. A remoção da água é possível adicionando--se uma substância que a absorva e não interfira na reacção (agente desidratante, por exemplo, peneiros moleculares); a eliminação da água também se pode conseguir adicionando à mistura reaccional um solvente que seja capaz 2 1º Ciclo Enologia Química Orgânica I de formar um azeótropo com a água, como por exemplo, o tolueno (neste caso, a água é eliminada por destilação desse azeótropo). Os ésteres, de uma maneira geral, não são muito solúveis em água pelo que a sua formação pode ser observada mediante o aparecimento de uma segunda fase líquida no recipiente de reacção. A reacção inversa da esterificação (R1COOR2 + H2O) é denominada hidrólise do éster e origina um ácido, R1COOH, e um álcool, R2OH. Tal como a anterior, esta reacção é muito lenta, mas pode ser acelerada tanto pela adição de um ácido forte como pela adição de uma base forte. Neste caso (hidrólise básica) os produtos de reacção são um álcool e um sal do ácido carboxílico. Se o ácido carboxílico for de cadeia longa não ramificada (ácido gordo) o sal formado constitui um sabão. É por este motivo que a hidrólise básica de ésteres também se designa por reacção de saponificação. O O NaOH OCH - 3 O Na Éster de um ácido gordo + sabão Uma característica que diferencia os ácidos carboxílicos dos ésteres é o seu cheiro. Os ácidos têm, geralmente, cheiros desagraváveis, enquanto que os ésteres têm normalmente aromas agradáveis e, em muitos casos, a frutas. Por exemplo, o ácido butanóico (CH3CH2CH2COOH) cheira a manteiga rançosa, enquanto que o butanoato de etilo constitui o principal composto responsável pelo aroma de ananás. O H + OH OH + O O Neste trabalho vamos sintetizar alguns ésteres com aromas que nos são familiares, por reacção de vários ácidos carboxílicos com diversos álcoois; tentaremos também identificar o aroma de cada um dos ésteres formados. 3 1º Ciclo Enologia Química Orgânica I MATERIAL E REAGENTES Para cada grupo - 4 Tubos de ensaio e suporte. - 2 copos de 100 ml. - 1 vareta de vidro - 1 proveta de 5 mL, uma proveta de 25 mL e um funil - luvas e óculos de protecção Para todos - 5 pipetas graduadas de 5 mL - 5 pompetes - 1 espátula - 2 banhos-maria - Ácido acético glacial (3 frascos pequenos) - Ácido salicílico - Álcool isoamílico, metanol, etanol, octan-1-ol (em frascos pequenos) - Ácido sulfúrico concentrado (4 conta-gotas) - Solução de carbonato de sódio a 10% (m/v) (2 frascos de 500 mL) PROCEDIMENTO 1. Introduza em 3 tubos de ensaio 3 mL de ácido acético (medidos com uma pipeta graduada de 5 mL); para o quarto tubo pese cerca de 0,5 g de ácido salicílico. 2. Adicione a cada um dos tubos 2 mL de álcool (medidos com uma pipeta graduada de 5 mL), de acordo com a tabela seguinte, e 5 gotas de ácido sulfúrico concentrado; homogeneíze a mistura reaccional com uma vareta de vidro. Tubo Ácido Carboxílico Álcool 1 Acético Etanol 2 Acético Isoamílico 3 Acético Octan-1-ol 4 Salicílico Metanol 4 1º Ciclo Enologia Química Orgânica I 3. Coloque os tubos em banho-maria a cerca de 60ºC durante 15 minutos. Retire-os do banho e observe se existem ou não duas fases líquidas. 4. Se não observar a existência de duas fases líquidas adicione à mistura reaccional cerca de 3 mL de água destilada (medidos a proveta de 5 mL) e agite a mistura com a vareta. Observe novamente a existência (ou não) de 2 fases líquidas. 5. Deite num copo de 100 mL cerca de 10 mL (medidos com a proveta de 25 mL) de solução de carbonato de sódio a 10% (m/v). 6. Verta o conteúdo do tubo no copo, oriente os vapores formados em direcção ao seu nariz e confirme (ou tente identificar) o cheiro do éster formado. QUESTIONÁRIO 1. Escreva as equações químicas que ilustram a síntese de todos os ésteres que sintetizou, assim como os nomes dos reagentes e produtos de reacção. 2. Qual foi o objectivo da adição da mistura reaccional à solução de carbonato de sódio? Escreva a equação química da reacção que ocorre neste passo. 3. Qual é o objectivo da adição do ácido sulfúrico à mistura reaccional? 5
Download