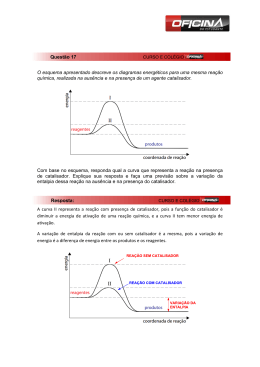
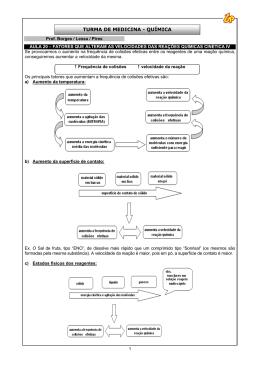
QUÍMICA Prof. Rodrigo Rocha 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1) A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos. 2) Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão. 3) Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas. Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3, respectivamente? a) Temperatura, superfície de contato e concentração. b) Concentração, superfície de contato e catalisadores. c) Temperatura, superfície de contato e catalisadores. d) Superfície de contato, temperatura e concentração. e) Temperatura, concentração e catalisadores. 2. Considere que um prego é fabricado apenas com o metal Fe. Se esse prego entrar em contato com uma solução aquosa de HC , acontecerá a seguinte reação de corrosão: Fe(s) 2 HC FeC (aq) 2(aq) H2(g) A velocidade com que a corrosão do Fe ocorre depende de alguns fatores. Assinale a alternativa que contém os fatores que podem influenciar a velocidade dessa reação. a) temperatura – massa molar – pressão b) temperatura – pressão – concentração dos reagentes c) concentração dos reagentes – pressão – densidade d) densidade – massa molar – temperatura e) catalisador – densidade – pressão 3. Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados. O gráfico a seguir representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D. Com base no diagrama, no sentido direto da reação, conclui-se que a a) energia de ativação da reação sem o catalisador é igual a 15 KJ. b) energia de ativação da reação com o catalisador é igual a 40 KJ. c) reação é endotérmica. d) variação de entalpia da reação é igual a 30 KJ. 4. Um professor, utilizando comprimidos de antiácido efervescente à base de NaHCO 3, realizou quatro procedimentos, ilustrados a seguir: Procedimento I – Comprimido inteiro e água a 25°C Procedimento II – Comprimido inteiro e água a 5°C Procedimento III – Comprimido pulverizado e água a 25°C Procedimento IV – Comprimido pulverizado e água a 5°C A reação ocorreu mais rapidamente no procedimento a) I. b) II. c) III. d) IV. 1 2015 - QUÍMICA - RODRIGO ROCHA - CINÉTICA QUÍMICA - 2º ANO - 16-09 - SITE 5. A síntese do álcool terc-butílico pode ser realizada via substituição nucleofílica de 1ª ordem, a partir do cloreto de terc-butila, de acordo com as etapas descritas. I. (CH3 )3 C C II. (CH3 )3 C (CH3 )3 C H2O III. (CH3 )3 C OH2 C (lenta) (CH3 )3 C OH2 (CH3 )3 C OH (rápida) H (rápida) A velocidade v para essa reação de síntese é expressa por a) k[(CH3 )3 C C ] d) k[(CH3 )3 C OH][H ] b) k[(CH3 )3 C OH2 ] e) k[(CH3 )3 C ][(CH3 )3 C OH2 ] c) k[(CH3 )3 C ]2 [C 6. ] O uso de catalisadores para diminuir a emissão de gases poluentes pelos escapamentos dos automóveis tem contribuído para redução da taxa de aumento da poluição urbana. São representadas duas curvas das energias envolvidas na reação das espécies reagentes A B C D na presença e na ausência do catalisador. Em relação à sua atuação no processo reacional, é correto afirmar que o catalisador a) aumenta a energia de ativação da reação direta, diminui a energia de ativação da reação inversa e desloca o equilíbrio reacional no sentido dos produtos. b) aumenta a energia de ativação da reação direta, aumenta a energia de ativação da reação inversa e não altera o equilíbrio reacional. c) diminui a energia de ativação da reação direta, aumenta a energia de ativação da reação inversa e desloca o equilíbrio reacional no sentido dos produtos. d) diminui a energia de ativação da reação direta, diminui a energia de ativação da reação inversa e não altera o equilíbrio reacional. e) diminui a energia de ativação da reação direta, diminui a energia de ativação da reação inversa e desloca o equilíbrio reacional no sentido dos produtos. 7. (IME) O gráfico abaixo ilustra as variações de energia devido a uma reação química conduzida nas mesmas condições iniciais de temperatura, pressão, volume de reator e quantidades de reagentes em dois sistemas diferentes. Esses sistemas diferem apenas pela presença de catalisador. Com base no gráfico, é possível afirmar que a) b) c) d) a curva 1 representa a reação catalisada, que ocorre com absorção de calor. a curva 2 representa a reação catalisada, que ocorre com absorção de calor. a curva 1 representa a reação catalisada com energia de ativação dada por E1 E3 . a curva 2 representa a reação não catalisada, que ocorre com liberação de calor e a sua energia de ativação é dada por E2 E3 . e) a curva 1 representa a reação catalisada, que ocorre com liberação de calor e a sua energia de ativação é dada por E1. 2 8. A tabela mostra a variação da velocidade inicial da reação hipotética representada pela equação A2(g) 2 B(g) C(g), em função das concentrações iniciais dos reagentes utilizados no processo. [A] inicial (mol/L) 1,0 2,0 1,0 2,0 Experimento 1 2 3 4 [B] inicial (mol/L) 1,0 1,0 1,0 2,0 Velocidade inicial (mol/L.min) 0,4 0,2 0,1 0,4 Temperatura (K) 338 298 298 298 Interpretando-se a tabela, considere as afirmações I, II, III e IV abaixo. I. O valor da constante de proporcionalidade k é igual para todos os experimentos. II. A lei cinética da velocidade pode ser expressa pela equação v = k∙[A]∙[B]. III. Trata-se de uma reação cuja ordem global é 2. IV. As ordens para os reagentes A e B são, respectivamente, zero e 2. São verdadeiras apenas as afirmações a) I e III. c) II e III. b) I e IV. d) II e IV. 9. e) III e IV. Os resultados de três experimentos, feitos para encontrar a lei de velocidade para a reação 2 NO(g) 2 H2 (g) N2 (g) 2 H2O(g) , encontram-se na tabela abaixo. Tabela 1 – Velocidade inicial de consumo de NO(g) Experimento 1 2 3 [NO] inicial -1 (mol L ) -3 4,0 x 10 -3 8,0 x 10 -3 4,0 x 10 [H2] inicial -1 (mol L ) -3 2,0 x 10 -3 2,0 x 10 -3 4,0 x 10 Velocidade de consumo -1 -1 inicial de NO(mol L s ) -5 1,2 x 10 -5 4,8 x 10 -5 2,4 x 10 De acordo com esses resultados, é correto concluir que a equação de velocidade é 2 2 1/2 a) v = k [NO] [H2] c) v = k [NO] [H2] e) v = k [NO] [H2] 2 2 4 b) v = k [NO] [H2] 2 d) v = k [NO] [H2] 10. A ação de um catalisador sobre uma reação química é tão importante para a ciência e para a indústria que existe um ramo de pesquisas que se destina ao estudo de reações que são realizadas com catalisador. Um exemplo de utilização industrial de catalisadores está na produção do oxigênio O2 a partir do clorato de potássio KC O3 , utilizando como catalisador o dióxido de manganês MnO2 . KC O3(s) MnO2 2KC (s) 3O2(g) A respeito dos catalisadores e de suas reações, pode-se afirmar que a) as reações com catalisadores são reações que não podem ser realizadas sem a sua utilização. b) as reações com catalisadores sempre fornecem maiores rendimentos. c) o catalisador faz com que ocorra uma diminuição na energia de ativação, e, com isso, a reação ocorre mais rapidamente. d) o catalisador faz com que ocorra um aumento na energia de ativação, e, com isso, a reação ocorre mais rapidamente. e) os catalisadores também podem ser chamados de inibidores de produtos indesejados. 11. Três experimentos foram realizados para estudar a cinética da reação: Experimento 1 2 3 2 IC (g) H2 (g) I2 (g) 2 HC (g) Concentração Inicial Velocidade Inicial –1 –1 (mol/L) (mol L s ) H2 IC –7 1,5 1,5 3,7 x 10 –7 3,0 1,5 7,4 x 10 –7 3,0 4,5 22 x 10 3 2015 - QUÍMICA - RODRIGO ROCHA - CINÉTICA QUÍMICA - 2º ANO - 16-09 - SITE De acordo com os dados obtidos experimentalmente, a lei de velocidade para esta reação é 2 a) v = k[H2] . e) v = k[H2]. c) v = k[IC ][H2 ]. b) v = k[IC ]2 . d) v = k[IC ]. 12. A reação de decomposição do peróxido de hidrogênio, bem como vários processos industriais, podem ser catalisados pela presença de metais. O gráfico representa o perfil da energia envolvida e o caminho da reação para um processo A + B C + D, sem e com catalisador. A curva ___________ é a da reação com catalisador. Na ausência de catalisador, a energia de ativação da reação inversa (C +D A + B) ___________ é que a da reação direta. A reação direta (A + B C + D) é __________________. As lacunas são correta e respectivamente preenchidas por a) I ... maior ... endotérmica d) II ... maior ... exotérmica b) I ... maior ... exotérmica e) II ... menor ... exotérmica c) II ... maior ... endotérmica 13. Considere as seguintes etapas de uma reação: Etapa 1: NO2(g) Etapa 2: NO3( g) NO2(g) NO3(g) CO( g) NO2( g) NO(g) lenta CO2( g) rápida Escreva a expressão para lei de velocidade e indique a ordem global da reação. 14. A amônia é matéria-prima para a fabricação de fertilizantes como a ureia (CON2H4 ), o sulfato de amônio [(NH4 )2 SO4 )] e o fosfato de amônio [(NH4 )3 PO4 )]. A reação de formação da amônia se processa em duas etapas, conforme equações químicas fornecidas abaixo. N2( g) 2 H2( g) N2H4(g) H2(g) N2H4(g) 1 lenta 2 NH3( g) 2 rápida Dessa forma, a velocidade da equação global N2(g) a) v k N2 b) v k NH3 H2 2 2 3H2(g) c) v k N2 H2 d) v k NH3 2NH3(g) é dada pela seguinte expressão: 3 2 N2 e) v H2 k N2H4 N2 H2 2 3 15. Os dados empíricos para a velocidade de reação, v, indicados no quadro a seguir, foram obtidos a partir dos resultados em diferentes concentrações de reagentes iniciais para a combustão do gás A, em temperatura constante. EXPERIMENTO 1 2 3 -1 -1 [A] (moℓ·L ) 1,0 2,0 1,0 [O2] (moℓ ) 4,0 4,0 2,0 -1 -1 v (moℓ·L ·min ) -4 4·10 -4 32·10 -4 2·10 x y A equação de velocidade para essa reação pode ser escrita como v = k [A] ·[O2] , em que x e y são, respectivamente, as ordens de reação em relação aos componentes A e O 2. Assim, de acordo com os dados empíricos obtidos, os valores de x e y são, respectivamente, a) 1 e 3. c) 3 e 1. e) 2 e 1. b) 2 e 3. d) 3 e 2. 4 16. Considere o gráfico a seguir, referente aos diagramas energéticos de uma reação química com e sem catalisador. De acordo com o gráfico, responda: a) Calcule a energia de ativação em presença do catalisador. b) Qual curva representa o diagrama energético da reação sem catalisador? 17. O gráfico abaixo representa uma reação genérica na ausência e na presença de um catalisador. Considerando que A + B são os reagentes e que C + D são os produtos, assinale o que for correto. a) b) Calcule a Energia de ativação da reação direta na ausência de catalisador. Cite três fatores que influenciam na velocidade de uma reação. GABARITO Resposta da questão 1: [C] São fatores que aceleram a velocidade das reações químicas: aumento da temperatura e da superfície de contato e a presença de catalisadores. Resposta da questão 2: [B] Os fatores que podem influenciar a velocidade desta reação são: - Superfície de contato do prego - Temperatura da solução - Pressão - Concentração do ácido clorídrico Resposta da questão 3: [D] Alternativa [A]: Falsa. A energia de ativação sem catalisador vale 40 kJ. Alternativa [B]: Falsa. A energia de ativação com catalisador vale 25 kJ. Alternativa [C]: Falsa. A reação é exotérmica, pois a energia dos produtos é menor em relação à energia dos reagentes, indicando que a reação liberou calor. Alternativa [D]: Verdadeira. ΔH HPRODUTOS – HREAGENTES 10 – 20 30kJ. Resposta da questão 4: [C] A temperatura e a superfície de contato são fatores que aumentam a velocidade da reação, sendo assim, o comprimido que está pulverizado e na temperatura de 25°C apresentará maior efervescência. Resposta da questão 5: [A] A velocidade v para essa reação de síntese é expressa pela equação referente à etapa lenta: (CH3 )3 C C v (CH3 )3 C C (lenta) k[(CH3 )3 C C ] 5 2015 - QUÍMICA - RODRIGO ROCHA - CINÉTICA QUÍMICA - 2º ANO - 16-09 - SITE Resposta da questão 6: [D] O equilíbrio reacional não sofrerá alteração devido à presença de catalisador. Resposta da questão 7: [E] Teremos: Ocorre liberação de calor, já que a reação é exotérmica. A curva 1 representa a reação catalisada, que ocorre com liberação de calor e a sua energia de ativação é dada por E1. Resposta da questão 8: [C] O valor da constante de velocidade é diferente para o experimento 1, pois a temperatura é maior. A partir da análise da tabela, vem: Partindo-se do experimento 3 para 2, verifica-se que a concentração de A dobra e a velocidade também. Concluise que a ordem de A é 1. Partindo-se do experimento 2 para 4, verifica-se que a concentração de B dobra e a velocidade também. Concluise que a ordem de B é 1. Então, v k[A]1[B]1. A ordem global da reação é 2. Resposta da questão 9: [C] A partir dos experimentos 1 e 2, a concentração de NO dobra e a velocidade quadruplica, logo, o expoente é 2. A partir dos experimentos 1 e 3, a concentração de H 2 dobra e a velocidade também dobra, logo, o expoente é 1. 2 1 Teremos: v = k [NO] [H2] . Resposta da questão 10: [C] Os catalisadores criam caminhos alternativos para as reações, consequentemente, a energia de ativação diminui e a velocidade aumenta. 6 Resposta da questão 11: [C] A partir da análise da tabela: Velocidade Inicial –1 –1 (mol L s ) Concentração Inicial (mol/L) Experimento 1 2 3 IC H2 1,5 3,0 3,0 1,5 1,5 4,5 –7 3,7 x 10 –7 7,4 x 10 –7 22 x 10 – Do experimento 1 para o 2 a concentração de H2 é constante (1,5 mol/L), a concentração de IC dobra de 1,5 mol/L para 3,0 mol/L e a velocidade também dobra de 3,7 10 7 mol L 1 s 1 para 7,4 10 7 mol L 1 s 1, consequentemente, o expoente associado ao IC é 1. – Do experimento 2 para o 3 a concentração de IC é constante (3,0 mol/L) e a concentração de H2 triplica de 1,5 mol/L para 4,5 mol/L, e a velocidade também triplica de 7,4 10 7 mol L 1 s 1 para 22 10 7 mol L 1 s 1, consequentemente, o expoente associado ao H2 é 1. De acordo com os dados obtidos experimentalmente, a lei de velocidade para esta reação é: v k IC 1 1 H2 . Resposta da questão 12: [D] A curva II representa a reação com catalisador, pois apresenta menor energia de ativação. A reação inversa apresenta energia de ativação maior em relação à energia de ativação da reação direta. Quando observamos o gráfico no sentido da reação direta, observamos que a entalpia dos produtos é menor em relação à entalpia dos reagentes, ou seja, a reação direta é exotérmica. Resposta da questão 13: A velocidade da reação depende da primeira etapa (Lenta) A expressão da velocidade de reação pode ser escrita como v = k[NO2][NO2] 2 Ou v = k[NO2] . Resposta da questão 14: [A] A reação de formação da amônia ocorre em 2 etapas, ou seja, trata-se de uma reação não elementar. Quando uma reação ocorre em mais de uma etapa e a determinante da velocidade é a lenta, assim a equação da velocidade ocorre a partir da equação 1. v k N2 H2 2 Resposta da questão 15: [C] Observe a resolução algébrica dada a seguir. De acordo com a tabela e pela equação da velocidade, vem: -4 x y 4 x 10 = K[1,0] [4,0] (1) -4 x y 32 x 10 = K[2,0] [4,0] (2) Dividindo (2) por (1), teremos: 8=2 x 3 x y y=1 2 =2 x=3 Como x = 3, então Dividindo (3) por (4), teremos: 1 2 =2 Conclusão, x = 3 e y = 1. Outra resolução: Pela tabela percebemos que: Quando a [A] fica constante, [O2] dobra e v também, logo o expoente é 1, ou seja, y = 1. Quando [O2] fica constante, [A] dobra e v octuplica, logo o expoente é 3, ou seja, x = 3. Resposta da questão 16: a) 50 kcal b) I Resposta da questão 17: a) 70 kcal b) São fatores que aceleram a velocidade das reações químicas: - Aumento da Superfície de contato, Temperatura, Pressão, Concentração dos reagentes e Presença de catalisadores. 7 2015 - QUÍMICA - RODRIGO ROCHA - CINÉTICA QUÍMICA - 2º ANO - 16-09 - SITE
Baixar