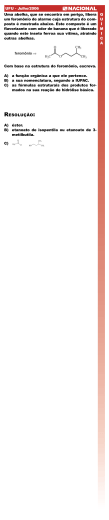ESTEREOQUÌMICA: MOLÉCULAS QUIRAIS ISÔMEROS CONSTITUCIONAIS E ESTEREOISÔMEROS Fórmula Molecular Isômeros Constitucionais CH3 C4H10 CH3CH2CH2CH3 H3C CH CH3 Cl C3H7Cl C2H6O CH3CH2CH2Cl CH3CH2OH H3C CH CH3 CH3OCH3 Isômeros constitucionais são isômeros que diferem porque seus átomos estão ligados em uma ordem diferente Estereoisômeros não são isômeros constitucionais – eles tem seus átomos constituintes ligados na mesma sequência Estereoisômeros diferem apenas no rearranjo de seus átomos no espaço Cl H C C Cl H Cis-1,2-dicloroeteno Cl H C Fórmula molecular C2H2Cl2 C H Cl trans-1,2-dicloroeteno Estereoisômeros Enântiomeros Diastereômeros Enantiômeros: São estereoisômeros cujas moléculas são imagens especulares uma da outra, que não se superpõem. Diastereômeros: são estereoisômeros cujas moléculas não são imagens especulares umas das outras. Cl X H C Cl C C Cl H C H H Cl Diastereômeros X Me Me Me H H H H Me SUBDIVISÃO DOS ISÔMEROS ISÔMEROS (compostos diferentes com a mesma fórmula molecular) ESTEREOISÔMEROS ISÔMEROS CONSTITUCIONAIS (isômeros cujos átomos têm conectividades diferentes) (isômeros que têm a mesma conectividade mas diferem no arranjo de seus átomos no espaço ENANTIÔMEROS DIASTEREÔMEROS (estereoisômeros que são imagens especulares um do outro, que não se superpõem) (estereoisômeros que não são imagens especulares um do outro) ENANTIÔMEROS E MOLÉCULAS QUIRAIS Molécula quiral: molécula que não é idêntica a sua imagem no espelho. Objetos (e moléculas) que se superpõem a suas imagens são aquirais. Como podemos saber quando existe a possibilidade de enantiômeros? Um par de enantiômeros sempre é possível para moléculas que contêm um átomo tetraédrico com quatro diferentes grupos ligados a ele. (hydrogen) H 1 2 3 4 * (methyl) H3C C CH2CH3 (ethyl) OH (hydroxyl) C2 é um estereocêntro, ou seja, um átomo carregando grupos de natureza tal que uma troca de quaisquer dois irá produzir um estereisômero. H CH3 OH CH3 HO CH3 H CH3 H3CCH3 H OH H OH CH3 H 3C Mirror H HO C H3C COOH (+)-Lactic acid, []D = +3.82 H C OH HOOC CH3 ()-Lactic acid, []D = -3.82 IMPORTÂNCIA BIOLÓGICA DA QUIRALIDADE O corpo humano é quiral, com o coração à esquerda do centro e o fígado a direita. A maioria das pessoas é destra. Muitas plantas apresentam quiralidade: A “madressilva” se enrola com uma hélice levógira (esquerda) A “adelaide” se enrola com uma hélice dextrógira (direita) A maioria das moléculas que constituem as plantas e animais são quirais, e geralmente apenas uma forma da molécula quiral ocorre em uma dada espécie. 19 dos 20 aminoácidos que constituem as proteínas são quirais, e são classificados como levógiros. As moléculas dos açúcares naturais são quase todas classificadas como dextrógiras, incluindo o açúcar que ocorre no DNA O DNA apresenta uma estrutural helicoidal e todos os Dna que ocorrem naturalmente se voltam para a direita A especificidade para uma molécula quiral em um sítio de recepção quiral é favorecida em apenas uma direção. NOMENCLATURA DE ENANTIÔMEROS: O SISTEMA (R – S) Sistema Cahn-Ingold-Prelog é amplamente utilizado e faz parte das regras da IUPAC Regras: 1 – A cada um dos grupos ligados ao estereocentro é atribuída uma prioridade ou preferência, baseada no número atômico do átomo que está diretamente ligado ao estereocentro. 2 – Quando uma prioridade não pode ser atribuída com base no número atômico dos átomos que estão diretamente ligados ao estereocentro, então o próximo conjunto de átomos presentes nos grupos não-designados é examinado. Este processo continua até que uma decisão possa ser tomada. 3 – Analise a fórmula, quando possível, colocando o grupo de prioridade mais baixa afastada do observador e observe o sentido de giro de acordo com as ordens de prioridade atribuídas Se, o sentido de análise for horário, o enantiômero é chamado de R (rectus) e, se, o sentido de análise for anti-horário, o enantiômero é chamado de S (sinister) Exemplos: H OH CH3 H C (R) OH CH2CH3 CH2CH3 H HO H C OH CH3 Cl Br (S) H C CH3 enantiômero 4 – Para grupos contendo ligações duplas ou triplas são atribuídas propriedades como se ambos os átomos estivessem duplicados ou triplicados C Y C Y como se fosse (Y) (C) (Y) (C) C Y C Y como se fosse (Y) (C) CH3 CH2 CH C Cl C2H5 ? PROPRIEDADES DE ENANTIÔMEROS: ATIVIDADE ÓPTICA Ponto de fusão = igual Ponto de ebulição = igual Índice de refração = igual Solubilidade em solventes comuns = igual Espectros de infravermelho = igual Velocidade de reação com reagentes aquirais = igual Comportamento diferente quando interagem com outras moléculas quirais Diferente velocidade de reação quando reagem com outras moléculas quirais Solubilidade diferente em solventes que contém um único enantiômero ou excesso de um único enantiômero Observação fácil frente ao seu comportamento em relação à luz plano-polarizada Luz plano-polarizada e o polarímetro Rotação específica [] rotação específica = rotação observada T [ ]D = lxc l = comprimento do tubo em dm c = concentração da solução em g/mL (densidade para líquidos puros) D = linha D de uma lâmpada de sódio ( 589,6 nm) T = temperatura da medida (25ºC) CH3 H HO C CH3 OH H C CH2 CH2 CH3 CH3 (R) -2-butanol (S) -2-butanol á 25 D á 25 D = + 13,52º = - 13,52º (R)-()-2-butanol (S)-(+)-2-butanol CH3 H HOH2C C C2H5 (R)-(+)-2-Metil-1-butanol á 25 D = + 5.756° CH3 H ClH2C C C2H5 (R)-(–)-1-Chloro-2-methylbutane 25 = –1.64° D á CH3 CH2OH H C C2H5 (S)-(–)-2-Metil-1-butanol á 25 D = – 5.756° CH3 CH2Cl H C C 2H 5 (S)-(+)-1-Chloro-2-methylbutane á 25 D = +1.64° Não existe correlação óbvia entre as configurações de enantiômeros e a direção da rotação da luz plano-polarizada. A origem da atividade óptica Formas racêmicas Formas racêmicas e excesso enantiomérico MOLÉCULAS COM MAIS DE UM ESTEREOCENTRO Quantidade de moléculas possíveis = 2n n = nº de estereocentros presentes na moléculas Mirror Mirror 1 COOH H C NH2 2 3 H C OH 4 CH3 2R,3R 1 COOH 1 COOH H2N C H 2 3 HO C H 4 CH3 2S,3S H C NH2 2 1 COOH H2N C H 2 3 3 HO C H 4 CH3 2R,3S H C OH 4 CH 3 2S,3R enantiômeros enantiômeros distereômeros Compostos meso 1 COOH Mirror H C OH 2 1 COOH 1 COOH HO C H 2 3 HO C H 4 COOH H C OH 2 3 H C OH 4 COOH 2R,3R 3 H C OH 4 COOH 2S,3S 2R,3S 1 COOH H C OH 2 3 H C OH 4 COOH Mirror 1 COOH HO 2 3 HO C H C H 4 COOH 2S,3R 1 COOH Rotate HO C H 2 180o 3 2R,3S HO C H 4 COOH 2S,3R Identical Molécula aquiral Nomeando compostos com mais que um estereocentro CH3 CH3 Br HO H H C C C C Br H H CH3 Cl CH2CH3 Fórmulas de projeções de Fischer CH3 Br CH3 H C Br H H Br = C Br H CH3 CH3 SÍNTESE DE MOLÉCULAS QUIRAIS Formas racêmicas CH3CH2CCH3 + H H O Ni (+)- CH3CH2*CHCH3 OH 2-butanona hidrogênio (moléculas aquirais) (moléculas aquirais) (±)-2-butanol [moléculas quirais, mas misturas 50:50 de (R) e (S)] Se a reação for realizada na presença de uma influência quiral (solvente opticamente ativo) ou enzima, o resultado final será diferente. Síntese Enantiosseletiva O OEt H F O Ethyl (R)-(+)-2-fluorohexanoate (>99% enantiomeric excess) lipase + + H OEt H OH O F Ethyl (+)-2-fluorohexanoate [an ester that is a racemate of (R) and (S) forms] OH F H (S)-()-2-Fluorohexanoic acid (>69% enantiomeric excess) O Et DROGAS QUIRAIS CH3 OH Apenas o isômero (S) é efetivo. Organismo converte lentamente (R) em (S) O Isômero (S) puro age mais rápido no organismo Ibuprofen – antiinflamatório (Advil, Motrin, Nuprin) HO HO CO2H H2 N CH3 Metildopa – anti-hipertensivo (Aldomet) Apenas o isômero (S) é efetivo CO2H HS H2N H Penicilina O isômero (S) é um agente terapêutico altamente potente para artrite crônica primária. O isômero (R) não tem ação terapêutica, e é altamente tóxico. RELACIONANDO CONFIGURAÇÕES ATRAVÉS DE REAÇÕES NAS QUAIS NÃO SE ROMPEM LIGAÇÕES COM ESTEREOCENTRO Same configuration CH3 CH2 OH + H H C heat Cl CH3 CH2 Cl H C CH2 CH2 CH3 CH3 (S)-(–)-2-metilbutanol [ ]25 D = –5.756° + H (S)-(+)-1-cloro-2-metilbutano = +1.64° [ ]25 D OH
Download