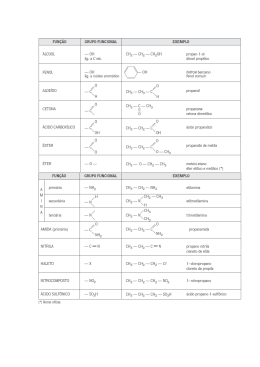
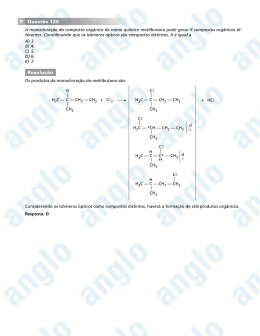
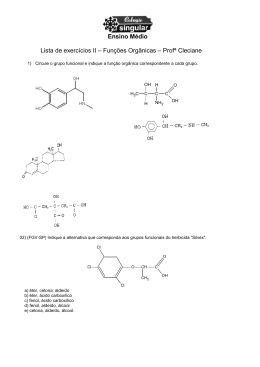
ISOMERIA Prof. César Lourenço carbonos H H H C C H H C2H6O hidrogênios oxigênio H O H H C H O H C H C2H6O H Os compostos H3C – CH2 – OH e H3C – O – CH3 são ISÔMEROS ISÔMEROS são compostos diferentes que possuem a mesma fórmula molecular A este fenômeno damos o nome de ISOMERIA Prof. César Lourenço ISOMERIA pode ser Plana ou Constitucional Espacial ou estereoisomeria Isomeria de cadeia. Geométrica. Isomeria de posição. Espacial. Isomeria de compensação. Isomeria de função. Isomeria de tautomeria Prof. César Lourenço ISOMERIA DE CADEIA OU NÚCLEO É quando os isômeros pertencem à mesma função química, mas possuem cadeias carbônicas diferentes. H3C CH CH3 H3C CH2 CH2 CH3 CH3 Ambos são hidrocarbonetos e possuem cadeias carbônicas diferentes H2C CH2 H2C CH2 H3C CH CH CH3 Prof. César Lourenço ISOMERIA DE POSIÇÃO É quando os isômeros pertencem à mesma função química, mas diferem na posição de um substituinte ou insaturação H2C CH CH2 CH3 H3C CH CH CH3 Ambos são hidrocarbonetos e diferem na posição da dupla ligação H3C CH OH CH2 CH3 H2C CH2 CH2 CH3 OH Ambos são alcoóis e diferem na posição da oxidrila Prof. César Lourenço ISOMERIA DE COMPENSAÇÃO OU METAMERIA É quando os isômeros pertencem à mesma função química, mas diferem na posição de um heteroátomo H3C CH2 H3C O O CH2 CH3 CH2 CH2 CH3 Ambos são éteres e diferem na posição do heteroátomo (oxigênio) O H3C CH2 C O O CH3 H3C C O CH2 CH3 Ambos são ésteres e diferem na posição do heteroátomo (oxigênio) Prof. César Lourenço ISOMERIA DE FUNÇÃO OU FUNCIONAL É quando os isômeros pertencem à funções química diferentes éter H3C CH2 álcool O CH2 CH3 H3C CH CH2 CH3 OH ácido carboxílico éster O H3C CH2 C OH O H3C C O CH3 Prof. César Lourenço ISOMERIA DE TAUTOMERIA É quando os isômeros coexistem em equilíbrio químico dinâmico ceto - enol OH H2C O C CH3 H3C enol C CH3 cetona aldo - enol OH O H3C CH enol CH H3C CH2 aldeído C H 01) Um isômero do éter CH3OCH3 é o: a) ácido acético. b) éter dietílico. Fórmula molecular do éter C2H 6O c) propanol. d) etanol. e) etano. éter dietílico propanol etanol ácido acético O H 3H C 3–C CH 2 – O – CH CH3 HH 3 –C 2C – 2CH – OH 2 2– –OH 3CH C– –CH OH Fórmula molecular Fórmula Fórmula molecular molecular C4H10O C232H H486O O2 C Prof. César Lourenço 02) Indique, dentre as alternativas a seguir, a que apresenta um hidrocarboneto isômero do 2, 2, 4 – trimetil – pentano. a) b) c) d) e) octano. pentano. propano. butano. nonano. 2, 2, 4 – trimetil – pentano CH3 H3C – C – CH2 – CH – CH3 CH3 CH3 Fórmula molecular C8H18 octano H3C – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 Fórmula molecular C8H18 03) Os compostos etanol e éter dimetílico demonstram que caso de isomeria? a) Cadeia. Por pertencerem à funções b) Posição. químicas diferentes c) Compensação. d) Função. são ISÔMEROS DE FUNÇÃO e) Tautomeria. Prof. César Lourenço 04) Os compostos etóxi – propano e metóxi – butano apresentam: a) isomeria de cadeia. b) isomeria de posição. c) isomeria de compensação. diferem na posição do HETEROÁTOMO d) isomeria funcional. e) tautomeria. etóxi – propano H3C – CH2 – O – CH2 – CH2 – CH3 metóxi – butano H3C – O – CH2 – CH2 – CH2 – CH3 Prof. César Lourenço 05) A, B e C têm a mesma fórmula molecular: C3H8O. “A” tem um hidrogênio em carbono secundário e é isômero de posição de “B”. Tanto “A” como “B” são isômeros de função de “C”. Escreva as fórmulas estruturais e os nomes de A, B e C. Os compostos “A” e “B” são alcoóis H3C – CH – CH3 H3C – CH2 – CH2 OH OH 2 – propanol 1 – propanol O isômero de função do álcool é um ÉTER H3C – O – CH2 – CH3 metoxi – etano 06) O propeno e o ciclopropano são representados, respectivamente, pelas fórmulas: CH2 CH2 = CH – CH3 H2C CH2 Pela análise dessas substâncias, pode-se afirmar que: a) são polares. b) são isômeros de cadeia. c) apresentam diferentes massas moleculares. d) apresentam mesma classificação de átomos de carbono. e) apresentam diferentes tipos de ligação entre os átomos. Prof. César Lourenço 07) (PUC-MG) “ A 4 – metil – 2 – pentanona é usada como solvente na produção de tintas, ataca o sistema nervoso central, irrita os olhos e provoca dor de cabeça”. O composto citado é isômero funcional de: a) 1 – hexanol. b) hexanal. 4 – metil – 2 – pentanona c) 4 – metil – butanal. d) 4 – metil – 1 – pentanol. e) pentanona. H3C – CH – CH2 – C – CH3 CH3 O Fórmula molecular C6H12O 1 – hexanol hexanal O H3C – CH2 – CH2 – CH2 – CH2 – CH C 2 – OH Fórmula molecular H C6H12 14O Prof. César Lourenço 08) Entre os compostos abaixo ocorre isomeria: H3C – C – CH3 e H2C = C – CH3 = O OH a) de posição. b) de cadeia. c) cis – trans. d) tautomeria. e) óptica Prof. César Lourenço 09) (UPE – 2007 – Q1) Analise o equilíbrio representado pela equação química abaixo: OH O H3C C H H2C CH Em relação ao conceito de isomeria, é verdadeiro afirmar que o equilíbrio: a) não exemplifica caso de isomeria. b) exemplifica um caso de isomeria de cadeia entre alcenos. c) apenas evidencia a mudança da fórmula estrutural do etanal para a cetona. d) evidencia um caso particular de isomeria funcional conhecido com o nome de tautomeria. e) evidencia tão somente o efeito ressonante entre alcoóis insaturados. Prof. César Lourenço Prof. César Lourenço É quando os isômeros apresentam as ligações entre seus átomos dispostas de maneira diferente no espaço Existem dois tipos de isomeria espacial Isomeria geométrica ou cis-trans (Z – E). Isomeria óptica. Prof. César Lourenço Pode ocorrer em dois casos principais: Em compostos com duplas ligações. Em compostos cíclicos. Prof. César Lourenço Nos compostos com duplas ligações deveremos ter a seguinte estrutura: R1 C=C R2 R1 R3 R2 e R4 R3 R4 Prof. César Lourenço H 3C CH3 H 3C C=C H CIS H C=C H H TRANS CH3 Estruturas que apresentam Estruturas que apresentam os ligantes de mesma os ligantes de mesma prioridade no mesmo lado prioridade em lados opostos do plano é a forma CIS do plano é a forma TRANS Prof. César Lourenço Nos compostos cíclicos a isomeria cis – trans é observada quando aparecerem grupos ligantes diferentes em dois carbonos do ciclo H H3C H3C CH3 H TRANS CH3 H H CIS Prof. César Lourenço No caso de não existirem dois átomos de hidrogênio nos carbonos da dupla ligação A IUPAC recomenda a utilização dos prefixos Z e E Z: zusammen (juntos) E: entgegen (opostos) Prof. César Lourenço O composto que apresentar, do mesmo lado do plano imaginário, os ligantes do carbono com os maiores números atômicos (Z), será denominado “Z” o outro será o “E” Cl Z=6 H3 C Z=6 C C Cl H Z = 17 Z=1 H3 C CH3 C C CH3 H Z-2-clorobut-2-eno H3 C Cl C C CH3 H E-2-clorobut-2-eno Prof. César Lourenço 01) Dados os seguintes compostos orgânicos: I. (CH3)2C = CCl2 III. CH3ClC = CClCH3 II. (CH3)2C = CClCH3 IV. CH3FC = CClCH3 Assinale a opção correta: a) Os compostos I e III são isômeros geométricos. b) Os compostos II e III são isômeros geométricos. c) O composto geométrica. II é o único que apresenta isomeria d) Os compostos III e IV são os únicos que apresentam isomeria geométrica. e) Todos os compostos apresentam isomeria geométrica. Prof. César Lourenço 02) (UESC) Admite isomeria geométrica, o alceno: a) 2, 3 – dimetil – 2 – hexeno b) 1 – penteno c) 3 – metil – 3 – hexeno d) eteno. e) 4 – etil – 3 – metil – 3 – hexeno metil –3 – hexeno 2, 3 – dimetil 1 – penteno –2 – hexeno – – CCH = C– –C CH 2C – – CH 2 – – CH 3 HH C = CH CH C = C – CH 3 2 2 3 3 2 2 3 H H CH H ligantes iguais CH ligantes iguais diferentes 3 CH3 3 ligantes diferentes Prof. César Lourenço 03) Apresenta isomeria cis - trans: a) 1 – buteno. b) 2 – metil – 2 – buteno. c) 2 , 3 – dimetil – 2 – buteno. d) 1 , 1 – dimetil – ciclobutano. e) 1 , 2 – dimetil – ciclobutano. 1, 2,–123 –––dimetil metil dimetil 1 – buteno – –2–ciclobutano –2buteno – buteno 1, 2 – dimetil ciclobutano H2 C H2 C C H2 H H C CH CH 2 CH 3 3 H H HC33C C C C C C CH CH33 C C H2 C C H HCH CH33 CH H3 CH3 CH3 CH3 C H2 Prof. César Lourenço 04)(UESC) Admite isomeria geométrica, o alceno: a) 2, 3 – dimetil – 2 – penteno. b) 1 – penteno. c) 3 – metil – 3 – hexeno. d) eteno. e) 4 – etil – 3 – metil – 3 – hexeno. 2, 33– –dimetil metil 1 – penteno ––32––hexeno penteno H3H C H3CC CH2 C C H C CH 2 2 CH CH CH 33 C 2C CHCH 2CH 3 H 3 3H CH3CHCH Prof. César Lourenço 05) (U . DE UBERABA – MG) As balas e as gomas de mascar com sabor de canela contêm o composto cinamaldeído (ou aldeído cinâmico) que apresenta a fórmula estrutural abaixo. O H 2 1 3 H H O nome oficial deste composto orgânico é: a) trans – 3 – fenil propenal. b) trans – 1 – fenil propenal. c) trans – 3 – fenil propanal. trans - 3 - fenil propenal d) trans – 3 – benzil propenal. e) cis – 3 – fenil propenal. Prof. César Lourenço 06) ( Covest – 2006 ) O óleo de soja, comumente utilizado na cozinha, contém diversos triglicerídeos (gorduras), provenientes de diversos ácidos graxos, dentre os quais temos os mostrados abaixo. Sobre esses compostos, podemos afirmar que: a) o composto 4 é um ácido carboxílico de cadeia aberta contendo duas duplas ligações conjugadas entre si. FALSO b) os compostos 2 e 3 são isômeros cis-trans. VERDADEIRO c) o composto 1 é um ácido carboxílico de cadeia insaturada. CH 3 ( CH 2 ) 16 COOH (1) CH 3 ( CH 2 ) 7 H H ( CH 2 ) 7 COOH (2) CH 3 ( CH 2 ) 7 H CH 3 ( CH 2 ) 4 H ( CH 2 ) 7 COOH H (3) CH 2 H H ( CH 2 ) 7 COOH H (4) d) o composto 2 é um ácido graxo de cadeia aberta contendo uma dupla ligação (cis). e) o composto 3 é um ácido graxo de cadeia fechada contendo uma insaturação (cis). É um ácido carboxílico de cadeia aberta com duas duplas ligações ISOLADAS Propriedade em desviar o plano da luz polarizada, para direita é dextrógido(d), para esquerda é levógiro(l), mas isso ocorre, devido a presença do carbono quiral ou assimétrico ou racemato. Carbono que apresenta quatro grupos ligantes diferentes entre si. LUZ NATURAL É um conjunto de ondas eletromagnéticas que vibram em vários planos, perpendiculares à direção de propagação do feixe luminoso representação de Fresnell LUZ POLARIZADA É um conjunto de ondas eletromagnéticas que vibram ao longo de um único plano representação de Fresnell Prof. César Lourenço A POLARIZAÇÃO DA LUZ NATURAL luz natural lâmpada bálsamo – do – canadá prisma de Nicol Prof. César Lourenço LUZ POLARIZADA raio extraordinário raio ordinário Algumas substâncias são capazes de provocar um desvio no plano da luz polarizada substância dextrógira luz natural luz polarizada levógira Estas substâncias possuem atividade óptica (opticamente ativas) As formas dextrógira e levógira, que correspondem uma a imagem da outra, foram chamadas ANTÍPODAS ÓPTICOS ou ENANTIOMORFOS ácido lático (ácido 2 – hidróxipropanóico) espelho COOH COOH C OH OH C H H CH3 CH3 A mistura em partes iguais dos antípodas ópticos fornece por compensação dos efeitos contrários um conjunto OPTICAMENTE INATIVO, que foi chamado MISTURA RACÊMICA Prof. César Lourenço As substâncias assimétricas possuem atividade óptica A estrutura orgânica que tem CARBONO ASSIMÉTRICO possuirá atividade óptica (opticamente ativa) Prof. César Lourenço Carbono assimétrico ou quiral É o átomo de carbono que possui quatro ligantes diferentes entre si H H OH C C H Cl H como o composto tem carbono assimétrico, ele apresenta ATIVIDADE ÓPTICA Prof. César Lourenço 01) Na estrutura abaixo, quando se substitui “ R ” por alguns radicais, o composto adquire atividade óptica. Qual dos itens indica corretamente esses radicais? R CH2 H 3C C CH2 R a) b) c) d) e) CH3 COOH CH2 CH3 metil e etil. metil e propil. etil e propil. dois radicais metil. dois radicais etil. Prof. César Lourenço 02) (FAFI – MG) Em relação ao ácido lático, cujas fórmulas espaciais estão representadas abaixo, estão corretas as opções, exceto: COOH H OH HO CH3 COOH COOH H H COOH OH HO H CH3 (I) espelho CH3 ( II ) CH3 espelho ácido lático – ácido – 2 – hidroxipropanóico a) Possui átomo de carbono assimétrico. b) Possui atividade óptica. c) Apresenta carboxila e oxidrila (hidroxila). d) Possui isomeria cis-trans. e) As suas estruturas não são superponíveis. Prof. César Lourenço 03) (UPE-2007 – Q2) Analise as estruturas I, II, III e IV, abaixo. CH2OH H OH CH2OH OH H CH3 CH3 (I) (II) CH2OH H OH CH2OH (III) CH2OH OH H CH2OH (IV) É correto afirmar que a) somente as estruturas I e II apresentam isomeria ótica. b) somente as estruturas I e III apresentam atividade ótica. c) somente as estruturas III e IV apresentam atividade ótica. d) somente as estruturas I e IV apresentam isomeria ótica. e) todas apresentam atividade ótica. Prof. César Lourenço 04) (Covest – 2005) Diversos compostos orgânicos são responsáveis pelo odor de vários alimentos. Dentre eles, podemos citar: A partir das estruturas acima pode-se afirmar que: 0 0 A nomenclatura do composto orgânico responsável pelo aroma da canela, é 3 – fenilpropanal. 1 1 A cicloexilamina possui um centro estereogênico (quiral). 2 3 4 2 3 4 O acetato de octila, responsável pelo aroma da laranja, apresenta uma função éter. O composto responsável pelo aroma da baunilha, apresenta as funções fenol, aldeído e éter. O composto responsável pelo aroma da canela, pode apresentar isomeria cis - trans. 05) (Covest-2007) A partir das estruturas H C C C H 3C H H 3C H 3C C C C C H 3C 2) Os compostos representados em (II) H heral são exatamente iguais; portanto não ( II ) H H diferentes; portanto, não apresentam nenhum tipo de isomeria. HOOC H H C HO O C C H 3) Os ácidos representados em (III) são C C CH H C 3 OH cis/trans. apresentam nenhum tipo de isomeria. H H geranial e heral, apresentam isomeria H C geranial H (I) C H compostos representados em (I), O C H C que: 1) Os H H 3C H 3C H moleculares ao lado podemos afirmar 3 COOH ácido lático Está(ão) correta(s): ( III ) b) 2 e 3 apenas CH 3 C H 3C H e) 3 apenas H H H H C C C ácido 2-metilbutanóico COOH C H 3C H d) 1, 2 e 3 H H c) 1 e 3 apenas COOH H a) 1 apenas ácido pentanóico 06) (UPE-2006-Q2) Analise as afirmativas acerca dos diversos compostos orgânicos e suas propriedades e assinale-as devidamente. F 0 0 Os compostos butanal e metilpropanal exemplificam um caso de isomeria espacial O F 1 1 Os isômeros de posição Opertencem à mesma função possuem diferem H3Corgânica H3C masCH C a mesma cadeia, C entre CH2 e CH 2 si apenas quanto à posição do heteroátomo H H V 2 2 Um hidrocarboneto cíclico pode ser isômero de um CH3ORGÂNICA ISÔMEROS DE POSIÇÃO PERTENCEM À MESMA FUNÇÃO hidrocarboneto alifático insaturado SÃO ISÔMEROS DE CADEIA E TÊM A MESMA CADEIA, MAS DIFEREM ENTRE SI PELA POSIÇÃO RADICAL OU UMA INSATURAÇÃO cresóis, C7DE H8UM O, são conhecidos quimicamente como V 3 3 Os hidroximetilbenzenos e podem apresentar isomeria plana, tanto de função de posição H2C e como CH CH3 SÃO ISÔMEROS F 4 4 A atividade ótica de uma substância está relacionada com a C3H6OH C3H6 OH simetria cristalina ou molecular das substâncias É UM CRESOL É RELACIONADA ISÔMERO DE É ISÔMERO DE ESTÁ COM A ASSIMETRIA FUNÇÃO DO POSIÇÃO DO CH2 CH3 OH CH3 Para uma substância orgânica, com carbono assimétrico, o número de isômeros ativos e inativos é dado pelas expressões: número de isômeros ativos número de isômeros inativos 2 2 n n–1 “n” é o número de carbonos assimétricos Prof. César Lourenço H H OH C C H Cl H tem um carbono assimétricos n = 1. 2 2 n–1 = 2 1 n = 2 isômeros ativos 1–1 = 2 0 = 1 isômero inativo 01) O número total de isômeros (ativos e inativos) da molécula abaixo é: H I H3C – C – I Cl a) 2. b) 4. c) 6. d) 8. e) 10. H I C – NH2 I Cl Este composto possui dois átomos de carbono assimétricos diferentes, portanto n = 2 n 2 = 2 2 n–1 2 = 4 isômeros ativos 2–1 = 2 total de isômeros: 1 = 2 = 2 isômero inativo 4 ativos + 2 inativos = 6 isômeros Prof. César Lourenço 02) (FESP-PE) Considere o composto: ácido 2, 3 – dicloro – 3 – fenilpropanóico Ele apresenta: a) 4 isômeros sem atividade óptica. b) um total de 6 isômeros, sendo 2 sem atividade óptica. c) um total de 4 isômeros, sendo 2 sem atividade óptica. d) não apresenta isomeria óptica. e) só 2 isômeros ativos e um meso composto. Tem dois carbonos assimétricos n = 2 n 2 2 = 4 isômeros ativos 2 n–1 = 2 2–1 = 2 1 = 2 isômeros inativos Total de isômeros = 4 + 2 = 6 isõmeros 03) O ácido cloromático Cl OH H H O O HOOCC– CHCl –CCOOH C – CHOH C HO OH apresenta: a) 4 isômeros ativos e 2 racêmicos. b) 2 isômeros ativos e 1 racêmico. c) 8 isômeros ativos e 4 racêmicos. d) 6 isômeros ativos e 3 racêmicos. e) 16 isômeros ativos e 8 racêmicos. Tem dois carbonos assimétricos diferentes, portanto n = 2 2 n 2 = 4 isômeros ativos n 2– 1 1 2 = 2 isômeros racêmicos EFEITOS FISIOLÓGICOS DOS ENANTIOMEROS Os isômeros comportam-se de modo diferente quando envolvidos em reações com reagentes assimétricos. Os sentidos do paladar e do olfato também dependem da quiralidade. Asparagina (estimula as papilas gustativa) doce – amargo Estudo recente associou o consumo de batatas fritas na adolescência a um maior risco de câncer na vida adulta. O risco se deve à presença de acrilamida, produzida durante a fritura, quando a glicose e determinados aminoácidos presentes na batata, como a asparagina, reagem entre si, conforme representado a seguir: TALIDOMIDA Levógira ( ℓ ) Dextrógira (d ) Naproxeno ( alivia a dor - causa danos ao fígado) Dextrógira (d ) Levógira ( ℓ )
Download