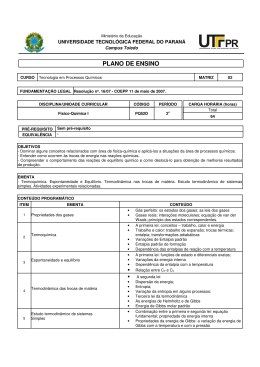
CAMPUS SÃO PAULO 1- IDENTIFICAÇÃO CURSO: Licenciatura em Ciências Biológicas Componente Curricular: Energia e Transformação da Matéria Semestre: 3º Nº aulas semanais: 4 Abordagem metodológica: T( ) P( ) ( X ) T/P Código: K3ETM Total de aulas: 76 Total de horas: 57,0 Uso de laboratório ou outros ambientes além da sala de aula? ( X ) SIM ( ) NÃO Qual(is)? Laboratório de química / laboratório de informática 2 - EMENTA: A disciplina trabalha os conceitos básicos do comportamento dos gases, de equilíbrio químico e de fases, de energia, incluindo 1ª e 2ª leis da termodinâmica, e as relações destes com fenômenos químicos e biológicos. 3 - OBJETIVOS: • • • • • • • • • • • • • Compreender o conceito de energia, pressão e de temperatura; Compreender comportamento dos gases e de equilíbrio de fases de substâncias puras; Diferenciar comportamento ideal e real de gases; Relacionar comportamento de gases ideais com a teoria cinética dos gases; Interpretar diagramas de fases; Calcular valores de pressão, temperatura e volume molar de gases utilizando equações de estado; Estimar a variação da pressão de vapor de um líquido utilizando diagrama de fases ou sua entalpia de vaporização; Compreender da interação matéria e energia nos processos físico-químicos; Conhecer o conceito de entropia e saber analisar sua variação nos processos físico-químicos e biológicos; Analisar a variação de energia nos processos físico-químicos e biológicos, verificando condições de espontaneidade; Compreender a dinâmica do equilíbrio químico, sua relação com as variações de energia do sistema; Calcular constantes de equilíbrio e condições de equilíbrio utilizando dados termodinâmicos; Planejar e executar trabalhos experimentais visando o ensino de temas relacionados à disciplina. 4 - CONTEÚDO PROGRAMÁTICO: • Pressão, volume molar e temperatura: conceito, determinação empírica e unidades; • Propriedades Empíricas dos Gases ideais: Lei de Boyle, Lei de Charles, princípio e Avogrado e lei gases ideais; • A teoria cinética dos Gases; • Gases Reais- equação e Van der Waals e aplicações; • Propriedades dos Líquidos e Sólidos; • Diagrama de fases de substâncias puras; • Princípio Zero da termodinâmica; • Energia, trabalho, calor; • Primeiro Princípio da Termodinâmica; • Termoquímica – variações na energia interna, entalpia e sua relação com trabalho e calor nas transformações da matéria; • Segundo Princípio da Termodinâmica; • Propriedades da Entropia e sua variação nas transformações da matéria; • Terceiro Princípio da Termodinâmica; • Condições termodinâmicas de espontaneidade e equilíbrio; • Energia Livre e cálculo de condições de equilíbrio. 5 - BIBLIOGRAFIA BÁSICA: [1] BROWN, T.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. 9 ed. São Paulo, Prentice-Hall, 2005. [2] ATKINS, P.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2006 [3] ATKINS, P.W. e DE PAULA, J. Físico-Química Biológica. Rio de Janeiro: LTC Editora, 2008. 6 - BIBLIOGRAFIA COMPLEMENTAR: [1] ATKINS, P. Físico-Química: Fundamentos. Ed. LTC, 2003. [2] CASTELLAN, G. Fundamentos de Físico-Química. Ed. LTC, 1986. [3] BORGNAKKE, C.; VAN WYLEN, G. J.; SONNTAG R. Fundamentos da Termodinâmica. Ed. Edgard Blücher, 2003. [4] LIDE, D. R. (Ed.). CRC Handbook of chemistry and physics: A ready-reference book of chemistry and physical data, 75. ed. CRC: Florida, 2006. [5] LEHNINGER, A. L.; NELSON; D. L.; COX, M. M. Princípios de Bioquímica. 4. ed. São Paulo: Sarvier, 2007.
Baixar