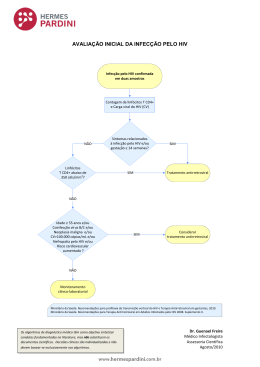
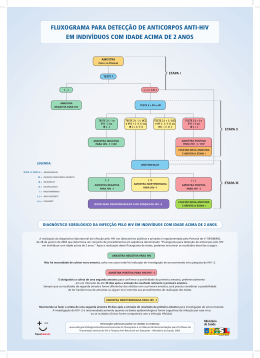
CONTACTOS: Mark Aurigemma; +1 646-270-9451; [email protected] Pedro Goicochea; +1 415-490-8350; [email protected] Folha de Fatos do iPrEx: Fatos importantes sobre o estudo iPrEx Nome do Estudo: iPrEx, que deriva do espanhol 'Iniciativa Profilaxis Preexposicion” (Iniciativa Profilaxia Pré-Exposição) Patrocinador do Estudo: O iPrEx é financiado pelos Institutos Nacionais de Saúde (NIH) dos Estados Unidos, através de uma subvenção aos Institutos J. David Gladstone, uma instituição de pesquisa independente, sem fins lucrativos filiada à Universidade da Califórnia em São Francisco (UCSF). Financiamento adicional foi fornecido pela Fundação Bill & Melinda Gates. Centros: O iPrEx foi realizado em 11 centros de estudo, em nove cidades de seis países localizado em quatro continentes: PERU: Asociación Civil Impacta Salud y Educación (Lima); Investigaciones Médicas en Salud (Lima); Asociación Civil Selva Amazónica (Iquitos) EQUADOR: Fundación Ecuatoriana Equidad (Guaiaquil) BRASIL: Instituto de Pesquisa Clínica Evandro Chagas -- FIOCRUZ (Rio de Janeiro); Projeto Praça Onze, Universidade Federal de Rio de Janeiro (Rio de Janeiro); Universidade de São Paulo (São Paulo) ESTADOS UNIDOS: Fenway Community Health (Boston); Departamento de Saúde Pública de São Francisco (São Francisco) ÁFRICA DO SUL: Fundação para o HIV Desmond Tutu, Universidade da Cidade do Cabo (Cidade do Cabo) TAILÂNDIA: Instituto de Pesquisa de Ciências da Saúde, Universidade de Chiang Mai (Chiang Mai) Participantes: O iPrEx incluiu 2.499 participantes; 56% dos participantes do iPrEx estava no Peru, 15% no Brasil, 12% no Equador, 9% nos Estados Unidos, 5% na Tailândia e 3% na África do Sul. Dos 2.499 participantes do estudo, 1.251 foram designados aleatoriamente para o braço da PrEP com FTC/TDF; 1.248 foram designados aleatoriamente para o braço do placebo. Duração: Após 3 anos de preparação, o iPrEx iniciou em 14 de junho de 2007, incluiu o primeiro participante em 10 de julho de 2007, e o último participante em 18 de dezembro de 2009. A partir de agosto de 2010, os participantes interromperam a medicação do estudo e continuaram no acompanhamento, para assegurar a segurança 1 após a medicação ter sido interrompida. A última visita de acompanhamento do estudo é esperada para ocorrer em março de 2011. A análise primária considerou visitas ocorridas até 1º de maio de 2010. Desenho: O iPrEx é um estudo randomizado, duplo-cego, controlado por placebo, orientado por eventos, para avaliar a segurança e a eficácia do uso de um medicamento tomado uma vez por dia, diariamente, por via oral, co-formulado de emtricitabina 200 mg/tenofovir 300 mg (FTC/TDF) para a prevenção da aquisição do HIV entre homens que são altamente expostos ao HIV e que também recebem um pacote completo de serviços de prevenção, que inclui exames anti-HIV e aconselhamento para redução de riscos, preservativos e controle de IST. O projeto teve como objetivo determinar se a PrEP é a) segura e aceitável; e b) reduz a soroincidência do HIV-1. Os resultados primários para este estudo são os eventos adversos e a soroconversão para o HIV. Agente do estudo: Emtricitabina (FTC 200 mg) e tenofovir (TDF 300 mg), são inibidores da transcriptase reversa licenciados para o tratamento do HIV-1 pelo FDA dos Estados Unidos. Expansão do Estudo: O iPrEx foi originalmente iniciado em quatro centros no Peru e Equador. Antes de incluir o primeiro participante, foram finalizados os planos de expansão do estudo para novos centros no Brasil, África do Sul, Tailândia e Estados Unidos, usando co-financiamento da Fundação Bill & Melinda Gates. Os centros da expansão iniciaram a inclusão em 24 de junho de 2008. A expansão do estudo teve como objetivo aumentar o poder e generalização dos resultados do estudo. Desenvolvimento do Protocolo e Análise: O iPrEx foi projetado e implementado de acordo com rigorosos padrões éticos internacionais. O trabalho com o protocolo do estudo iPrEx começou em fevereiro de 2004, através de consultas com líderes comunitários, participantes da pesquisa prospectiva, patrocinadores, financiadores e representantes do governo, usando métodos que mais tarde passaram a ser chamados de "Boas Práticas. O protocolo foi patrocinado pela Divisão de Aids do NIH e registrado no FDA dos Estados Unidos sob o número 71859 de Nova Droga Investigacional . O protocolo iPrEx foi aprovado pelos Comitês de Ética em cada um dos 11 centros de estudo, por parte das autoridades nacionais em cada país: o Instituto Nacional de Salud (Peru), Ministerio de Salud Pública (Equador), Conselho de Pesquisa Médica (África do Sul), Ministério da Saúde, Conselho Nacional de Saúde e a Comissão Nacional de Ética em Pesquisa (CONEP, Brasil), Ministério da Saúde Pública (Tailândia). Critérios de Inclusão: Os participantes do iPrEx são do sexo masculino no nascimento e homossexuais e mulheres transgêneras que fazem sexo com homens, 2 uma população de risco extremamente elevado para a infecção pelo HIV em todo o mundo que é muitas vezes negligenciada nos estudos e serviços de prevenção do HIV, com idade de 18 anos no momento da inscrição, em boa saúde, HIV-1 negativos, não infectados de forma aguda com hepatite B, dispostos e aptos a prestar o consentimento informado, fisicamente capazes de fornecer sangue e urina para as avaliações de segurança; e com alto risco para a aquisição sexual do HIV. Critérios de Riscos: A evidência de risco para aquisição do HIV incluiu qualquer dos seguintes nos 6 meses anteriores à triagem: sexo anal com 3 ou mais parceiros do sexo masculino, um diagnóstico de uma doença sexualmente transmissível, a história de atividade sexual transacional, ou o sexo anal sem preservativo com um parceiro que estava infectado pelo HIV ou com resultado de sorologia desconhecido. Critérios de Exclusão: Os critérios de exclusão foram: doença grave e ativa, incluindo a diabetes que exigisse agentes hipoglicemiantes, tuberculose ativa e câncer exigindo terapia; uso de substâncias, suficiente para prejudicar a conformidade com as visitas, uso de agentes nefrotóxicos. A creatinina sérica e contagem de plaquetas tinha que estar dentro dos limites normais e uma contagem absoluta de neutrófilos de pelo menos 1.500 células / mm3 foi exigida. Pessoas com hepatite B ativa poderiam ser incluídas, desde que fossem informadas dos riscos e benefícios especiais do uso de FTC/TDF e consentissem submeter-se a 24 semanas de acompanhamento após a interrupção da droga em estudo. Visitas do Estudo: As visitas de estudo foram agendadas a cada 4 semanas após a inclusão. Cada visita de 4 semanas incluía a dispensação dos medicamentos, aconselhamento para a adesão, teste de anticorpos contra o HIV com testes rápidos, o aconselhamento pré- e pós-teste de redução de risco e histórico médico. Cada visita de 12 semanas também envolveu uma entrevista de comportamento sexual com um entrevistador e uma auto-entrevista assistida por computador (CASI) e coleta e armazenamento de plasma e de soro. As pessoas que tiveram testes rápidos de HIV reativos foram acompanhados a cada duas semanas até que sua infecção por HIV-1 fosse confirmada, e depois na semana 4, 8, 12 e cada 12 semanas. Avaliação e Acompanhamento: Todos os participantes foram avaliados em intervalos de 4 semanas ao longo do estudo. Todos os participantes foram acompanhados por, no mínimo, 8 semanas após terem interrompido a medicação do estudo, até o fim de outubro de 2010. Além disso: Os participantes reativos aos antígenos da hepatite são acompanhados para anormalidades hepáticas por 16 semanas adicionais, para um total de 24 semanas após a interrupção da droga do estudo. 3 Os participantes incluídos no subestudo opcional de densidade mineral óssea, distribuição de gordura e lipídios de jejum são convidados a retornar para uma visita adicional de 24 semanas após a interrupção da droga do estudo. Os participantes que se infectaram pelo HIV durante a sua participação no estudo são acompanhados por pelo menos 24 semanas, depois de pararem de tomar a droga do estudo. Intervenções de Prevenção: Todos os participantes receberam intervenções de prevenção padrão, incluindo testes de HIV e aconselhamento de redução de risco, preservativos e diagnóstico e tratamento das infecções sexualmente transmissíveis, incluindo gonorréia e clamídia, uretrite e sífilis. A sorologia para herpes simplex e de infecções sexualmente transmissíveis assintomáticas foi realizada a cada 24 semanas. Todos os participantes foram instruídos a se proteger do HIV através de outros métodos que não a PrEP, porque os comprimidos que recebiam poderiam ser tanto placebo quanto a droga ativa, que pode ter nenhum poder de proteção. Os participantes que relatem uma recente exposição desprotegida a um parceiro infectado pelo HIV-1 foram encaminhados para profilaxia pós-exposição (PEP), em locais onde a PEP está disponível e é considerada o padrão de cuidados de prevenção e a medicação do estudo foi temporariamente interrompida. Coleta de dados: Os dados foram coletados nos Formulários de Relato de Casos (CRF) e enviados a um servidor Datafax na DFNet, uma instituição de gerenciamento de dados baseada em Seattle, estado de Washington, nos Estados Unidos. O reconhecimento ótico de caracteres foi seguido por duas rodadas de controle de entradas. As discrepâncias foram resolvidas pelos centros, usando documentos-fonte. Uma auto-entrevista assistida por computador (CASI) foi usada para coletar informações sobre a situação educacional, identidade social, uso de álcool e substâncias, e comportamento sexual. Exames laboratoriais: Os exames para anticorpos do HIV foram realizados com dois testes rápidos a cada visita (Bioline e Determine, nos centros internacionais; Oraquick e Clearview, nos centros dos Estados Unidos). Todos os testes rápidos reativos foram testados usando um Western Blot (BioRad). Os exames de plasma do RNA do HIV (Abbott and Roche) foram realizados na inclusão, se a soroconversão tiver sido detectada em até12 semanas após a inclusão ou se tiver havido visitas perdidas antes da primeira visita de soropositivo. Além disso, o exame de nível de plasma do RNA do HIV foi realizado para avaliar o estado da infecção na inclusão ou entre aqueles com resultado indeterminado em testes Western Blot em três amostras. O monitoramento do nível de plasma viral RNA do HIV e a contagem de células CD4 foi medida entre aqueles com infecção pelo HIV confirmada. A genotipagem para resitência à drogas foi realizada usando o teste Trugene (Siemens), um ensaio de genotipagem da população, 4 e a fenotipagem foi realizada usando o teste PhenoSense (Monogram). Os exames para Doenças Sexualmente Transmissíveis (DST) incluíram avaliação de uretrite, com o uso de uma fita reagente para o exame de leucócito esterase (LE), um RPR, e uma sorologia para HSV-2. Os exames de leucócito esterase positivos foram seguidos por testes de ácido nucléico para gonorréia e clamídia. Os RPRs reativos foram seguidos por exames de sífilis (treponemas) confirmatórios. Outros exames laboratoriais foram realizados pelo laboratórios locais que participaram da garantia da qualidade externa do Colégio Americano de Patologistas conforme gerido pelo programa SMILE do NIH. Auditorias nos laboratórios foram realizadas uma ou mais vezes por ano. Monitoramento do CMDS: O estudo foi monitorado pelo Comitê de Monitoramento de Dados de Segurança Multinacional do NIH/NIAID/DAIDS em novembro de 2007(segurança), novembro de 2008 (segurança), maio de 2009 (segurança), novembro de 2009 (segurança e eficácia) e maio de 2010 (segurança). Término do Estudo: O tamanho da amostra do protocolo foi orientada para conter 85 eventos de soroconversão para a análise de intenção-de-tratar modificada. Em novembro de 2009, o CMDS recomendou que a inclusão no iPrEx fosse interrompida em dezembro de 2009 por que a inclusão já era suficiente para atender os objetivos do estudo. Sem acesso a qualquer informação divulgada, o patrocinador decidiu, em outubro de 2010, que a análise primária deveria ser realizada logo após 85 soroconversões terem acontecido. Em dezembro de 2009, o patrocinador decidiu que as visitas realizadas até 1º de maio de 2010 deveriam ser incluídas. A data foi escolhida para permitir que as lições aprendidas com o estudo fossem analisadas e relatadas o mais rapidamente possível. Outros números:O iPrEx envolveu: 43.248 visitas de participante voluntários 39.754 visitas para aconselhamento e testagem para o HIV 650.000 páginas de dados enviadas por fax para o centro de gerência de dados 1.184.400 comprimidos do medicamento do estudo distribuídos 4.533 doses da vacina para HBV aplicadas 1.019 casos de sífilis diagnosticados e tratados ~500.000 preservativos distribuídos aos participantes *** 5
Download