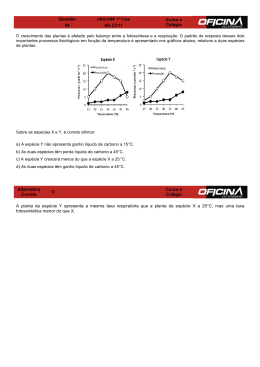
ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 25 8 REDUÇÃO CARBOTÉRMICA (Redutor Sólido) 8.1 INTRODUÇÃO É o tratamento químico de redução de uma substância mineral (quimicamente um óxido) com o emprego do gás CO que tem origem numa substância portadora do elemento carbono – comumente nas ‘formas’ coque ou carvão vegetal 1 – para a produção de um metal. Devido à alta temperatura empregada – característica da operação – com a exceção da substância portadora do carbono, todos os outros componentes da carga normalmente acabam por se fundir e os produtos – excetuando-se naturalmente os gases – são removidos no estado líquido. Uma reação que descreve o processo pode ser a seguinte: MeO + CO(g) = Me(l) + CO2(g) Enquanto o óxido do metal de valor é reduzido, o restante da ganga 2 – que acompanha o minério e é constituída normalmente por minerais também pertencentes à classe química dos óxidos – permanece inalterada, porém, pela alta temperatura do processo, funde-se e dá origem à parte principal da escória. A fusão não se dá por acaso, mas pelo ajuste da composição da ganga para uma região de baixo ponto de fusão, com o uso de fundentes. A imiscibilidade e a diferença de densidade promovem a separação, por ação da gravidade, das fases metal e escória em duas camadas. A escória, sobrenadante, deve ter uma baixa viscosidade para permitir que as gotas de metal líquido, mais densas, continuamente produzidas mais acima, no reator, tenham a possibilidade de atravessá-la. Embora seja necessário, para alguns metais, o uso de temperaturas maiores que um determinado valor 3, essa separação líquido-líquido entre a ganga e o metal é, de fato, o principal motivo para se operar o processo a uma temperatura elevada – acima dos pontos de fusão do metal e da escória (quando o ponto de fusão da ganga é muito elevado adiciona-se fundentes para reduzí-lo. Contudo, a temperatura de operação deve ser mantida abaixo dos 1800°C, senão os custos do processo de redução aumentam substancialmente. Isto se deve, entre outras razões, (i) aos problemas de custo dos materiais refratários, (ii) ao aumento da reatividade do metal com o meio que o cerca (o que resulta na sua progressiva contaminação) e, (iii) à perda de metal junto com os gases que deixam o reator (principalmente quando o ponto de ebulição do metal é muito baixo, ou quando um óxido ou subóxido do metal de valor – matéria-prima – é volátil). O uso de uma cuba acima do cadinho pode servir para: (i) recuperar o calor sensível que deixa o forno com os gases (o calor latente é recuperado pela sua combustão em outro reator e utilizado para aquecer o ar,); (ii) recuperar parte do poder redutor dos gases – aproveitado para reduzir em algum nível a valência do óxido do metal de vapor; e, por fim, (iii) para condensar o metal de valor que deixa o cadinho com os gases – acaba por condensar, também, os álcalis. A altura máxima da cuba está diretamente relacionada com esses fatos. O uso da cuba pressupõe um leito permeável. Por isso, todo o material da carga deve apresentar: (i) granulometria homogênea 4 ‘elevada’ (diâmetro entre 50 e 100 mm) e (ii) boas propriedades mecânicas à temperatura da redução. Pelo primeiro motivo, há necessidade de aglomeração dos minérios pulverulentos e da classificação da carga para separá-la dos seus finos (aos do redutor diz-se moinha). 1 Algumas formas da tecnologia ‘redução direta’ já empregaram carvão mineral não-coqueificável beneficiado. A ganga não é removida totalmente no tratamento de minérios pois é mais vantajoso – em termos econômicos – executar a parte final dessa tarefa na metalurgia extrativa. 3 Veja a ‘Termodinâmica da Redução Carbotérmica’, mais adiante. 4 Usa-se a expressão bitolado – aplicada ao minério, sínter e coque. 2 ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 26 O coque ou o carvão vegetal – agentes químicos da redução, ou redutores – constituem o produto da pirólise de substâncias carbonosas: carvão mineral e madeira, respectivamente. Aos problemas técnicos da sua produção somam-se outros como, por exemplo: (i) apenas uma pequena fração dos carvões minerais pode ser utilizada para se produzir coque; (ii) os carvões minerais são recursos naturais não-renováveis; (iii) a produção de carvão vegetal requer extensas áreas cultiváveis próximas às usinas, tempo para a massa vegetal crescer e apresenta manejo complexo; (iv) a demanda por carvão vegetal – é bom salientar, um recurso natural renovável – pode provocar, como uma espécie de efeito colateral, uma pressão para a destruição das matas nativas. Além de ser um agente redutor, o carbono também é capaz de se combinar com alguns metais. Quando a afinidade de um metal pelo carbono é baixa, eles formam uma solução líquida, e o metal líquido estará saturado com o carbono à temperatura do processo. Por esta razão obtém-se ferro gusa (com ~ 4% C) ao se reduzir o óxido de ferro por meio de carbono. Quando a afinidade é alta, o emprego da redução carbotérmica não é aconselhada (veja a Tabela 8.1). No caso intermediário podem aparecer carbonetos no seio da solução. Pelo conjunto das razões mencionadas, os metais: Fe, Mn, Cr, Sn, Pb e o Zn (este último é um caso especial) são os principais metais produzidos a partir da redução carbotérmica dos seus óxidos pelo carbono. Adicionam-se a eles algumas ferro-ligas, que também são produzidas por este processo. Na operação de redução carbotérmica, o calor necessário para a fusão e para a redução pode ser fornecido de forma parcial ou total pela eletricidade mas, normalmente, provém da combustão de parte do agente redutor. Para se evitar o desperdício de redutor com a geração de calor, está sendo utilizada cada vez mais a adição – em um ponto técnicamente apropriado do reator, tipicamente a ventaneira onde ar é injetado no forno – de materiais carbonosos ‘secundários’ (moinha de coque e de carvão vegetal, ou outras substâncias combustíveis) que desempenham o papel de combustível. À isso chama-se ‘injeção de carvão pulverizado’, PCI. Tabela 8.1 Afinidade Nenhuma Muito baixa Mediana Alta Grau de afinidade de diferentes metais em relação ao carbono e suas conseqüências Metal Implicações Preciosos, Cu, Zn Co, Ni, Mg a) Fe, Mn, Cr Formam soluções sólidas e líquidas com o carbono (ou misturas com carbonetos) b) Al, Ca, Si Formam carbonetos insolúveis Ta, Ti, V, Hf, Nb, Zr, Be Formam somente carbonetos Muitos tipos de reatores podem ser empregados nesta operação; os mais comuns são: o forno de cuba (que, no caso da metalurgia extrativa do ferro, leva o nome de alto-forno) e o forno elétrico de redução (também denominado de baixo-forno elétrico). 8.2 TERMODINÂMICA DA REDUÇÃO CARBOTÉRMICA (Redutor Sólido) Os sulfetos metálicos – matérias primas abundantes na natureza – normalmente não podem ser reduzidos pelo carbono pois o ∆°G de formação do CS2, embora negativo, é – em comparação com o ∆°G de formação da maioria dos sulfetos metálicos – insuficiente. Mesmo quando a possibilidade existe, o carbono não é utilizado, pois a eliminação do CS2 é problemática. ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 27 O carbono – também por razões termodinâmicas – é desaconselhado como agente redutor dos haletos, restando assim como matéria-prima para a redução pelo carbono os óxidos que ocorrem naturalmente ou que são produto da aplicação da tecnologia mineral. Não é estritamente correto dizer-se que a redução carbotérmica pode ser expressa pela equação genérica (denominada redução direta – não confundir com o processo homônimo!): MeO + C(s)= Me(l) + CO(g) – como freqüentemente é feito. Essa equação é apenas o resultado da soma das duas outras reações: MeO + CO = Me + CO2 + CO2 + C = 2 CO MeO + C = Me + CO (a primeira delas é denominada de redução indireta e a segunda é a reação de Boudouard – veja explicações adiante). Assim, a redução realmente ocorre por intermédio da fase gasosa. A reação de redução direta pode expressar o caso da redução dos óxidos muito estáveis, onde a concentração de CO na fase gasosa resultante é – necessáriamente – extremamente elevada! Na redução carbotérmica, a composição da atmosfera oscila entre os valores determinados (i) pelo equilíbrio do sub-sistema ‘redução do óxido pelo CO’ e (ii) pelo subsistema da ‘reação de Boudouard’ – mais próxima daquele que apresentar a taxa de conversão mais rápida. A partir de dados termodinâmicos, é possível calcular os valores da pressão parcial dos gases para o primeiro equilíbrio, para qualquer temperatura, utilizando-se a seguinte reação: MeO + CO(g) = Me + CO2(g). Enquanto o metal e o óxido coexistem com atividades iguais à unidade, a razão pCO2/pCO – correspondente ao equilíbrio entre as fases: atmosfera, MeO e Me – é função somente da temperatura – pois é idêntica à expressão da própria constante de equilíbrio! Os valores numéricos desta razão – considerando-se vários metais – cobrem uma faixa muito grande: desde 1x105 – para a redução de Cu2O a Cu – até valores da ordem de 1x10-5 ou menores – para a redução de MnO e SiO2 aos metais correspondentes; esses valores podem ser vistos na Figura 8.1. A entalpia das reações de redução dos óxidos pelo CO pode ser deduzida da Figura 8.1 com o auxílio da equação de van’t Hoff : d ln K = - ∆H° . d (1/T) R Assim, a redução dos metais relativamente ‘nobres’ pelo CO é exotérmica, enquanto que a redução dos reativos é endotérmica. Pelo fato da reação entre o C(s) e o CO2(g) ser fortemente endotérmica, a redução carbotérmica de praticamente todos os óxidos metálicos importantes é endotérmica, e a entalpia da redução aumenta com o incremento da estabilidade do óxido. O segundo equilíbrio mencionado pode ser compreeendido considerando que, na presença de carbono sólido, o oxigênio reage formando os gases CO e CO2; isto pode ser descrito por meio das reações: C(s) + O2(g) = CO2(g) 2 C(s) + O2(g) = 2 CO(g). A diferença entre elas elimina a variável pO2 do sistema (embora isto não diminua a grande importância do oxigênio no sistema) e a reação obtida é conhecida pelo nome de ‘reação de Boudouard’ ou de ‘Baur-Glaessner’: CO2(g) + C(s) = 2 CO(g). A razão ‘simples’ entre as pressões parciais dos gases, obtida com a ajuda da expressão da constante de equilíbrio, K, expressa por: ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 28 pCO2/pCO = pCO/K mostra que o seu valor – ao contrário do caso anterior –, além de ser uma função da temperatura, também o é da pCO e, por conseqüência, da pressão total, P: P = pCO + pCO2. (A contribuição dada pela pressão parcial do oxigênio presente na fase gasosa é, neste caso, desprezível, embora nem sempre se possa dizer o mesmo da pN2 ou, então, da pMe – para aqueles metais com um ponto de ebulição muito baixo.) Fig. 8.1 Quociente pCO2/pCO de quilíbrio para a redução de alguns óxidos de metais comuns e para a reação de Boudouard em função do inverso da temperatura (Rosenqvist, T.: Princ. of Extr. Metall., McGraw-Hill, 1972, Figura 9-1, p. 266) Esse sistema, de duas equações e duas incógnitas, permite – uma vez fixados os valores de P e da temperatura – o cálculo das pressões pCO e pCO2 em equilíbrio com o carbono sólido. Assim, uma atmosfera contendo excesso de CO2, em contato com o carbono, reage formando CO e, no caso contrário, contendo um excesso de CO (dita instável) se decompõe gerando CO2 e ‘fuligem’ – observadas as limitações de ordem cinética. ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 29 Os valores da razão pCO2/pCO (‘curva de Boudouard’), em função da temperatura, também aparecem graficados na Figura 8.1 para o valor de uma atmosfera de pressão total. A variação do valor numérico desta razão também é digno de nota. Como se pode verificar, muitas razões pCO2/pCO desejadas podem ser obtidas, bastando, para isso, que se disponha de uma temperatura adequada! O limite superior é, evidentemente, dado pelo custo e pela tecnologia. Para valores de P maiores (ou menores) do que uma atmosfera, a curva de Boudouard sofre uma translação correspondente, para cima, ou para baixo. A intercessão entre a curva de Boudouard e a da linha de composições de equilíbrio da reação de redução de um óxido de um metal particular – caso exista – determina a ‘temperatura mínima termodinâmica’ necessária para que o metal possa ser produzido. A temperatura real, no entanto, conforme foi comentado, deve considerar também os pontos de fusão do metal e da escória – a maior dentre as três deve ser a efetivamente usada. Para a redução de óxidos de metais relativamente ‘nobres’ (caso onde não haja intercessão), como Cu, Ni, Pb, pode-se usar qualquer atmosfera prevista pela reação de Boudouard, pois as composições da atmosfera de equilíbrio entre Me e MeO sempre estarão ‘abaixo’ daquelas necessárias para a redução do óxido. Assim, a atmosfera encontrada dentro do reator será determinada ‘exclusivamente’ pela cinética dos processos (i) de redução dos óxidos e (ii) de gaseificação do carbono. A formação de carbonetos – possibilidade prevista para certos metais – pode ser minimizada pela adição da quantidade apenas estequiométrica de carbono; o produto será uma mistura de carboneto com óxido não-reagido que, se aquecida, provocará a reação: Me3C + MeO = 4 Me + CO(g) entre seus componentes pois, à pressão atmosférica, o equilíbrio deste tipo de reação (endotérmica) se desloca para a ‘direita’ com o aumento da temperatura; por outro lado, à temperatura constante (pelo fato de haver a presença de um gás), o Me3C pode ser ‘convertido’ à metal e CO pelo decréscimo da pressão total no reator. Contudo, apesar da possibilidade da decomposição da fase carboneto pelo seu aquecimento com um excesso de óxido metálico, na prática, o metal resultante ainda conterá uma quantidade apreciável de carbono dissolvido. 8.3 CINÉTICA DA REDUÇÃO CARBOTÉRMICA (Redutor sólido) Embora para alguns metais relativamente nobres ‘qualquer’ atmosfera pode ser considerada redutora, a reação do carbono com o oxigênio exige uma temperatura mínima para que a energia de ativação seja superada (normalmente aquela onde o carvão adquire a cor rubra). Para se representar a combustão do carbono pelo oxigênio podem ser escritas – no máximo – duas reações linearmente independentes como, por exemplo, as já citadas: C + O2 = CO2 e 2 C + O2 = 2 CO. Sob condições padronizadas, a primeira delas mostrou experimentalmente uma taxa de conversão aproximadamente 100 vezes maior do que aquela da reação de Boudouard. Para essa reação, e para uma única ‘forma’ de C(s), a taxa intrínseca de gaseificação do carbono encontrada experimentalmente foi: d nC = K ⋅ pCO2________ dt r ⋅ pCO2 + s ⋅ pCO + 1 onde K, r e s são constantes independentes das pressões parciais dos gases. Devido ao fato do C(s) poder assumir diferentes ‘formas’ como, por exemplo, carvão não-coqueificável, carvão vegetal, coque, etc., medições da razão pCO2/pCO mostram valores diferentes dos previstos pelo equilíbrio de Boudouard. Para as ‘formas’ menos reativas – ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A Nestor Cezar Heck - DEMET / UFRGS 30 como o coque – a razão pCO2/pCO é mais elevada – em outras palavras, há uma translação da curva de Boudouard para ‘cima’ na Figura 8.1 – para as outras, as medições coincidem com os valores previstos. Esta resistência química do redutor em relação à reação (e conhecida aqui pelo nome de solution loss): C(s) + CO2 = 2 CO(g), é extremamente necessária na redução carbotérmica pois, se ela ocorrer antes do coque atingir a zona de redução do minério, o CO produzido simplesmente não poderá ser utilizado na redução; o significado disso é – em última instância – a perda do precioso redutor.
Download