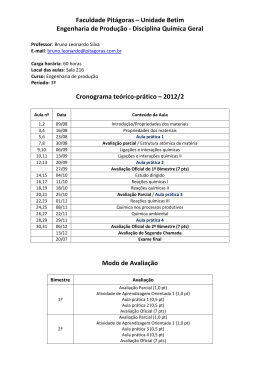
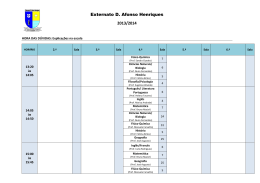
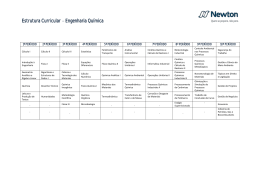
8 ln P (kPa) UNIVERSIDADE COMUNITÁRIA DA REGIÃO DE CHAPECÓ ÁREA DE CIÊNCIAS EXATAS E AMBIENTAIS CURSO: ENGENHARIA QUÍMICA PERIODO: 6° DISCIPLINA: FÍSICO-QUÍMICA EXPERIMENTAL PROFESSORA: JAQUELINE SCAPINELLO y = -5,0345x + 18,085 4 0 2,2 2,6 3 3,4 1/T (x10³) [K] EXPERIMENTO 01 GASES: RELAÇÃO PRESSÃO –TEMPERATURA 1. OBJETIVOS - Medir como varia a pressão de um gás confinado, a volume constante, com a variação da temperatura. 2. MATERIAIS a) Equipamentos - Régua; - Mangueira de borracha transparente; - Rolha com furo para o termômetro. - 1 Kitassato; - 2 Suportes; b) Reagentes - Tripé com tela de amianto; - Mercúrio; - Bico de Bunsen; - Água. - Termômetro; 3. TEORIA A Lei de Boyle-Mariotte expressa a relação entre o volume de um gás e a pressão que suporta. Em condições isotérmicas, o produto de volume pela pressão de um gás é constante, PxV = K, com aumento do volume a pressão diminui. Essa relação é valida para gases ideais (ATKINS, 1999). A Lei de Charles-Gay-Lussac expressa a relação entre o volume e a temperatura (V/T = K ). O volume de uma certa massa de gás varia diretamente com a variação da temperatura absoluta, se a pressão permanecer constante (BARROW, 1983). Nas equações anteriores K é uma constante de proporcionalidade. A Figura 1 apresenta o gráfico da relação pressão por temperatura para um gás ideal. Pressão (atm) 1,2 1,1 1 0,9 0 20 40 60 80 Temperatura (°C) Figura 1. Relação Pressão x Temperatura 4. PROCEDIMENTO EXPERIMENTAL Primeiramente, monte o aparato que será utilizado na prática, conforme é mostrado na Figura 2. Inicie o aquecimento mediante o uso de um banho de água (para garantir a homogeneidade na distribuição do calor), deixando o kitassato o mais coberto de água possível. No mesmo instante, meça a diferença de altura do fluido manométrico e a temperatura (inicial). Repita este procedimento para cada 7 - 8°C desde a temperatura inicial até atingir aproximadamente 80°C. Observe como varia a pressão com a mudança de temperatura. Figura 2. Aparato experimental 5. RELATÓRIO - Construir um gráfico de Pressão vs Temperatura. Explicar que relação pode ser deduzida a partir do gráfico. - Obter o valor de K para o gráfico obtido no experimento. - Relacionar os resultados obtidos com as Leis citadas no item 3. - Discutir o que foi encontrado e relacionar com o que relata a literatura. 6. DADOS Registrar as observações experimentais no Quadro 1. Quadro 1 – Comportamento do ar durante o processo de aquecimento. Temperatura (°C) hmanômetro (mm) Observações 7. BIBLIOGRAFIA ATKINS, Peter. Físico-química. 6. ed. Rio de Janeiro: LTC, 1999. 252 p. ATKINS, Peter; PAULA, Julio de. Physical chemistry. 7. ed. New York: Oxford, 2002. 1149 p. CASTELLAN, Gilbert. Fundamentos de físico-química. 1.ed. Rio de Janeiro: LTC, 1996-2001. 527 p. CHAGAS, Aécio Pereira. Termodinâmica química: fundamentos, métodos e aplicações . São Paulo: UNICAMP, 1999. 409 p. MACEDO, Horacio. Físico-química I. Rio de Janeiro: Guanabara Dois, 1981. 627 p. 9. DADOS PARA O PROFESSOR Tabela 1 – Comportamento do ar durante o processo de aquecimento. Temperatura (°C) hmanômetro (mm) Observações EQUIPE: ________________________________________ _________________________________________ _________________________________________ _________________________________________
Baixar