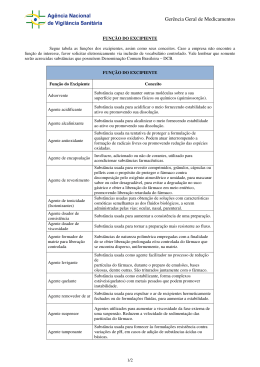
Departamento de Engenharia Química e Biológica Cinética da libertação de fármacos a partir de matrizes sólidas Dissertação apresentada para a obtenção do grau de Mestre em Processos Químicos e Biológicos Autor Elsa Alexandra do Nascimento Ribeiro Orientador Doutora Maria Nazaré Coelho Marques Pinheiro Instituição Instituto Superior de Engenharia de Coimbra Coimbra, Dezembro, 2011 ii Elsa Alexandra do Nascimento Ribeiro AGRADECIMENTOS Este espaço é dedicado àqueles que, de uma forma directa ou indirecta, contribuíram para a realização desta dissertação. A todos eles deixo aqui o meu agradecimento sincero. Desejo expressar o meu reconhecido agradecimento à professora Doutora Maria Nazaré Coelho Marques Pinheiro pela oportunidade, apoio, orientação, disponibilidade e motivação que me foi prestada ao longo de todo o trabalho. À Doutora Paula Ferreira Calvinho pelas suas sugestões e palavras de incentivo. À colega Andreia Silva pela ajuda prestada no trabalho experimental. À Engenheira Martine Costa que prontamente nos ajudou sempre que necessário. Elsa Alexandra do Nascimento Ribeiro iii iv Elsa Alexandra do Nascimento Ribeiro RESUMO Um sistema de libertação controlada de fármacos é composto, essencialmente, por um agente terapêutico incorporado numa matriz e a sua aplicação permite a libertação progressiva do fármaco, para que seja mantida no organismo uma concentração adequada pelo período necessário à terapêutica. Neste trabalho estudou-se a cinética de libertação de um fármaco incorporado em suportes de natureza polimérica, compostos por uma matriz de hidrogéis. Os parâmetros estudados incluem a composição das matrizes poliméricas, o método de incorporação do fármaco no interior das matrizes e os métodos de monitorização da libertação do fármaco. O estudo da cinética de libertação do fármaco em matrizes sólidas foi realizado com matrizes poliméricas, com composição de HEMA e MAA e de HEMA e MMA, com fármaco impregnado por oclusão e absorção, métodos simples e eficazes que permitiram a inclusão das quantidades mínimas necessárias de maleato de timolol, utilizado no tratamento do glaucoma. As metodologias utilizadas na monitorização da concentração do fármaco no meio de libertação mostraram-se adequadas, pois permitiram a reprodutibilidade e fiabilidade dos resultados experimentais obtidos, sendo que o método implementado neste trabalho, o de monitorização contínua, em circuito fechado e com manutenção de volume constante, uma alternativa vantajosa ao método de monitorização descontínua, utilizado em estudos semelhantes, pois permite registar os resultados sucessivamente, durante longos períodos, não sendo necessária a presença de um operador. A forma do perfil de libertação do maleato de timolol, característica de um processo de libertação controlada de fármacos, manteve-se idêntica em todos os ensaios, não sofrendo alterações significativas com a variação da composição das lentes ou com o método de incorporação do fármaco. Nos ensaios realizados com as lentes de composição HEMA e MAA, com o maleato de timolol adicionado por oclusão, obtiveram-se as maiores percentagens de libertação, em massa, de fármaco, onde se atingiram valores (médios) entre os 85,25% e os 93,06%. Palavras-chave: cinética de libertação de fármacos; matrizes poliméricas; hidrogéis; HEMA; MAA; MMA; oclusão; absorção; monitorização contínua; quantificação do fármaco. Elsa Alexandra do Nascimento Ribeiro v ABSTRACT A system for controlled release of drugs consists essentially of a therapeutic agent embedded in a matrix, and its application allows the gradual release of the drug into the organism while maintaining an appropriate concentration during the period necessary to therapy. In this work we studied the release kinetics of a drug incorporated into a polymeric support, consisting of a hydrogel matrix. The parameters studied include the composition of the polymer matrices, the method of drug incorporation inside the matrix and the methods of monitoring drug release. The kinetics study of drug release from solid matrices was carried out with polymeric matrices with composition HEMA and MAA, and HEMA and MMA, with the drug impregnated by occlusion or absorption. These two simple and effective methods of drug impregnation allowed the inclusion of the minimum quantities required for timolol maleate during the treatment of glaucoma. The methodologies used to monitor the drug concentration in the release medium proved to be adequate, since they allowed reproducibility and reliability of data. The method implemented in this work, with continuous monitoring in closed circuit and constant volume, is an advantageous alternative to the method of discontinuous monitoring, used in similar studies, because it is possible record the results for long periods not requiring the presence of an operator. The shape of the release profile of timolol maleate, characteristic of a controlled drug release process, remained similar in all experiments performed, with no significant changes with composition of the lens used or with the method of drug incorporation. The experiments performed with lenses made with HEMA and MAA impregnated with timolol maleate by occlusion, presented the highest percentages (in weight) of drug released, reaching (average) values between 85.25% and 93.06%. Keywords: kinetics of drug delivery, polymer matrices, hydrogels, HEMA, MAA, MMA, occlusion, soaking, continuous monitoring, quantification of the drug. vi Elsa Alexandra do Nascimento Ribeiro ÍNDICE Índice CAPÍTULO 1 1 INTRODUÇÃO 1.1 2 Sistemas de libertação controlada de fármacos 2 1.1.1 Sistemas controlados pela difusão 5 1.1.2 Sistemas controlados por erosão 9 1.1.3 Sistemas controlados osmoticamente 10 1.1.4 Sistemas pulsáteis 11 1.2 Aplicações biomédicas dos sistemas de libertação controlada 1.2.1 1.3 Aplicações oftalmológicas 12 Estudos efectuados com sistemas de libertação controlada de fármacos com aplicação em oftalmologia 1.4 11 13 Propriedades dos polímeros: aplicação em sistemas de libertação controlada de fármacos 1.4.1 14 Composição das matrizes poliméricas estudadas 15 1.5 Metodologias de incorporação do fármaco em lentes oftalmológicas 16 1.6 Objectivos 17 1.7 Organização da tese 17 CAPÍTULO 2 2 PROCESSO, FÁRMACO E METODOLOGIAS 2.1 Processo 2.1.1 2.2 20 Reagentes e equipamentos 21 Fármaco – Maleato de timolol 22 2.2.1 Determinação do comprimento de onda máximo 24 2.2.2 Curvas de Calibração 26 2.3 viii 20 Metodologias 30 2.3.1 Preparação das membranas poliméricas 30 2.3.2 Estudo da capacidade de absorção de água das lentes 32 2.3.3 Incorporação do fármaco nas lentes 35 2.3.4 Ensaio de degradação do fármaco 40 Elsa Alexandra do Nascimento Ribeiro Índice 2.3.5 Estudo da cinética de libertação do fármaco a partir das lentes poliméricas 41 CAPÍTULO 3 3 CINÉTICA DE LIBERTAÇÃO DO FÁRMACO 3.1 Cinética de libertação do maleato de timolol 3.2 Cinética de libertação do maleato de timolol em lentes com composição HEMA e MAA 3.2.1 46 47 Cinética de libertação do maleato de timolol de lentes com o fármaco incorporado por absorção 3.3 46 Cinética de libertação do maleato de timolol de lentes com o fármaco incorporado por oclusão 3.2.2 46 54 Cinética de libertação do maleato de timolol em lentes com composição HEMA e MMA 3.3.1 Cinética de libertação do maleato de timolol em lentes incorporadas por oclusão (monitorização contínua e descontínua) 3.3.2 59 59 Cinética de libertação do maleato de timolol em lentes incorporadas por absorção (monitorização contínua e descontínua) 62 CAPÍTULO 4 4 CONCLUSÕES GERIAS E SUGESTÕES PARA TRABALHO FUTURO 66 4.1 Conclusões gerais 66 4.2 Sugestões para trabalho futuro 68 ANEXOS A B Lentes poliméricas 74 A.1 Massa das lentes 74 A.2 Dimensões das lentes 75 A.3 Massa de maleato de timolol nas lentes incorporado por oclusão 79 Cinética de libertação do maleato de timolol em lentes com composição HEMA e MMA Elsa Alexandra do Nascimento Ribeiro 81 ix Índice B.1 Monitorização contínua da concentração de maleato de timolol no meio de libertação, para lentes com fármaco incorporado por oclusão B.2 Monitorização descontínua da concentração de maleato de timolol no meio de libertação, de lentes com fármaco incorporado por oclusão C Cálculo das incertezas C.1 82 83 Cálculo da incerteza associada à percentagem de absorção de água pelas lentes C.2 81 83 Cálculo das incertezas associadas às curvas de calibração do maleato de timolol 84 C.3 Cálculo da incerteza associada à concentração de maleato de timolol C.4 Cálculo da incerteza associada à massa de fármaco em solução, massa de 85 fármaco incorporada por soaking, massa de fármaco libertada no meio de libertação e percentagem de fármaco libertado x 86 Elsa Alexandra do Nascimento Ribeiro Índice de Figuras CAPÍTULO 1 Figura 1 – Perfil plasmático resultante da administração de um fármaco em três situações distintas (adaptado de Liechty WB, 2010). 3 Figura 2 – Esquema de sistemas de hidrogéis de libertação controlada de fármacos (Ferreira, 2010). 9 Figura 3 - Representação esquemática do processo de difusão versus erosão (adaptado de Barbosa, 2010). 9 Figura 4 – Esquema da libertação controlada de fármacos por um sistema controlado osmoticamente (adaptado de Industrial Laser Solutions). 10 CAPÍTULO 2 Figura 5 – Espectro de absorvância da solução de NaCl a 0,9% (m/v). 21 Figura 6 – Estrutura molecular do maleato de timolol. 23 Figura 7 – Espectro de absorvância obtido com uma solução de maleato de timolol proveniente dos laboratórios Cambrex. 25 Figura 8 – Espectro de absorvância obtido com uma solução de maleato de timolol proveniente dos laboratórios Sigma AldrichTM. 25 Figura 9 – Curva de calibração do maleato de timolol (Cambrex) obtida a λmáx de 292 nm. 28 Figura 10 – Curva de calibração do maleato de timolol (Sigma AldrichTM) obtida a λmáx de 293 nm. 29 Figura 11 – Esquema do molde usado na preparação das membranas poliméricas. 31 Figura 12 – Estrutura molecular do metacrilato de metilo (MMA). 34 Figura 13 – Estrutura molecular do ácido metacrílico (MAA). 34 Figura 14 – Espectros de absorvâncias obtidos durante o ensaio de degradação do maleato de timolol (Cambrex), realizado a 60°C. 40 Figura 15 – Esquema da instalação experimental. 42 Figura 16 – Ilustração da célula espectrofotométrica de fluxo contínuo. 42 Elsa Alexandra do Nascimento Ribeiro xi Índice de Figuras CAPÍTULO 3 Figura 17 – Monitorização contínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MAA (λmáx = 292 nm). 48 Figura 18 – Cinética de libertação do maleato de timolol incorporado por oclusão em lentes de HEMA e MAA, com monitorização contínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). 49 Figura 19 – Monitorização descontínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” de composição HEMA e MAA (λmáx = 292 nm). 51 Figura 20 – Cinética de libertação do maleato de timolol incorporado por oclusão em lentes de HEMA e MAA, com monitorização descontínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). 52 Figura 21 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por oclusão, em lentes de HEMA e MAA (λmáx = 292 nm). 53 Figura 22 – Cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MAA, com monitorização contínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). 55 Figura 23 – Cinética de libertação do maleato de timolol incorporado por absorção em lentes de HEMA e MAA, com monitorização descontínua da concentração de fármaco no meio de libertação (λmáx = 293 nm). 56 Figura 24 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MAA. 58 Figura 25 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por oclusão, em lentes de HEMA e MMA (λmáx = 293 nm). 60 Figura 26 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MMA (λmáx = 293 nm). xii 62 Elsa Alexandra do Nascimento Ribeiro Índice de Figuras ANEXOS Figura B.1 – Monitorização contínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MMA (λmáx = 293 nm). 81 Figura B.2 – Monitorização descontínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MMA (λmáx = 293 nm). Elsa Alexandra do Nascimento Ribeiro 82 xiii Índice de Tabelas CAPÍTULO 2 Tabela 1 – Reagentes utilizados na preparação das membranas poliméricas e no meio de libertação. 22 Tabela 2 – Equipamentos utilizados na preparação das lentes poliméricas e nos ensaios de libertação do fármaco. 22 Tabela 3 – Concentração de maleato de timolol nas soluções preparadas, para a obtenção da curva de calibração do fármaco proveniente dos laboratórios Cambrex, e respectivas absorvâncias. 27 Tabela 4 – Concentração de maleato de timolol nas soluções preparadas, para a obtenção da curva de calibração do fármaco proveniente dos laboratórios Sigma AldrichTM, e respectivas absorvâncias. 28 Tabela 5 – Composição das membranas poliméricas preparadas para utilização no estudo de libertação de um fármaco. 30 Tabela 6 – Massas e dimensões das lentes preparadas para o estudo de libertação de um fármaco. 32 Tabela 7 – Evolução da massa das lentes poliméricas com composição HEMA e MAA e da sua capacidade de absorção de água. 33 Tabela 8 – Evolução da massa das lentes poliméricas com composição HEMA e MMA e da sua capacidade de absorção de água. 33 Tabela 9 – Massas e dimensões das lentes preparadas para o estudo de libertação de um fármaco incorporado por oclusão. 36 Tabela 10 – Variação da concentração de maleato de timolol na solução onde são mergulhadas as lentes de HEMA e MAA para incorporação do fármaco por absorção. 37 Tabela 11 – Evolução da massa de fármaco em solução e massa de fármaco incorporada nas lentes de composição HEMA e MAA. 38 Tabela 12 – Variação da concentração de maleato de timolol na solução onde são mergulhadas as lentes de HEMA e MMA para incorporação do fármaco por absorção. 39 Tabela 13 – Evolução da massa de fármaco em solução e massa de fármaco incorporada nas lentes de composição HEMA e MMA. xiv 39 Elsa Alexandra do Nascimento Ribeiro Índice de Tabelas CAPÍTULO 3 Tabela 14 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA, com fármaco ocluso (0,435 ± 0,013 mg), obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. 50 Tabela 15 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA, com fármaco ocluso (0,435 ± 0,013 mg), obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. 52 Tabela 16 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA com fármaco absorvido, obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. 55 Tabela 17 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA com fármaco absorvido, obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. 57 Tabela 18 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco ocluso (0,315 ± 0,021 mg), obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. 61 Tabela 19 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco ocluso (0,315 ± 0,021 mg), obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. 61 Tabela 20 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco absorvido, obtidas dos ensaios com monitorização contínua da concentração de fármaco em meio de libertação. 63 Tabela 21 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco absorvido, obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. Elsa Alexandra do Nascimento Ribeiro 64 xv Índice de Tabelas ANEXOS Tabela A.1 – Massa individual das lentes de composição HEMA e MAA. 74 Tabela A.2 – Massa individual das lentes de composição HEMA e MMA. 75 Tabela A.3 – Diâmetro das lentes com composição HEMA e MAA. 76 Tabela A.4 – Diâmetro das lentes com composição HEMA e MMA. 77 Tabela A.5 – Espessura das lentes com composição HEMA e MAA. 78 Tabela A.6 – Espessura das lentes com composição HEMA e MMA. 79 Tabela A.7 – Massa das membranas poliméricas, massa média de uma lente e massa de maleato de timolol incorporado nas membranas e em uma lente das diferentes composições preparadas. xvi 80 Elsa Alexandra do Nascimento Ribeiro CAPÍTULO 1 INTRODUÇÃO CAPÍTULO 1 1 INTRODUÇÃO Ao longo deste capítulo serão apresentadas algumas ideias sobre a aplicação de materiais poliméricos como biomateriais, nomeadamente, na área da biomédica, e em sistemas de libertação controlada de fármacos. Abordar-se-ão também as formas de incorporação de fármacos em sistemas oftálmicos. 1.1 Sistemas de libertação controlada de fármacos Nas últimas décadas tem-se assistido a notáveis avanços na biotecnologia, que permitiram o isolamento, a síntese ou a produção biológica de novos fármacos. No entanto, a sua administração com sucesso é um desafio, uma vez que se verificam problemas relacionados com o difícil acesso aos respectivos locais de acção. Na sua origem estão diversos factores, nomeadamente, tempos de semivida biológica curtos, dificuldades em atravessarem as mucosas, biodegradação rápida pelas enzimas digestivas, poder antigénio, entre outros (Bodor, et al., 1987). A solução para os problemas apresentados surge na associação dos fármacos a sistemas transportadores que permitam, através da alteração de propriedades e comportamento in vivo, que estes se aproximem o mais possível de fármacos ideais, isto é, fármacos que apenas actuem nos locais de acção desejados, na quantidade desejada e durante o tempo necessário à terapêutica. A associação destas características numa só formulação traduz-se no aumento significativo do índice terapêutico do fármaco, ou seja, da razão entre a dose eficaz média e a dose tóxica média, reflectindo a eficácia, a selectividade e a segurança do fármaco (Bodor, et al., 1987). As formas farmacêuticas convencionais permitem uma libertação rápida e indiscriminada da substância activa. Estes sistemas são responsáveis por um aumento brusco da concentração do agente activo no sangue, sendo atingido um pico plasmático seguindo-se uma diminuição exponencial, o que obriga a que sejam efectuadas várias administrações de forma a restabelecer os níveis terapêuticos. Quando a concentração plasmática se encontra acima da concentração mínima eficaz (dose terapêutica), o fármaco exerce a sua acção terapêutica, mas quando a concentração desce abaixo desse limite, a sua acção é inútil no organismo. 2 Elsa Alexandra do Nascimento Ribeiro Introdução Porém, se a concentração do fármaco se encontra acima do limite superior da dose terapêutica torna-se tóxico e, portanto, para que a concentração do fármaco seja eficaz e não tóxica, ou seja, se localize dentro do intervalo terapêutico de forma continuada é necessário administrá-lo várias vezes ao dia, originando variações expressivas dos níveis de fármaco no organismo (Chien, 1992; Hillery, 2001). A Figura 1 mostra o comportamento da quantidade de um fármaco no organismo administrado de três formas distintas: numa só aplicação, em várias aplicações e incorporado num sistema de libertação controlada (SLC). Figura 1 – Perfil plasmático resultante da administração de um fármaco em três situações distintas (adaptado de Liechty WB, et al., 2010). Dado que as formas farmacêuticas clássicas apresentam eficácia reduzida, sendo necessária a administração regular de várias doses, para produzir o efeito terapêutico pretendido, surgiu a necessidade de se desenvolverem sistemas não convencionais de libertação de fármacos. Estes apresentam características que controlam a velocidade de libertação dos fármacos e que os direccionam para o tecido alvo, mantendo a actividade terapêutica durante o período desejável ou orientando-a especificamente. O conceito de libertação controlada de fármacos pressupõe não só a acção prolongada no tempo, mas a uma velocidade conhecida e pré-determinada. Ou seja, os sistemas de libertação controlada podem, de facto, controlar a libertação do fármaco no organismo sendo caracterizados por possuírem comportamentos previsíveis e reprodutíveis (Chien, 1992). Assim, a libertação controlada tem como principais objectivos: a obtenção de níveis terapêuticos do fármaco no organismo, através de um mecanismo de libertação a velocidade constante; o direccionamento específico do fármaco para tecidos ou órgãos alvo, não reagindo com tecidos ou órgãos adjacentes; a redução de efeitos secundários; a Elsa Alexandra do Nascimento Ribeiro 3 CAPÍTULO 1 diminuição da quantidade de fármaco utilizada para valores que correspondam ao estritamente necessário e a consequente diminuição do número de administrações. Como é evidente, para que se atinjam objectivos de tamanha especificidade, são necessárias estratégias diferentes e poucos sistemas conseguem, na prática, abrangê-las simultaneamente (Chien, 1992). A melhoria no desenvolvimento de SLC depende fortemente da selecção de um agente apropriado, capaz de abranger todas as características essenciais a um SLC ideal. Dentro das várias opções, os polímeros são os agentes que contemplam o maior número dessas propriedades, e, portanto, que possuem maior capacidade para desempenharem tais funções (Lopes, et al., 2005). Existem diversas formas de abordagem durante o desenvolvimento de SLC. As direccionadas para o tipo de material suporte ou para a tecnologia utilizada nos sistemas de libertação controlada: ligação/associação entre o sistema e o material transportado, mecanismo de libertação, via de administração e finalidade. Desta forma a classificação usual dos SLC é feita de acordo com os tipos de materiais, com as tecnologias utilizadas na formulação dos mesmos e com os modelos de libertação de fármacos. Numa abordagem física são formulados sistemas macroscópicos, usando diversos materiais, tais como, metais, polímeros e poliésteres (Chien, 1992). Este tipo de materiais pode complexar, adsorver, incorporar ou encapsular o fármaco, originando matrizes sólidas, membranas semipermeáveis e membranas microporosas, sistemas de micro reservatórios, cápsulas, entre outros. Nestes sistemas, idealmente, o fármaco vai-se libertando do suporte a uma velocidade controlada e constante. Numa perspectiva química a libertação controlada consiste na modificação química de fármacos. Através da modificação química podem obter-se moléculas com propriedades físico-químicas e farmacocinéticas alteradas e cuja actividade farmacológica é apenas recuperada in vivo. Neste caso são designados de pró-fármacos. O fármaco é transformado num derivado inactivo que só será reactivado após convenientes degradações, sequenciais e programadas, de modo a libertarem a substância activa no local de acção (Bodor, et al., 1987). Quando a modificação química produz uma molécula com novas propriedades físico-químicas, farmacocinéticas e farmacológicas, é originado um novo fármaco, análogo ao fármaco original (Bodor, et al., 1987). Neste novo fármaco, a modificação química inserida não deve inactivar a substância activa e a molécula inicial não é regenerada in vivo. A alteração das propriedades físico-químicas através da modificação química pode facilitar o acesso ao local de acção, objectivo desejável neste tipo de formulações. Podem ainda ser alteradas características como a toxicidade e a selectividade, uma vez que são alteradas as propriedades farmacocinéticas inibindo a formação de metabolitos. 4 Elsa Alexandra do Nascimento Ribeiro Introdução Numa vertente Bioquímica e Biotecnológica, são utilizados materiais biológicos e/ou biocompatíveis tais como: macromoléculas de origem natural, células e ainda sistemas coloidais lipídicos e poliméricos (lipossomas, microsferas, nanopartículas). A inovação destes sistemas reside nos componentes utilizados na sua formulação, que, sendo, essencialmente, materiais de origem natural, têm a vantagem de não provocarem reacções imunológicas indesejáveis, e possuem características que os tornam veículos eficazes no transporte de fármacos instáveis, como, os de natureza proteica e outros de origem biotecnológica. Tal como exposto, para além da natureza do suporte do fármaco, também o seu mecanismo de libertação é uma característica que permite diferenciar os sistemas de libertação controlada. Existem sistemas com libertação controlada pela difusão, pela erosão, osmoticamente e sistemas que são regulados pelas necessidades do organismo designados por sistemas pulsáteis. Os sistemas de libertação mais comummente utilizados são os sistemas controlados por difusão, existindo, contudo, alguns SLC cujo mecanismo de libertação depende da associação de vários factores. 1.1.1 Sistemas controlados pela difusão Difusão é o processo pelo qual se dá o transporte de matéria de um local para outro no interior de um dado sistema, devido a um gradiente de concentração. A lei de Fick descreve o processo de difusão através de uma equação que permite avaliar a velocidade de transferência por unidade de superfície, da substância a difundir e que é representada pela equação (1). (1) traduz a velocidade de difusão, coeficiente de difusão, é a massa de fármaco transportado no tempo , é a concentração de fármaco e éo a direcção da difusão do fármaco. O segundo membro da equação carece de um sinal negativo, pelo facto de a difusão ocorrer no sentido contrário ao do aumento de concentração. Em soluções de fármaco diluídas, pode admitir-se constante (Coelho, 2007). Elsa Alexandra do Nascimento Ribeiro 5 CAPÍTULO 1 Quando o SLC é composto por membranas ou matrizes poliméricas, o coeficiente de difusão depende, não só, da concentração do fármaco, mas também, de outros factores, como a densidade de reticulação, o grau de ramificação, o grau de cristalinidade e o tamanho das zonas cristalinas (Coelho, 2007). Os sistemas de libertação controlados pela difusão são, de todos, os mais amplamente utilizados e com variadíssimas aplicações. Existem dois tipos de sistemas de libertação controlados pela difusão: os sistemas reservatório e os sistemas matriciais. Teoricamente são controlados pela lei da difusão de Fick, embora, cineticamente tenham padrões mecanísticos diferentes. Seguidamente serão expostas algumas das principais características destes SLC, assim como alguns exemplos dos sistemas que pertencem a estas categorias. Os sistemas reservatório são constituídos por um núcleo, no qual está contida a substância activa, revestido por uma membrana polimérica. É através da membrana que envolve o fármaco, que este vai sendo libertado por difusão sendo, essencialmente, as características da membrana e da substância activa que controlam a libertação. O mecanismo de libertação controlada em sistemas reservatório pode, também, ocorrer “por camadas”, ou seja, o sistema é composto por camadas alternadas de substância activa e polímero hidrossolúvel. O fármaco é libertado gradualmente, à medida que cada camada de polímero se dissolve, pelo que a velocidade de libertação do fármaco é regulada pela velocidade de dissolução do polímero no meio, factor que é totalmente dependente da espessura das camadas poliméricas (Coelho, 2007). Os sistemas de libertação de fármaco microencapsulado são um exemplo deste tipo de SLC. Estes são constituídos por um núcleo que contém o agente activo envolvido por uma camada de polímero biocompatível de espessura variável (Suave, et al., 2006). As microcápsulas são formadas por uma camada de um agente encapsulante, normalmente um material polimérico que actua como um filme protector, isolando a substância activa e evitando o efeito da sua exposição inadequada. Através de alterações das características físico-químicas do meio (temperatura, pH, força iónica), ocorre a rotura mecânica da microcápsula e o agente activo é libertado. No entanto, o agente activo pode também ser libertado por biodegradação e por difusão. A principal vantagem que decorre da utilização deste tipo de sistemas de libertação controlada é a taxa de libertação constante que se obtém durante longos períodos de tempo. 6 Elsa Alexandra do Nascimento Ribeiro Introdução Os lipossomas são, um outro exemplo de, sistemas de libertação controlada que pertence ao grupo dos sistemas reservatório. São estruturas constituídas por membranas lipídicas organizadas em bicamadas, fechadas e concêntricas, obtidas a partir de dispersões de lípidos polares insolúveis em água. As bicamadas lipídicas estão separadas entre si por espaços aquosos, sendo, também, aquoso o espaço interno do lipossoma. São impermeáveis a macromoléculas, apresentando baixa permeabilidade a moléculas carregadas. Os lipossomas têm características que os tornam sistemas de incorporação e transporte apropriados, tanto para substâncias solúveis em água, como para substâncias solúveis em solventes orgânicos. As substâncias hidrofílicas são agregadas ao espaço interno aquoso dos lipossomas e as hidrofóbicas na bicamada lipídica. As substâncias de solubilidade intermédia apresentam problemas de estabilização, necessitando de técnicas de formulação especiais, como por exemplo, manipulação do pH ou promoção da complexação da substância no compartimento interno dos lipossomas. Pelo exposto, pode afirmar-se, que salvo raras excepções, é possível incorporar qualquer tipo de substância, independentemente do seu peso molecular, carga eléctrica e solubilidade. Os lipossomas são formados sobretudo por lípidos, muitos de origem natural, o que proporciona a estes SLC baixa toxicidade, tendo, também, a possibilidade de direccionamento específico para locais onde se pretende que exerçam a sua acção através de marcação superficial, nomeadamente por ligação a anticorpos. Nos sistemas matriciais o fármaco encontra-se distribuído num sistema formado por cadeias de uma ou várias substâncias polimerizadas, hidrofílicas ou inertes, que definem o perfil de libertação da substância activa que ocorre do exterior progredindo para o interior da matriz de acordo com a velocidade de degradação das camadas superficiais (Lopes, et al., 2005). A dissolução do agente activo ocorre após a “invasão” do fluido de dissolução através dos poros da matriz polimérica, seguindo-se a difusão lenta do fármaco. O factor que limita a velocidade de libertação do agente activo nestes sistemas é a entrada do fluido de dissolução na matriz, que pode ser favorecida pela incorporação de agentes molhantes, seguido de difusão e de erosão. Ao contrário do que acontece nas matrizes inertes ou hidrofílicas, nas matrizes lipídicas ou hidrofóbicas a libertação do fármaco é controlada pela difusão através dos poros ou pela degradação da própria matriz, o que depende das suas características físico-químicas. Em termos de classificação, as membranas lipídicas são, muitas vezes, incluídas na classe das matrizes inertes, dado que, também não alteram a sua estrutura, quando em contacto Elsa Alexandra do Nascimento Ribeiro 7 CAPÍTULO 1 com a água, e o seu mecanismo de libertação é análogo (Lopes, et al., 2005). Embora as matrizes lipídicas sejam aparentemente uma alternativa às matrizes hidrofílicas, as primeiras apresentam problemas de estabilidade nas condições normais de acondicionamento. Pois os compostos lipídicos são de natureza lábil, podendo sofrer alterações ao nível da sua estrutura física, levando ao seu endurecimento com o tempo, provocando a diminuição da velocidade de libertação do fármaco. (Coelho, 2007). Os sistemas matriciais apresentam inúmeras vantagens como a versatilidade, eficácia, baixo custo e produção simples, o que faz destes sistemas os mais comummente utilizados e os mais estudados como formas alternativas aos sistemas convencionais. Uma grande vantagem que advém, também, da utilização destes sistemas é a incorporação de elevadas quantidades de fármaco. Apesar da simplicidade de formulação, estes sistemas apresentam como grande desvantagem a possível rotura brusca da matriz, ocorrendo a libertação descontrolada do fármaco e a necessidade de intervenção cirúrgica, para retirar a matriz após libertação completa do fármaco. No entanto, estão a ser estudadas novas formulações para evitar a necessidade de extracção da matriz do organismo. Nomeadamente, matrizes poliméricas biodegradáveis adequadas ao controlo da taxa de libertação do fármaco. Os sistemas de hidrogéis são um exemplo de sistemas matriciais. Os hidrogéis são estruturas poliméricas tridimensionais, geralmente reticuladas, altamente hidrofílicas, com grande capacidade para absorver água (ou fluidos biológicos) sem se dissolver nela. Podem ser quimicamente estáveis ou degradarem-se com o tempo, podendo, no limite, desintegrar-se (Almeida, 2010). A capacidade de absorção de água, que os hidrogéis, normalmente apresentam, pode ocorrer de uma forma natural ou caso se tratem de hidrogéis inteligentes, depende de factores externos como o pH ou a temperatura, o que facilita a adequação destes sistemas ao meio onde vão libertar o fármaco. Hidrogéis inteligentes são materiais poliméricos cuja característica que os diferencia dos hidrogéis convencionais, é a de variar a sua capacidade de absorção consoante os estímulos e necessidades do meio. Assim, a cadeia polimérica pode expandir em resposta a mudanças no ambiente em que se encontra, nomeadamente, mudanças de temperatura, pH, composição do solvente, força iónica do meio, entre outras. Nos sistemas de libertação controlada constituídos por hidrogéis, o fármaco é incorporado na matriz polimérica uniformemente e aquando o contacto da matriz hidrofílica com o meio aquoso ocorre a sua expansão, ou seja, as cadeias poliméricas tornam-se mais flexíveis libertando o fármaco por difusão (Figura 2). 8 Elsa Alexandra do Nascimento Ribeiro Introdução Figura 2 – Esquema de sistemas de hidrogéis de libertação controlada de fármacos (Ferreira, 2010). O sistema de libertação controlada de fármacos preparado e analisado neste estudo era de origem polimérica, composto por uma matriz de hidrogéis. O agente activo foi distribuído uniformemente na matriz polimérica hidrofílica reticulada, no estado sólido e, quando esta entrou em contacto com um meio aquoso ocorreu a sua expansão e consequente libertação do fármaco contido. 1.1.2 Sistemas controlados por erosão Os sistemas controlados por erosão podem apresentar-se sob duas formas, envolvidos por uma membrana erodível de forma controlada ou incorporando o fármaco numa matriz erodível. A libertação do fármaco ocorre pela dissolução do polímero que compõe a membrana ou matriz que envolvem a substância activa. O perfil de libertação do fármaco depende fortemente da forma como se dá a erosão do polímero. Quando a substância activa é muito solúvel, a sua libertação é controlada pelo processo de difusão, mas para fármacos não solúveis (ou pouco solúveis) a libertação é fortemente dependente do processo de erosão (Coelho, 2007). A Figura 3 representa o processo de difusão do fármaco através da matriz e a libertação do fármaco pela erosão da matriz. Figura 3 - Representação esquemática do processo de difusão versus erosão (adaptado de Barbosa, 2010). Elsa Alexandra do Nascimento Ribeiro 9 CAPÍTULO 1 A erosão pode ser classificada como homogénea (se ocorre no interior do sistema) ou heterogénea (se ocorre à superfície do sistema). A erosão homogénea ocorre de uma forma aleatória e depende do volume da matriz, sendo difícil prever a velocidade a que ocorre a difusão. Na erosão heterogénea, esse problema já não se coloca, pois a velocidade de libertação da substância activa é proporcional à taxa de degradação do polímero, pelo que elegendo uma geometria de superfície apropriada pode obter-se uma cinética de libertação de ordem zero (Coelho, 2007). 1.1.3 Sistemas controlados osmoticamente Os sistemas osmóticos são constituídos por um núcleo osmótico, no qual está contido o fármaco, revestido por uma membrana semipermeável à água, que tem um pequeno orifício. No interior da membrana existe uma elevada concentração de um agente osmótico, que estimula a entrada de água através da membrana. Como consequência o volume do compartimento aumenta, sendo o fármaco forçado a sair pelo orifício de libertação, devido ao aumento da pressão osmótica. Na Figura 4 é exemplificado o processo descrito. Figura 4 – Esquema da libertação controlada de fármacos por um sistema controlado osmoticamente (adaptado de Industrial Laser Solutions). Com a utilização destes sistemas obtêm-se taxas de libertação constantes e mais elevadas que por difusão, podem libertar-se macromoléculas e a taxa de libertação do fármaco é independente das propriedades do agente activo. 10 Elsa Alexandra do Nascimento Ribeiro Introdução 1.1.4 Sistemas pulsáteis Durante os processos de terapia, nem sempre é favorável que a concentração do fármaco se mantenha constante no organismo, pelo que existe a necessidade de criação de sistemas cuja libertação do fármaco ocorra consoante a necessidade do organismo. Desta necessidade, surgiram os sistemas de libertação pulsáteis, cujo modo de actuação pressupõe a libertação de doses múltiplas em intervalos distintos e pré-definidos de acordo com o ritmo circadiano do organismo. Aquando a sua administração existe um período no qual se encontra inactivo, designado de período de latência, após o qual, se pretende que o fármaco seja libertado de uma forma periódica. Os mecanismos de acção dos sistemas pulsáteis podem suceder de forma controlada no tempo, induzida por estímulos como a temperatura ou o pH e regulada exteriormente por magnetismo, ultra-sons ou efeito eléctrico (Barbosa, 2010). Os comprimidos com multicamadas são das principais aplicações destes sistemas. O fármaco é incorporado por camadas de forma a obter várias taxas de libertação, para que a libertação se dê de uma forma intermitente. 1.2 Aplicações biomédicas dos sistemas de libertação controlada O uso de sistemas de libertação de fármacos tem sido muito relevante na área farmacêutica, pois pode proporcionar alternativas terapêuticas farmacologicamente mais eficientes, e com efeitos colaterais bastante reduzidos, a partir da reintrodução de fármacos convencionais, muitas vezes descartados pela sua potencial toxicidade. Uma vez que a produção de novos fármacos é altamente dispendiosa, a possibilidade de manipular fármacos já existentes e associá-los a sistemas de libertação controlada, confere a estes sistemas uma atenção especial dos mercados, tornando-se um tema de destaque nas últimas décadas no sector farmacêutico, devido aos grandes benefícios terapêuticos e às vantagens económicas. Os sistemas de libertação controlada de fármacos começam a ser amplamente aplicados na maioria das áreas da medicina, como a cardiologia, ginecologia, imunologia, odontologia e oftalmologia (área de interesse deste estudo), entre outras. Estes sistemas podem ser usados para aplicação local (intra-ocular, dérmica, intra-uterina, bucal), pelas vias intravenosa e oral e ainda por via subcutânea sob a forma de implantes. Elsa Alexandra do Nascimento Ribeiro 11 CAPÍTULO 1 Existem várias aplicações biomédicas destes sistemas transportadores de fármacos, tais como, implantes subcutâneos biodegradáveis utilizados no tratamento do carcinoma da próstata (Zoladex®,Zeneca), dispositivos intra-uterinos para contracepção (Progestasert® IUD, Alza), implantes subdérmicos para libertação de levonorgestrel, como controlo de fertilidade (Norplant®,Wyeth-Ayerst), sistemas transdérmicos para libertação prolongada de nitroglicerina, para a prevenção da angina de peito (De ponit®, Schwarz; Minitran®,3M, Nitrodic®,Searle), sistema de libertação gastrointestinal de nifedipina para o tratamento de angina de peito e hipertensão (Procardia XL®,Pfizer), sistemas de libertação de insulina em pacientes diabéticos, utilizando a degradação do sistema para permitir a libertação do composto no organismo do doente, implante ocular para libertação de pilocarpina, como controlo do glaucoma (Ocusert system®,Ciba), entre outras. Uma vez que o sistema de libertação controlada de fármaco analisado neste estudo tinha como objectivo a aplicação em oftalmologia, a secção seguinte foi orientada para esta área. 1.2.1 Aplicações oftalmológicas A maioria dos fármacos utilizados em oftalmologia é aplicada topicamente, sob a forma de gotas. Trata-se de uma terapêutica de fácil aplicação e de baixo custo. No entanto, esta via de administração revela-se ineficaz, pois dada a baixa biodisponibilidade que apresenta (apenas 5% do fármaco contido nas gotas aplicadas penetra na córnea e atinge os tecidos intra-oculares) é necessária a aplicação repetida do fármaco no olho, ao longo do tempo (Carreira, 2008). Também, quando a administração do fármaco oftalmológico se faz por via de injecções intravenosas, a biodisponibilidade não é superior a 1 - 3%, no local de acção desejado, a córnea (Rouxinol, 2009). No sentido de ultrapassar as dificuldades apresentadas pelas formas farmacêuticas convencionais, sistemas de libertação controlada de fármacos têm sido estudados para aplicação em oftalmologia. A utilização destes sistemas, nesta área, apresenta-se como uma opção válida, pois permite que a quantidade de fármaco libertado, continuamente, permaneça dentro dos limites terapêuticos, aumentando o seu tempo de residência no olho, reduzindo efeitos colaterais (como a dissipação do fármaco para a corrente sanguínea) e o número de administrações necessárias, sendo o fármaco direccionado para o local de acção pretendido. As lentes de contacto impregnadas com fármaco têm sido alvo de diversos estudos e apresentam-se como uma solução aos problemas acima mencionados, tendo sido este o tipo de sistema seleccionado para desenvolver o presente estudo. 12 Elsa Alexandra do Nascimento Ribeiro Introdução Relativamente ao fármaco usado neste estudo, optou-se por um fármaco da gama de fármacos utilizados na redução de problemas de pressão intra-ocular, o maleato de timolol, uma vez que apresenta elevada eficácia no tratamento de glaucoma. O glaucoma é uma doença que causa danos no nervo óptico, sendo o maior factor de risco a pressão intra-ocular. Esta doença é, normalmente, tratada com ß-bloqueadores através da aplicação tópica de soluções oftálmicas para redução da pressão intra-ocular, como o cloridrato de metilpropanolol, cloridrato de carteolol, betaxolol e o maleato de timolol. 1.3 Estudos efectuados com sistemas de libertação controlada de fármacos com aplicação em oftalmologia Os estudos da cinética de libertação de fármacos em sistemas de libertação com aplicação oftalmológica são, frequentemente, desenvolvidos através da monitorização descontínua do fármaco libertado em meio aquoso. O método de monitorização descontínua é usualmente realizado com duas metodologias muito semelhantes, cuja principal diferença está na reposição da amostra recolhida para análise, ao meio de libertação, ou na sua substituição por meio de libertação fresco. O sistema com o fármaco incorporado é colocado num frasco com um volume conhecido de solução de libertação, normalmente solução PBS (solução tampão fosfato salino) ou soro fisiológico, para recriar o ambiente ocular. Para analisar a concentração de fármaco libertado, são recolhidas, periodicamente, amostras do meio de libertação que logo após a sua análise são repostas à solução ou são recolhidas amostras e um volume equivalente de meio de libertação fresco é adicionado ao sistema. Os estudos realizados e publicados por Cordeiro (2007), Rouxinol (2009) e Fonseca (2003) tiveram como principal objectivo a preparação e validação de sistemas de libertação controlada de fármacos, com aplicação oftalmológica. Para tal, realizaram estudos de cinética de libertação do fármaco recorrendo às metodologias referidas. Os métodos de monitorização descontínua da concentração de fármaco no meio de libertação apresentam algumas desvantagens, tal como, a variação, ainda que momentânea, de volume, ou a variação de concentração, e a necessidade de previsão do comportamento do sistema de libertação do fármaco entre a recolha de amostras. Para ultrapassar tais problemas, neste trabalho, foi levado a cabo o estudo da cinética de libertação de um fármaco num meio de libertação, onde a concentração de fármaco em solução foi monitorizada continuamente, mantendo-se um fluxo contínuo e o volume total da solução constante. Elsa Alexandra do Nascimento Ribeiro 13 CAPÍTULO 1 1.4 Propriedades dos polímeros: aplicação em sistemas de libertação controlada de fármacos A grande maioria, dos sistemas de libertação controlada de fármacos, utilizados actualmente, são de base polimérica. Estes biomateriais são alvo de diversos estudos, focados na necessidade de modificar algumas propriedades que permitam o controlo do fluxo de libertação do agente activo. O interesse nos polímeros como veículos de fármacos prende-se com a sua facilidade de preparação, a sua natureza elástica (semelhante à dos tecidos naturais), a grande variabilidade de compostos obtidos por reacções de polimerização, propriedades físicas e mecânicas, a possibilidade de modificação de superfícies, a sua biocompatibilidade e fácil biodegradação. A biodegradação é uma característica que torna interessante a utilização dos polímeros nestes sistemas, pois a remoção do material após a acção terapêutica do fármaco contido, torna-se desnecessária, uma vez que o polímero se degrada in vivo, em fragmentos menores, que podem ser excretados pelo organismo. A degradação pode ocorrer através de um processo biológico activo (através de enzimas), por meio passivo (como resultado de reacções químicas) ou simplesmente pela solubilização do polímero (Almeida, 2010). É importante que com a degradação do polímero não ocorra a formação de metabolitos tóxicos. Relativamente às propriedades que os polímeros devem apresentar, para que possam ser aplicados em sistemas de libertação de fármacos, devem ter-se em atenção dois critérios: as características químicas não devem comprometer a acção dos princípios activos e as características físicas devem ser resistentes e reprodutíveis em cada lote (Mauro, 2007). Na preparação de um sistema polimérico de libertação de fármacos para aplicação oftálmica, outras qualidades devem ser consideradas, tais como, transparência, flexibilidade, biocompatibilidade, não tóxico, permeabilidade, hidrofilicidade, lubrificação, adesão, solubilidade e conforto para o paciente. 14 Elsa Alexandra do Nascimento Ribeiro Introdução 1.4.1 Composição das matrizes poliméricas estudadas O sistema de libertação de fármacos utilizado neste estudo é constituído por matrizes poliméricas, nas quais foi incorporado o fármaco. Estas foram preparadas com metacrilato de 2-hidroxietilo (HEMA), componente maioritário, ao qual se adicionou ácido metacrílico (MAA) ou metacrilato de metilo (MMA). O HEMA é um hidrogel altamente hidrofílico, do grupo dos hidrogéis superabsorventes, isto é, tem uma capacidade de absorção de água acima dos 99,5%. Estes hidrogéis podem dividir-se em duas categorias, de acordo com o tamanho dos poros e a sua estrutura. As diferentes porosidades que o hidrogel de composição HEMA pode apresentar, resultam do processo de polimerização a que este é submetido. Quando o HEMA é sujeito a polimerização em massa, ocorre a formação de um polímero rígido transparente, que quando é imerso em água, incha tornando-se flexível. (M. Malmonge, et al., 1997). A presença do HEMA em copolímeros favorece a biocompatibilidade dos materiais aos quais é adicionado. Sendo um hidrogel sintético, apresenta óptimas propriedades mecânicas, pelo que, da sua adição aos outros componentes, resulta uma matriz polimérica com propriedades adequadas à sua aplicação como sistemas de libertação de fármacos (Casimiro, 2008). O ácido metacrílico (MAA) é um composto orgânico, que quando em solução se torna incolor e viscoso. É solúvel em água e miscível na maioria dos solventes orgânicos. O MAA é produzido industrialmente em larga escala, como um percursor de ésteres, nomeadamente de metacrilato de metilo (MMA) e de poli metacrilato de metilo (PMMA). A principal aplicação deste composto é na produção destes polímeros, sendo também utilizado, na produção de lentes de contacto. O metacrilato de metilo (MMA) é um éster metílico proveniente do ácido metacrílico. A principal aplicação deste composto orgânico é a produção de plásticos (PMMA). Quando em solução, é incolor, volátil e apresenta solubilidade moderada em água. Elsa Alexandra do Nascimento Ribeiro 15 CAPÍTULO 1 1.5 Metodologias de incorporação do fármaco em lentes oftalmológicas Os métodos de imobilização de fármaco em lentes oftalmológicas podem ser muito variados, existindo dois grandes grupos, os químicos e os físicos. Dos métodos químicos são exemplo, a ligação covalente e a imobilização por interacções iónicas ou adsorção. Os métodos de incorporação de fármaco por oclusão, absorção e encapsulamento são exemplos de formas de imobilização física do fármaco. A ligação covalente é um método através do qual ocorre a ligação química entre o fármaco e os grupos funcionais do suporte. É um procedimento simples no qual as propriedades físicas e químicas das substâncias envolvidas no processo sofrem alterações, muitas vezes, irreversíveis. A imobilização do fármaco por interacções iónicas caracteriza-se pelas ligações iónicas que se obtêm entre a substância activa e material de suporte. É um método pouco utilizado, pois envolve procedimentos de elevado controlo da temperatura, pH, polaridade e força iónica, o que dificulta o controlo da libertação do fármaco, uma vez que este se solta com facilidade do suporte. O método mais simples de incorporação de fármaco é designado por absorção ou soaking e consiste, essencialmente, em colocar as lentes de contacto numa solução de fármaco de concentração conhecida, de modo a que as lentes absorvam a água que, por sua vez, transporta o fármaco. A impregnação de fármaco por oclusão consiste no aprisionamento da substância activa no interior do polímero. Para tal, coloca-se o fármaco na mistura reaccional junto com os monómeros, permitindo que o fármaco fique retido no interior da matriz polimérica. O revestimento das partículas da substância activa por uma membrana denomina-se por encapsulamento. Nestes sistemas, o fármaco encontra-se livre em solução, apenas limitado pela membrana que o rodeia. Neste trabalho foram utilizados métodos físicos de imobilização do fármaco, nomeadamente a oclusão e absorção do fármaco pelo polímero. 16 Elsa Alexandra do Nascimento Ribeiro Introdução 1.6 Objectivos Com o presente trabalho pretendeu-se: (i) Implementar uma metodologia experimental para determinação da concentração de fármaco no meio de libertação, mantendo um fluxo contínuo do meio a analisar, em circuito fechado, que passasse através de uma cuvete localizada no espectrofotómetro. (ii) Monitorizar continuamente a concentração de fármaco em solução durante a sua libertação da matriz polimérica, mantendo o volume total da solução constante. (iii) Comparar a metodologia experimental implementada com a metodologia geralmente usada, onde a monitorização da concentração do fármaco em solução é descontínua. (iv) Preparar sistemas de libertação controlada de fármacos por diferentes métodos de incorporação do princípio activo, com aplicação oftalmológica. (v) 1.7 Estudar a cinética de libertação do princípio activo (o maleato de timolol). Organização da tese A tese organiza-se em quatro capítulos onde se enquadra e descreve o trabalho desenvolvido. No Capítulo 2 é descrito o processo em estudo, são enumerados os reagentes e principais equipamentos utilizados na preparação das matrizes poliméricas e no processo de monitorização da concentração de fármaco libertado. As metodologias adoptadas no estudo da libertação do maleato de timolol de lentes de contacto são pormenorizadamente descritas. No Capítulo 3 são apresentados os resultados obtidos do estudo da cinética de libertação do fármaco. Este capítulo foi organizado tendo por base as diferentes composições de matrizes poliméricas estudadas, seguindo-se o processo de incorporação do fármaco e finalmente os diversos métodos de monitorização da concentração do fármaco libertado. No Capítulo 4 são apresentadas as conclusões obtidas do estudo realizado e enumerados alguns aspectos para trabalhos a desenvolver no futuro. Elsa Alexandra do Nascimento Ribeiro 17 18 Elsa Alexandra do Nascimento Ribeiro CAPÍTULO 2 PROCESSO, FÁRMACO E METODOLOGIAS CAPÍTULO 2 2 PROCESSO, FÁRMACO E METODOLOGIAS Neste capítulo são enumerados os reagentes e principais equipamentos utilizados no processo de produção dos hidrogéis, concretamente, nas lentes poliméricas empregadas neste estudo, assim como, no processo de monitorização da libertação de fármaco das mesmas. Também neste capítulo são referidas as principais características do fármaco escolhido, o maleato de timolol, e as metodologias aplicadas em todos os estágios desta investigação. 2.1 Processo Nesta secção são contemplados os reagentes e equipamentos utilizados durante todo o processo, desde a preparação das lentes poliméricas até aos ensaios de libertação do fármaco. Na formulação das membranas sólidas usadas no estudo de libertação controlada do fármaco, foram utilizadas duas composições. O polímero usado em maior quantidade é o metacrilato de 2-hidroxietilo (HEMA), ao qual se adiciona, numa formulação, o ácido metacrílico (MAA) e, na outra, metacrilato de metilo (MMA). Para promover a reacção de polimerização, foi adicionado dimetacrilato de etilenoglicol (EGDMA) como reticulante e azobisisobutironitrilo (AIBN) como iniciador da reacção de polimerização por adição. O estudo de libertação do fármaco foi levado a cabo usando uma solução de NaCl 0,9% (m/v), com pH 6,56 ± 0,31, como meio de libertação. Esta é a composição típica do soro fisiológico, que se aproxima às características da lágrima do olho humano, local de aplicação do objecto deste estudo. Para apurar se o espectro de absorvâncias do soro fisiológico interferiria com o correspondente ao maleato de timolol e, portanto, com a determinação da concentração de fármaco libertado, foi feita uma determinação do espectro da solução de NaCl. Para tal, foi preparada a solução de NaCl a 0,9% (m/v) e foram registadas, através do computador acoplado ao espectrofotómetro (Unicam Helios Gamma & Delta), as absorvâncias correspondentes a cada comprimento de onda na gama de radiação ultravioleta (entre 200 e 400 nm). O espectro foi realizado para tais comprimentos de onda, pois como se apresenta na secção seguinte, o comprimento de onda de absorvância máximo do fármaco encontra-se nesta gama de radiação. 20 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias Na Figura 5 encontra-se a representação do espectro obtido com a solução de NaCl. 2,0 Absorvância 1,5 1,0 0,5 0,0 200 250 300 350 400 λ (nm) Figura 5 – Espectro de absorvância da solução de NaCl a 0,9% (m/v). Pela visualização do gráfico da Figura 5, é evidente que, a absorvância do soro fisiológico na gama de comprimentos de onda considerada, não é relevante (correspondendo em média a uma absorvância de 0,06), não interferindo de forma significativa na determinação da concentração do fármaco durante o estudo de libertação. 2.1.1 Reagentes e equipamentos As membranas poliméricas foram preparadas em dois estágios distintos, isto é, prepararam-se inicialmente as membranas com ácido metacrílico, MAA, e posteriormente as membranas com metacrilato de metilo, MMA, sendo que os reagentes comuns às duas formulações não pertenciam ao mesmo lote. Na Tabela 1, são enumerados todos os reagentes utilizados na preparação das membranas poliméricas e no meio de libertação do fármaco. Elsa Alexandra do Nascimento Ribeiro 21 CAPÍTULO 2 Tabela 1 – Reagentes utilizados na preparação das membranas poliméricas e no meio de libertação. Reagente Grau de Pureza Peso Molecular Fabricante NaCl 99,5% 58,44 Panreac AIBN (iniciador) > 98,0% 164,21 Iluka HEMA e MAA maleato de timolol 432,50 Cambrex EGDMA (reticulante) 98,0% 198,22 s/ ref. HEMA 97,0% 130,14 MAA 99,0% 86,09 HEMA e MMA maleato de timolol Sigma Aldrich TM Merck 432,50 Sigma Aldrich TM EGDMA (reticulante) 98,0% 198,22 Acrós Organics HEMA 97,0% 130,14 Acrós Organics MMA 99,0% 100,12 Acrós Organics Seguidamente são apresentados os equipamentos, de maior relevo, utilizados neste trabalho, desde a concepção das lentes poliméricas até aos ensaios de libertação do fármaco. Tabela 2 – Equipamentos utilizados na preparação das lentes poliméricas e nos ensaios de libertação do fármaco. Equipamento Marca Modelo Balança Mettler Toledo Vaporizador Celta Germany AG204 GS101 Craveira digital HELIOS Espectrofotómetro Spectronic Unicam Bomba Peristáltica Ismatec SA ± 0,1 mg ± 0,01 mm 21001043 (150 mm) Unicam Helios Gamma & ± 0,001 Delta ISM054 A Termómetro G105 DIN 12785 1h/G7-h Banho Termostatizado ISCO GTR 190 Placa de Agitação Magnética IKA Labortechnik RH 2.2 Precisão ± 0,5 °C Fármaco – Maleato de timolol Como referido ao longo do Capítulo 1, o maleato de timolol foi o fármaco seleccionado para este estudo. É um medicamento oftálmico de aplicação tópica, usado como agente bloqueador dos receptores ß-adrenérgicos, para redução da pressão intra-ocular. A fórmula molecular do maleato de timolol é a seguinte: C13H24N4O3S•C4H4O4 22 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias A molécula de maleato de (S)-1-tert-butilamino-3-(4-morfolino-1,2,5-tiadiazol-3-iloxi) propano-2-ol possui um átomo de carbono assimétrico, sendo a sua estrutura molecular a seguidamente apresentada na Figura 6. Figura 6 – Estrutura molecular do maleato de timolol. A formulação terapêutica deste fármaco apresenta-se sob a forma particulada (pó) de cor branca, inodoro e solúvel em água, metanol e etanol. É um fármaco estável à temperatura ambiente. A concentração de timolol na solução aplicada não deve exceder os 0,5%, o que corresponde a uma gota da solução com cerca de 0,2 mg de maleato de timolol, em cada administração, sendo aconselhada a utilização de duas vezes diárias (MERCK SHARP & DOHME DE MÉXICO, S. A. de C. V.). Quando em solução, o maleato de timolol, é susceptível de ser quantificado, por exemplo, por espectrofotometria de absorção, método utilizado neste estudo. Este método permite determinar a concentração de fármaco em solução aquosa, pois existe uma relação directa entre o número de moléculas de fármaco presentes em solução e a sua absorvância. O método de espectroscopia de absorção baseia-se na lei de Beer-Lambert. Esta lei traduz a relação entre a absorvância (quantidade de luz absorvida) de uma solução e a sua concentração, quando atravessada por um feixe de luz. A quantidade de radiação absorvida é tanto maior quanto mais concentrada for a solução por ela atravessada. Assim, para um λ (comprimento de onda) fixo, pela Lei de Beer-Lambert vem: (2) Sendo molar, a absorvância, a luz incidente, a luz transmitida, o coeficiente de extinção a concentração da substância e a distância percorrida pelo feixe luminoso através da amostra. Como é uma medida do poder de absorção do composto, este é constante para uma dada solução. Sendo também constante o comprimento da cuvete, a absorvância, para um determinado comprimento de onda λ, é directamente proporcional à concentração da solução contida na cuvete. Elsa Alexandra do Nascimento Ribeiro 23 CAPÍTULO 2 2.2.1 Determinação do comprimento de onda máximo Tal como já foi referido, o estudo da cinética de libertação do maleato de timolol foi realizado numa solução de NaCl a 0,9% (m/v), composição característica do soro fisiológico, sendo a concentração de fármaco no meio de libertação determinada por espectrofotometria UV/Vis. Para isso, foi necessário obter um espectro de absorvâncias do fármaco utilizado nos ensaios, com o objectivo de se identificar o comprimento de onda para o qual a absorvância é máxima, designado por comprimento de onda máximo (λmáx). É relevante referir que, como a preparação das membranas poliméricas ocorreu em dois estágios, o fármaco utilizado não teve a mesma proveniência. Foi utilizado maleato de timolol fornecido pelos laboratórios Cambrex na preparação das lentes cuja composição integra HEMA e MAA com fármaco ocluso e em todos os ensaios realizados com lentes com esta formulação. Maleato de timolol proveniente dos laboratórios Sigma AldrichTM foi usado na preparação das lentes oclusas, com composição HEMA e MMA, e em todos os ensaios em que foram usadas lentes com esta formulação. Foi também utilizado este segundo fármaco, na incorporação de maleato de timolol por absorção nas lentes com composição HEMA e MAA que foram usadas no estudo com monitorização descontínua, da concentração de fármaco, que será descrito na secção 2.3.5.2. A diferença substancial entre o maleato de timolol proveniente dos laboratórios Cambrex ou Sigma AldrichTM encontra-se no facto de o primeiro estar fora do prazo de validade, podendo, por isso, ter sofrido algumas alterações das suas características. Nas Figura 7 e 8, abaixo apresentadas, são reproduzidos os espectros de absorvância efectuados para determinação dos comprimentos de onda máximos, correspondentes a cada um dos fármacos utilizados neste estudo. Como referido, a importância desta determinação, prende-se com o facto de neste estudo se pretender monitorizar a libertação de fármaco a partir de lentes. Para obter os espectros de absorvância foi preparada uma solução de fármaco de concentração 0,1 mg/mL, a qual foi colocada numa cuvete no espectrofotómetro, e foi registado através de um computador conectado a este, a absorvância correspondente a cada comprimento de onda entre os 200 e os 400 nm. 24 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias λmáx = 292 nm 3,0 Absorvância 2,5 2,0 1,5 1,0 0,5 0,0 200 250 300 350 400 λ (nm) Figura 7 – Espectro de absorvância obtido com uma solução de maleato de timolol proveniente dos laboratórios Cambrex. λmáx = 293 nm 3,0 Absorvância 2,5 2,0 1,5 1,0 0,5 0,0 200 250 300 350 400 λ (nm) Figura 8 – Espectro de absorvância obtido com uma solução de maleato de timolol proveniente dos TM laboratórios Sigma Aldrich . Na Figura 7 é bem visível a existência de um pico de absorvância máximo, obtido com uma solução de maleato de timolol proveniente dos laboratórios Cambrex. Trata-se de um pico bem delineado e cujo comprimento de onda é 292 nm, correspondente a uma absorvância de 1,897. É a este comprimento de onda, que serão analisadas as amostras recolhidas do meio de libertação durante os ensaios de libertação de fármaco, nos quais é este o fármaco empregado. Elsa Alexandra do Nascimento Ribeiro 25 CAPÍTULO 2 Na Figura 8 é, também, claramente observado um pico de absorvância máximo, sendo este obtido com uma solução de fármaco proveniente dos laboratórios Sigma AldrichTM. O comprimento de onda deste pico de absorvância é 293 nm e o valor da absorvância é 2,103. Será, então, a este comprimento de onda que serão lidas as absorvâncias das amostras recolhidas durante os estudos de libertação de fármaco, nos ensaios em que é este o fármaco utilizado. 2.2.2 Curvas de Calibração Para poder converter os valores de absorvância, registados para as amostras recolhidas durante o estudo de libertação do maleato de timolol, em concentração de fármaco, é necessário recorrer a uma curva de calibração. Para a elaboração da curva de calibração, prepararam-se algumas soluções de fármaco em soro fisiológico, com concentrações conhecidas, e mediram-se as respectivas absorvâncias. Tal como foi referido anteriormente, o maleato de timolol usado nas experiências teve diferentes proveniências, pelo que foram obtidas duas curvas de calibração, uma para cada um dos fármacos utilizados. Na Tabela 3 são apresentadas as concentrações das soluções utilizadas na obtenção da curva de calibração, para o maleato de timolol proveniente dos laboratórios Cambrex, assim como as respectivas absorvâncias obtidas a λmáx de 292nm. Os valores associados à concentração traduzem a incerteza combinada na determinação da mesma, com um nível de confiança de aproximadamente igual a 95%. Esta foi calculada com base na incerteza associada à diluição de uma solução (IPAC, 2007). 26 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias Tabela 3 – Concentração de maleato de timolol nas soluções preparadas, para a obtenção da curva de calibração do fármaco proveniente dos laboratórios Cambrex, e respectivas absorvâncias. Absorvância Concentração (mg/mL) 0,0005 ± 0,0001 λ = 292 nm 0,007 0,0010 ± 0,0001 0,018 0,0020 ± 0,0001 0,040 0,0040 ± 0,0001 0,077 0,0060 ± 0,0001 0,112 0,0080 ± 0,0001 0,151 0,0100 ± 0,0002 0,185 0,0300 ± 0,0005 0,574 0,0500 ± 0,0006 0,957 0,0700 ± 0,0007 1,336 A curva de calibração do maleato de timolol foi obtida pelo método dos mínimos quadrados, que é um método de optimização matemática. O seu objectivo é ajustar uma curva a um conjunto de dados obtidos experimentalmente, minimizando a soma dos quadrados das diferenças entre o valor estimado e os dados observados, sendo essa diferença designada por resíduo. A curva de calibração obtida para o maleato de timolol proveniente dos laboratórios Cambrex, apresenta um comportamento linear na gama de concentrações usada e pode ser traduzida pela seguinte equação: ( Na equação (3), ) ( ) (3) representa a absorvância obtida para uma solução de concentração em mg/mL. São, também, apresentados os erros inerentes à determinação da curva de calibração, ou seja, as incertezas associadas à determinação do declive e da ordenada na origem, da recta obtida, cujo método de cálculo está apresentado em anexo (ver Anexo C.2). Na Figura 9 está representada a curva de calibração do maleato de timolol proveniente dos laboratórios Cambrex, onde associado aos pontos experimentais estão as barras de erro correspondentes às incertezas das concentrações das soluções preparadas. Elsa Alexandra do Nascimento Ribeiro 27 CAPÍTULO 2 1,4 1,2 Absorvância 1,0 0,8 0,6 0,4 0,2 y = 19,124x - 0,001 R² = 1 0,0 0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 Concentração (mg/mL) Figura 9 – Curva de calibração do maleato de timolol (Cambrex) obtida a λmáx de 292 nm. Tal como foi descrito para a determinação da curva de calibração do fármaco proveniente dos laboratórios Cambrex, procedimentos semelhantes foram levados a cabo, na determinação da curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM. Na Tabela 4 são apresentadas as concentrações das soluções preparadas para a determinação da curva de calibração, para o maleato de timolol proveniente dos laboratórios Sigma AldrichTM, assim como as respectivas absorvâncias, obtidas a λmáx de 293 nm. Os padrões apresentados foram obtidos a partir de uma solução mãe, cujas diluições foram preparadas utilizando NaCl a 0,9% (m/v) como solvente. Tabela 4 – Concentração de maleato de timolol nas soluções preparadas, para a obtenção da curva de TM calibração do fármaco proveniente dos laboratórios Sigma Aldrich , e respectivas absorvâncias. 28 Concentração (mg/mL) Absorvância 0,0005 ± 0,0001 0,018 0,0010 ± 0,0001 0,031 0,0020 ± 0,0001 0,053 0,0040 ± 0,0001 0,098 0,0060 ± 0,0001 0,138 0,0080 ± 0,0001 0,181 0,0100 ± 0,0002 0,227 0,0200 ± 0,0005 0,446 0,0300 ± 0,0005 0,655 0,0400 ± 0,0005 0,877 0,0500 ± 0,0006 1,088 λ = 293 nm Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias Da mesma forma que na Tabela 3, os valores associados à concentração traduzem a incerteza combinada na sua determinação, com um nível de confiança de aproximadamente igual a 95%, sendo determinada com base na incerteza associada à diluição de uma solução (IPAC, 2007). A curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM pode ser traduzida pela seguinte equação: ( ) ( ) (4) Também a curva de calibração representada pela equação (4) foi obtida pelo método dos mínimos quadrados, ajustando uma recta aos pontos obtidos experimentalmente pela medição das absorvâncias ( ), correspondentes à concentração ( ), em mg/mL, de cada uma das soluções preparadas, para obtenção da curva de calibração. Os factores representados na equação, associados ao declive e à ordenada na origem, representam o erro inerente à determinação de cada uma das grandezas. Na Figura 10 está representada a curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM. 1,2 1,0 Absorvância 0,8 0,6 0,4 0,2 y = 21,655x + 0,008 R² = 0,999 0,0 0,00 0,01 0,02 0,03 0,04 0,05 0,06 Concentração (mg/mL) TM Figura 10 – Curva de calibração do maleato de timolol (Sigma Aldrich ) obtida a λmáx de 293 nm. Elsa Alexandra do Nascimento Ribeiro 29 CAPÍTULO 2 2.3 Metodologias Nesta secção são descritos todos os procedimentos utilizados na preparação das membranas poliméricas, assim como os métodos de incorporação de fármaco nas mesmas. São também enunciados os métodos empregados no estudo de algumas características físicas das lentes poliméricas e no estudo de verificação da degradação do fármaco. Finalmente descrever-se-ão as diferentes metodologias usadas para monitorizar o processo de libertação do fármaco a partir de lentes de contacto. 2.3.1 Preparação das membranas poliméricas Na preparação das membranas poliméricas foram pesadas as quantidades correspondentes de HEMA, MAA (ou MMA), AIBN (iniciador) e EGDMA (reticulante), de forma a obter uma membrana com a composição apresentada na Tabela 5. Tabela 5 – Composição das membranas poliméricas preparadas para utilização no estudo de libertação de um fármaco. HEMA 97% (% massa) MMA ou MAA 3% (% massa) AIBN 0,25% (% molar) EGDMA 0,50% (% molar) A composição das membranas preparadas a partir de HEMA e MAA é idêntica à composição das lentes de contacto comerciais Etafilcon A, produzidas por Vistakon do grupo Johnson & Johnson. Caso os reagentes tenham sido estabilizados aquando o seu armazenamento, é necessário proceder-se à sua purificação. Para tal, recorre-se a um filtro composto por lã de vidro, alumina e algodão, e faz-se passar o reagente pelo filtro, obtendo-se assim o reagente purificado. Após a pesagem das quantidades necessárias de cada um dos componentes, estes foram colocados num gobelé, e foi promovida a agitação com o auxílio de um agitador magnético e uma placa de agitação, até se obter uma mistura homogénea. Entretanto, foram preparados os moldes para as membranas poliméricas, constituídos por duas placas de vidro (forradas com acetato), com cerca de (10 x 15) cm, e uma membrana 30 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias de silicone com 0,5 mm de espessura. Limparam-se convenientemente as superfícies do vidro que estarão em contacto com o polímero e colocou-se a membrana de silicone numa das superfícies de uma das placas do molde. A aderência entre o molde e a membrana de silicone deve ser perfeita, pois é esta membrana que serve de vedante e define a espessura da membrana polimérica. Seguidamente, cobriu-se com a outra placa de vidro, forrada também com acetato, e comprimiu-se para que não existissem fugas da mistura líquida de polímero. Com o auxílio de uma seringa de agulha fina, injectou-se a solução do polímero no interior do molde preparado, como está ilustrado na Figura 11. É importante referir que a quantidade de solução polimérica preparada (10 g para ambas as formulações, HEMA e MAA, HEMA e MMA) foi distribuída por dois moldes como o apresentado na Figura 11. (4) (1) (1) Placas de vidro (2) Membrana de silicone (3) Volume livre para injecção (5) (2) da solução de polímero (4) Seringa de agulha fina (5) Solução polimérica (3) Figura 11 – Esquema do molde usado na preparação das membranas poliméricas. Depois de injectar o polímero no molde, este foi colocado numa estufa a 60°C, durante 24 horas. Após esse período de tempo na estufa, as membranas poliméricas foram retiradas dos moldes, sendo posteriormente humedecidas com o auxílio de um vaporizador, durante cerca de 30 minutos, para que ficassem maleáveis e fosse possível efectuar o seu corte. As membranas foram cortadas recorrendo a um objecto cortante, que permitisse definir a forma e tamanho das lentes pretendidas. No estudo realizado, as membranas foram cortadas em pequenos discos com cerca de 17 cm, que constituíram as lentes. Posteriormente as lentes foram colocadas novamente na estufa a 60°C para remover a humidade, durante aproximadamente 4 horas. Por fim, foram armazenadas num exsicador para que estas mantivessem a sua humidade até serem usadas no estudo da cinética de libertação do fármaco. É relevante referir que, antes de se colocarem as lentes no exsicador, foram efectuadas as pesagens de cada lente individualmente e foram realizadas medidas de diâmetro e espessura de cada uma, com o auxílio de uma craveira (valores apresentados no Elsa Alexandra do Nascimento Ribeiro 31 CAPÍTULO 2 anexo A.2). Na Tabela 6 estão indicados os valores médios das massas das lentes obtidas, assim como o valor médio do diâmetro e espessura, para cada uma das formulações usadas neste estudo. Associada a cada uma das grandezas encontra-se a incerteza relativa à determinação das mesmas, obtida pelo desvio padrão das medições efectuadas. Tabela 6 – Massas e dimensões das lentes preparadas para o estudo de libertação de um fármaco. 2.3.2 Lentes HEMA e MAA HEMA e MMA Massa (mg) 137,2 ± 7,5 134,3 ± 9,8 Diâmetro (mm) 16,86 ± 0,27 16,96 ± 0,44 Espessura (mm) 0,52 ± 0,03 0,49 ± 0,03 Estudo da capacidade de absorção de água das lentes O estudo levado a cabo para determinar algumas características associadas às lentes poliméricas teve como objectivo avaliar a sua capacidade de absorção de água (ou swelling, do inglês), isto é, a capacidade que as lentes possuem de absorver água sem que se dissolvam nesta. A capacidade de absorção de água é avaliada através do aumento da massa das lentes. Para isso, estas foram colocadas em soro fisiológico, à temperatura ambiente, e em períodos de tempo pré-estabelecidos foram pesadas. Ao fim de algum tempo atingiu-se o equilíbrio, sendo a massa das lentes constante, o que possibilitou a determinação da capacidade de absorção de água. Algumas propriedades características dos polímeros que constituem as lentes, tais como o seu grau de hidrofilicidade e o grau de reticulação polimérica podem condicionar a percentagem de água absorvida. Para o ensaio da capacidade de absorção de água, foram utilizadas algumas lentes com composição HEMA e MAA e, também, HEMA e MMA. Estas foram mergulhadas em frascos com 5 mL de soro fisiológico. Após 48 horas, foram pesadas para percepção da evolução da massa e, por fim, após 168 horas (7 dias) o ensaio terminou, garantindo-se que estas tinham atingido o equilíbrio e que não ocorreriam variações na sua massa. Sempre que se procedeu à pesagem das lentes, estas foram retiradas dos frascos e as gotículas de água na sua superfície foram removidas com papel absorvente. Após esse procedimento foram, então, pesadas para posterior determinação do swelling a partir da equação (5). Este ensaio foi realizado à temperatura de aproximadamente 25 °C. 32 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias (5) Na equação (5), representa a massa da lente após a absorção de água, quando este valor permanece constante, e representa a massa da lente seca, antes de se iniciar o processo de hidratação. Como referido anteriormente, a hidrofilicidade e o grau de reticulação são alguns dos factores que podem influenciar de forma significativa a capacidade de absorção de água por parte dos materiais poliméricos. Para avaliar essa capacidade, foram mergulhadas, individualmente, 5 lentes poliméricas, de cada uma das composições preparadas, em soro fisiológico. A massa das lentes, ao longo do tempo, assim como a capacidade de absorção, calculada através da equação (5), são seguidamente apresentadas nas Tabela 7 e Tabela 8. Associada aos valores da percentagem de absorção de água pelas lentes, encontra-se a incerteza combinada, usando um factor de expansão igual a 2, que permite associar o resultado a um grau de confiança de aproximadamente 95% (IPAC, 2007). Tabela 7 – Evolução da massa das lentes poliméricas com composição HEMA e MAA e da sua capacidade de absorção de água. Ensaio 0h 48 h 168 h massa (mg) massa (mg) % absorção massa (mg) % absorção 1 145,4 191,1 31,43 ± 0,05 191,2 31,50 ± 0,05 2 127,2 169,7 33,41 ± 0,06 170,1 33,73 ± 0,06 3 139,2 181,9 30,68 ± 0,05 183,8 32,04 ± 0,05 4 147,8 197,7 33,76 ± 0,05 198,4 34,24 ± 0,05 5 147,8 198,4 34,24 ± 0,05 198,4 34,24 ± 0,05 Tabela 8 – Evolução da massa das lentes poliméricas com composição HEMA e MMA e da sua capacidade de absorção de água. Ensaio 0h 48 h 168 h massa (mg) massa (mg) % absorção massa (mg) % absorção 1 139,7 185,9 33,07 ± 0,05 185,2 32,57 ± 0,05 2 148,6 198,2 33,38 ± 0,05 198,2 33,38 ± 0,05 3 152,5 203,6 33,51 ± 0,05 204,9 34,36 ± 0,05 4 140,9 176,4 25,20 ± 0,04 175,6 24,63 ± 0,04 5 136,8 171,7 25,51 ± 0,04 171,2 25,15 ± 0,04 Elsa Alexandra do Nascimento Ribeiro 33 CAPÍTULO 2 Observando os valores presentes nas Tabela 7 e Tabela 8, verifica-se inequivocamente, que ocorreu um aumento do valor da massa de todas as lentes, ao fim de 48 horas imersas no soro fisiológico. No período seguinte, das 48 horas até às 168 horas, existe, na maioria dos casos, um ligeiro aumento do valor da massa das lentes. Contudo, em algumas lentes com composição HEMA e MMA a massa diminui ligeiramente. Sendo HEMA o componente maioritário da composição das lentes poliméricas, é o que mais influencia a capacidade de absorção. Este componente é altamente hidrofílico, sendo-lhe muitas vezes atribuída a designação de superabsorvente, isto é, um componente polimérico cuja capacidade de absorção de água se encontra acima dos 99,5% (Ferreira, 2008). No entanto, este componente quando associado a MMA ou a MAA, mesmo que em pequenas quantidades (3% em massa), não alcançou mais que 35% de capacidade de absorção. O MAA é uma substância hidrofílica que tem na sua estrutura um grupo funcional OH, enquanto o MMA é um composto ligeiramente hidrofóbico, apresentando um grupo funcional constituído por CH3; as estruturas moleculares do MMA e MAA estão representadas na Figura 13 e Figura 12, respectivamente. As características referidas também são notoriamente identificadas quando é comparada a solubilidade destes dois compostos em água, sendo de 98 g/L e 15,9 g/L para o MAA e MMA, respectivamente (dados fornecidos pelos fabricantes). Ora, seria então de esperar que a capacidade de absorção em todas as lentes com MAA na sua composição fosse superior à verificada para as lentes com MMA na sua formulação, mas tal não aconteceu. Percentagens de absorção de água entre 31,50 - 34,24%, foram obtidas com as lentes com MAA, e entre 24,63 – 34,36% para as lentes com MMA. Figura 13 – Estrutura molecular do Figura 12 – Estrutura molecular do ácido metacrílico (MAA). metacrilato de metilo (MMA). Os polímeros reticulados possuem capacidade para absorver água, sem que se dissolvam nela (Ferreira, 2010), sendo o grau de reticulação um parâmetro que interfere significativamente na capacidade de absorção. Quanto maior a quantidade de reticulante 34 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias adicionada, maior a interacção entre os locais de ligação das cadeias poliméricas, tornando-se o polímero mais compacto e com maior resistência à entrada de água (Fonseca, 2003). No entanto, sendo a quantidade de reticulante adicionada sensivelmente a mesma na preparação das membranas poliméricas, este não contribui significativamente para a diferença obtida na percentagem de absorção de água para as duas formulações. 2.3.3 Incorporação do fármaco nas lentes Seguidamente são descritos os dois procedimentos usados para incorporar o fármaco nas lentes: oclusão e absorção (soaking). 2.3.3.1 Oclusão O método de impregnação do fármaco por oclusão consiste em adicionar o fármaco na mistura reaccional junto com os monómeros, permitindo que o fármaco fique retido no interior da matriz polimérica. O procedimento usado é descrito seguidamente. Aquando da mistura dos reagentes constituintes da membrana polimérica (ver secção 2.3.1), adicionou-se uma quantidade adequada de fármaco (20,7 mg na formulação com HEMA e MAA e 10,0 mg na formulação de HEMA e MMA, pois as quantidades totais preparadas eram diferentes e correspondentes a aproximadamente 2 mg/mL), no estado sólido, e agitou-se toda a mistura até ficar homogénea. Posteriormente, a solução polimérica foi injectada nos moldes que foram depois colocados na estufa para obtenção das membranas poliméricas. Por fim, as membranas foram cortadas, dando origem às lentes com o maleato de timolol incorporado por oclusão. Na Tabela 9 são apresentados os valores médios, da massa, diâmetro e espessura das lentes, com o fármaco incorporado pelo método descrito. Para determinar a massa, em média, de maleato de timolol presente em cada lente, foi necessário pesar todas as lentes, de cada membrana, individualmente. Foi determinada a massa, média, das lentes, e calculada a massa de fármaco, que cada lente teria, incorporada, sendo (0,435 ± 0,013) mg, em lentes de HEMA e MAA, e (0,315 ± 0,021) mg, em lentes de HEMA e MMA. O cálculo deste valor é apresentado em anexo (Anexo A.3). Elsa Alexandra do Nascimento Ribeiro 35 CAPÍTULO 2 Tabela 9 – Massas e dimensões das lentes preparadas para o estudo de libertação de um fármaco incorporado por oclusão. Lentes HEMA e MAA HEMA e MMA Massa (mg) 151,1 ± 5,4 127,8 ± 10,5 Diâmetro (mm) 17,28 ± 0,27 17,12 ± 0,45 Espessura (mm) 0,53 ± 0,04 0,47 ± 0,03 2.3.3.2 Absorção (Soaking) Um dos métodos mais simples de incorporação de fármaco em lentes é o método de soaking, ou absorção. Este método consiste em colocar as lentes numa solução aquosa com uma concentração conhecida de fármaco, de forma a que as lentes absorvam a água que, por sua vez, transporta o fármaco. Para incorporação do fármaco nas lentes por soaking, foram colocadas oito lentes, de cada uma das composições estudadas, secas, numa solução de fármaco de concentração conhecida, durante um determinado período de tempo predefinido. Assim, as lentes poliméricas obtidas usando o procedimento descrito na secção 2.3.1, foram mergulhadas, individualmente, em 5 mL de uma solução de maleato de timolol com uma concentração de 1 mg/mL. A partir desse momento iniciou-se o processo de incorporação do maleato de timolol por soaking, que teve uma duração de 168 horas (7 dias). O tempo foi definido de forma a garantir uma distribuição uniforme do fármaco no interior da lente e para permitir que esta absorvesse a quantidade máxima possível de fármaco. Para determinar a massa de fármaco absorvida pelas lentes, procedeu-se do seguinte modo. Quarenta e oito horas após as lentes terem sido mergulhadas na solução concentrada de fármaco retirou-se uma pequena amostra de 0,5 mL da solução que foi diluída (1:50) e, por espectrofotometria, foi determinada a concentração de maleato de timolol. Depois, tendo em conta o volume total da solução em que a lente tinha sido mergulhada, a concentração foi convertida, em massa de fármaco. Por diferença entre a massa de fármaco na solução inicial, onde as lentes foram mergulhadas, e na amostra agora recolhida, determinou-se a massa de fármaco absorvida pela lente. O mesmo procedimento foi usado para uma amostra recolhida ao fim de 168 h e foi, então, determinada a massa de fármaco máxima absorvida pela lente. No cálculo da massa de fármaco absorvido foi tida em consideração a variação de volume da solução. Foi também, realizado um ensaio, em simultâneo, com uma lente “branca” (lentes sem fármaco incorporado), de cada uma das diferentes composições, em 5 mL de solução de NaCl 0,9% (m/v), durante as mesmas 168 horas. Ao fim desse período de tempo foi medida a absorvância. Valor que foi subtraído, ao valor das absorvâncias obtidas nas amostragens 36 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias da solução, na qual são mergulhadas as lentes para absorção do fármaco. E através dos quais, se determina a concentração de fármaco presente na solução. Este ensaio foi realizado para que as leituras da absorvância da solução de maleato de timolol, não fossem afectadas pela possível existência de componentes libertados da superfície das lentes (como por exemplo, monómeros não reagidos). Na Tabela 10 e 11, são apresentados os valores da concentração de maleato de timolol na solução onde foram mergulhadas as lentes de HEMA e MAA para incorporação do fármaco por absorção, os valores correspondentes de massa de fármaco em solução a cada momento de amostragem, assim como a massa de fármaco incorporada na lente. Associados aos valores de concentração e massa apresentados nas Tabela 10 e Tabela 11, estão as incertezas combinadas de cada um dos parâmetros, que foram obtidas, de acordo com os procedimentos descritos em IPAC (2007). As incertezas apresentadas são expandidas, calculadas com um factor de expansão igual a 2, permitindo, assim, associar o resultado a um grau de confiança de aproximadamente 95%. Os ensaios 1 a 5 correspondem à incorporação de fármaco nas lentes usadas no estudo com monitorização contínua da libertação de fármaco e nos ensaios 6 a 8, estão envolvidas as lentes que foram utilizadas nas experiências com monitorização descontínua da libertação de fármaco, estudos descritos nas secções seguintes, 2.3.5.1 e 2.3.5.2, respectivamente. Tabela 10 – Variação da concentração de maleato de timolol na solução onde são mergulhadas as lentes de HEMA e MAA para incorporação do fármaco por absorção. Ensaio 0h Concentração de fármaco na solução (mg/mL) 48 h 168 h 1 1,079 ± 0,014 1,007 ± 0,014 0,987 ± 0,014 2 1,055 ± 0,014 0,991 ± 0,014 0,972 ± 0,014 3 1,094 ± 0,015 1,004 ± 0,014 0,996 ± 0,014 4 1,097 ± 0,014 0,992 ± 0,014 0,992 ± 0,014 5 1,085 ± 0,014 1,024 ± 0,014 0,983 ± 0,014 6 0,913 ± 0,012 0,859 ± 0,012 0,846 ± 0,012 7 0,937 ± 0,012 0,877 ± 0,012 0,845 ± 0,012 8 0,902 ± 0,012 0,851 ± 0,012 0,841 ± 0,012 Elsa Alexandra do Nascimento Ribeiro 37 CAPÍTULO 2 Tabela 11 – Evolução da massa de fármaco em solução e massa de fármaco incorporada nas lentes de composição HEMA e MAA. massa de fármaco na solução (mg) 0h 48 h 168 h massa de fármaco incorporada na lente (mg) 1 5,394 ± 0,081 5,037 ± 0,077 4,443 ± 0,064 0,951 ± 0,103 2 5,277 ± 0,080 4,954 ± 0,077 4,372 ± 0,062 0,904 ± 0,101 3 5,468 ± 0,086 5,019 ± 0,077 4,482 ± 0,063 0,986 ± 0,106 4 5,486 ± 0,080 4,958 ± 0,077 4,463 ± 0,063 1,023 ± 0,102 5 5,425 ± 0,080 5,120 ± 0,079 4,423 ± 0,063 1,001 ± 0,102 6 4,563 ± 0,069 4,293 ± 0,066 3,809 ± 0,054 0,754 ± 0,088 7 4,686 ± 0,069 4,386 ± 0,067 3,802 ± 0,056 0,884 ± 0,089 8 4,509 ± 0,068 4,255 ± 0,066 3,784 ± 0,053 0,725 ± 0,086 Ensaio Observando a Tabela 10, é perceptível que a concentração de maleato de timolol na solução na qual são mergulhadas as lentes diminui ao longo do tempo, tal como seria de esperar, pois o fármaco está a ser absorvido pelas lentes. Na Tabela 11 é, também, visível o decréscimo da massa de fármaco presente na solução. Verifica-se, ainda, que a quantidade de fármaco que é incorporada nas lentes de composição HEMA e MAA, por absorção, é em média de 0,893 mg, o que corresponde a aproximadamente 17,4% da massa de fármaco inicialmente contida na solução. Na Tabela 12 e 13 são apresentados os valores da concentração de maleato de timolol na solução onde foram mergulhadas as lentes de HEMA e MMA para incorporação do fármaco por absorção, os valores correspondentes de massa de fármaco em solução a cada momento de amostragem, assim como a massa de fármaco incorporada na lente. Os valores que aparecem associados às concentrações e massas, na Tabela 12 e 13, são as incertezas combinadas correspondentes a cada um dos parâmetros. E foram obtidos da mesma forma que os apresentados nas Tabela 10 e Tabela 11. A incorporação de fármaco nas lentes de composição HEMA e MMA, correspondentes aos ensaios 1 a 5, dizem respeito às lentes utilizadas no estudo com monitorização contínua da libertação de fármaco, e, os ensaios 6 a 8 referem-se às lentes que foram utilizadas nas experiências com monitorização descontínua da libertação de fármaco. 38 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias Tabela 12 – Variação da concentração de maleato de timolol na solução onde são mergulhadas as lentes de HEMA e MMA para incorporação do fármaco por absorção. Ensaio 0h Concentração de fármaco na solução (mg/mL) 48 h 168 h 1 0,892 ± 0,017 0,846 ± 0,018 0,834 ± 0,017 2 0,891 ± 0,017 0,840 ± 0,018 0,842 ± 0,017 3 0,895 ± 0,017 0,842 ± 0,017 0,832± 0,017 4 0,894 ± 0,017 0,836 ± 0,017 0,834 ± 0,017 5 0,894 ± 0,017 0,835 ± 0,017 0,810 ± 0,016 6 0,931 ± 0,018 0,870 ± 0,017 0,844 ± 0,017 7 0,906 ± 0,017 0,871 ± 0,017 0,859 ± 0,017 8 0,935 ± 0,018 0,863 ± 0,017 0,847 ± 0,017 Tabela 13 – Evolução da massa de fármaco em solução e massa de fármaco incorporada nas lentes de composição HEMA e MMA. massa de fármaco na solução (mg) 0h 48 h 168 h massa de fármaco incorporada na lente (mg) 1 4,459 ± 0,092 4,232 ± 0,093 3,753 ± 0,076 0,706 ± 0,119 2 4,455 ± 0,091 4,201 ± 0,093 3,788 ± 0,076 0,667 ± 0,119 3 4,474 ± 0,092 4,209 ± 0,091 3,743 ± 0,077 0,731 ± 0,120 4 4,470 ± 0,091 4,182 ± 0,090 3,753 ± 0,077 0,717 ± 0,119 5 4,470 ± 0,092 4,174 ± 0,091 3,646 ± 0,074 0,825 ± 0,118 6 4,653 ± 0,094 4,349 ± 0,090 3,800 ± 0,086 0,853 ± 0,127 7 4,530 ± 0,092 4,353 ± 0,090 3,866 ± 0,085 0,664 ± 0,126 8 4,676 ± 0,096 4,315 ± 0,090 3,810 ± 0,085 0,866 ± 0,128 Ensaio Também após observação das Tabela 12 e Tabela 13 é possível inferir que ocorreu, de facto, absorção do fármaco pelas lentes, no entanto, tal como já tinha acontecido com as lentes de composição HEMA e MAA, as quantidades absorvidas são muito pequenas (0,735 mg, em média), que corresponde a aproximadamente 16,64% da massa inicial de maleato de timolol em solução. Elsa Alexandra do Nascimento Ribeiro 39 CAPÍTULO 2 2.3.4 Ensaio de degradação do fármaco Quando o fármaco é impregnado nas membranas poliméricas por oclusão, ou seja, quando o fármaco é colocado na mistura reaccional antes da polimerização, é necessário garantir que este não se degrada quando a temperatura da mistura é elevada até à temperatura de polimerização, que no presente estudo é de 60°C. Para tal, foi preparada uma solução de maleato de timolol com concentração 0,07 mg/mL (concentração máxima prevista de fármaco na solução de libertação) e foi colocada na estufa a 60°C, durante 24 horas. Durante esse período de tempo foram retiradas algumas amostras para ser obtido o espectro de absorvâncias, entre 200 e 400 nm, e verificar se este era alterado após tratamento térmico. Os espectros obtidos a partir das amostras recolhidas, encontram-se representados no gráfico da Figura 14. λmáx = 292 nm 3,0 Absorvância 0h 2,5 1h 2,0 3h 5h 1,5 8h 22h 1,0 24h 0,5 0,0 200 250 300 350 400 λ (nm) Figura 14 – Espectros de absorvâncias obtidos durante o ensaio de degradação do maleato de timolol (Cambrex), realizado a 60°C. É relevante referir, que o estudo de degradação do fármaco com a temperatura foi, apenas, realizado com o maleato de timolol proveniente dos laboratórios Cambrex. Uma vez que as características apresentadas por ambos os fármacos, aquando da determinação do comprimento de onda de absorvância máximo, se apresentaram muito semelhantes, não se considerou relevante efectuar o mesmo estudo com os dois fármacos. 40 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias Observando o gráfico da Figura 14, é notório que não existiram alterações significativas ao longo do tempo, no comprimento de onda para o qual a absorvância é máxima. Em particular, o valor médio de absorvância obtido foi (1,393 ± 0,017) para λmáx= 292 nm. 2.3.5 Estudo da cinética de libertação do fármaco a partir das lentes poliméricas Para estudar a cinética de libertação do fármaco a partir das membranas poliméricas recorreu-se à técnica de espectroscopia de absorção na zona do ultravioleta (200 a 400 nm) para quantificar a concentração de fármaco no meio de libertação. O estudo de libertação do maleato de timolol foi efectuado usando duas metodologias diferentes. Uma primeira, em que o estudo foi realizado com monitorização contínua da concentração de fármaco em solução que foi libertado das lentes. Na segunda metodologia usada, a monitorização da concentração de fármaco libertado das lentes foi efectuada de uma forma descontínua, ou seja, periodicamente foram recolhidas amostras da solução de libertação, para análise. Foram realizados ensaios da libertação de fármaco com lentes cuja composição continha HEMA e MAA e HEMA e MMA, com o fármaco incorporado quer por oclusão quer por absorção, para ambas as metodologias descritas. Para todas as condições testadas, foram realizados ensaios com lentes “brancas” (lentes sem qualquer substância activa incorporada). Pretendia-se verificar se ao comprimento de onda a que são efectuadas as leituras (292 nm com o fármaco proveniente dos laboratórios Cambrex, 293 nm com o fármaco proveniente dos Laboratórios Sigma AldrichTM), eram detectados alguns compostos que não teriam reagido, como por exemplo, alguns monómeros. 2.3.5.1 Monitorização contínua da concentração de fármaco no meio de libertação No estudo da cinética de libertação do maleato de timolol em que a concentração do fármaco era monitorizada continuamente, usou-se uma célula (em quartzo) de fluxo contínuo no interior do espectrofotómetro, tal como está esquematizado nas Figura 15 e 16. Elsa Alexandra do Nascimento Ribeiro 41 CAPÍTULO 2 Termómetro Soro fisiológico + fármaco libertado Água de aquecimento Recipiente de libertação Bomba peristáltica Banho termostatizado Espectrofotómetro Placa com agitação Figura 15 – Esquema da instalação experimental. Para dar início a uma experiência, o soro fisiológico era colocado no frasco de libertação com 250 mL e seguidamente eram asseguradas as condições de temperatura (37°C, a temperatura média do corpo humano) e de agitação perfeita. Para tal, foi utilizada uma camisa de aquecimento, constituída por um tubo que envolvia o frasco e cujas extremidades se encontravam ligadas a um banho termostatizado, permitindo dessa forma a manutenção da temperatura pretendida no interior do frasco de libertação. Para garantir a agitação foi utilizado um agitador magnético e uma placa de agitação, que em funcionamento coordenado, permitiam a perfeita agitação da solução. Posteriormente promoveu-se o escoamento, em circuito fechado, do meio de libertação, colocando em funcionamento a bomba peristáltica. Assim, a solução percorria todo o sistema, isto é, a solução fluía desde o frasco de libertação até ao interior da célula de fluxo contínuo (esquematizada na Figura 16), colocada no interior no espectrofotómetro, e desta, retornava novamente ao frasco de libertação. O caudal de escoamento da solução através do sistema foi medido, sendo o seu valor de 0,225 mL/s. Recipiente de libertação Bomba peristáltica Célula espectrofotométrica Figura 16 – Ilustração da célula espectrofotométrica de fluxo contínuo. 42 Elsa Alexandra do Nascimento Ribeiro Processo, Fármaco e Metodologias No instante em que se colocava a lente no frasco com soro fisiológico, eram iniciadas as leituras de absorvância pelo espectrofotómetro e registadas no computador que se encontrava acoplado a este para aquisição de dados. Deve referir-se, que as leituras de absorvância foram efectuadas aos comprimentos de onda máximos de cada um dos fármacos, determinados anteriormente, e que, previamente, foi usada a solução de NaCl a 0,9% (m/v), o meio de libertação, para se ajustar o zero de absorvância. Obtidos os valores de absorvância, era necessário convertê-los em valores de concentração, pelo que, foi necessário recorrer à curva de calibração de cada um dos fármacos. Inicialmente, o estudo de libertação do maleato de timolol, ocorreu num volume de 100 mL de soro fisiológico, durante 24 horas, com monitorização contínua da concentração de fármaco no meio de libertação. Os baixos valores de absorvância que eram obtidos (inferiores a 0,1) durante as experiências não garantiam confiança nas concentrações de fármaco calculadas, pois o erro associado às medições espectrofotométricas era considerável. Para ultrapassar este problema o volume da solução de libertação foi reduzido para 30 mL, o que permitiu obter valores de absorvância maiores e com menores erros associados. Segundo Gonçalves (2001), a gama de valores, para os quais as leituras espectrofotométricas apresentam um menor erro encontra-se entre 0,2 e 0,6. 2.3.5.2 Monitorização descontínua da concentração de fármaco no meio de libertação Nos ensaios de libertação de fármaco, cuja monitorização da concentração é realizada descontinuamente, o procedimento é semelhante ao descrito anteriormente. Contudo, não foram utilizados os elementos do sistema que permitem a monitorização contínua da concentração do fármaco libertado, tais como: a bomba peristáltica, os tubos de ligação entre o frasco e a célula espectrofotométrica e a própria célula de fluxo contínuo. Neste estudo, colocaram-se 30 mL de soro fisiológico no frasco de libertação e garantiram-se as condições de temperatura e agitação. Seguidamente, introduziu-se uma lente no interior do recipiente de libertação e, no mesmo instante, retirou-se uma primeira amostra, com cerca de 4 mL, correspondente ao tempo 0 min. Essa amostra foi colocada numa cuvete (em quartzo) e foi efectuada a leitura da absorvância no espectrofotómetro, repondo-se rapidamente esse volume de amostra retirado no interior do frasco de libertação. Elsa Alexandra do Nascimento Ribeiro 43 CAPÍTULO 2 Neste estudo, e contrariamente ao descrito na secção 2.3.5.1, as leituras não foram efectuadas automaticamente pelo espectrofotómetro e adquiridas pelo computador, mas foram recolhidas amostras de 45 em 45 min, durante um período de 9 horas, para análise espectrofotométrica. Uma última amostra foi recolhida após 24 horas, finalizando-se o ensaio nesse momento. Sempre que era retirada uma amostra do meio de libertação para análise, o valor da absorvância era medido de imediato para que rapidamente a amostra fosse reposta no frasco de libertação. O período de tempo entre a recolha e a reposição da amostra foi em média de 60 segundos. Com este procedimento pretendia-se minimizar o efeito da redução do volume do meio de libertação na cinética de libertação do fármaco. O intervalo entre a recolha das amostras foi definido para que as condições de libertação do maleato de timolol estabilizassem entre cada recolha. Foi testada uma outra metodologia que se mostrou inconclusiva. Sempre que era retirada uma amostra de 5 mL, do meio de libertação para análise espectrofotométrica foram adicionados 5 mL de soro fisiológico ao frasco de libertação, para compensar o volume retirado e evitar variações de volume, no meio de libertação, do fármaco. Ora, como o volume inicial usado era pequeno (30 mL), de cada vez que se retirava uma amostra e se adicionavam 5 mL de soro fisiológico, diluía-se bastante o meio de libertação, pelo que as condições eram alteradas significativamente. Esta metodologia foi usada por diversos autores, como por exemplo Cordeiro (2007) e Rouxinol (2009), para estudar sistemas de libertação controlada de fármacos no tratamento de doenças oftalmológicas. Para verificação da viabilidade dos SLC preparados, aqueles autores, determinaram a cinética de libertação do fármaco in vitro das substâncias activas encapsuladas, usando uma solução de PBS (solução salina, semelhante ao soro fisiológico) como solução de libertação. Para avaliar o comportamento da libertação do fármaco, eram recolhidas, periodicamente, amostras do meio de libertação e adicionada uma quantidade idêntica de solução PBS fresca. 44 Elsa Alexandra do Nascimento Ribeiro CAPÍTULO 3 CINÉTICA DA LIBERTAÇÃO DE FÁRMACOS CAPÍTULO 3 3 CINÉTICA DE LIBERTAÇÃO DO FÁRMACO 3.1 Cinética de libertação do maleato de timolol A cinética de libertação do maleato de timolol foi estudada usando dois métodos: um com monitorização contínua da libertação do maleato de timolol e outro com monitorização em descontínuo da concentração de maleato de timolol no meio de libertação. No capítulo 2 foram descritas estas duas metodologias usadas durante o trabalho experimental. Neste capítulo são apresentados os resultados obtidos do estudo da cinética de libertação do maleato de timolol de lentes com diferentes formulações (HEMA e MAA, HEMA e MMA), onde o fármaco foi incorporado por oclusão e por absorção. Este capítulo foi estruturado tendo por base as diferentes composições das lentes analisadas, seguindo-se o método de incorporação do fármaco e, por fim, as diferentes formas de monitorização do fármaco libertado. 3.2 Cinética de libertação do maleato de timolol em lentes com composição HEMA e MAA Nesta secção serão apresentados os resultados obtidos do estudo da cinética de libertação do fármaco em lentes com composição HEMA e MAA. Na secção 3.2.1, são expostos os resultados obtidos com as lentes com o fármaco incorporado por oclusão e, na secção 3.2.2, os resultados apresentados dizem respeito ao estudo em que as lentes usadas continham o fármaco adicionado por absorção. Cada uma destas secções é, por sua vez, subdividida para apresentar os resultados correspondentes ao maleato de timolol libertado das lentes, usando o método de monitorização contínua e descontínua da concentração de fármaco libertado. 46 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco 3.2.1 Cinética de libertação do maleato de timolol de lentes com o fármaco incorporado por oclusão Como referido anteriormente, a incorporação do maleato de timolol por oclusão ocorre durante a reacção de polimerização, pelo que se assume que o fármaco se distribui uniformemente por toda a membrana polimérica. Na análise da libertação do fármaco ocluso nas lentes de composição HEMA e MAA, foram estudadas oito lentes, individualmente, em 30 mL de soro fisiológico. As primeiras cinco lentes foram utilizadas em ensaios de monitorização contínua da libertação de fármaco, sendo as três últimas utilizadas nos ensaios realizados em descontínuo. Cada ensaio teve a duração de 24 horas, e, no fim desse período de tempo, foi calculada a percentagem de fármaco libertado, em massa, de cada uma das lentes. A massa de maleato de timolol, inicialmente presente em cada lente com composição HEMA e MAA, era de (0,435 ± 0,013) mg (ver Anexo A.3). 3.2.1.1 Monitorização contínua da concentração de maleato de timolol no meio de libertação Os ensaios com monitorização contínua da concentração de maleato de timolol presente no meio de libertação realizaram-se segundo o procedimento descrito na secção 2.3.5.1. Antes de se iniciarem os ensaios de libertação do maleato de timolol, foram efectuados ensaios com lentes “brancas”, isto é, lentes sem fármaco incorporado. Houve esta necessidade, pois desconhecia-se o comportamento das lentes quando expostas durante 24 horas ao soro fisiológico. Assim, seria verificada a possibilidade de degradação, ou a presença de monómeros não reagidos na superfície das membranas, que se libertariam assim que expostos a uma solução aquosa. Posteriormente, ao valor das absorvâncias registadas durante o estudo de libertação do fármaco pelas lentes com o fármaco ocluso, foi subtraído o correspondente valor obtido com as lentes “brancas”. No gráfico da Figura 17 encontram-se representadas as curvas de absorvância obtidas para 24 horas de libertação do fármaco, em 30 mL de soro fisiológico, monitorizadas continuamente, assim como a média das absorvâncias dos ensaios realizados com lentes “brancas” de composição HEMA e MAA, com o respectivo desvio padrão. Elsa Alexandra do Nascimento Ribeiro 47 CAPÍTULO 3 1 Ensaios 0,300 2 3 4 5 branca Absorvância 0,250 0,200 0,150 0,100 0,050 0,000 0 2 4 6 8 10 12 Tempo (h) 14 16 18 20 22 24 Figura 17 – Monitorização contínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MAA (λmáx = 292 nm). Pela observação da Figura 17, verifica-se que os valores máximos de absorvância obtidos, com as lentes “brancas” são de ordem de grandeza inferior (0,024 ± 0,007) aos valores de absorvância alcançados pelas lentes com fármaco ocluso (0,235 ± 0,006); cerca de dez vezes inferior. Considerou-se pertinente retirar o valor de absorvância obtido com as lentes brancas ao valor de absorvância registado durante o estudo da libertação do fármaco, para os mesmos tempos de exposição das lentes ao meio de libertação. Na Figura 18 encontram-se representadas as curvas que traduzem a evolução da concentração de fármaco no meio de libertação, onde o seu valor foi monitorizado continuamente. Estas foram obtidas convertendo os valores de absorvância em concentração, usando a curva de calibração do maleato de timolol proveniente dos laboratórios Cambrex, traduzida pela equação (3). 48 Elsa Alexandra do Nascimento Ribeiro Concentração de fármaco (mg/mL) Cinética de libertação do fármaco 1 Ensaios 0,016 2 3 4 5 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 14 16 18 20 22 24 Tempo (h) Figura 18 – Cinética de libertação do maleato de timolol incorporado por oclusão em lentes de HEMA e MAA, com monitorização contínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). Tal como era determinante demonstrar, os perfis de libertação para os cinco ensaios realizados nas mesmas condições, são idênticos. Embora as condições de libertação se tenham mantido constantes em todos os ensaios, para tempos entre 1 e 5 horas verifica-se uma diferença significativa (no máximo de 34,90%) entre as concentrações de fármaco obtidas para o meio de libertação. Estas diferenças podem resultar do facto de o fármaco não estar distribuído uniformemente por toda a membrana polimérica, tal como foi assumido para determinar a quantidade de fármaco em cada lente. Observando as curvas representadas na Figura 18, verifica-se a existência de um primeiro período de libertação rápida, entre as 0 e as 6 horas (aproximadamente), em que a concentração do fármaco no meio de libertação, inicialmente igual a zero, sobe até uma concentração de, aproximadamente, (0,010 ± 0,001) mg/mL. Após as 6 horas, e até ao fim do ensaio, com a duração de 24 horas, ocorre um ligeiro aumento da concentração, verificando-se que a concentração máxima do maleato de timolol no meio de libertação oscila entre os 0,012 e os 0,013 mg/mL, nos cinco ensaios realizados. Na Tabela 14 encontram-se os valores da massa total de maleato de timolol libertado no soro fisiológico, para as diversas experiências, e a correspondente percentagem, em massa, do fármaco inicialmente existente nas lentes que foi libertado. Associadas àqueles valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Elsa Alexandra do Nascimento Ribeiro 49 CAPÍTULO 3 Tabela 14 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA, com fármaco ocluso (0,435 ± 0,013 mg), obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. Ensaios 1 2 3 4 5 m fármaco libertada (mg) 0,366 ± 0,009 0,385 ± 0,008 0,377 ± 0,009 0,363 ± 0,009 0,362 ± 0,009 % fármaco libertado 84,24 ± 5,35 88,57 ± 5,56 86,76 ± 5,47 83,52 ± 5,32 83,16 ± 5,30 Analisando a Tabela 14, verifica-se que, para todas as lentes poliméricas, mais de 83% do fármaco adicionado por oclusão foi libertado, existindo uma diferença máxima de 5,41% entre os diversos valores obtidos para os ensaios realizados, o que é comparável à incerteza associada aos valores calculados. 3.2.1.2 Monitorização descontínua da concentração de maleato de timolol no meio de libertação De seguida são apresentados os resultados experimentais recolhidos durante o estudo de libertação do maleato de timolol das lentes poliméricas com composição HEMA e MAA, em 30 mL de soro fisiológico, com monitorização da concentração de fármaco no meio de libertação realizada descontinuamente. A obtenção da evolução da quantidade de fármaco libertado foi possível com a recolha periódica de amostras. Foram recolhidas amostras de 45 em 45 min durante 9 horas, sendo uma última amostra recolhida e analisada ao fim de 24 horas. Foram efectuados três ensaios em condições de libertação iguais e com lentes semelhantes, para verificar a reprodutibilidade dos resultados obtidos. Os resultados obtidos com este estudo serão comparados com os obtidos do estudo em que foi realizada a monitorização contínua da concentração de maleato de timolol no meio de libertação. Usualmente em estudos de libertação de fármacos a monitorização do processo não é feita continuamente, pelo que com a recolha periódica de amostras para análise, o volume do meio de libertação sofre alterações. Entre outros investigadores, Fonseca (2003) usou um método descontínuo de monitorização da concentração de fármaco no meio de libertação, com recolha periódica de amostras e reposição no meio de libertação, no estudo realizado para o desenvolvimento de sistemas de libertação controlada de fármacos com aplicação oftalmológica, nomeadamente no tratamento do glaucoma. 50 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco Tal como nos ensaios realizados com monitorização contínua da libertação de maleato de timolol, também neste caso foram realizados três ensaios com lentes “brancas”, para eliminação de possíveis erros devido à libertação de monómeros não reagidos das lentes. No gráfico da Figura 19 encontram-se representados os valores de absorvância obtidos das amostras recolhidas durante a libertação do maleato de timolol, assim como a média dos valores obtidos dos ensaios realizados com lentes “brancas” de composição HEMA e MAA, com o respectivo desvio padrão. Ensaios 0,300 6 7 10 12 8 branca Absorvância 0,250 0,200 0,150 0,100 0,050 0,000 0 2 4 6 8 14 16 18 20 22 24 Tempo (h) Figura 19 – Monitorização descontínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” de composição HEMA e MAA (λmáx = 292 nm). Tal como aconteceu anteriormente, os valores de absorvância das amostras recolhidas nos ensaios com as lentes “brancas” são muito inferiores aos obtidos nos ensaios com lentes com fármaco ocluso. O valor máximo de absorvância obtido com as lentes brancas é de 0,040 e o valor máximo de absorvância obtido com as lentes com fármaco ocluso é de 0,262. Aos valores de absorvância obtidos com as lentes com o fármaco incorporado por oclusão, foi subtraído o valor de absorvância obtido com as lentes brancas, correspondente ao mesmo período de tempo, pelos motivos já enunciados. Os valores de absorvância indicados na Figura 20 foram posteriormente convertidos em concentrações de fármaco, recorrendo à curva de calibração do maleato de timolol proveniente dos laboratórios Cambrex, traduzida pela equação (3). A evolução da concentração do maleato de timolol, no meio de libertação, e que foi libertado das lentes com composição HEMA e MAA, é apresentada na Figura 20. Elsa Alexandra do Nascimento Ribeiro 51 CAPÍTULO 3 Ensaios Concentração fármaco (mg/mL) 0,016 6 7 8 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 Tempo (h) 14 16 18 20 22 24 Figura 20 – Cinética de libertação do maleato de timolol incorporado por oclusão em lentes de HEMA e MAA, com monitorização descontínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). Observando atentamente o gráfico da Figura 20 verifica-se um aumento rápido da concentração de fármaco durante um período inicial de aproximadamente 6 horas. Embora entre as 9 e as 24 horas não tenham sido recolhidas amostras do meio de libertação, é possível inferir sobre a tendência da evolução da concentração, nesse intervalo de tempo. O valor da concentração de maleato de timolol obtido ao fim das 9 horas foi de (0,011 ± 0,001) mg/mL, aumentando até aproximadamente (0,013 ± 0,001) mg/mL, ao fim de 24 horas. Na Tabela 15 estão indicados os valores da massa total de maleato de timolol libertado e correspondente percentagem, em massa, do fármaco que existia nas lentes e que foi libertado. Associadas aos referidos valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Tabela 15 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA, com fármaco ocluso (0,435 ± 0,013 mg), obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. 52 Ensaios 6 7 8 m fármaco libertada (mg) 0,413 ± 0,008 0,393 ± 0,007 0,408 ± 0,008 % fármaco libertado 94,99 ± 5,85 90,30 ± 5,58 93,91 ± 5,79 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco Da Tabela 15, verifica-se que para todas as lentes poliméricas a percentagem de fármaco libertado é sempre superior a 90%, sendo a diferença máxima (4,69%) entre os valores obtidos inferior à incerteza associada às percentagens calculadas. Para facilitar a comparação entre os resultados obtidos, usando as duas metodologias para analisar o meio de libertação do fármaco, optou-se por representar conjuntamente os resultados indicados nas Figura 18 e Figura 20. Assim, no gráfico da Figura 21 apresentam-se os resultados obtidos durante a monitorização contínua (ensaios 1 a 5) e a monitorização descontínua (ensaios 6 a 8) da concentração de fármaco no soro fisiológico. 1 Concentração de fármaco (mg/mL) Ensaios 2 3 4 5 6 7 8 0,016 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 14 16 18 20 22 24 Tempo (h) Figura 21 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por oclusão, em lentes de HEMA e MAA (λmáx = 292 nm). Pela observação da Figura 21, verifica-se que o perfil de libertação do maleato de timolol obtido com as duas metodologias implementadas é muito semelhante para as lentes HEMA e MAA com o fármaco adicionado por oclusão. Todos os ensaios realizados apresentam nas primeiras horas, até aproximadamente 6 a 8 horas, um aumento rápido da concentração do fármaco no meio de libertação. Após esse período, observa-se uma tendência para o valor da concentração de maleato de timolol estabilizar. O valor máximo das concentrações obtidas pelos diferentes métodos de monitorização é, em média, de (0,012 ± 0,001) mg/L para os ensaios 1 a 5, e de (0,013 ± 0,001) mg/mL, para os ensaios 6 a 8, pelo que a diferença é de apenas 8,3%. Assim sendo, as duas metodologias permitem obter resultados idênticos, sendo, no entanto, vantajosa a metodologia que usa a monitorização em contínuo da concentração, pois evita a presença de um operador e permite registar resultados ininterruptamente durante longos períodos. Elsa Alexandra do Nascimento Ribeiro 53 CAPÍTULO 3 3.2.2 Cinética de libertação do maleato de timolol de lentes com o fármaco incorporado por absorção Neste estudo foram utilizadas oito lentes brancas de composição HEMA e MAA que, tal como descrito na secção 2.3.3.2, foram mergulhadas, individualmente, numa solução de maleato de timolol com concentração 1mg/mL durante 168 horas, para que pudessem absorver a maior quantidade de fármaco possível. Cinco destas lentes foram utilizadas nos ensaios com monitorização contínua da libertação do fármaco, sendo as restantes usadas no estudo com monitorização descontínua da concentração de fármaco libertado. Contrariamente ao que foi feito no estudo de libertação do maleato de timolol com lentes onde o fármaco foi incorporado por oclusão, nesta análise não se sentiu a necessidade de se realizarem ensaios com lentes “brancas”. Pois, para que o maleato de timolol seja incorporado por absorção, as lentes são mergulhadas numa solução aquosa, o que permite já a sua “lavagem”, ou seja, a remoção de possíveis componentes não reagidos da superfície das mesmas. 3.2.2.1 Monitorização contínua da concentração de maleato de timolol no meio de libertação As curvas que representam a evolução da concentração do maleato de timolol no meio de libertação com o tempo, para as lentes com composição HEMA e MAA, onde o fármaco foi incorporado por absorção, encontram-se representadas na Figura 22. A concentração foi monitorizada continuamente e calculada através dos valores de absorvância, usando a curva de calibração do maleato de timolol proveniente dos laboratórios Cambrex (equação (3)). 54 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco Concentração de fármaco (mg/mL) Ensaios 1 2 3 4 5 0,016 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 14 16 18 20 22 24 Tempo (h) Figura 22 – Cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MAA, com monitorização contínua da concentração de fármaco no meio de libertação (λmáx = 292 nm). A cinética de libertação do maleato de timolol das lentes de composição HEMA e MAA, onde aquele foi incorporado por absorção, é idêntica à cinética de libertação do fármaco em lentes com o maleato de timolol ocluso. Assim, também nas primeiras horas de estudo se observa uma rápida libertação de fármaco, seguindo-se um período de estabilização do valor da concentração de fármaco no meio de libertação. Na Tabela 16 encontram-se os valores da massa total de maleato de timolol libertado, e correspondente percentagem, em massa, do fármaco inicialmente existente nas lentes que foi libertado. Associadas aos referidos valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Para facilitar, a quantidade de fármaco que cada lente usada contém encontra-se também indicada na Tabela 16. Tabela 16 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA com fármaco absorvido, obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. Ensaios 1 2 3 4 5 m inicial fármaco nas lentes(mg) 0,951 ± 0,103 0,904 ± 0,101 0,986 ± 0,106 1,023 ± 0,102 1,001 ± 0,102 m fármaco libertada(mg) % fármaco libertado 0,448 ± 0,008 0,448 ± 0,008 0,396 ± 0,007 0,308 ± 0,007 0,437 ± 0,008 47,05 ± 5,05 Elsa Alexandra do Nascimento Ribeiro 49,50 ± 5,53 40,14 ± 4,19 30,10 ± 3,06 43,60 ± 4,46 55 CAPÍTULO 3 Analisando a Tabela 16, verifica-se que a percentagem, em massa, de maleato de timolol libertado pelas lentes poliméricas varia entre os 30,10% e os 49,50%. A diferença máxima entre as percentagens de fármaco libertado para os cinco ensaios realizados nas mesmas condições é de 19,40%, o que é significativamente superior às incertezas associadas aos valores calculados. As lentes de HEMA e MAA, nas quais o fármaco foi absorvido, continham maior quantidade de fármaco do que as lentes com a mesma composição com o maleato de timolol incorporado por oclusão, mas a percentagem de fármaco libertado durante os ensaios foi menor. 3.2.2.2 Monitorização descontínua da concentração de maleato de timolol no meio de libertação Seguidamente são apresentados os resultados do estudo de libertação do fármaco a partir de lentes poliméricas de composição HEMA e MAA, com monitorização da concentração de fármaco libertado obtida através da recolha periódica de amostras. Na Figura 23 é apresentada a cinética de libertação do maleato de timolol de lentes de composição HEMA e MAA onde o fármaco foi incorporado por absorção. Concentração fármaco (mg/mL) 0,016 6 Ensaios 7 8 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 14 16 18 20 22 24 Tempo (h) Figura 23 – Cinética de libertação do maleato de timolol incorporado por absorção em lentes de HEMA e MAA, com monitorização descontínua da concentração de fármaco no meio de libertação (λmáx = 293 nm). 56 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco As concentrações de fármaco apresentadas na Figura 23 foram obtidas através dos valores de absorvância, lidos para as amostras recolhidas, recorrendo à curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM, equação (4). No gráfico da Figura 23, é possível observar que, entre as 0 horas e as 9 horas, a concentração de maleato de timolol no meio de libertação aumenta significativamente, sendo posteriormente, o aumento pouco expressivo até às 24 horas de libertação. A concentração máxima de maleato de timolol no soro fisiológico, obtida nestes ensaios foi (0,013 ± 0,001) mg/mL. Na Tabela 17 encontram-se os valores da massa total de maleato de timolol libertado das lentes, onde a incorporação de fármaco ocorreu por absorção, e as correspondentes percentagens, em massa, de fármaco libertado. Associadas aos referidos valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Para melhor percepção, a quantidade de fármaco que cada lente usada contém, encontra-se também na Tabela 17. Tabela 17 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MAA com fármaco absorvido, obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. Ensaios 5 6 7 m inicial fármaco nas lentes(mg) 0,754 ± 0,088 0,884± 0,089 0,725± 0,086 m fármaco libertada (mg) 0,391 ± 0,009 0,399 ± 0,009 0,397 ± 0,009 % fármaco libertado 51,79 ± 6,29 45,11 ± 4,74 54,86 ± 6,63 A percentagem da massa total de maleato de timolol que foi libertada das lentes de HEMA e MAA, onde o maleato de timolol foi absorvido pelas próprias lentes, varia entre os 45,11% e 54,86% nos ensaios realizados, sendo a dispersão de resultados superior à incerteza dos valores calculados. Na investigação levada a cabo por García et al. (2004) foi estudada a cinética de libertação do maleato de timolol de polímeros com a forma de disco, com (1,00 ± 0,05) mm de espessura, constituídos só por HEMA, ou só por MAA, em 10 mL de uma solução tampão, similar a um fluido lacrimal, com pH de 7,4 e a 37°C. O fármaco foi incorporado por absorção nos discos dos diversos polímeros. A monitorização da concentração de fármaco libertado foi realizada com recolha periódica de amostras, durante um período de 24 h, e as amostras foram analisadas por espectroscopia UV a 294 nm. A percentagem de maleato de timolol libertado ao fim de 24 horas, obtida por aqueles autores, para os discos de HEMA, foi de (38,00 ± 0,01)% e, para os discos de MAA, foi de (56,00 ± 0,02)%. Comparando os Elsa Alexandra do Nascimento Ribeiro 57 CAPÍTULO 3 resultados alcançados no presente estudo, com os valores publicados por García et al. (2004), para condições semelhantes, verifica-se que os valores obtidos da percentagem de maleato de timolol libertado são superiores (diferença máxima de 16,86%) aos indicados por estes autores para os discos preparados a partir de HEMA. Ora, como os hidrogéis preparados no presente trabalho, possuem, além de HEMA, 3% (em massa) do monómero MAA, era de esperar maiores quantidades de fármaco libertado, o que, aliás, está bem patente nos resultados publicados por García et al. (2004). Mais uma vez, para facilitar a comparação dos resultados obtidos com as duas metodologias, na Figura 24 apresentam-se as concentrações do maleato de timolol no soro fisiológico, e que foi libertado de lentes com composição HEMA e MAA com o fármaco incorporado por absorção. Os resultados foram obtidos usando monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8), do meio de libertação. Concentração de fármaco (mg/mL) Ensaios 1 2 3 4 5 6 7 8 0,016 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 14 16 18 20 22 24 Tempo (h) Figura 24 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MAA. Pela observação da Figura 24, verifica-se que o perfil de libertação do maleato de timolol obtido pelas duas metodologias usadas é semelhante, tendo-se obtido uma concentração máxima de fármaco no soro fisiológico de (0,014 ± 0,002) mg/L nos ensaios 1 a 5, e (0,013 ± 0,001) mg/mL, nos ensaios 6 a 8. 58 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco 3.3 Cinética de libertação do maleato de timolol em lentes com composição HEMA e MMA Nesta secção serão apresentados, agora, os resultados obtidos durante o estudo da cinética de libertação do maleato de timolol a partir de lentes com composição HEMA e MMA. A divisão desta secção 3.3 em subsecções seguiu o mesmo princípio usado na secção anterior. Assim, na secção 3.3.1, serão apresentados os resultados obtidos com as lentes onde o fármaco foi incorporado por oclusão e, na secção 3.3.2, os resultados correspondentes às lentes com o maleato de timolol adicionado por absorção, e optou-se por apresentar em conjunto os resultados obtidos com as duas metodologias experimentais implementadas. 3.3.1 Cinética de libertação do maleato de timolol em lentes incorporadas por oclusão (monitorização contínua e descontínua) Na análise da libertação do fármaco ocluso nas lentes de composição HEMA e MMA, foram usadas oito lentes semelhantes em ensaios realizados nas mesmas condições. Cinco lentes foram utilizadas em ensaios com monitorização contínua da libertação de fármaco e três foram utilizadas nos ensaios com monitorização em descontínuo. Cada ensaio teve a duração total de 24 horas, e, no final, foi calculada a percentagem, em massa, do fármaco inicialmente contido em cada uma das lentes, que foi libertado. A massa (média) de maleato de timolol, inicialmente presente em cada lente com a composição HEMA e MMA, era de (0,315 ± 0,021) mg (cálculo no Anexo A.3). Também com as lentes de HEMA e MMA foram realizados ensaios com lentes “brancas” (sem fármaco incorporado). Aos valores da absorvância registados durante a libertação do fármaco foi subtraído o valor médio obtido dos ensaios com as lentes “brancas”, para os mesmos tempos de libertação. As curvas de absorvâncias obtidas durante a libertação do maleato de timolol para as experiências realizadas, quer com monitorização contínua, quer com monitorização descontínua, da concentração de fármaco no meio de libertação encontram-se em anexo (ver Anexo B.1 e B.2, respectivamente), tal como a curva correspondente à média dos ensaios realizados com lentes “brancas” e o respectivo desvio padrão. De seguida, no gráfico da Figura 25, são apresentadas em conjunto as curvas de concentração obtidas durante a libertação do fármaco no soro fisiológico com as duas Elsa Alexandra do Nascimento Ribeiro 59 CAPÍTULO 3 metodologias experimentais implementadas, para melhor comparar os resultados experimentais. As concentrações de fármaco apresentadas, foram obtidas através dos valores de absorvância lidos, recorrendo à curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM, equação (4). Concentração de fármaco (mg/mL) Ensaios 1 2 3 4 5 6 7 8 0,016 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 Tempo (h) 14 16 18 20 22 24 Figura 25 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por oclusão, em lentes de HEMA e MMA (λmáx = 293 nm). Pela observação da Figura 25, verifica-se que o perfil de libertação do maleato de timolol, obtido com as duas metodologias implementadas, é muito semelhante, para as lentes HEMA e MMA com o fármaco adicionado por oclusão, existindo, inclusive, sobreposição em alguns momentos. Todos os ensaios realizados apresentam nas primeiras horas, até aproximadamente 4 a 6 horas, um aumento rápido da concentração do fármaco no meio de libertação. Após esse período, observa-se uma tendência para o valor da concentração do maleato de timolol estabilizar, o que indica que praticamente não é libertado fármaco das lentes O valor médio das concentrações obtidas, ao fim de 24 horas, pelos diferentes métodos de monitorização, foi de (0,007 ± 0,001) mg/mL para os ensaios 1 a 5, e de (0,008 ± 0,001) mg/mL para os ensaios 6 a 8, pelo que a diferença é de 17,44%. Pode inferir-se que as duas metodologias são válidas, e na ausência de equipamentos que permitam a monitorização contínua, pode optar-se pelo método de monitorização descontínua da concentração de fármaco libertado de um sistema de libertação controlada. Na Tabela 18 e Tabela 19 encontram-se os valores da massa total de maleato de timolol libertado no soro fisiológico, nos diversos ensaios realizados, e a correspondente 60 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco percentagem, em massa, do fármaco, inicialmente existente nas lentes, que foi libertado. Associadas a estes valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Tabela 18 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco ocluso (0,315 ± 0,021 mg), obtidas dos ensaios com monitorização contínua da concentração de fármaco no meio de libertação. Ensaios 1 2 3 4 5 m fármaco libertada (mg) 0,171 ± 0,008 0,251 ± 0,009 0,193 ± 0,008 0,197 ± 0,008 0,225 ± 0,009 % fármaco libertado 54,30 ± 7,83 79,89 ± 11,19 61,36 ± 8,75 62,69 ± 8,92 71,51 ± 10,08 Tabela 19 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco ocluso (0,315 ± 0,021 mg), obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. Ensaios 6 7 8 m fármaco libertada(mg) 0,242 ± 0,009 0,264 ± 0,009 0,223 ± 0,009 % fármaco libertado 77,16 ± 10,82 84,21 ± 11,76 70,98 ± 10,01 Analisando a Tabela 18, verifica-se que as lentes poliméricas libertaram entre 54,30% a 79,89% do fármaco que lhes foi adicionado por oclusão, sendo a dispersão de valores obtida nos cinco ensaios significativa; a diferença máxima entre os valores obtidos é de 25,59%. Na Tabela 19, em que são apresentados os valores relativos ao estudo com monitorização descontínua da concentração do fármaco libertado, verifica-se que a percentagem média de libertação do fármaco é de (77,45 ± 6,62) %, sendo a diferença máxima entre os valores obtidos de 13,23%, valor próximo da incerteza associada às percentagens calculadas. Alvarez-Lorenzo et al. (2002) estudou a cinética de libertação do maleato de timolol incorporado (por oclusão) em lentes com composição semelhante (2,56%, em moles, de MAA e 97,44% de HEMA e 2,56%, em moles, de MMA e 97,44% de HEMA). O meio de libertação usado por aqueles autores, embora com composição idêntica (fluido lacrimal artificial) o valor do seu pH era de 8. A percentagem de maleato de timolol libertado, ao fim de 12 horas, foi de, aproximadamente, 98% para as lentes com MAA na sua composição e de, cerca de, 75% para as lentes onde o MMA é um dos monómeros constituintes do hidrogel. Estes valores são comparáveis aos valores alcançados no presente estudo. Elsa Alexandra do Nascimento Ribeiro 61 CAPÍTULO 3 3.3.2 Cinética de libertação do maleato de timolol em lentes incorporadas por absorção (monitorização contínua e descontínua) Neste estudo, realizado com lentes com composição HEMA e MMA, tal como já foi descrito no estudo efectuado com lentes com composição HEMA e MAA, foram utilizadas oito lentes com o fármaco incorporado por absorção. No estudo de monitorização contínua da concentração do maleato de timolol, no meio de libertação, foram utilizadas cinco lentes, sendo as restantes três lentes, usadas no estudo com monitorização descontínua da concentração de fármaco libertado. Tal como anteriormente referido, na secção 3.2.2, também nestes ensaios, não foram realizadas experiências com lentes “brancas”, pois como as lentes são mergulhadas numa solução aquosa de maleato de timolol para impregnar o fármaco, já permite a remoção de possíveis componentes não reagidos da sua superfície. As curvas que representam a evolução da concentração do maleato de timolol, no meio de libertação, com o tempo, para as lentes com o fármaco absorvido, encontram-se representadas na Figura 26. A concentração foi monitorizada, continua e descontinuamente, e calculada através dos valores de absorvância, usando a curva de calibração do maleato de timolol proveniente dos laboratórios Sigma AldrichTM, equação (4). Concentração de fármaco (mg/mL) Ensaios 1 2 3 4 5 6 7 8 0,016 0,014 0,012 0,010 0,008 0,006 0,004 0,002 0,000 0 2 4 6 8 10 12 Tempo (h) 14 16 18 20 22 24 Figura 26 – Monitorização contínua (ensaios 1 a 5) e descontínua (ensaios 6 a 8) da cinética de libertação do maleato de timolol incorporado por absorção, em lentes de HEMA e MMA (λmáx = 293 nm). 62 Elsa Alexandra do Nascimento Ribeiro Cinética de libertação do fármaco Os perfis de libertação do maleato de timolol, representados na Figura 26, apresentam-se muito semelhantes entre os diversos ensaios, sendo o ensaio 3 uma excepção. Todos exibem um aumento rápido da concentração do fármaco até cerca das 6 horas e, após esse período, uma tendência para a estabilização do seu valor. Observa-se, no entanto, que os perfis de libertação do fármaco das lentes com composição HEMA e MMA, monitorizados descontinuamente (ensaios 6 a 8), apresentam valores de concentração superiores (cerca de 11,38%, em média) aos obtidos com monitorização contínua (ensaios 1 a 5) ao longo de todo o tempo de estudo. Nos ensaios 1, 2, 4 e 5 obteve-se uma concentração máxima média de maleato de timolol de (0,012 ± 0,001) mg/mL. O ensaio 3 foi, de todos os ensaios realizados com monitorização contínua, o que maior desvio apresentou (20,49%) em termos de concentração de fármaco libertado, tendo-se obtido uma concentração máxima de maleato de timolol no meio de libertação de (0,010 ± 0,003) mg/mL. Relativamente aos ensaios 6, 7 e 8, também estes apresentam semelhanças, quer em termos de cinética de libertação do maleato de timolol, quer em termos da concentração de fármaco libertada, sendo o seu valor máximo (médio) de (0,013 ± 0,001) mg/mL. Nas Tabela 20 e 21 encontram-se os valores da massa total de maleato de timolol libertado nos ensaios monitorizados em contínuo e descontinuo, respectivamente. São, também, apresentados os valores da percentagem, em massa, do fármaco inicialmente existente nas lentes que foi libertado e associadas aos referidos valores, estão as incertezas combinadas na determinação dos mesmos, com um nível de confiança de aproximadamente 95%, (IPAC, 2007). Para facilitar, a quantidade de fármaco que cada lente usada contém, encontra-se também indicada nas Tabela 20 e 21. Tabela 20 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco absorvido, obtidas dos ensaios com monitorização contínua da concentração de fármaco em meio de libertação. Ensaios 1 2 3 4 5 m inicial fármaco nas lentes(mg) 0,706 ± 0,119 0,667 ± 0,119 0,731 ± 0,120 0,717 ± 0,119 0,825 ± 0,118 m fármaco libertada (mg) 0,350 ± 0,009 0,349 ± 0,009 0,291 ± 0,008 0,357 ± 0,009 0,343 ± 0,009 % fármaco libertado 49,65 ± 8,63 Elsa Alexandra do Nascimento Ribeiro 52,31 ± 9,62 39,76 ± 6,71 49,82 ± 8,45 41,65 ± 6,18 63 CAPÍTULO 3 Tabela 21 – Massa de maleato de timolol libertada e correspondente percentagem de fármaco libertado, para lentes de HEMA e MMA, com fármaco absorvido, obtidas dos ensaios com monitorização descontínua da concentração de fármaco no meio de libertação. Ensaios 6 m inicial fármaco nas lentes(mg) 0,853 ± 0,127 7 8 0,664 ± 0,126 0,866 ± 0,128 m fármaco libertada (mg) 0,366 ± 0,009 0,384 ± 0,009 0,389 ± 0,009 % fármaco libertado 43,29 ± 6,68 44,65 ± 6,75 45,96 ± 6,93 Analisando a Tabela 20, verifica-se que a média dos valores obtidos da percentagem, em massa, do maleato de timolol libertado, é de (46,64 ± 5,56) %. A diferença máxima entre as percentagens de fármaco libertado, para os cinco ensaios realizados, nas mesmas condições, e monitorizados continuamente, é de 12,55%, ligeiramente superior ao valor das incertezas associadas. A percentagem da massa total do maleato de timolol que foi libertado, nos ensaios que foram monitorizados descontinuamente (Tabela 21) é idêntica entre os diversos ensaios, sendo em média, de (44,64 ± 1,33) %. Comparando os valores obtidos em todos os ensaios, realizados com as lentes com composição HEMA e MMA, com o fármaco absorvido, verifica-se uma grande semelhança. 64 Elsa Alexandra do Nascimento Ribeiro CAPÍTULO 4 CONCLUSÕES GERAIS E SUGESTÕES PARA TRABALHO FUTURO Conclusões gerais e Sugestões para trabalho futuro 4 CONCLUSÕES GERIAS E SUGESTÕES PARA TRABALHO FUTURO 4.1 Conclusões gerais Para a realização do estudo da cinética de libertação de um fármaco em matrizes sólidas foram preparadas matrizes poliméricas com duas composições distintas. Uma das matrizes poliméricas preparadas, era constituída pelos hidrogéis HEMA e MAA e, a outra, tinha na sua composição HEMA e MMA. No estudo da cinética de libertação do maleato de timolol numa solução de NaCl 0,9% (m/v) (pH 6,56), foram efectuadas algumas modificações, não só na composição das lentes preparadas, mas também na forma de incorporação do fármaco nas lentes e na monitorização da libertação do mesmo. Relativamente aos hidrogéis constituintes das matrizes poliméricas, a sua capacidade de absorção de água, foi, também, analisada. Desta análise não se obtiveram resultados que permitissem distinguir as lentes com as duas composições preparadas, pois os valores obtidos por ambas, não superaram os 34,36 %, sendo muito semelhantes entre si. Este estudo permitiu, apenas, inferir sobre a classificação das lentes quanto à sua capacidade de absorção de água, sendo esta baixa (entre 10 e 50 %) (Ferreira, 2010). Os métodos de incorporação do fármaco utilizados neste estudo, oclusão e absorção, mostraram-se eficazes, uma vez que, se conseguiram impregnar as quantidades mínimas de maleato de timolol aconselhadas à terapêutica diária do glaucoma, cerca de 0,2 mg/dia. Quanto aos métodos experimentais utilizados na monitorização da concentração do fármaco no meio de libertação, após a sua libertação controlada das lentes, monitorização contínua e descontínua, mostraram-se eficientes, pois foi possível observar a reprodutibilidade e fiabilidade dos resultados experimentais obtidos. E, tal como era determinante demonstrar, o método de monitorização em contínuo da concentração do maleato de timolol presente no meio de libertação, apresentou-se como uma método válido para a quantificação de fármaco libertado. Assim, o método de monitorização contínua, em circuito fechado, com volume constante, implementado neste estudo, é uma alternativa vantajosa à monitorização descontínua vulgarmente usada em estudos de libertação controlada de fármacos, pois evita a presença de um operador e permite registar resultados ininterruptamente durante longos períodos de tempo. Verificou-se que o perfil de libertação do maleato de timolol, incorporado nas lentes com as duas composições diferentes e pelos dois métodos de impregnação, é idêntico entre todas 66 Elsa Alexandra do Nascimento Ribeiro CAPÍTULO 4 as lentes estudadas. Observou-se sempre, um período de libertação rápida, no início, até cerca das 6 a 8 horas de libertação e, depois desse período, a concentração do maleato de timolol no meio de libertação tende a estabilizar, pois, provavelmente, é atingido o equilíbrio entre a concentração de fármaco na lente e no meio de libertação. No estudo da cinética de libertação do maleato de timolol dos sistemas de libertação controlada, obtiveram-se, sempre, percentagens de libertação, em massa, de fármaco superiores com as lentes onde o fármaco foi adicionado por oclusão. Percentagens de libertação entre 83,16% e 94,99% foram obtidas com as lentes de composição HEMA e MAA e com o fármaco incorporado por oclusão, enquanto que em lentes com a mesma composição e o fármaco adicionado por absorção a percentagem de libertação situou-se entre os 30,10% e os 54,96%. Quanto às lentes com composição HEMA e MMA, embora as percentagens de libertação sejam, em geral, inferiores às indicadas para a outra composição estudada, a mesma tendência para a fracção de fármaco libertado diminuir quando este é incorporado por absorção é observada; a percentagem de libertação é de 54,30 % - 84,21%, quando o fármaco é adicionado por oclusão, e de 39,76% - 45,96% quando o maleato de timolol foi incorporado por absorção. É de realçar que para algumas das condições estudadas a dispersão de resultados obtidos é significativa, sendo mesmo superior à incerteza associada ao cálculo das percentagens de libertação do fármaco. Comparando, agora, os resultados obtidos com as lentes de composições diferentes, verifica-se que, em geral, a fracção de maleato de timolol libertado é superior nas lentes mais hidrófilas (HEMA e MAA), quer quando o fármaco é impregnado por oclusão, quer quando este é adicionado por absorção. Além do estudo realizado com as lentes impregnadas com fármaco, foram, também, realizados ensaios com lentes “brancas”, isto é, lentes sem qualquer substância activa agregada. Tal estudo foi realizado com o intuito de se verificar se da superfície das lentes se desprenderiam monómeros não reagidos e, sempre que se justificou, os valores de absorvância obtidos foram subtraídos aos valores correspondentes de absorvância registados durante o estudo da libertação do maleato de timolol. Uma vez que os métodos de monitorização implementados neste estudo se mostraram fiáveis quanto aos resultados experimentais obtidos, pode concluir-se que terão grande aplicabilidade quando utilizados em estudos cinéticos na produção de lentes de contacto com aplicação terapêutica oftalmológica. Elsa Alexandra do Nascimento Ribeiro 67 Conclusões gerais e Sugestões para trabalho futuro 4.2 Sugestões para trabalho futuro Em trabalhos futuros, seria interessante realizarem-se estudos que permitissem caracterizar os polímeros utilizados o que complementaria os estudos efectuados neste trabalho. Seria importante, nomeadamente, a realização de testes para caracterizar fisicamente os hidrogéis e para testar a biocompatibilidade das lentes poliméricas para futura aplicação oftalmológica. Relativamente ao estudo da cinética de libertação do fármaco era importante implementar uma metodologia que permitisse manter as condições de libertação e, em particular, a quantidade de fármaco incorporado em cada lente, e melhorar as características físicas do meio de inserção do sistema de libertação do fármaco, para que sejam o mais semelhantes possível ao meio real de aplicação. Seria, também, interessante a realização de testes da cinética de libertação de fármacos, variando a quantidade de fármaco adicionado às lentes, de maneira a optimizar o processo, assim como a realização do estudo da cinética com outros fármacos para verificar a reprodutibilidade dos métodos aplicados. Poderia, também, verificar-se a influência da concentração de fármaco imobilizado na determinação do seu coeficiente de difusão e investigar-se se a quantidade inicial de fármaco incluso afecta o padrão de libertação. 68 Elsa Alexandra do Nascimento Ribeiro REFERÊNCIAS BIBLIOGRÁFICAS Referências Bibliográficas Almeida, José Filipe da Silva Lapas. 2010. Preparação e Caracterização de Hidrogéis para Aplicações Biomédicas. Coimbra : Faculdade de Ciências e Tecnologia da Universidade de Coimbra, 2010. Almeida, José Filipe; Fonseca, Anabela; Baptista, Cristina M. S. G.; Leite, Eugénio; Gil Maria Helena. 2007. Immobilization of drugs for glaucoma treatment. Springer Science+Business Media. 2007. Alvarez-Lorenzo, Carmen; Hiratani, Haruyiki; Gómez-Amoza, José Luís; MartínezPacheco, Ram'n; Souto, Consuelo; Concheiro, Angel. 2002. Soft contact lenses capable of sustained delivery of timolol. Journal of pharmaceutical sciences. 10, 2002, Vol. 91. Barbosa, C. N. 2010. Novas Formas Farmacêuticas Para Uso Veterinário. Porto : Universidade Fernando Pessoa, Faculdade de Ciências da Saúde, 2010. Bodor, N. e Loftsson, T. 1987. Novel chemical approaches for sustained drug delivery. Controlled Drug Delivery: Fundamentals and Applications. 2ª Ed., 1987, pp. 337-371. Calvinho, P. F. 2010. Diapositivos da Unidade Curricular Biomateriais. Sistemas de Libertação Controlada de Fármacos. Coimbra : ISEC, 2010. Caroni, A. F. 2009. Estudos de adsorção de tetraciclina em partículas de quitosano. Brasil : Universidade Federal do Rio Grande do Norte, 2009. Carreira, Ana de Sousa. 2008. Difusão Não Fickniana em Polímeros e Aplicações Médicas. Coimbra : Faculdade de Ciências e Tecnologia da Universidade de Coimbra, 2008. Casimiro, Maria Helena Freitas. 2008. Preparação e caracterização de sistemas de libertação de fármacos de base quitosano. Lisboa : Faculdade de Ciências da Universidade de Lisboa, 2008. Chien, Y. W. 1992. Novel Drug Delivery Systems. 2ª Ed., 1992. Coelho, P. S. 2007. Desenvolvimento de formulações de libertação modificada de ranitidina. Porto : Faculdade de Fármácia da Universidade do Porto, 2007. Cordeiro, Rosemeyre Amaral. 2007. Preparação e caracterização de microsferas para libertação controlada de fármacos em Oftalmologia. Coimbra : Faculdade de Ciências e Tecnologias da Universidade de Coimbra, 2007. Dash, Suvakanta; Murthy, Padala Narasimha; Nath, Lilakanta; Chowdhury, Prasanta. 2010. Kinetic modeling on drug release from controlled drug delivery systems. Polish Pharmaceutical Society. 3, 2010, Vol. 67. 70 Elsa Alexandra do Nascimento Ribeiro Referências Bibliográficas Ferreira, Luís Miguel Mota. 2008. Modificação de polietileno por copolimerização de enxerto induzida por radiação gama : sua aplicação na área dos biomateriais. s.l. : Faculdade de Ciências da Universidade de Lisboa, 2008. Ferreira, Paula. 2010. Sebenta de Biomateriais. Hidrogéis. s.l. : ISEC, Coimbra, Maio de 2010. Ferreira, Paula; Calvinho, Paulo; Cabrita, António Silvério; Schacht, Etienne; Gil, Maria Helena. 2006. Synthesis and characterization of new methacrylate based hydrogels. Brazilian Journal of Pharmaceutical Sciences. 3, 2006, Vol. 42. Fonseca, Anabela Almeida Lopes da. 2003. PREPARAÇÃO E CARACTERIZAÇÃO DE SISTEMAS DE LIBERTAÇÃO CONTROLADA DE FÁRMACOS COM APLICAÇÃO OFTALMOLÓGICA. Coimbra : Faculdade de Ciências e Tecnologias da Universidade de Coimbra, 2003. García, D. M., Escobar, J.L.; Noa, Y.; Hernáez, E.; Katime, I. 2004. Timolol maleate release from pH-sensible poly(2-hydroxyethyl methacrylate-co-methacrylic acid) hydrogels. European Polymer Journal. 40, 2004. Gonçalves, Maria de Lurdes Sadler Simões. 2001. Métodos instrumentais para análise de soluções. 4ª Edição, Lisboa : Calouste Gulbenkian, 2001. Hillery, A. M. 2001. Drug Delivery: the basic concepts. Drug Delivery and Targeting for Pharmacists and Pharmaceutical Scientists. London : Taylor & Francis, 2001. Hiratani, Haruyuki e Alvarez-Lorenzo, Carmen. 2002. Timolol uptake and release by imprinted soft contact lenses made of N,N-diethylacrylamide and methacrylic acid. Journal of controlled release. 83, 2002. Industrial Laser Solutions. [Online] [Citação: 23 de Novembro de 2011.] http://www.industrial-lasers.com/articles/2007/09/pill-drill.html. IPAC. 2007. GUIA PARA A QUANTIFICAÇÃO DA INCERTEZA EM ENSAIOS QUÍMICOS. 2007. Liechty, William B.; Kryscio, David R.; Slaughter, Brandon V.; Peppas, Nicholas A. 2010. Polymers for Drug Delivery Sistems. Annual Review of Chemical and Biomolecular Engineering. 2010. Lopes, C., Lobo, J. e Costa, P. 2005. Formas farmacêuticas de liberação modificada: polímeros hidrifílicos. Universidade do Porto, Porto : Revista Brasileira de Ciências Farmacêuticas, 2005. Elsa Alexandra do Nascimento Ribeiro 71 Referências Bibliográficas Lyra, M.; Soares-Sobrinho, J.; Brasileiro, M.; Roca, M. La; Barraza, J.; Viana, O.; RolimNeto, P. 2007. Sistemas Matriciais Hidrofílicos e Mucoadesivos para Libertação Controlada de Fármacos. Latin American Jounal of Pharmacy. 2007, Vol. 26. M. Malmonge, Sonia e Zavaglia, Cecília A. C. 1997. Hidrogéis de PoliHEMA para Reparo de Defeitos da Cartilagem Articular. 1- Síntese e Caracterização Mecânica. Campinas : FEM/UNICAMP, 1997. Manadas, R., Pina, M.E. e Veiga, F. 2002. A dissolução in vitro na previsão da absorção oral de fármacos em formas farmacêuticas de libertação modificada. Revista Brasileira de Ciências Farmacêuticas. 2002, Vol. 38. Mauro, Carolina Pereira. 2007. Comprimidos de Liberação controlada. São Paulo : Centro Universitário das Faculdades Metropolitanas Unidas, 2007. MERCK SHARP & DOHME DE MÉXICO, S. A. de C. V. Dicionário de especialidades farmacêuticas. [Online] [Citação: 7 de Junho de 2011.] http://www.libreriamedica8a.com/productos/3029.htm. Pezzini, B. R., Silva, M. S. e Ferraz, H. G. 2007. Formas farmacêuticas sólidas orais de libertação prolongada: sistemas monolíticos e multiparticulados. Revista Brasileira de Ciências Farmacêuticas, 2007, Vol. 43. Rouxinol, Florbela da Silva. 2009. Preparação de nanopartículas para sistemas de libertação controlada de substâncias activas usadas no tratamento de doenças oftalmológicas. Departamento de Engenharia Química : Faculdade de Ciências e Tecnologias da Universidade de Coimbra, 2009. Singh, Vinod; Bushetti, S. S.; Raju, S. Appala; Ahmad, Rizwan; Singh, Mamta. 2001. Glaucoma: a treatment by hydrogel. Pharma science monitor an international jounal of pharmaceutical sciences. 2001, Vol. 2. Suave, J.; Dalli Agnol, E. C.; Pezzin, A. P. T.; Silva, D. A. K.; Meier, M. M.; Soldi, V. 2006. Microencapsulação: Inovação em diferentes áreas. Revista Saúde e Ambiente. 2006, Vol. 7. Vaz, Fátima. 2005. Biomateriais II. Sistemas de Libertação Controlada de Fármacos. [Online] 8 de Agosto de 2005. [Citação: 18 de Dezembro de 2010.] nebm.ist.utl.pt/repositorio/download/720/14. 72 Elsa Alexandra do Nascimento Ribeiro ANEXOS Anexos A Lentes poliméricas Nesta secção são apresentadas algumas características das lentes das duas composições preparadas, nomeadamente, a massa das lentes, as dimensões (diâmetro e espessura) e a massa de maleato de timolol incorporada nas lentes, pelo método de oclusão. A.1 Massa das lentes Nas Tabela A.1 e Tabela A.2 são expostos os valores obtidos das pesagens efectuadas a cada lente, individualmente. Embora tenham sido preparadas um número elevado de lentes, apenas oito, de cada uma das composições, foram apresentadas, nos estudos da cinética da libertação de fármaco incorporado por oclusão e por absorção. Tabela A.1 – Massa individual das lentes de composição HEMA e MAA. 118,0 143,3 145,7 147,9 133,6 135,2 144,0 138,8 131,5 138,8 143,0 143,0 128,9 132,7 74 Massa das Lentes HEMA e MAA (mg) Brancas Com fármaco incorporado por oclusão 144,9 158,7 136,9 126,5 156,1 154,5 130,4 154,8 152,7 138,4 149,1 141,4 131,0 151,2 148,7 126,2 157,8 146,9 146,2 156,5 153,8 138,1 151,2 139,8 153,6 139,4 153,4 138,6 148,6 129,0 149,8 145,8 152,7 144,4 Elsa Alexandra do Nascimento Ribeiro Anexos Tabela A.2 – Massa individual das lentes de composição HEMA e MMA. 132,4 132,6 142,0 112,6 131,7 124,5 121,0 125,4 134,5 130,3 139,6 135,4 137,7 137,2 134,0 126,4 123,1 149,0 129,2 Massa das Lentes HEMA e MMA (mg) Brancas Com fármaco incorporado por oclusão 130,6 124,2 138,7 137,5 121,8 120,2 135,0 119,9 149,2 120,1 117,8 134,9 138,0 126,9 148,2 109,1 139,7 129,5 150,5 143,5 121,6 125,7 138,0 120,4 136,3 135,7 148,1 144,4 133,3 109,0 145,7 132,6 151,7 120,6 125,4 142,7 132,1 A.2 Dimensões das lentes Seguidamente são apresentados os valores obtidos, com o auxílio de uma craveira digital, das medidas, diâmetro e espessura, de cada lente. Foram efectuadas cerca de 4 medições a cada lente. Elsa Alexandra do Nascimento Ribeiro 75 Anexos Tabela A.3 – Diâmetro das lentes com composição HEMA e MAA. 16,84 17,12 17,16 16,89 17,19 17,27 17,31 16,95 17,09 16,94 17,18 16,19 16,56 16,56 16,77 16,90 16,53 17,53 16,68 16,89 16,68 16,76 17,31 17,48 76 16,61 16,72 16,71 17,14 16,85 16,63 16,85 16,86 16,72 16,85 16,91 17,12 17,05 16,78 17,17 16,85 16,62 16,62 16,62 17,09 17,42 17,34 17,32 16,87 Diâmetro das lentes HEMA e MAA (mm) Brancas Com fármaco incorporado por oclusão 16,41 16,66 16,64 16,96 17,86 17,73 17,67 16,50 16,96 16,74 16,65 17,37 17,48 17,76 16,63 17,22 16,88 17,00 17,42 17,04 17,77 16,62 17,38 16,79 16,30 17,33 17,14 16,95 16,43 17,01 16,74 17,46 17,40 17,35 17,05 16,58 17,04 16,87 17,64 17,22 17,18 16,87 16,62 16,73 16,48 17,52 17,34 17,11 16,78 16,51 16,43 16,61 17,32 17,28 17,26 16,95 17,01 16,61 16,69 17,32 17,10 17,31 17,09 17,16 16,53 16,51 17,13 17,57 17,39 16,94 17,02 16,71 16,85 17,14 16,86 17,27 17,18 17,06 16,81 16,81 16,59 17,29 17,39 17,24 16,68 16,56 16,46 17,15 17,36 17,39 17,39 16,68 17,18 16,54 17,38 17,29 17,29 17,52 16,59 17,35 16,73 17,23 17,56 16,84 17,35 16,80 17,32 16,70 17,09 17,29 17,00 17,43 17,14 17,01 16,57 17,63 17,54 17,00 17,59 17,21 16,64 16,62 17,61 16,97 16,83 17,35 17,35 16,73 16,99 17,45 17,22 17,29 17,33 17,20 16,75 17,01 17,50 17,07 17,31 17,29 16,68 16,64 17,08 17,49 17,16 17,62 17,70 16,70 17,09 16,90 17,34 17,19 17,26 17,38 16,84 16,85 17,11 17,28 17,20 17,44 17,34 16,87 16,67 17,48 17,16 17,44 17,51 Elsa Alexandra do Nascimento Ribeiro Anexos Tabela A.4 – Diâmetro das lentes com composição HEMA e MMA. 16,83 16,89 16,78 16,43 16,88 16,89 16,73 16,74 17,76 17,69 17,71 17,55 17,41 17,48 17,39 17,45 16,93 17,22 17,01 16,95 17,18 17,17 17,09 16,75 17,04 16,64 16,28 17,18 16,73 16,57 16,61 16,65 17,39 17,33 16,87 17,56 16,86 16,71 16,59 16,71 17,69 17,71 17,45 17,66 16,43 16,99 17,01 16,84 17,03 17,01 17,02 17,34 17,19 17,37 17,23 16,85 17,82 17,84 17,38 17,87 16,28 16,10 16,32 16,42 17,52 16,81 17,44 17,19 17,33 17,09 16,68 16,63 Diâmetro das lentes HEMA e MMA (mm) Brancas Com fármaco incorporado por oclusão 16,38 16,97 16,45 16,88 17,47 17,01 17,45 17,50 16,62 17,09 16,34 17,14 17,21 17,04 17,54 17,58 16,42 17,12 16,70 17,08 17,12 16,77 17,42 17,79 16,51 17,12 16,67 17,14 17,22 17,04 17,25 17,57 16,73 16,83 17,45 16,64 17,12 17,16 17,44 16,65 17,19 16,58 16,55 16,37 16,96 17,44 16,63 15,80 16,73 16,75 17,26 16,97 17,38 16,76 17,34 17,00 16,24 16,72 17,17 17,29 15,98 16,88 17,20 17,44 17,65 17,21 17,70 15,89 16,59 17,02 17,48 17,31 16,63 17,67 16,13 16,48 16,92 17,04 17,64 17,15 17,76 16,43 16,75 16,64 17,53 17,51 16,66 17,77 17,41 17,49 16,41 16,54 17,08 17,81 16,95 17,39 17,44 15,92 16,40 17,18 17,71 17,05 17,31 17,26 16,24 16,50 17,27 17,82 16,87 17,41 17,25 16,45 16,06 17,35 17,47 16,78 17,33 16,41 16,41 17,32 17,44 17,16 16,95 17,21 16,76 17,18 16,57 17,34 17,34 17,09 17,28 16,81 16,29 17,34 17,20 17,28 16,94 17,31 16,82 16,26 16,42 17,27 17,05 17,18 17,77 16,79 17,29 17,43 16,72 16,98 17,24 17,65 17,08 17,37 17,25 16,74 16,11 17,39 17,38 16,77 17,21 17,20 15,32 17,31 17,52 17,03 16,75 17,13 17,08 15,74 17,10 17,35 Elsa Alexandra do Nascimento Ribeiro 77 Anexos Tabela A.5 – Espessura das lentes com composição HEMA e MAA. 0,51 0,48 0,49 0,49 0,49 0,46 0,47 0,46 0,50 0,50 0,50 0,48 0,49 0,50 0,50 0,54 0,54 0,51 0,51 0,55 0,56 0,50 0,51 0,54 78 0,50 0,51 0,53 0,50 0,53 0,51 0,52 0,52 0,54 0,54 0,55 0,53 0,50 0,48 0,52 0,51 0,52 0,57 0,52 0,52 0,51 0,52 0,51 0,50 Espessura das lentes HEMA e MAA (mm) Brancas Com fármaco incorporado por oclusão 0,50 0,53 0,51 0,58 0,58 0,53 0,51 0,50 0,50 0,51 0,58 0,58 0,49 0,54 0,53 0,51 0,51 0,58 0,53 0,50 0,52 0,51 0,51 0,51 0,61 0,52 0,49 0,50 0,55 0,59 0,50 0,55 0,51 0,52 0,51 0,54 0,53 0,52 0,55 0,52 0,51 0,51 0,59 0,55 0,54 0,54 0,55 0,52 0,47 0,55 0,55 0,66 0,54 0,53 0,51 0,50 0,54 0,52 0,53 0,56 0,49 0,51 0,51 0,53 0,53 0,53 0,59 0,51 0,50 0,49 0,53 0,53 0,53 0,55 0,51 0,51 0,47 0,52 0,53 0,54 0,55 0,53 0,54 0,50 0,53 0,46 0,50 0,62 0,48 0,51 0,55 0,58 0,51 0,49 0,63 0,47 0,51 0,51 0,55 0,51 0,49 0,61 0,50 0,50 0,47 0,52 0,54 0,50 0,61 0,48 0,51 0,50 0,49 0,54 0,51 0,56 0,50 0,51 0,51 0,49 0,54 0,49 0,58 0,51 0,51 0,50 0,49 0,52 0,51 0,62 0,51 0,51 0,50 0,48 0,53 0,51 0,58 0,51 0,50 0,51 0,49 0,59 0,50 0,66 0,42 0,52 0,50 0,51 0,59 0,50 0,55 0,49 0,52 0,49 0,51 0,55 0,51 0,57 0,52 0,53 0,50 0,51 0,57 0,56 0,50 0,46 0,50 Elsa Alexandra do Nascimento Ribeiro Anexos Tabela A.6 – Espessura das lentes com composição HEMA e MMA. 0,46 0,46 0,42 0,44 0,45 0,46 0,47 0,46 0,5 0,52 0,45 0,46 0,42 0,44 0,48 0,49 0,5 0,52 0,54 0,49 0,45 0,48 0,55 0,49 0,49 0,48 0,52 0,48 0,55 0,50 0,50 0,52 0,53 0,48 0,52 0,48 0,49 0,48 0,47 0,47 0,47 0,49 0,49 0,52 0,42 0,45 0,49 0,47 0,47 0,41 0,47 0,48 0,49 0,48 0,48 0,49 0,49 0,48 0,42 0,47 0,51 0,44 0,40 0,50 0,47 0,49 0,47 0,54 0,49 0,48 0,46 0,52 Espessura das lentes HEMA e MMA (mm) Brancas Com fármaco incorporado por oclusão 0,47 0,42 0,51 0,52 0,44 0,47 0,49 0,48 0,49 0,47 0,49 0,56 0,50 0,49 0,47 0,47 0,49 0,48 0,49 0,56 0,46 0,45 0,49 0,47 0,50 0,47 0,48 0,56 0,45 0,45 0,46 0,46 0,48 0,46 0,50 0,43 0,46 0,44 0,51 0,50 0,46 0,47 0,43 0,47 0,43 0,51 0,51 0,48 0,45 0,48 0,46 0,42 0,47 0,48 0,47 0,48 0,47 0,45 0,45 0,50 0,55 0,50 0,48 0,49 0,49 0,46 0,51 0,47 0,51 0,53 0,49 0,48 0,47 0,49 0,48 0,50 0,48 0,47 0,48 0,49 0,47 0,49 0,49 0,50 0,51 0,46 0,49 0,50 0,50 0,42 0,49 0,42 0,48 0,53 0,55 0,53 0,44 0,48 0,43 0,50 0,49 0,51 0,54 0,47 0,50 0,45 0,48 0,48 0,47 0,52 0,48 0,53 0,45 0,52 0,47 0,50 0,48 0,48 0,53 0,51 0,50 0,46 0,51 0,47 0,48 0,53 0,46 0,49 0,49 0,50 0,46 0,52 0,46 0,47 0,45 0,51 0,50 0,47 0,57 0,46 0,44 0,45 0,48 0,51 0,47 0,48 0,50 0,44 0,47 0,42 0,50 0,48 0,50 0,48 0,46 0,44 0,42 0,49 0,51 0,47 0,48 0,44 0,44 0,42 0,50 0,46 0,53 0,5 0,44 0,46 0,44 0,50 A.3 Massa de maleato de timolol nas lentes incorporado por oclusão Tal como referido na secção 2.3.1, após a preparação da solução de polímero e da junção do fármaco, a mistura homogénea é colocada na estufa durante 24 horas. Após esse procedimento, são obtidas as membranas poliméricas que, apenas, depois de cortadas em pequenos discos, tomam a designação de lentes. Para determinação da massa, média, de maleato de timolol em cada lente, foi necessário saber a quantidade de fármaco que inicialmente se tinha colocado na mistura reaccional, a massa das membranas poliméricas obtidas, e a massa média das lentes. Valores indicados na Tabela A.7. Elsa Alexandra do Nascimento Ribeiro 79 Anexos Tabela A.7 – Massa das membranas poliméricas, massa média de uma lente e massa de maleato de timolol incorporado nas membranas e em uma lente das diferentes composições preparadas. Massas (mg) massa de fármaco nas membranas (mg) massa das membranas (mg) massa de uma lente (mg) massa de fármaco numa lente (mg) HEMA e MAA 20,7 ± 0,1 7192,5 ± 0,1 151,1 ± 5,4 0,435 ± 0,013 HEMA e MMA 10,0 ± 0,1 4070,9 ± 0,1 127,8 ± 10,5 0,314 ± 0,021 Seguidamente é apresentada a expressão utilizada no cálculo da massa de maleato de timolol presente numa lente. (A.1) Em que: é a massa de maleato de timolol presente, em média, em cada lente, com fármaco incorporado por oclusão; é a massa, média, de cada lente; é a massa de maleato de timolol incorporado nas membranas poliméricas; é a massa da membranas poliméricas obtidas. 80 Elsa Alexandra do Nascimento Ribeiro Anexos B Cinética de libertação do maleato de timolol em lentes com composição HEMA e MMA Nesta secção são apresentados os perfis de libertação do maleato de timolol, em lentes com composição HEMA e MMA, obtidos através da monitorização contínua e descontínua da concentração de fármaco no meio de libertação. B.1 Monitorização contínua da concentração de maleato de timolol no meio de libertação, para lentes com fármaco incorporado por oclusão No gráfico da Figura B.1 estão representadas as curvas de absorvância obtidas durante a libertação do fármaco no soro fisiológico, que foi monitorizada continuamente, assim como a média dos ensaios realizados com lentes “brancas” de composição HEMA e MMA, com o respectivo desvio padrão. Ensaios 1 2 3 4 5 branca 0,300 Absorvância 0,250 0,200 0,150 0,100 0,050 0,000 0 2 4 6 8 10 12 Tempo (h) 14 16 18 20 22 24 Figura B.1 – Monitorização contínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MMA (λmáx = 293 nm). Elsa Alexandra do Nascimento Ribeiro 81 Anexos B.2 Monitorização descontínua da concentração de maleato de timolol no meio de libertação, de lentes com fármaco incorporado por oclusão No gráfico da Figura B.2 encontram-se representadas as curvas de absorvância obtidas da libertação do maleato de timolol, que foi monitorizada descontinuamente, assim como a média dos ensaios realizados com lentes “brancas” de composição HEMA e MMA, com o respectivo desvio padrão. Ensaios 6 7 8 branca 0,300 Absorvância 0,250 0,200 0,150 0,100 0,050 0,000 0 2 4 6 8 10 12 14 Tempo (h) 16 18 20 22 24 Figura B.2 – Monitorização descontínua da libertação do maleato de timolol em lentes com o fármaco ocluso e em lentes “brancas” com composição HEMA e MMA (λmáx = 293 nm). 82 Elsa Alexandra do Nascimento Ribeiro Anexos C Cálculo das incertezas Nesta secção são apresentadas as expressões utilizadas da determinação das incertezas associadas aos valores apresentados ao longo desta dissertação. É relevante referir que após a determinação do valor da incerteza, este é multiplicado por um factor de expansão igual a 2, o que permite associar ao resultado um nível de confiança aproximadamente igual a 95%. C.1 Cálculo da incerteza associada à percentagem de absorção de água pelas lentes A percentagem da capacidade de absorção de água pelas lentes é determinada pela equação (5). (C.1) ( Em que ) representa a massa da lente após a absorção de água e representa a massa da lente seca. Efectuando as derivadas parciais à expressão (C.1) em ordem a cada um dos membros intervenientes da equação, obtém-se a expressão (C.2) que permite determinar a incerteza associada ao valor da percentagem de absorção de água. √( ) ( ) (C.2) Em que: é a incerteza associada ao valor da percentagem de absorção de água; é o valor da percentagem de absorção de água; Elsa Alexandra do Nascimento Ribeiro 83 Anexos é a incerteza associada ao valor da massa da lente hidratada; é a massa da lente hidratada; é a incerteza associada ao valor da massa da lente seca; é a massa da lente hidratada seca. C.2 Cálculo das incertezas associadas às curvas de calibração do maleato de timolol Sendo as curvas de calibração obtidas, descritas de forma adequada pelo modelo de regressão designado por método dos mínimos quadrados (polinómio do 1º grau, de acordo com a norma ISO 8466/1), o desvio padrão residual da curva de calibração é determinado através da expressão representada pela equação (C.3). ⁄ √∑ ( ( )) (C.3) Em que: ⁄ é o desvio padrão residual da curva de calibração; é a ordenada na origem da recta de calibração; é o declive da curva de calibração; é o número de leituras de padrões utilizados no traçado da curva de calibração; é a concentração de cada um dos padrões de calibração; é o sinal instrumental de cada padrão de calibração. 84 Elsa Alexandra do Nascimento Ribeiro Anexos C.3 Cálculo da incerteza associada à concentração de maleato de timolol Seguidamente é apresentado o cálculo da incerteza associada às concentrações de maleato de timolol, obtidas através das curvas de calibração do fármaco. Representado a curva de calibração com a expressão genérica: (C.4) Em que representa a absorvância obtida para uma solução de concentração declive da curva de calibração e , é o a ordenada na origem da recta de calibração. Efectuando as derivadas parciais da expressão de em ordem a cada um dos membros intervenientes da equação, obtém-se a expressão (C.5) que permite determinar a incerteza associada ao valor da concentração determinado através de cada uma das curvas de calibração do maleato de timolol. √( ) ( ) ( ) (C.5) Em que: é a incerteza associada ao valor da concentração; é o valor da concentração; é a incerteza associada ao valor do declive da curva de calibração; é o declive da curva de calibração; é a incerteza associada ao valor da ordenada na origem da curva de calibração; é a ordenada na origem da curva de calibração. Elsa Alexandra do Nascimento Ribeiro 85 Anexos C.4 Cálculo da incerteza associada à massa de fármaco em solução, massa de fármaco incorporada por soaking, massa de fármaco libertada no meio de libertação e percentagem de fármaco libertado O cálculo das incertezas associadas à massa de fármaco na solução utilizada no estudo de absorção (soaking), à massa de fármaco incorporada por soaking, à massa de fármaco libertada no meio de libertação e à percentagem de fármaco libertado, baseia-se nas expressões apresentadas em bibliografia (IPAC, 2007). 86 Elsa Alexandra do Nascimento Ribeiro
Download