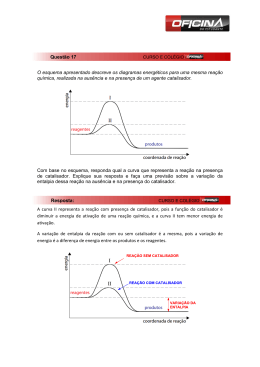
COLÉGIO ESTADUAL DR. REBOUÇAS – ENSINO FUNDAMENTAL E MÉDIO RIO BOM – PR PROFESSORA: ILDA FRACASSI BATISTA Proposta disciplinar- Química Química embutida Conteúdo estruturante: Biogeoquímica Conteúdos básicos: Reações químicas Conteúdo especifico: Velocidade das reações; Fatores que influenciam na velocidade da reação Quantidade de aulas: 4 aulas Etapa: Ensino Médio Recursos a serem utilizados: rótulos de embalagens de alimentos de enlatados e embutidos Livro didático quadro de giz laboratório de informática laboratório de química Encaminhamento metodológico O desenvolvimento da proposta será divida em quatro aulas. Em um primeiro momento será apresentado um texto para despertar a atenção dos alunos e os envolver no assunto proposto. No segundo momento será realizada pesquisas e analise de embalagens de embutidos, onde serão retirados dados necessários para o encaminhamento da aula, e no terceiro e quarto momento serão trabalhados conteúdos da cinética química. Aula 1 Nesse primeiro momento será apresentado um texto introdutório sobre alimentos embutidos, seus componentes e efeitos maléficos para a saúde com intuito de possibilitar aos alunos uma aproximação entre o conhecimento do dia- a- dia e o conhecimento cientifico, onde será realizado um momento de discussões. Você se alimenta ou come? Você já parou para pensar na diferença entre se alimentar e comer? É simples. Quando você se serve de um prato colorido, rico em fibras, minerais e vitaminas, está se alimentando. Por outro lado, se você monta um prato cheio de produtos enlatados e embutidos, está apenas matando a fome. Claro que a praticidade dos produtos enlatados é tentadora, mas é preciso muito cuidado. Não descuide da nutrição. Evite consumir enlatados e embutidos muitas vezes na semana. Para conservar estes tipos de alimentos, as indústrias abusam aditivos químicos. Para tornar estes alimentos mais atraentes, duráveis e práticos, os fabricantes usam inúmeros aditivos químicos. Os mais comuns são os aromatizantes, corantes, antioxidantes, estabilizantes, conservantes e acidulantes. São eles os responsáveis pelo sabor, cheiro e aspecto naturais dos alimentos industrializados. Estes tipos de alimentos trazem riscos à saúde. Podem causar alergias e doenças cardiovasculares. Quando consumidos em excesso, podem levar ao desenvolvimento de tipos específicos de câncer. Evite ceder à praticidade, porém se não tiver outra opção tenha muito cuidado ao escolher a lata. Alimentos enlatados e embalados à vácuo são mais suscetíveis a bactéria Clostridium Botulinum, isso porque o micro-organismo se desenvolve em locais sem oxigênio. Latas estufadas é sinal da presença da bactéria, o “inchaço” acontece pelos gases produzidos pela Clostridium Botulinum. Você já ouviu falar em nitritos e nitratos? Estas substâncias são usadas para conservação de alimentos como picles, salsichas, outros embutidos e alguns tipos de enlatados. Acontece que, no estômago, nitritos e nitratos se transformam em nitrosaminas, composição cientificamente cancerígena se consumida de forma continua e abundante. Lembre-se: alimentação saudável exige a ingestão de alimentos naturais e frescos, já os produtos industrializados, ricos em gordura saturada, sal e açúcar, devem passar longe do prato. Para prevenir doenças cardiovasculares, obesidade, diabetes e outros problemas de saúde, tenha uma alimentação adequada. Frutas, verduras, legumes e cereais integrais são ricos em vitaminas, minerais e fibras. Faças destes alimentos sua principal fonte de alimentação. Para a que a saúde não seja comprometida, lave os vegetais com atenção e produtos adequados. No final da aula será pedido aos alunos que tragam embalagens diversas de alimentos embutidos de casa para a próxima aula. Aula 2 Nesse momento os alunos serão divididos em grupos e orientados a analisar e em seguida anotar os componentes químicos e as quantidades presentes em cada alimento embutido e enlatado. Logo após realizarão pesquisas no laboratório de informática sobre as quantidades aceitáveis para consumo diário e será realizado uma comparação com os dados obtidos em sala de aula, sendo apresentados aos demais. Os alunos serão orientados a pesquisar os valores aceitáveis de componentes químicos no site da ANVISA (Agência Nacional de Vigilância Sanitária). Aula 3 Nessa aula será explicado o conteúdo: tipos de reações químicas. A aula será ministrada oralmente, utilizando como apoio o quadro de giz, o livro didático do aluno e o texto abaixo, que é um resumo que será entregue impresso a cada aluno. Tipos de reações químicas O que evidencia uma reação é a transformação que ocorre nas substâncias em relação ao seu estado inicial, essas modificações dependem do tipo de reação que os reagentes irão passar. Existem vários critérios para classificar reações químicas, um deles relaciona o número de substâncias que reagem (reagentes) e o número de substâncias produzidas (produtos). Para melhor exemplificar iremos utilizar as letras: A, B, C, X, Y. Reação de síntese ou adição: são aquelas que duas ou mais substâncias originam um único produto. A+ B → C Exemplo dessa reação: quando o magnésio reage com o oxigênio do ar: 2Mg(s) + 1 O2(g) → 2MgO(s) Essa reação se faz presente em flashes fotográficos descartáveis e foguetes sinalizadores. Reação de análise ou decomposição: nessa reação uma única substância gera dois ou mais produtos. A→ B + C Algumas reações recebem nomes especiais: Eletrólise: as substâncias se decompõem pela passagem de corrente elétrica. Fotólise: Pirólise: decomposição decomposição da pela substância ação do química calor e pela luz. do fogo. Exemplo: Os airbags são dispositivos de segurança presentes em vários automóveis. Quando acionamos esse dispositivo, a rápida decomposição do composto de sódio NaN3(s) origina N2(g) que faz inflar os airbags. Veja a reação: 2 NaN3(s) → 3 N2(g) + 2 Na(s) Reação de simples troca ou deslocamento: ocorre quando uma substância simples reage com uma composta originando novas substâncias: uma simples e outra composta. A + XY → AY + X Exemplo: Quando uma lâmina de zinco é introduzida em uma solução aquosa de ácido clorídrico, vai ocorrer a formação de cloreto de zinco e o gás hidrogênio vai ser Zn (s) + 2 HCl (aq) → ZnCl2(aq) + H2 (g) Observe que o Zinco deslocou o Hidrogênio, daí o porque do nome “reação de deslocamento”. Reação de dupla troca: dois reagentes reagem formando dois produtos, ou seja, se duas substâncias compostas reagirem dando origem a novas substâncias compostas recebem essa denominação. AB + XY → AY + XB Exemplo: a reação entre o ácido sulfúrico com hidróxido de bário produz água e sulfato de bário. H2SO4 (aq) + Ba(OH)2(aq) → 2 H2O(l) + BaSO4(s) O produto sulfato de bário: BaSO4(s) é um sal branco insolúvel. Por Líria Alves (Graduada em Química) Logo após será entregue aos alunos uma folha de atividades complementares. Colégio Estadual Dr Rebouças- Ensino Fundamental e Médio. Aluno (a) : __________________________________________ nº: ________ Atividades 1) A reação que representa a formação do cromato de chumbo II, que é um pigmento amarelo usado em tintas, é representada pela equação: Pb(CH3COO)2 + Na2CrO4 → PbCrO4 + 2 NaCH3COO Que é uma reação de: a) oxirredução b) dupla troca c) síntese d) deslocamento e) decomposição 2) O fermento de pão pode ser obtido através da seguinte reação química: CO2 + NaCl + NH3 + H2O → NaHCO3 + NH4Cl Reagentes para a obtenção do fermento (NaHCO3): gás carbônico (CO2), cloreto de sódio(NaCl), amônia (NH3) e água (H2O). Fermento para pães A equação acima demonstra a formação dos produtos: a) carbonato de sódio e cloreto de amônio b) bicarbonato de sódio hidrogenado e cloreto de amônio c) bicarbonato de sódio e cloreto de amônio d) tricarbonato de sódio e cloreto de amônio 3) No filme fotográfico, quando exposto à luz,ocorre a reação: 2 AgBr →2 Ag + Br2 Essa reação pode ser classificada como: a) pirólise. b) eletrólise. c) fotólise. d) síntese. e) simples troca. 4) O consumo de ácido sulfúrico pode ser utilizado como um indicador do desenvolvimento de um país. Industrialmente, esse ácido pode ser obtido a partir da pirita de ferro, que consiste basicamente em sulfeto ferroso (FeS). Classifique as equações de obtenção industrial do ácido sulfúrico mostradas a seguir: I. FeS + O2 → Fe + SO2 II. 2 SO2 + 2 O2 → 2 SO3 III. SO3 + H2O → H2SO4 a) Dupla troca, síntese, síntese. b) Dupla troca, análise, análise. c) Síntese, simples troca, dupla troca. d) Simples troca, análise, análise. e) Simples troca, síntese, síntese. Aula 4: Nessa aula será explicado o conteúdo velocidade das reações e quais são os fatores que implicam na velocidade da reação . Como na aula 3, o conteúdo será explicado oralmente , utilizando como apoio o quadro de giz e livro didático do aluno, textos e atividades impressas. Velocidade das reações químicas A Cinética Química é um campo que estuda os fatores que influenciam a taxa de desenvolvimento das reações químicas, isto é, a velocidade com que se processam. Há cada vez mais pesquisas em torno desta área, visto que muitas vezes queremos acelerar algumas reações ou diminuir a rapidez de outras. Isso é especialmente importante para as indústrias e essas pesquisas têm importantes consequências tecnológicas. Mas, visto que a velocidade de uma reação pode variar em cada intervalo de tempo e de uma substância para outra, costuma-se calcular a velocidade média das reações. Considere a reação genérica a seguir, em que os coeficientes são as letras minúsculas e os reagentes e produtos estão representados pelas letras maiúsculas: aA+bB→cC+dD A velocidade média dessa reação será dada dividindo-se a velocidade média de reação de qualquer uma das substâncias reagentes ou a velocidade média de formação de qualquer um dos produtos pelo seu respectivo coeficiente na equação química. Isto é dado por: FATORES QUE ALTERAM A VELOCIDADE DAS REAÇÕES QUÍMICAS Alguns fatores podem aumentar ou diminuir a velocidade de uma reação química. São eles: - temperatura - superfície de contato - pressão - concentração - presença de luz - catalisador - inibidores Temperatura A temperatura está ligada à agitação das moléculas. Quanto mais calor, mais agitadas ficam as moléculas. Se aumenta a temperatura, aumenta a energia cinética das moléculas (movimento). Se as moléculas se movimentam mais, elas se chocam mais e com mais energia, diminuindo a energia de ativação e em consequência, aumenta o número de colisões efetivas e portanto a velocidade da reação também aumenta. Por este motivo, aumentamos a chama do fogão para cozinhar e utilizamos a geladeira para evitar a deterioração dos alimentos. Superfície de Contato A área de contato entre os reagentes também interfere na velocidade das reações químicas. Quanto maior a superfície de contato, maior o número de moléculas reagindo, maior o número de colisões eficazes e portanto, aumenta a velocidade da reação. Isto explica porque devemos tomar um comprimido de aspirina, por exemplo, inteiro do que em pó. O comprimido em pó reage mais rapidamente, causando lesões no nosso estômago. Se ele for ingerido inteiro, levará mais tempo para reagir, evitando lesões. Uma substância em pó reage mais rápido do que uma substância inteira porque possui maior superfície de contato. Veja outros exemplos: - a carne é digerida mais facilmente quando mastigada do que inteira; - gravetos queimas mais rápido do que um pedaço de madeira de mesma massa; - palha de aço queima mais rápido do que um pedaço de ferro de mesma massa. Pressão Pressão é a razão entre força e área, ou seja, fazer força sobre uma determinada área. Com o aumento da pressão em um recipiente, diminui o volume e desta forma aumenta a concentração dos reagentes. As moléculas se chocam mais, aumentando o número de colísões e portanto, aumenta a velocidade da reação. Concentração está relacionado à quantidade de soluto e de solvente de uma substância. Se aumenta a concentração de reagentes , aumenta o número de moléculas dos reagentes, aumentando o número de colísões e aumentando também a velocidade da reação. Está associada à Lei Cinética (Lei de Guldber-Waage). Quando se aumenta a concentração de oxigênio numa queima, a combustão acontece mais rápido. Presença de Luz Algumas reações químicas ocorrem com maior velocidade quando estão na presença de luz. A luz influencia na velocidade das reações porque é uma energia em forma de onda eletromagnética que ajuda a quebrar a barreira da energia de ativação. A água oxigenada, por exemplo, se decompõe mais facilmente quando está exposta à luz, por isso devemos deixá-la guardada em local escuro. A fotossíntese realizada pelas plantas é um tipo de reação que é influenciada pela presença da luz. Outra reação onde é muito utilizada a luz é a decomposição do AgBr que dá origem aos filmes fotográficos. Catalisador Catalisador é uma substância química que não participa da reação química. Diminui a energia de ativação e aumenta a velocidade da reação. O catalisador acelera a reação mas não altera a composição química dos reagentes e produtos envolvidos. A quantidade de substância produzida na reação não se altera com o uso de catalisadores. Se a reação for reversível, a reação inversa também será acelerada, pois sua energia de ativação também O catalisador não altera a variação de entalpia. terá um valor menor. Gráficos com e sem catalisadores: Catálise é o aumento de velocidade da reação, provocado pelo catalisador. A palavra catálise, do grego katálysis, foi introduzida, em 1835, por Berzeliu. No nosso organismo existem muitos catalisadores, que são chamados de enzimas. A saliva e o suco gástrico (que contém ácido clorídrico) são exemplos de enzimas que aumentam a velocidade da reação, no caso, a digestão. Nas indústrias químicas, principalmente a petroquímica, os catalisadores são muito utilizados para acelerar as reações, deixando o processo mais barato. Uma forma de ver a ação dos catalisadores é adicionando açúcar ao refrigerante. Os refrigerantes carbonatados contém dióxido de carbono (gás carbônico) e pode ser eliminado mais facilmente com adição de açúcar. A reação de eliminação do gás acontece com mais velocidade e percebe-se a formação de bolhas do gás deixando a solução. Na equação química, coloca-se o catalisador em cima da seta que representa a reação química. Em função dos estados físicos dos reagentes e produtos, a catálise pode ser homogênea ou heterogênea. - catálise homogênea: quando reagentes e catalisador estão no mesmo estado físico formando um sistema monofásico. - catálise heterogênea: quando reagentes e catalisador não estão no mesmo estado físico formando um sistema heterogêneo. Não existe um tipo ideal de catalisador. Para cada reação química existe um tipo diferente de catalisador. Os catalisadors mais comuns são: - metais - principalmente os de transição: Co, Ni, Pt, Pd - ácidos - que catalisam muitas reações orgânicas: H2SO4 - óxidos metálicos – Al2O3, Fe2O3 - bases - NaOH - enzimas – produzidas pelos organismos vivos: lipase, suco gástrico. Inibidores São substâncias, que ao contrário dos catalisadores, aumentam a energia de ativação e como consequência diminuem a velocidade da reação química. Pode ser chamado também de veneno de catalisador ou anticatalisador. Antigamente era chamado de catalisador negativo. Velocidade Instantânea Nas reações químicas a velocidade a cada instante é diferente da velocidade média. As velocidades instantâneas nunca são as mesmas, possuindo valores diferentes durante a reação. Se os intervalos de tempo utilizados nas medidas da velocidade média forem ficando cada vez menores, a velocidade média tenderá a assumir valores cada vez mais próximos da velocidade em um certo instante. Velocidade Instantânea é o valor para o qual tende a velocidade média quando os intervalos de tempo vão se tornando cada vez menores. Após a explicação do conteúdo,será realizados experimentos para melhor fixação. Experimento 1: Influência da temperatura na velocidade da reação Esse experimento será observado o que ocorre com a velocidade das reações quando se varia a temperatura. Para isto, serão medidos os tempos de reação para três sistemas formados pelos mesmos componentes , mas sob temperaturas diferentes. Materiais e reagentes 3 copos de 250 mL cronômetro água gelada e água quente termômetro até 100 ° C. 3 comprimidos de anti – ácido efervescente Procedimento: 1. Encha um copo com água gelada, anote sua temperatura. 2. Coloque um comprimido efervescente no béquer e anote o tempo que decorre até dissolução completa. 3. Repita as mesmas operações com água à temperatura ambiente (25 ° C) e água a 50° C. Experimento 2: Influencia da superfície de contato na velocidade da reação Nesse experimento será verificado o que ocorre com a velocidade das reações quando existe uma maior ou menor superfície de contato. Materiais e reagentes 2 copos com 250 mL de água 2 comprimidos anti – ácido efervescente Procedimento: 1. Coloque um comprimido efervescente inteiro em um copo com água e no outro copo um comprimido triturado. Observe. Após os experimentos, os alunos farão um relatório explicando o observado. Perspectiva de abordagem interdisciplinar: Biologia- Fungos e bactérias: ação dos mesmos sobre os alimentos. Matemática- Porcentagem, gráficos e tabelas: interpretação de informações contidas nos rótulos, e criação e leitura de gráficos e tabelas. Material complementar Alimentos enlatados e embutidos causam danos à saúde . Disponível em: http://saude.consultaclick.com.br/6591/ alimentacao/alimentos-enlatados-eembutidos-causam-danos-a-saude. Acesso em: 29/out./2014. Cinética química. Disponível em: http://www.soq.com.br/conteudos/em/cineticaquimica/p5.php. Acesso em: 30/out./2014. Tipos de reações químicas. Disponível em: www.brasilescola.com/quimica/tiposreacoes-quimicas.htm. Acesso em: 30/out.//2014. Velocidades das reações. Disponível em: http://www.brasilescola.com/quimica/velocidade-das-reacoes-quimicas.htm. Acesso em: 30/out./2014. Referencias Diretrizes Curricular do Ensino Médio
Download