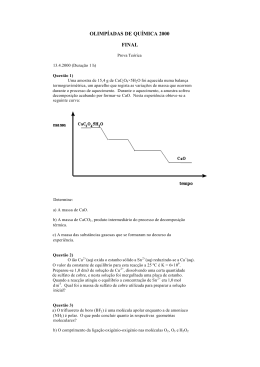
Estudo da reactividade de alguns metais Sílvia Carina Carvalho Ribeiro Escola Secundária Ibn Mucana, Rua do Pombal, 2645-074 Alcabideche Objectivo Estudo da reactividade de alguns metais através da ocorrência de reacções de deslocamento de acordo com a posição dos metais na tabela dos pontecias normais de redução (E0). Introdução Um metal num composto pode ser deslocado por outro metal no estado não combinado, através de reacções de oxidação-redução. uma forma de prever se uma reacção irá ocorrer é recorrendo a série electroquímica. Esta série é uma escala onde os elementos químicos estão colocados por ordem decrescrente de reactividade e por ordem crescente de pontencial normal de redução, ou seja, qualquer metal com menor potencial normal de redução 0 do que o Hidrogénio ( E2 H + / H 2 = 0volt ) desloca o Hidrogénio da água ou ácidos, enquanto que os metais com o pontencial normal de redução maior do que o Hidrogénio não reagem com água ou ácidos, deste modo o elemento mais reactivo desloca o menos reactivo da vizinhança dos outros átomos. Assim ter-se-á[1]: Li, K, Rb, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Pb, H, Cu, Ag, Pd, Au Menor Reactividade e Maior Potencial de Redução Todos os ensaios foram realizados em tubo de ensaio e os resultados apreciados de um modo qualitativo, ou seja observação das cores das soluções, formação de depósitos metálicos e/ou libertação gasosa. Resultados C – Reacção de deslocamento entre elementos metálicos • Cu2+ (aq) + Zn (s) → Zn2+ (aq) + Cu (s) A cor azul da solução de Sulfato de Cobre torna-se menos intensa ao mesmo tempo que se forma um depósito de Cobre sobre o Zinco. A – Reacção de alguns metais com HCl • Magnésio Mg (s) + 2H+ (aq) → H2 (g) + Mg2+ (aq) A reacção é muito rápida, com libertação de calor e de Hidrogénio. • Após agitação da solução de Sulfato de Zinco com as aparas de Cobre, não se verificou qualquer reacção. • Alumínio 2Al (s) + 6H+ (aq) → 3H2 (g) + 2Al3+ (aq) A reacção é rápida, com libertação de Hidrogénio. • Cu2+ (aq) + Mg (s) → Mg2+ (aq) + Cu (s) Observa-se a dissolução do Magnésio ao mesmo tempo que se forma uma depósito de Cobre. A cor azul da solução de Sulfato de Cobre torna-se menos intensa. • Zinco Zn (s) + 2H+ (aq) → H2 (g) + Zn2+ (aq) A reacção é rápida, com libertação do Hidrogénio. • Após a agitação da solução de Sulfato de Magnésio com as aparas de Cobre, não se verificou qualquer reacção. • Ferro Fe (s) + 2H+ (aq) → H2 (g) + Fe2+ (aq) A reacção é lenta, com libertação de Hidrogénio. • Nas três situações: Adição de aparas de Cobre, Zinco e de Alumínio a uma solução de Cloreto de Sódio não se observou qualquer reacção em nenhum caso. • Cobre Não se observa qualquer reacção. B – Reacção do Cobre com o HNO3 : Cu (s) + 4H+ (aq) + 2NO3- (aq) → Cu2+ (aq) + 2NO2 (g) + 2H2O (l) A reacção dá-se com velocidade moderada, com libertação de calor e ocorrendo a libertação de um gás, NO2, amarelo acastanhado, no final a mistura torna-se azul. • 2Ag+ (aq) + Mg (s) → Mg2+ (aq) + 2Ag (s) Verifica-se a dissolução do Magnésio e a formação de um depósito cinzento de Prata. • 2Ag+ (aq) + Zn (s) → Zn2+ (aq) + 2Ag (s) Verifica-se a dissolução do Zinco e a formação de um depósito cinzento de Prata. Conclusões O magnésio, o Alumínio, o Ferro e o Zinco em solução de HCl, reagiram, libertando H2(g), porque são metais reactivos e com valores de potenciais 0 0 normais de redução E( M n+ / M ) menores do que o potencial de redução E20H + / H = 0Volt . O Cobre não reagiu nesta solução, porque E 2+ maior do que / Cu Cu 2 0 o do E2 H + / H = 0 . 2 O Cobre reagiu somente com uma solução de ácido nitrico libertando NO2 (g). Nas reacções de deslocamento entre metais constatou-se que o mais reactivo desloca o menos reactivo da vizinhança das outras espécies em solução.. Referências [1]- R. Chang, Química, Lisboa, McGraw-Hill, 5ª Edição (1994) Estágio realizado em Setembro de 2005 Agradecimentos Agradeço à Ciência Viva (Agência Nacional para a Cultura Ciêntifica e Tecnológica) ao Centro de Estudos de Engenharia Química do ISEL (CEEQ), e aos orientadores Engº. António Pontinha e Enga. Vanda Pacheco da Secção de Química Inorgânica.
Baixar