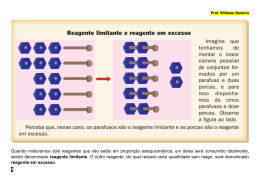
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 15/05/2012 Tema da aula: Reagente em excesso e reagente limitante “Os cálculos estequiométricos vistos até agora referem-se a condições teóricas. Na prática, em certas situações, os reagentes são misturados em quantidades não estequiométricas, ou então apresentam impurezas. Nem sempre, também, as reações ocorrem com aproveitamento total. A seguir estudaremos algumas dessas situações práticas”. Reagente em excesso e reagente limitante Quando misturamos dois reagentes que não estão em proporção estequiométrica, um deles será consumido totalmente, sendo denominado reagente limitante. O outro reagente, do qual restará certa quantidade sem reagir, será denominado reagente em excesso. Para resolver questões que envolvem reagentes limitantes e em excesso, podemos seguir as etapas abaixo: a) considere um dos reagentes como limitante e determine quanto de produto seria formado; b) repita o procedimento para o outro reagente; c) a menor quantidade de produto encontrada corresponde ao reagente limitante e indica a quantidade de produto formada. Veja um exemplo: Foram misturados 40 g de hidrogênio (H2) com 40 g de oxigênio (O2), com a finalidade de produzir água, segundo a equação: 2 H2 (g) + 1 O2 (g) → 2 H2O (v) Determine: a) o reagente limitante; b) a massa do produto formado; c) a massa do reagente em excesso. (Dados: massas molares: H2 = 2 g/mol, O2 = 32 g/mol, H2O = 18 g/mol). Aula 25 Página 1 Solução Inicialmente vamos considerar que o H2 (g) seja o reagente limitante: Em seguida, vamos considerar que o O2 (g) seja o reagente limitante: Observe que a menor quantidade de água produzida será de 45 g, correspondente ao consumo total de O2 (g), que é, então, o reagente limitante. Agora vamos calcular a massa de H2 (g) que será consumida e o que restou em excesso: A massa de H2 que irá reagir é igual a: Como a massa total de H2 (g) era de 40 g e só 5 g de H2 (g) reagiram, teremos um excesso de 35 g de H2 (g). Assim, temos: a) reagente limitante: O2 (g); b) massa de água formada: 45 g; c) massa de H2 (g) em excesso: 35 g. EXERCÍCIOS DE CLASSE 1. (FUVEST) – Nas indústrias petroquímicas, enxofre pode ser obtido pela reação: 2 H2S + SO2 → 3 S + 2 H2O Qual é a quantidade máxima de enxofre, em gramas, que pode ser obtida partindo-se de 5 mols de H2S e 2 mols de SO2? Indique os cálculos. (Dado: massa molar do S = 32 g/mol) 2. (VUNESP) – A reação para a produção do pesticida organoclorado DDT é: CCl3CHO + 2 C6H5Cl → (ClC6H4)2CHCCl3 + H2O (Massas atômicas: H = 1; O = 16; C = 12; Cl = 35,5). a) Calcule a massa de DDT que se forma quando 100 g de CCl3CHO reagem com 100 g de C6H5Cl. b) Indicar o reagente que está em excesso justificando a resposta. O que deve ocorrer, se a massa de CCl 3CHO for duplicada? Aula 25 Página 2 3. (UNIFESP 2010) – Em uma aula de laboratório de química, foram realizados três experimentos para o estudo da reação entre zinco e ácido clorídrico. Em três tubos de ensaio rotulados como I, II e III, foram colocados em –3 cada um 5,0 x 10 mol (0,327 g) de zinco e 4,0 mL de solução de ácido clorídrico, nas concentrações indicadas na figura. Foi anotado o tempo de reação até ocorrer o desaparecimento completo do metal. A figura mostra o esquema dos experimentos, antes da adição do ácido no metal. a) Qual experimento deve ter ocorrido com menor tempo de reação? Justifique. b) Determine o volume da solução inicial de HCl que está em excesso no experimento III. Apresente os cálculos efetuados. EXERCÍCIOS COMPLEMENTARES 1. (VUNESP) – 24 g de ferro (massa molar do Fe = 56 g/mol) reagem com 8 g de enxofre (massa molar do S = 32 g/mol) para formar FeS. A reação ocorre por aquecimento até o desaparecimento de um dos reagentes. Qual é o reagente em excesso e qual a massa que restou desse reagente após a reação? 2. (FUVEST) – Qual a quantidade máxima de carbonato de cálcio que pode ser preparada a partir da mistura de 2 mols de carbonato de sódio e 3 mols de cloreto de cálcio? (Dado: massa de um mol de carbonato de cálcio = 100 g). a) 100 g. b) 200 g. c) 300 g. d) 400 g. e) 500 g. 3. (UFRJ 2010) – O Complexo Petroquímico do Estado do Rio de Janeiro (COMPERJ), atualmente em fase de implantação no município de Itaboraí, utilizará como matéria-prima principal o petróleo pesado produzido no Campo de Marlim, na Bacia de Campos. Os produtos mais importantes do COMPERJ podem ser vistos na tabela a seguir. Principais produtos do COMPERJ a Produtos de 1 geração Produção mensal (em 1.000 ton.) Eteno Propeno Benzeno Butadieno p-xileno Enxofre a 1300 881 608 157 700 45 Produtos de 2 geração Produção mensal (em 1.000 ton.) Polipropileno Polietileno Estireno Etilenoglicol Ácido tereftálico PET 850 800 500 600 500 600 A produção de enxofre elementar no COMPERJ será realizada através do processo Claus, que utiliza o sulfeto de hidrogênio retirado do petróleo. O processo envolve duas etapas: na primeira etapa, sulfeto de hidrogênio, em excesso, reage com oxigênio para formar dióxido de enxofre. Na segunda etapa, o dióxido de enxofre formado na primeira etapa reage com o sulfeto de hidrogênio, fornecendo o enxofre elementar. Sabendo que as reações são completas e que para cada mol de oxigênio consumido são adicionados 170 g de sulfeto de hidrogênio, calcule as quantidades (em g) de enxofre elementar produzido e de sulfeto de hidrogênio que não reagiu. Aula 25 Página 3 4. (UNICAMP) – Antoine Laurent Lavoisier (1743-1794), o iniciador da Química Moderna, realizou, por volta de 1775, vários experimentos. Em um deles aqueceu 100 g de mercúrio (Hg) em presença de ar, dentro de um recipiente de vidro fechado, obtendo 54 g de óxido vermelho de mercúrio, tendo ficado ainda sem reagir 50 g de mercúrio. Pergunta-se: a) qual a razão entre a massa de oxigênio e a de mercúrio que reagiram? b) qual a massa de oxigênio que seria necessária para reagir com todo o mercúrio inicial? 5. (UFMG 2010) – Considere uma reação hipotética que ocorre em fase gasosa e envolve os reagentes X e Y e o produto Z. Num experimento, foram misturados, em um recipiente, 5 mol de X com 5 mol de Y. Após 1 minuto, nesse recipiente, havia 4 mol de X, 3 mol de Y e 1 mol de Z, como registrado neste quadro: X Início Y 5 mol 5 mol Z 0 Após 1min 4 mol 3 mol 1 mol Suponha que essa reação prossegue até o consumo total do reagente limitante. Considerando-se a quantidade inicial de X e Y, é CORRETO afirmar que a quantidade máxima de Z a ser obtida nessa reação é de a) 2,5 mol. Aula 25 b) 3,5 mol. c) 4 mol. d) 5 mol. Página 4
Download