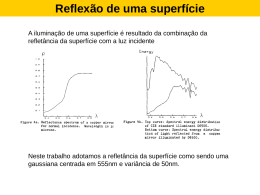
Sistema XYZ No sistema Yxy, as diferenças não são uniformes: Sistema L*u*v* O sistema L*u*v* (1976) é obtido a partir de XYZ: L*=100(Y/Yn)1/3-16 Un*=13L*(u*-un*) Vn*=13L*(v*-vn*) Onde: 4X 4 X + 15Y + 3Z 9Y v* = X + 15Y + 3Z u* = E=((L*)2+(u*)2+(v*)2) 4 Xn un* = 4 Xn + 15Yn + 3Zn 9Yn vn* = Xn + 15Yn + 3Zn Sistema L*u*v* Sistema L*a*b* O Sistema CIE L*a*b* (1976) também é uniforme: L*=116 (Y/Yn)1/3 - 16 a*=500 ((X/Xn)1/3 - (Y/Yn)1/3) b*=200 ((Y/Yn)1/3 - (Z/Zn)1/3) A diferença entre duas cores se dá pela relação: E=((L*)2+(a*)2+(b*)2)1/2 Obs.: Xn, Yn e Zn correspondem ao branco nominal. Sistema L*a*b* L* = 100 L* = claridade (100 a 0) +a* = vermelho - a* = verde +b* = amarelo - b* = azul + b* - a* + a* - b* L* = 0 Sistema L*C*h Associadas ao sistema L*a*b* existem as seguintes variáveis: Luminosidade: L*=116 (Y/Yn)1/3 - 16 Saturação: C*=(a*2+b*2)1/2 Ângulo de Tonalidade: h=arc tg (b*/a*) Que definem o sistema L*C*h Sistemas L*a*b* e L*C*h Diferenças de cor • Para a determinação de diferenças de cor usa-se o parâmetro E: E * ab = ( L* )2 + ( a* )2 + ( b* )2 • Para a determinação de diferenças de tonalidade usase o parâmetro H: * * 2 * 2 * 2 Hab = ( Eab ) ( L ) ( Cab ) Diferenças de cor E Diferença de cor < 0,2 imperceptível 0,2 a 0,5 muito pequena 0,5 a 1,5 pequena 1,5 a 3,0 distinguível 3,0 a 6,0 facilmente distinguível 6,0 a 12,0 grande > 12,0 muito grande Norma CIE 1994 Apesar do espaço CIE L*a*b* de 1976 ser uniforme, a percepção de diferenças de cor no seu interior não é uniforme, o que levou a CIE a criar o parâmetro E*94 L E = kL .SL * * 94 Onde: C + kC .SC 2 SL = 1 * SC = 1 + 0,045Cab * SH = 1 + 0,015Cab kL = kC = kH = 1 * ab H + kH .SH 2 * ab 2 Norma CIE 1994 Como o valor de E*94 depende do valor de C*ab, normalmente usa-se o valor do padrão. Quando nenhuma das amostras pode ser considerada como padrão, usa-se a média geométrica entre ambas: SL = 1 * * SC = 1 + 0,045 Cab . C ,1 ab, 2 * * SH = 1 + 0,015 Cab . C ,1 ab, 2 Norma CIE 1994 Em algumas aplicações pode ser interessante alterar os parâmetros colorimétricos kL, kC ou kH. Neste caso a notação deve ser: E*94(kL,kC,kH) Na indústria têxtil é comum usar kL=2, de forma que a notação a ser usada é: E*94(2,1,1) Norma CMC O ECMC é similar ao E*94: ECMC L C H + + = l.SL c.SC SH * * SL = 0.040975L 1 + 0.01765L* SL = 0.511 2 , L* > 16 , L* 16 * 0.0638C = + 0.638 SC * 1 + 0.0131C SH = ( FT +1 - F )SC * 2 * 2 Na indústria têxtil utiliza-se normalmente: l=2 c=1 INTERAÇÃO LUZ-MATÉRIA Emissão Reflexão Transmissão Absorção Difração Emissão A emissão de luz ocorre por quatro mecanismos básicos: • Emissão atômica ou molecular • Emissão térmica • Fluorescência e fosforescência • Emissão estimulada Emissão atômica ou molecular É a emissão devida à transição de elétrons entre um estado excitado e o estado fundamental. Se caracteriza pela emissão em raias estreitas. Raias de emissão Do hidrogênio Emissão térmica Se dá pela dissipação da energia vibracional dos átomos e/ou moléculas na forma de fótons. É caracterizada por um espectro contínuo dependente da temperatura. Fluorescência e fosforescência Ocorre quando o retorno de um elétron do estado excitado ao fundamental se dá em mais de um estágio, passando por condições meta-estáveis. •Fluorescência: tempos de até 10-6 s •Fosforescência: tempos de até 10 s Fluorescência Fluorescência Luz do dia Lâmpada incandescente Emissão estimulada • Ocorre quando a passagem de um fóton perto de um elétron excitado, induz a emissão de um fóton idêntico. • Caracteriza-se por uma emissão monocromática, paralela, polarizada e coerente (mesma fase) • É o LASER (“Light Amplification by Stimulated Emission of Radiation”) Laser Absorção Da mesma forma que um eletron excitado emite um fóton ao passar para o estado fundamental, um elétron no estado fundamental pode absorver um fóton e passar para um estado de maior energia. Uma substância irá absorver luz na região do visível se houverem transições eletrônicas possíveis com energias envolvidas da grandeza da energia de um fóton de luz visível. Absorção Normalmente as energias associadas às transições eletrônicas em átomos ou moléculas simples são da ordem de grandeza da energia de fótons de Raios-X. Mas em moléculas ou cristais de estrutura eletrônica mais complexa, estas transições podem ocorrem com energias mais baixas, na região do visível. Absorção Teoria dos campos ligantes 4p* 4p s* 4s* eg* 4s t2g 3d s eg s 4p 4s Fe+2 FeS2 S-2 Absorção • Teoria das bandas de energia Energia Bandas de condução E E Bandas de valência Isolante Semicondutor Condutor Objetos transparentes A luz não sofre espalhamento ao atravessá-los mas é parcialmente absorvida. reflectância especular fonte de luz transmitância regular Objetos translúcidos A luz sofre espalhamento e absorção parciais ao atravessá-los reflectância difusa transmitância difusa reflectância especular fonte de luz transmitância regular Objetos opacos A luz não atravessa os objetos reflectância difusa fonte de luz reflectância especular (brilho) Ótica Geométrica • Refração Lei de Snell: sin b sin a = n0 n1 Ótica Geométrica • Reflexão regular sen 2 (a - b ) R^ = 2 sen (a + b ) tan2 (a - b ) R|| = tan2 (a + b ) Rreg 1 sen2 (a - b ) tan2 (a - b ) = 2 + 2 2 sen (a + b ) tan (a + b ) Ótica Geométrica Polarização da luz refletida 1.0 Perpedicular 0.9 Paralela 0.8 Total Reflexão 0.7 0.6 0.5 n0=1,00 n1=1,57 0.4 0.3 0.2 0.1 0.0 0 10 20 30 40 50 Angulo (graus) 60 70 80 90 Ótica Geométrica • Reflexão total n0 sena 0= n1 • Incidência perpendicular Rreg n1 - n0 = n1 + n0 2 Treg 4n1n0 = 2 + ( n1 n0 ) Ótica Geométrica Comportamento da luz refletida 1.0 Perpedicular 0.9 Paralela 0.8 Total Reflexão 0.7 0.6 n0=1,57 n1=1,00 0.5 0.4 0.3 0.2 0.1 0.0 0 10 20 30 40 50 Angulo (graus) 60 70 80 90 Índices de refração Índices de refração de alguns minerais: Carbonato de cálcio (calcita) 1,486 - 1,658 Talco 1,54 – 1,60 Mica muscovita 1,55 – 1,61 Sulfato de bário 1,636 – 1,648 Óxido de magnésio Caulim Sílica (quartzo) Dióxido de titânio (rutilo) Dióxido de titânio (anatásio) 1,736 1,55 – 1,57 1,544 – 1,553 2,61 – 2,90 2,498 – 2,562 Sulfato de cálcio hidratado (gipsita) 1,52 – 1,55 Silicato de zircônio (zirconita) 1,96 – 2,01 Óxido de zircônio (badeleita) 2,13 – 2,20 Sílica hidratada (opala) 1,3 – 1,45 Hidróxido de alumínio 1,56 – 1,60 Índices de refração Índices de refração de alguns polímeros: Acetato de celulose (CA) 1,49 Butil acetato de celulose (CAB) 1,478 Policloreto de vinila (PVC) 1,54 Fluoreto de polivinilideno (PVDF) 1,42 Nylon 6 (PA6) 1,53 Policarbonato (PC) 1,585 Polietileno sulfonato (PES) 1,65 Polietileno de baixa densidade (LDPE) 1,51 Polietileno de alta densidade (HDPE) 1,54 Polietileno tereftalato (PET) 1,58 - 1,64 Polimetilmetacrilato (PMMA) 1,49 Polioximetileno (POM) 1,48 Poliestireno (PS) Politetrafluoretileno (PTFE) 1,59 - 1,60 1,38 Índices de refração Índices de refração de alguns líquidos: Acetona 1,357 Tetracloreto de carbono 1,459 Etileno glicol 1,431 Etanol 1,359 Metanol 1,326 Metiletilcetona (MEK) 1,377 Polietileno glicol 1,460 Tolueno 1,493 Ciclohexano 1,424 Estireno 1,545 Água 1,335 Índices de refração O índice de refração pode ser também representado por um número complexo do tipo n-ik, onde k é o coeficiente de absorção do material. Para o óxido de cobre I: l (nm) n k 300 2,00 1,85 350 2,40 1,44 400 2,80 0,99 450 3,06 0,60 500 3,12 0,35 550 3,10 0,19 600 3,02 0,13 650 2,90 0,10 700 2,83 0,083 Funcionamento da fibra ótica O funcionamento da fibra ótica se baseia no fenômeno da reflexão total: Toda a luz que penetrar em uma extremidade da fibra com um ângulo menor que o limite de reflexão total vai sendo refletida indefinidamente sem ocorrer perda lateral de energia. Ótica Geométrica Iluminação difusa (Lei de Lambert) p 2 Rdif = 2 Rreg (a ). sena . cos a .da 0 Reflexão regular/difusa • A diferença entre uma reflexão regular ou difusa está na qualidade da superfície. • A transição entre estes modos pode ser estimada pelo critério de Rayleigh: h= l 8. cos q Luz visível: (380 a 780 nm) h : altura das irregularidades l : comprimento de onda q : ângulo de incidência q = 0o q = 45o h = 0,07 mm q = ~90o h = 4,0 mm h = 0,10 mm Reflexão regular x difusa Uma superfíce perfeitamente difusora é um modelo ideal que não é observado na prática. Superfícies reais misturam reflexão especular com difusa. Reflexão especular Luz incidente Amostra Espalhamento de luz O espalhamento da luz por partículas de matéria se dá pela combinação de três fenômenos: Reflexão Refração Difração Espalhamento de luz À combinação dos três fenômenos juntos chama-se Difusão (ou espalhamento): O espalhamento aumenta: • Com o aumento da diferença entre os índices de refração das partículas e do meio • Quando o tamanho das partículas se aproxima do comprimento de onda da luz Espalhamento da luz Existem vários modelos para descrever a difusão causada por partículas individuais: Mie Rayleigh/Gans 1 0 Dimensão relativa MEIOS TRANSPARENTES Lei de Beer-Lambert Lei de Beer-Lambert Lei de Lambert (meios absorventes) I = I0 .e - 4pks l0 Lei de Beer-Lambert (em função da concentração) I = I0 .e - e .c . d 1 A = ln = e .c.d T Lei de Beer-Lambert • A lei de Beer-Lambert determina que a absorbância é aditiva em relação à concentração, ou seja: A = e i .ci .d i MEIOS OPACOS (DIFUSORES) Modelo de Kubelka-Munk Correção de Saunderson Modelo de Kubelka-Munk Pressupostos: • Iluminação difusa (lei de Lambert) • Tamanho das partículas muito menor que a espessura do meio • Partículas aleatoriamente distribuídas e aproximadamente da mesma dimensão • Inexistência de reflexão especular Modelo de Kubelka-Munk dI = -( K + S ) I + SJ dx dJ = -( K + S ) J + SI dx d I J 0 Rg dx Modelo de Kubelka-Munk 1 S .d . R R Rg - R 1 .e - R Rg R R R= 1 S .d . R 1 R ( Rg R ) Rg .e R (1 - R ) K = F ( R ) 2 R S 2 Modelo de Kubelka-Munk Permite uma relação entre a reflectância e a composição: n K = S mist K ici Sici i =1 n i =1 “Modelo de duas constantes” Modelo de Kubelka-Munk O coeficiente de difusão da mistura pode ser considerado constante quando: • Toda a difusão ocorre no substrato (têxteis, etc…) • Um componente altamente difusor (branco) está presente em largo excesso Modelo de Kubelka-Munk Neste caso: F(R) K Ki = ci = K ici S mist i =0 S 0 i =0 n n “Modelo de uma constante” K’ F0 c Correção de Saunderson Raio incidente Substrato difusor (Kubelka-Munk) Modelamento Raio incidente k1 Interface k2 Substrato difusor (Kubelka-Munk) Equacionamento Rc = k1 + (1 - k1 )R (1 - k 2 )+ (1 - k1 )Rk 2 R (1 - k 2 )+ (1 - k1 )Rk 2 Rk 2 R (1 - k 2 )+ ... [ ] Rc = k1 + (1 - k1 )(1 - k 2 )R 1 + k 2 R + (k 2 R )2 + (k 2 R )3 + ... Como x = n n =0 Temos: Rc = k1 1 1- x (1 - k1 )(1 - k2 )R + 1 - k2 R para x<1 Rc - k1 ou R = 1 - k1 - k 2 (1 - Rc ) MEDIÇÃO Colorímetros Espectrocolorímetros Geometrias de Medição Colorímetro Iluminação X=20,82 Y=18,34 Z=36,53 Filtros Amostra Detectores Espectrocolorímetro Iluminação Detectores R400=05,42 R420=06,84 Amostra . . . . Rede de difração R680=82,74 R700=83,12 Espectrocolorímetro Espectrocolorímetro Geometrias de Medição 8o 8o 0/45 detector detector detector d/0 d/0 Especular Incluso Especular Excluso Geometria d/8
Download