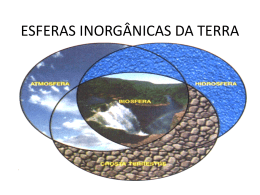
Disciplina: ACA 225 Licenciatura em Geociências Prof Fabio L T Gonçalves E-mail: [email protected] Ementa Objetivos – Proporcionar aos estudantes uma visão do ensino de ciências da Terra através da aplicação dos conceitos dos diversos campos da Física e sua manipulação matemática. Formação da atmosfera e do oceano As teorias sobre como se formaram a atmosfera e o oceano devem começar com a teoria da origem do planeta Terra. ~ 4,6 bilhões de anos (4,6 Ga) Acresção de planetesimais Choque com um planeta proximo ao tamanho de Marte e formação da Lua http://zebu.uoregon.edu/internet/l2.html TERRA Heterogênea e dinâmica Sucessivas diferenciações após a acresção 1- Fusão do Fe e formação do núcleo terrestre 2- início do vulcanismo e da tectônica de placas (sucessivas fusões e solidificações de materiais do manto) formando a crosta continental e oceânica e as “esferas fluidas” atmosfera e hidrosfera 3- Água na Terra e as marés A primeira atmosfera (se é que existiu...): Composição: provavelmente H2 e He (materiais mais abundantes no Sistema Solar) Esses gases são relativamente raros na atmosfera da Terra comparados a outras localidades no universo e, possivelmente foram perdidos para o espaço no início da história da Terra devido ao fato de que a gravidade terrestre não ser intensa o suficiente para reter os gases mais leves e pela intensa radiação solar. Kasting, 1993 Atmosfera Secundária Gerada a partir dos compostos voláteis contidos nos planetesimais a partir dos quais a Terra foi formada. A liberação destes compostos voláteis foram provocadas por: – – Impactos entre planetesimais (durante o período de acresção que durou entre 10 a 100 milhões de anos) Erupções vulcânicas (iniciado no período de diferenciação) Kasting, 1993 http://www.globalchange.umich.edu/globalchange1/current/lectures/first _billion_years/first_billion_years.html A segunda atmosfera Produzida pela emissão de gases de atividade vulcânica. Os gases emitidos por três vulcões hoje são mostrados na tabela abaixo (%): Além disso também eram emitidos N2 , CH4 e H2 Nota-se que não há emissão de O2 (oxigênio livre) http://www.globalchange.umich.edu/globalchange1/current/lectures/first_billion_years/first_billion_ye ars.html Composição Atmosférica de outros planetas Origem dos oceanos Ao final do período de acresção, com o resfriamento da superfície da Terra (há 4,6 Ga), o vapor d’água contido na atmosfera pôde condensar, formando um oceano (Kasting, 1993) que cobria a Terra inteira, ou seja, não exitiam os continentes (Suguio e Suzuki, 2003). Há teorias que consideram que parte da água veio de outros corpos celestes que impactaram na Terra. APÓS A DIFERENCIAÇÃO INTERNA T do planeta condensação de H2O com absorção de CO2 enriquecimento relativo em N2 início do ciclo da água, carregando para os oceanos o CO2 da atmosfera e o Ca do intemperismo das rochas da crosta continental, deposição de calcários nos fundos marinhos Origem da vida Grandes impactos terminaram há ~3,8 Ga. (um grande impacto poderia evaporar completamente o oceano, esterilizando o planeta) Há evidências da presença de estromatólitos (do grego strôma, "o que cobre" ou "tapete", e líthos, pedra), formado por bacterias há 3,5 3,7 Ga. Assim, a vida deve ter se originado entre 3,8 e 3,5 Ga. Composição e Evolução da Atmosfera T ppt do vapor d´água a atmosfera torna-se suficientemente transparente (há mais de 3,5 Ga) a luz solar começa a chegar com mais intensidade à superfície E o oxigênio? Uma importante questão é como foi processada a adição de O2 livre na atmosfera, que hoje é da ordem de ~21%. A produção do oxigênio: 1. Dissociação fotoquímica 1. Dissociação fotoquímica • A fotólise do vapor d´água e do dióxido de carbono, por radiação ultravioleta e possivelmente relâmpagos, produzem hidroxila (OH) e oxigênio atômico, respectivamente, que, então, se recombinam, produzindo oxigênio em pequenas quantidades. Este processo produziu oxigênio na atmosfera primitiva antes do processo de fotossíntese se tornar dominante. • Os átomos de hidrogênio formados nestas reações são leves e uma pequena fração escapa para o espaço, possibilitando um pequeno acúmulo de O2. http://www.globalchange.umich.edu/globalchange1/current/lectures/samson/ev olution_atm/index.html#evolution 2. Fotossíntese A maior produção de oxigênio se deu pelo processo de fotossíntese: 6CO2 + 6H2O <--> C6H12O6 + 6O2 Onde o dióxido de carbono e água, na presença de luz, produzem matéria orgânica e oxigênio. Inicialmente, este processo foi realizado pelas cianobactérias (microorganismos que têm estrutura celular que corresponde a célula de uma bactéria. São fotossintetizadoras, apresentando fotossistemas, mas sem estar organizados em cloroplastos, como as plantas). fotossíntese grande consumo de CO2 da atmosfera e liberação de O2 em quantidade (primeiro lixo da biosfera) Estromatólitos Estromatólito do Proterozóico Inferior, Bolívia Uma das definições mais aceitas atualmente caracteriza os estromatólitos como estruturas organosedimentares produzidas pelo aprisionamento, retenção e/ou precipitação de sedimentos resultante do crescimento e da atividade metabólica de microorganismos, principalmente cianofíceas (“algas” verdes-azuis, bacterias) Walter, M. R. 1976. Glossary of selected terms. In Walter, M. R. (ed.), Stromatolites. Developments in Sedimentology, 20: 687692. Estromatólito atual Australia Estromatólitos Estromatólitos (desde 3,7 Ga): testemunhos da atividade de cianobactérias, fotossintetizadoras, que provocam a precipitação de CaCO3 (há equivalentes atuais na Austrália e na Flórida etc.). Os + antigos são australianos. A freqüência dos estromatólitos aumentou a partir de 2,2 a 2,3 Ga, mantendo-se abundantes até 550 Ma. Estromatólitos Estromatólito de Sharks Bay, Australia, com um corte transversal ao sentido de crescimento da estrutura e um detalhe da cianobactéria que constrói a feição. Imagem de http://www.dme.wa.gov.au/ancientfossils/sharkbay2.jpg. Produção X Consumo de O2 a produção de oxigênio é feita exclusivamente pela fotossíntese; outros processos como a fotólise da água na alta atmosfera, não são importantes quantitativamente o consumo de oxigênio ocorre por fenômenos biológicos (respiração dos seres vivos) e geológicos (intemperismo de rochas envolvendo reações de oxidação e oxidação de gases vulcânicos reduzidos) o oxigênio liberado foi utilizado para oxidar os materiais geológicos (registros sedimentares) e também para formar O3 na alta atmosfera (registros biológicos). Grandes momentos da evolução do O na atmosfera – há ~ de 2,7 Ga (materiais geológicos já oxidados) acumulação absoluta de oxigênio na atmosfera – há ~ de 1,8 Ga a camada de ozônio começou a formar-se (filtragem da radiação UV) – por volta de 500 Ma (início da era Paleozóica), torna-se possível a ocupação continental pela vida – somente há cerca de 400 Ma o teor em O2 e em O3 atingiu os níveis “normais” (entre 20 e 30%) Composição e Evolução principal traço da evolução: diminuição de CO2 e aumento de O2 e O3 o oxigênio livre está ausente nos outros planetas (admite-se que apenas os seres vivos são capazes de produzi-lo e que jamais houve outros sistemas produtores de O2 em quantidades importantes) Evolução da atmosfera A aquisição de oxigênio nas esferas externas da Terra (atmosfera e hidrosfera) ocorreu devido à atividade biológica (faz tempo que a Vida modifica o planeta...); instalou-se primeiro na hidrosfera (estromatólitos) e só depois na atmosfera (quando a fixação por processos no ambiente aquático não consumia todo o oxigênio produzido). Acumulação de oxigênio produzido Indícios geológicos de presença de oxigênio na atmosfera Rochas sedimentares oceânicas e continentais (tema Ciclo geológico externo) Indícios geológicos e histórico da evolução do oxigênio na atmosfera Datações dos materiais terrestres e interpretações dos processos geológicos envolvidos (Tempo Geológico - datação relativa e absoluta) Indícios geológicos sobre o oxigênio na atmosfera 1 - Camadas vermelhas (couches rouges - red beds) John Charlton , Kansas Geological Survey, Educational Resources Credit the Kansas Geological Survey for photos you use.URL=http://www.kgs.ku.edu/Images/DB/index.html Program updated Nov. 11, 2004. Photos added periodically Indícios geológicos sobre o oxigênio na atmosfera 2 - Formações ferríferas bandadas (BIF) Banded iron formation, illustrating the alternating layers of magnetite and hematite (the red iron) and chert. Image from http://www.agso.gov.au/education/factsheet/ironform.html. Evolução da Composição da atmosfera terrestre CO2 N2 H2O caráter ácido e redutor N2 (78%) O2 (20%) CO2 caráter oxidante Composição da Atmosfera, Ciclos Biogeoquímicos e Tempos de Residência Composição média da Atmosfera CH3OOH 700 H2 500 Nitrogênio 78% CO2 380 Ne H2O Argonio 1% He (5) CH4 (1.8) 500 Etano 500 N2O Oxigênio 20% H2O2 CO 18 ppm Ozônio 310 100 30 ppb NH3 400 HCHO HNO3 300 300 SO2 NOx 200 100 outros ppt Quais os elementos presentes na atmosfera? Nitrogênio Oxigênio Carbono Hidrogênio Enxofre Gases Nobres: He, Ne, Ar E quais os principais elementos dos seres vivos? CICLOS BIOGEOQUÍMICOS (CICLAGEM DE NUTRIENTES) Nutrientes = elementos essenciais aos seres vivos Ciclo biogeoquímico Movimento de um determinado elemento ou elementos químicos através da atmosfera, hidrosfera, litosfera e biosfera da Terra. Os caminhos percorridos ciclicamente entre o meio abiótico e biótico pela água e por elementos químicos conhecidos, como C, S, O, P, Ca e N Ciclo da água Ciclo do Carbono Ciclo do Nitrogênio O ciclo do Enxofre Evolução do impacto ambiental ao longo dos anos Época 1.000.000 AC 100.000 AC Consumo de Principais fontes energia diário per capita (kcals) 2.000 Alimentos; força humana 4-5.000 Alimentos; fogo; ferramentas simples Uso Impacto ambiental Vida diária Mínimo Aquecimento; cozimento de alimentos; caça Local e pequeno; principalmente destruição da vegetação e redução da população de animais Local e grande; principalmente em centros de agricultura (Egito, Mesopotâmia); vegetação nativa cede lugar a culturas; ambiente aquático modificado; início da degradação dos solos Local, grande e permanente; vegetação natural removida; poluição urbana 5.000 AC 12.000 Animais; agricultura Transportes; agricultura; construção 1.400 DC 26.000 Vento, água, carvão, moinhos, roda d’água 1.800 DC 50.000 1.980 DC 300.000 Local, regional e grande; começamas maiores mudanças na paisagem; poluição do ar e da água comuns em áreas industriais Combustíveis Operações Local; regional e fósseis, energia mecânias; processos global; permanente nuclear, combustão industriais; e talvez interna em transporte; irreversíveis máquinas, desenvolvimento deteriorações do ar, eletricidade social e cultural solo e água em escala global; chuva ácida; efeito estufa; buraco de ozônio; aumento da turbidez atmosférica Operações mecânicas; bombas de água; serralherias; moagem de grãos; transporte Carvão, máquinas a Operações vapor mecânicas; processos industriais; transporte Interferência das atividades humanas sobre os ciclos biogeoquímicos Processos e compostos envolvidos na poluição do ar. OXIDANTES, METAIS, AEROSSOL, SAIS, COMPOSTOS ORGÂNICOS, E AMÔNIA ATMOSFÉRICOS O3 H2O2 HCOOH HCHO TRANSPORTE, DILUIÇÃO E REAÇÕES QUÍMICAS REMOÇÃO HIDROCARBONETOS SO2 NO NO2 NH3 PARTÍCULAS EMISSÃO NO2/NO3- SO2/SO42- DEPOSIÇÃO SECA MATERIAL PARTICULADO, O3, H2O2, NOX/SO2 (NH4)2SO4 NH4NO3 DEPOSIÇÃO ÚMIDA H2SO4 HNO3 H2O2 (NH4)2SO4 NH4NO3 Poluição atmosférica em centros urbanos Aspectos históricos Historicamente A preocupação com o ar que respiramos não é um fenômeno recente “Comparing the air of cities to the air of deserts and arid lands is like comparing waters that are befouled and turbid to waters that are fine and pure” Moses Maimonides (1135-1204) - Século 13 - Século 17 Carvão substituiu a “It is horrid smoke which madeira no uso obscures our Church and doméstico e industrial makes our palaces look old, which fouls our cloth and corrupts the waters, so as the very rain, and refreshing dews which fall in the several seasons, precipitate to impure vapour, which, with its black and tenacious quality, spots, contaminates whatever is exposed to it.” London Smog John Evelyn smog = smoke + fog (poeira + neblina) Poluição urbana Queima de carvão (Revolução industrial) – smog sulfuroso ou londrino Eventos de excesso de óbitos associados ao “smog” Ano Lugar 1930 1948 1952 1962 Vale do Meuse, Bélgica Donora, Pensilvânia Londres Londres Número de óbitos em excesso 63 20 4000 700 Smog sulfuroso O episódio de poluição atmosférica em Londres, 1952: relação entre concentração de fumaça e óbitos Episódio de poluição atmosférica em Londres, 1962: confirmado a presença de aerossóis contendo sais de sulfato e ácido sulfúrico Smog de Los Angeles • No final da década de 1940, um novo fenômeno de poluição do ar começou a ser observado na área de Los Angeles, EUA. • Diferentemente do smog de Londres, o ar ambiente continha poluentes extremamente oxidantes e os eventos ocorriam em dias quentes com muita incidência de radiação solar. smog = smoke + fog (poeira + neblina) Poluição urbana Queima de carvão (Revolução industrial) – smog sulfuroso ou londrino Queima de combustíveis fosseis (veículos) – smog fotoquímico ou de Los-Angeles Fog ou ar úmido smog industrial (cinzento) a b luz solar smog fotoquímico (castanho) SO2 e MP originados da queima de carvão óxidos de nitrogênio e compostos orgânicos voláteis a) smog industrial, ou smog cinza, ocorre quando carvão é queimado e a atmosfera está úmida (ex. Londres); b) smog fotoquímico, ou fumaça castanha, ocorre em presença de luz solar agindo sobre poluentes veiculares (ex. Los Angeles e São Paulo). Donora, Pensilvânia - em outubro de 1944 foi cenário de um grande desastre de poluição de ar. Smog na Cidade do México, devido localização geográfica e tráfego veicular. Smog fotoquímico Smog fotoquímico em São Paulo (~1990). O gás de cor castanha, NO2, é formado quando o NO, que é um gás incolor, reage com o oxigênio do ar. (P.W. Atkins, “Atoms, Electrons, and Change”, 1991) Comparação entre as características gerais da POLUIÇÃO DO AR Sulfurosa (Londres) e Fotoquímica (Los Angeles, São Paulo) (Finlayson-Pitts & Pitts, 1986). Características Sulfurosa Fotoquímica (Londres) (Los Angeles, São Paulo) reconhecimento século 19 século 20 (década de 40) Poluentes primários SO2, partículas de NOx, compostos fuligem orgânicos Poluentes H2SO4, aerossóis, O3, HNO3, aldeídos, PAN secundários sulfatos, ácidos (peroxiacetil nitrato), sulfônicos, etc. nitratos, sulfatos, etc. o o Temperatura frio ( 2 C) quente ( 23 C) Umidade relativa alta, com neblina baixa, quente e seco Tipo de inversão radiação (terra) subsidência Picos de poluição início da manhã início da tarde URBANIZAÇÃO e INDUSTRIALIZAÇÃO Poluentes atmosféricos: O3 (ozônio) SO2 (dióxido de enxofre) CO (monóxido de carbono) MP (material particulado) NOx (NO + NO2, óxidos de nitrogênio) Composição química da Atmosfera CH3COOH 700 H2 N2 78% CO2 O2 H2O Argonio 500 20% 1% H2O2 500 Etano 500 NH3 400 HCHO HNO3 300 300 200 100 380 Ne He (5) CH4 (1.8) 18 N2O 310 CO 100 O3 30 ppm ppb ppm = 10-6 ppb = 10-9 SO2 NOx outros ppt ppt = 10-12 Bibliografia • • • • • Kasting, 1993: “Earth’s early atmosphere”, Science, 12 fevereiro 1993. Suguio e Suzuki, 2003: A evolucão geológica da Terra e a fragilidade da vida. http://www.globalchange.umich.edu/globalchange1/cur rent/lectures/first_billion_years/first_billion_years.html http://www.globalchange.umich.edu/globalchange1/cur rent/lectures/samson/evolution_atm/index.html#evoluti on CETESB: Relatório da Qualidade do Ar Bibliografia • C. Baird. “Química Ambiental”, 2a.ed., Bookman, Porto Alegre, 2002. • J.C. Rocha, A.H. Rosa, A.A. Cardoso, “Introdução à Química Ambiental”, Bookman, Porto Alegre, 2004. • Brasseur, G.P., Orlando, J.J., Tyndall, G.S., Atmospheric Chemistry and Global Change, Oxford University Press, New York, 1999. • J.H. Seinfeld e S. N. Pandis, "Atmospheric Chemistry and Physics: from air pollution to climate change", John Wiley & Sons, New York, 1998. • http://www.abema.org.br/ (Associação Brasileira de Entidades Estaduais de Meio Ambiente) • http://www.cetesb.sp.gov.br/ • http://www.epa.gov/air/
Download