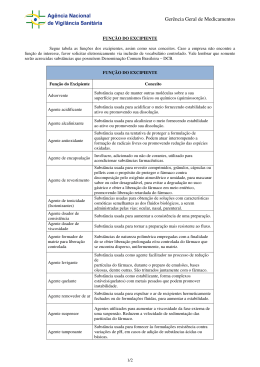
1 LÍVIA SILVA SOUSA DESENVOLVIMENTO DE FORMULAÇÃO DE IBUPROFENO COMPRIMIDO E AVALIAÇÃO DO SEU PERFIL DE DISSOLUÇÃO Monografia apresentada ao curso de graduação em Farmácia da Universidade Católica de Brasília, como requisito parcial para aprovação na disciplina de Trabalho de Conclusão de Curso II. Orientador: MSc. Wilsione José Carneiro Brasília 2011 2 Monografia de autoria de Lívia Silva Sousa, intitulada “DESENVOLVIMENTO DE FORMULAÇÃO DE IBUPROFENO COMPRIMIDO E AVALIAÇÃO DO PERFIL DE DISSOLUÇÃO”, apresentada como requisito parcial para obtenção de grau de bacharel em Farmácia da Universidade Católica de Brasília, em (DATA DE APROVAÇÂO), defendida e aprovada pela banca examinadora abaixo assinada: Prof. Mestre Wilsione José Carneiro Orientador Farmácia - UCB Prof. Dra. Silvia Keli de Barros Alcanfor Farmácia - UCB Profa. Mestre Kélia Xavier Resende Farmácia - UCB Brasília 2011 3 À Deus, que sempre me deu força e guiou meus caminhos. Aos meus pais, João e Conceição, por toda dedicação e carinho. À minha irmã, Giovana, por estar sempre ao meu lado. 4 AGRADECIMENTO A Deus pelo dom da Vida e pela força e tranqüilidade encontradas nos momentos difíceis em que recorri a Ele. Aos meus pais, João Alves e Maria da Conceição pela dedicação e carinho durante toda a caminhada na universidade. À minha irmã Giovana que sempre me presenteou com seu carinho e seu apoio. Ao meu namorado João Ricardo, pela compreensão, paciência e carinho nos momentos ao meu lado. Aos colegas de graduação, pelos momentos de estudo e também de descontração, pelos ótimos cinco anos de convivência. Às minhas amigas da UCB, por todos os momentos vividos e que levarei comigo para sempre. Pelas risadas, choro, viagens, conversas, estudos, por tudo. Muito obrigada. À Christiane Moraes, que esteve comigo do primeiro ao último dia de aula. Que me fez crescer, aprender e ser uma pessoa melhor, que me acompanhou em todos os trabalhos, provas, aulas, palestras, seminários, artigos e até no Trabalho de Conclusão de Curso. Muito obrigada pela amizade e pela doçura. Aos amigos de Anápolis, onde de passei o último semestre de graduação, pela força e pela companhia. À Renata Oliveira, técnica dos laboratórios do curso de Farmácia, pela disponibilidade e auxílio durante a realização desse trabalho. A todos os professores que me auxiliaram na caminhada da universidade. Ao professor Wilsione Carneiro, que guiou essa nova experiência na área de Tecnologia Farmacêutica e que me abriu novos caminhos. 5 “O correr da via embrulha tudo. A vida é assim: esquenta e esfria, aperta e daí afrouxa, sossega e depois desinquieta. O que ela quer da gente é coragem.” João Guimarães Rosa 6 RESUMO Referência: SOUSA, Lívia Silva; Título: Desenvolvimento de Formulação de Ibuprofeno Comprimido e Avaliação do Perfil de Dissolução. 53 folhas. Farmácia – Universidade Católica de Brasília, Brasília, 2011. O ibuprofeno é um antiinflamatório não-esteroidal (AINE) que possui propriedades analgésicas, antiinflamatórias e antipiréticas. É recomendado para febre, enxaqueca, dismenorréia primária e outras dores leves a moderadas. O desenvolvimento do comprimidos foi baseado no medicamento referência, Dalsy®, utilizando concentrações usuais dos excipientes presentes no medicamento referência. Os núcleos (comprimidos) de ibuprofeno foram obtidos utilizando-se a técnica de compressão direta e sem revestimento. O presente trabalho também avaliau o perfil de dissolução in vitro do medicamento teste e do medicamento referência, mostrando que os mesmos são equivalentes farmacêuticos, pois apresentaram gráficos de liberação versus tempo muito semelhante, além de apresentarem aprovação em outros testes farmacopéicos em que foram submetidos. Todas as análises foram baseadas na monografia de ibuprofeno comprimidos da Farmacopéia Brasileira – 4ª Edição. Palavras-chave: Ibuprofeno. Comprimidos. Desenvolvimento de formulação. Compressão direta. Perfil de dissolução. 7 ABSTRACT Ibuprofen is a non steroidal antiinflammatory drug (NSAID) that has analgesic, antiinflammatory and antipyretic properties. It is recommended for fever, migraine, primary dysmenorrhea and other aches mild to moderate. The development of the tablets was based on the reference drug, Dalsy®, using the usual concentrations of these excipients presents in the drug reference. The cores (tablets) of ibuprofen were obtained using the technique of direct compression and uncoated. This work also has to evaluate the in vitro dissolution profile of the drug test and reference drug, showing that they are pharmaceutical equivalents, since their release versus time graphs are very similar, also present in other tests approved pharmacopoeia where they were submitted. All tests were based on the monograph of ibuprofen tablets of the Brazilian Pharmacopoeia - 4th Edition. Keywords: Ibuprofen. Tablets. Formulation development. Direct compression. Dissolution profile. 8 SUMÁRIO INTRODUÇÃO .......................................................................................................... 10 OBJETIVOS .............................................................................................................. 12 1.GERAIS........................................................................................................ 12 2. ESPECÍFICOS ........................................................................................... 12 REVISÃO DA LITERATURA .................................................................................... 13 1. IBUPROFENO .............................................................................................. 13 2. MECANISMO DE AÇÃO, ASPECTOS FARMACOCINÉTICOS E FARMACODINÂMICOS .................................................................................... 13 3. ESTUDOS DE PRÉ-FORMULAÇÃO ............................................................ 14 4. EXCIPIENTES .............................................................................................. 16 4.1 Diluentes ......................................................................................... 18 4.2 Aglutinantes ................................................................................... 20 4.3 Desintegrantes ............................................................................... 21 4.4 Lubrificantes, deslizantes e antiaderentes .................................. 23 5. MÉTODOS DE COMPRESSAO ................................................................... 25 5.1 Granulação por via seca................................................................ 25 5.2 Granulação por via úmida ............................................................. 25 5.3 Compressão direta......................................................................... 26 6. DISSOLUÇÃO .............................................................................................. 27 7. PERFIL DE DISSOLUÇÃO ........................................................................... 28 METODOLOGIA ....................................................................................................... 31 1. MATÉRIAS-PRIMAS ..................................................................................... 31 2. EQUIPAMENTOS E ACESSÓRIOS ............................................................. 32 3. PLANEJAMENTO ESTATÍSTICO DA FORMULAÇÃO E PERFIL DE DISSOLUÇÃO .................................................................................................. 32 4. MÉTODOS .................................................................................................... 34 RESULTADOS E DISCUSSÃO ................................................................................ 36 1. MANIPULAÇÃO ............................................................................................ 36 2. COMPRESSÃO ............................................................................................ 37 9 3. PESO MÉDIO ............................................................................................... 37 4. DUREZA ....................................................................................................... 38 5. PERFIL DE DISSOLUÇÃO .......................................................................... 40 CONCLUSÃO ........................................................................................................... 46 REFERÊNCIAS BIBLIOGRÁFICAS ......................................................................... 47 ANEXOS ................................................................................................................... 52 10 INTRODUÇÃO Segundo Ansel o medicamento é definido como: O agente destinado a diagnóstico, mitigação, tratamento, cura ou prevenção de doenças em seres humanos ou animais. Uma das suas mais surpreendentes qualidades reside na diversidade de suas ações e efeitos sobre o organismo. Essa qualidade torna seu uso seletivo em várias condições patológicas comuns e raras, envolvendo órgãos, tecidos e células. (ANSEL, 2005, p. 16) A Agência Nacional de Vigilância Sanitária (ANVISA) ainda define medicamento como “produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico”. (BRASIL, 1973) Assim, plantas medicinais e outros produtos com tais fins são utilizados há muito tempo pelo homem até pela questão de instinto e sobrevivência, cujo emprego de tais experiências terapêuticas se dá antes dos registros históricos, nos quais homem utilizava técnicas simples, como lavagem de ferimentos com água fria, para garantir sua sobrevivência (ANSEL, 2005). Com o passar do tempo, as metodologias foram aprimoradas, garantindo técnicas mais específicas para as terapias e somente algumas pessoas que possuíam maior conhecimento, e por meio da prática diária, detinham o poder da cura. Surgiu então a figura do boticário, um homem que detinha a arte da sintetização, extração, preparação e administração de medicamentos e consequentemente da cura de algumas doenças (SILVA, W., 2009). Com a melhoria das preparações farmacêuticas e das técnicas e a qualidade dos medicamentos também melhorou. Galeno, considerado o pai da farmácia, contribuiu muito para essa melhoria, pois detinha vasto conhecimento que foi utilizado por outras pessoas durante anos. Assim, a partir das definições do profissional farmacêutico, esta profissão desvinculou-se cada dia mais da medicina, construindo uma posição na sociedade (SILVA, W., 2009). Diante de toda essa mudança do papel do farmacêutico e de novos conhecimentos relacionado à produção e uso de medicamentos, a investigação de novos fármacos, a passagem da manipulação em pequenas escalas para escalas industriais que, juntamente com a melhoria do processo produtivo e das informações destinadas ao cuidado da saúde, passou a ter uma grande importância na sociedade (ANSEL, 2005). 11 A tecnologia farmacêutica se faz presente nos dias de hoje de forma significante, dando abertura para novas formulações farmacêuticas, como comprimidos, cápsulas, drágeas, soluções, suspensões, pomadas, óvulos, supositórios, aerossóis e todas as outras formas farmacêuticas presentes no mercado, dotadas de máxima atividade e doseadas com muita precisão. Está presente de forma ainda mais significante nos comprimidos, que apresenta algumas vantagens em relação às demais formas farmacêuticas, como ser de fácil manipulação, apresentar melhor forma para embalagem e transporte, apresentando boa estabilidade química e microbiológica, custo algumas vezes menor do que outras formas farmacêuticas, além de ser administrado com mais frequência em dose única apresentando uma fácil administração, o que melhora adesão do paciente ao tratamento. Em contrapartida também podem possuir desvantagens, como baixa biodisponibilidade de alguns fármacos e até irritações locais da mucosa gastrintestinal (ANSEL, 2005; AULTON, 2005). Toda essa tecnologia que envolve a produção de comprimidos inclui o fármaco e seus adjuvantes, que são utilizados como diluentes, desintegrantes, revestidores, corantes, deslizantes, lubrificantes entre outros, cada um com funções específicas na formulação que irá promover a melhoria da qualidade do comprimido, além de melhorar aspectos físicos, químicos e biológicos (ANSEL, 2005; AULTON, 2005). O ibuprofeno é um ácido fraco, derivado simples do ácido fenilpropiônico que possui efeitos analgésico, antipirético e antiinflamatório, sendo classificado como antiinflamatório não esteróide (AINE), apresentando tais efeitos por meio da inibição da síntese de prostaglandinas. Este AINE é indicado para o controle da febre, dores, artrite reumatóide e dismenorréia primária, sendo utilizado para cada patologia em doses diferentes (KATZUNG, 2006; DRUGDEX, 2010). Hoje, o ibuprofeno é encontrado na forma de comprimidos, comprimidos revestidos, cápsulas, suspensão oral e solução oral, e algumas dessas formulações passam por testes de dissolução e perfil de dissolução, avaliando a quantidade liberada de fármaco de acordo com tempo e condições pré-determinadas. Assim, é possível comparar medicamento teste com o medicamento de referência, in vitro, e submeter o medicamento teste a estudos de biodisponibilidade, podendo comparar quanto do fármaco estará possivelmente disponível in vivo (ANSEL, 2005; BRASIL, 2010). 12 OBJETIVOS Geral Ø Propor uma formulação de comprimido para o ibuprofeno 400mg e avaliar o perfil de dissolução dos comprimidos produzidos na UCB. Específicos Ø Apresentar e analisar parâmetros físico-químicos da formulação proposta e características adequadas. Ø Avaliar formulação produzida. Ø Testar e avaliar o perfil de dissolução do fármaco. Ø Comparar o perfil de dissolução do Dalsy® com o do medicamento teste e avaliar a sua liberação no meio de dissolução. 13 REVISÃO DA LITERATRURA 1. IBUPROFENO O ibuprofeno, ou ácido(±)-α-metil-4-(2-metilpropil)benzenoacético, é um derivado simples do ácido fenilpropiônico fazendo parte da classe dos antiinflamatórios não-esteroidias (Ver figura 1). Este fármaco consiste em uma mistura racêmica de enantiômeros +S e -R. Ele forma como metabólitos o ácido 2(p-(2hidroximetil-propil)fenil) propiônico e o ácido 2-(p-(2carboxi-propil)fenil) propiônico que são inativos, entre outros metabólitos e substâncias relacionadas (FARMACOPÉIA BRASILEIRA, 1988; KATZUNG, 2006; DRUGDEX, 2010). Figura 1: Estrutura do Ibuprofeno 2. MECANISMO DE AÇÃO, ASPECTOS FARMACOCINÉTICOS E FARMACODINÂMICOS O ibuprofeno possui atividade antiinflamatória, analgésica, aliviando dores leves e moderadas, e antipirética por inibir a enzima cicloxigenase que leva a uma redução na síntese de prostaglandinas, o que inibe a cascata do processo inflamatório. Segundo a Food and Drug Administration (FDA) é recomendado para febre, dor de cabeça, enxaqueca, osteoartrite, dor, dismenorréia primária e artrite reumatóide e é indicado para adultos e crianças maiores de seis meses de idade e nunca ultrapassando o limite de 3200mg diárias (DALSY, 2010; KATZUNG, 2006). O início da ação ocorre cerca de trinta minutos após a administração oral, atinge um pico em 1-2 horas e permanece por quatro a seis horas com alívio da inflamação e dor. O fármaco apresenta meia-vida de aproximadamente duas horas. O metabolismo do ibuprofeno em adultos ocorre no fígado, pela enzima CYP2C9, 14 em que o próprio ibuprofeno e seus metabólitos são conjugados com acil glicuronídeos (DALSY, 2010, KATZUNG, 2006; DRUGDEX, 2010). A excreção se dá por via renal, em que 10 a 15% do fármaco se encontra na forma inalterada e cerca de 80% representa os seus metabólitos, que são inativos (DALSY, 2010; DRUGDEX, 2010). Há indicação para a utilização do fármaco somente para pacientes acima de seis meses de idade, não sendo encontradas doses adequadas para pacientes com idade inferior, havendo necessidade de ajuste de dose de acordo com a idade. Além disso, o ibuprofeno possui algumas contra indicações como: pacientes que apresentam alguma hipersensibilidade ao ibuprofeno ou a outros AINES, asmáticos, pacientes com urticária, sangramentos no trato gastrintestinal, complicações renais agudas, entre outros. Também é importante relatar os possíveis efeitos adversos relacionados com o fármaco, como falência renal, agranulocitose, sangramentos no trato gastrintestinal que podem levar a ulcerações com o uso prolongado (KATZUNG, 2006; DRUGDEX, 2010). A biodisponibilidade do ibuprofeno é maior que 92% quando é administrado somente o enantiômero S, já a mistura racêmica do fármaco apresenta uma disponibilidade de 71% do enantiômero S e de 58% do R, sendo que é necessário considerar que o enantiômero R é convertido em S in vivo (DRUGDEX, 2010). 3. ESTUDOS DE PRÉ-FORMULAÇÃO Após a análise do fármaco que se deseja trabalhar, iniciam-se os estudos de pré-formulação que irão testar a compatibilidade do fármaco a certos excipientes, avaliando o desempenho do fármaco na forma farmacêutica estabelecida com os adjuvantes utilizados. Tais estudos também devem considerar características anatômicas e fisiológicas, vias de administração e características de absorção do fármaco (PRISTA et al, 2003, WANCZINSKI et al, 2002). O planejamento farmacotécnico tem o objetivo de desenvolver novas formulações que sejam estáveis, de fácil administração, que tenham características específicas em relação a aspectos físicos e sistema de liberação específico, que seja eficaz e seguro além de facilitar sua conservação. Tais parâmetros são definidos a partir de etapas que englobam os estudos de pré-formulação e formulação, e que possuem extrema importância para um bom resultado. Conhecer 15 as características físicas, químicas e biológicas do fármaco e dos excipientes propostos para a formulação também requer muitos cuidados na sua avaliação, tanto isoladamente quanto associados no produto acabado, levando em consideração também a sua qualidade no seu recipiente, que deve ser mantida durante todo o seu prazo de validade. Além disso, os estudos de pré-formulação podem avaliar as possíveis vantagens e desvantagens de produzir o medicamento naquela forma farmacêutica, como interações do fármaco com excipientes, interferência dos excipientes na liberação do fármaco e indicações para determinado método de compressão, considerando se não há impedimentos significativos para a produção (ANSEL, 2005; MAMEDE et al, 2007; PRISTA et al, 2003). Nos estudos de pré-formulação estão inclusos testes de qualificação da substância, nos quais cada uma apresenta parâmetros físicos e químicos específicos que devem ser considerados e dentre estes estão o estudo da solubilidade, coeficiente de partição, constante de dissociação, características físicas, tamanho da partícula, polimorfismo e estabilidade (ANSEL, 2005). A solubilidade irá avaliar se o fármaco é capaz de se dissolver em meios semelhantes aos fluidos gastrointestinais e quanto do fármaco é solúvel em água. Este fármaco precisa apresentar pelo menos um pouco de solubilidade nesse meio para se obter a resposta terapêutica, já que o meio biológico é composto por água. Além da solução assemelhando-se com o fluido biológico, o pH dessa solução também deve ser aproximado, já que o pH irá interferir na absorção dos fármacos, e se estes estiverem ionizados não serão absorvidos. Deve-se avaliar também os excipientes que compõem a formulação, pois estes podem favorecer ou prejudicar a absorção do fármaco, dependendo das suas características (ANSEL, 2005, LACHMAN, 2001). O coeficiente de partição indica a capacidade de uma substância penetrar em meios de diferentes fases, analisando sua lipofilicidade e hidrofilicidade e a velocidade de dissolução irá indicar a velocidade em que o fármaco se dissolve no meio, ou seja, é a preferência do fármaco pela fase aquosa ou oleosa. Como os fármacos frequentemente se apresentam como bases ou ácidos fracos, a constante de dissociação irá indicar, em um determinado pH, quanto do fármaco está na forma ionizada ou não ionizada, fazendo com que isso interfira nos aspectos farmacocinéticos, como a absorção que requer os fármacos não ionizados, sejam 16 eles ácidos ou básicos, pois atravessam a barreira lipídica com mais facilidade do que os ionizados (ANSEL, 2005; AULTON, 2005; LACHMAN, 2001). A forma física indica propriedades do fármaco e dos excipientes que podem influenciar no resultado final, como na dureza do comprimido, na sua solubilidade e até absorção. Já o tamanho da partícula determina a superfície do fármaco que entrará em contato com a solução para ser dissolvido. Assim, quanto menor o tamanho das partículas que compõem o fármaco, maior a superfície em contato com o meio e, consequentemente, a dissolução ocorrerá mais rápido. Segundo Lachman, mesmo se duas partículas possuírem um mesmo perfil de solubilidade, a que se encontra em tamanho menor se dissolverá mais rápido (ANSEL, 2005, LACHMAN, 2001). O fármaco pode se apresentar na sua forma cristalina ou amorfa. A cristalina indica que as moléculas estão dispostas em uma ordem que se repete ao longo de toda partícula, quando esse padrão não é seguido, ou seja, a substância não apresenta uma ordem estabelecia de disposição de suas moléculas, ela se encontra na forma amorfa (AULTON, 2005). Essa diferença de forma, chamada de polimorfismo, pode alterar as aspectos da substância, fazendo com que sua forma cristalina e amorfa possuam propriedades diferentes, como por exemplo, solubilidade e ponto de fusão. Formas polimórficas são relativamente comuns e algumas vezes um fármaco pode apresentar mais de um polimorfo (ANSEL, 2005; AULTON, 2005). Levando em consideração as características citadas, têm-se um subsídio para o desenvolvimento da formulação em si. 4. EXCIPIENTES UTILIZADOS EM FORMULAÇÕES FARMACÊUTICAS Ferreira (2008, p. 21) define veículo ou excipiente como “substância ou composto inerte (sem atividade farmacológica) utilizado na diluição ou transporte do princípio ativo”, mas além dessas atribuições os adjuvantes, como os excipientes também são conhecidos, possuem a função desintegrante, aglutinante, adsorvente, antiaderente, lubrificante, conservante, deslizante, de revestimento entre outras que são muito importantes para cada tipo de forma farmacêutica (FERREIRA, 2008; PRISTA et al, 2003). 17 Os comprimidos necessitam desses excipientes já que frequentemente o fármaco não apresenta o volume necessário para compressão, pois muitas vezes a quantidade de fármaco é pequena e não pode ser comprimido sozinho, necessitando completar a quantidade de pó. Além disso, existem outros quesitos que o fármaco não apresenta sozinho, como uma boa compactabilidade ou um bom escoamento no alimentador da compressora, fazendo com que se tenha que acrescentar adjuvantes para que essas características sejam obtidas (ANSEL, 2005; BARACAT et al, 2001). Como demonstram alguns autores, os excipientes são substâncias inertes na formulação, mas alguns estudos mostram que estes exercem funções importantes. Então, “os excipientes farmacêuticos são substâncias adicionadas ao processo de fabricação para proteger e melhorar a biodisponibilidade, atribuindo segurança e eficácia ao produto durante o período de estocagem e uso” como mostra Baracat (2001, p. 20), que demonstra que os excipientes são indispensáveis à formulação e que podem exercer funções essenciais (ANSEL, 2005; BARACAT et al, 2001). Aguiar ainda ressalta que: A absorção de fármacos, a partir de formas farmacêuticas sólidas administradas por via oral, depende de sua liberação e dissolução nas condições fisiológicas e permeabilidade das membranas biológicas que necessitam transpor (AGUIAR et al, 2005, p.451) Assim os excipientes dos comprimidos devem ser selecionados de tal forma que os padrões de liberação e absorção no organismo aconteçam de maneira adequada e alcance o efeito terapêutico desejado (AGUIAR et al, 2005). Os comprimidos geralmente são acompanhados de diluentes, aglutinantes, desintegrantes, antiaderentes, deslizantes, lubrificantes, molhantes, tampões entre outros adjuvantes mais específicos de cada formulação, como flavorizantes ou corantes. Cada excipiente exerce funções específicas na formulação para que, ao final do processo de compressão, a forma farmacêutica se apresente dentro das especificações exigidas pelas farmacopéias. 18 4.1 DILUENTES Diluente “trata-se de material de enchimento inerte usado para produzir um volume, propriedade de fluxo e características de compressão desejáveis em cápsulas e comprimidos” (ANSEL, 2005, p. 146). Os diluentes são adicionados aos pós com a finalidade de aumentar o peso do núcleo quando a quantidade de fármaco é muito pequena apresentando-se com frequência como um dos componentes com maior concentração percentual em uma formulação, quando comparado a outros excipientes (LACHMAN, 2001; PRISTA et al, 2003). Devem apresentar algumas características essenciais: · ser inerte, não exercendo nenhum efeito fisiológico; · ser biocompatível e não ser tóxico; · não apresentar contra-indicações; · não apresentar nenhum efeito prejudicial ao fármaco; · não ser higroscópico; · não deve apresentar crescimento microbiano e deve ser estável fisicamente e quimicamente; · possuir boas propriedades físico químicas, como ser hidrossolúvel, ter boa compactabilidade, boa dissolução e ter um gosto aceitável; · ser compatível com os outros excipientes da formulação; · ter baixo custo (AULTON, 2005; LACHMAN, 2001). Vale ressaltar que não só os diluentes, mas também os outros excipientes devem apresentar essas características, já que são essenciais à boa qualidade da formulação (LACHMAN, 2001). Um dos diluentes mais empregados na indústria farmacêutica para fabricação de comprimidos e que preenche a maioria das características citadas é a lactose. É um diluente excelente, e dentre várias características é possível ressaltar que a lactose não reage com a maioria dos fármacos, tem baixo custo, possui boa solubilidade em água e boa compactabilidade (AULTON, 2005; PRISTA et al, 2003). A lactose pode ser encontrada na forma anidra ou hidratada, em que a vantagem da forma anidra é que esta não está passiva de sofrer a reação de 19 Maillard, que pode levar ao escurecimento do comprimido. Em contrapartida, a forma anidra pode reter água quando exposta à umidade elevada. Porém, as boas propriedades da lactose, seja em sua forma anidra ou hidratada, permitem diversos tipos de compressão, sendo que ambas permitem a utilização da compressão direta e auxiliam na desintegração de comprimidos por ser muito solúvel em água. (LACHMAN, 2001; ROWE, 2009). Uma incompatibilidade apresentada pela lactose é a sua utilização com oxidantes fortes já que a lactose pode acelerar processos de hidrólise de aminas primárias, secundárias e ésteres, acarretando na reação de Maillard anteriormente mencionada. A lactose mostra-se incompatível com aminoácidos, aminofilina, anfetaminas e lisinopril. Além dessas incompatibilidades, pessoas intolerantes a lactose podem apresentar reações adversas como diarréia e cólica já que a lactose não será digerida (ROWE, 2009). Celulose microcristalina também é outro diluente muito utilizado em preparações farmacêuticas, tanto para compressão por via úmida quanto por compressão direta. É principalmente utilizada como diluente, mas também possui propriedade lubrificante e desintegrante dependendo da concentração em que esta se encontra na formulação. Apesar se apresentar características higroscópicas, a celulose microcristalina é estável se armazenada em condições ideais. Este excipiente apresenta incompatibilidade com oxidantes fortes e apresenta uma baixa toxicidade, porém não é absorvido para a circulação sistêmica. Assim, no geral possui ótimas características, fazendo com que a celulose microcristalina seja um ótimo componente da formulação (ROWE, 2009). Segundo os estudos de Bushra, a utilização da celulose microcristalina no método de compressão direta mostrou excelente compressibilidade dos comprimidos de ibuprofeno, pois, juntamente com o lubrificante, houve um bom escoamento do produto pelo alimentador, sem se aderir aos punções e matrizes devido a sua propriedade lubrificante (BUSHRA et al,, 2008). A lactose e a celulose microcristalina são os diluetnes mais utilizados nas preparações farmacêuticas. O amido ocasionalmente também é utilizado como diluente. Este pode ser obtido a partir do milho, de trigo, de batata, entre outros. Além de diluente, alguns estudos mostram que o amido, em quantidades ideais, pode melhorar parâmetros de friabilidade, dureza e taxa de dissolução (LACHMAN, 2001; ROWE, 2009; WANCZINSKI et al, 2002). 20 Tais diluentes também podem ser associados nas formulações para que atinjam os parâmetros necessários de compressibilidade, dissolução, desintegração e até mesmo um menor custo (LACHMAN, 2001). 4.2 AGLUTINANTES “São substâncias usadas para provocar a adesão das partículas do pó nos granulados destinados à compressão” (ANSEL, 2005, p. 145). A escolha do aglutinante é essencial na formulação como coloca Bushra em seus estudos indicando que podem existir alterações nos comprimidos como laminação, capeamento e menor friabilidade quando não se utiliza o aglutinante adequado na compressão direta. A laminação se refere à quebra do comprimido durante o processo de compressão ou durante os testes físico-químicos e o capping, ou capeamento, esta relacionado à quebra da superfície dos comprimidos, em que estas se soltam como uma capa (BUSHRA et al,, 2008, p. 116). Esses problemas podem ser observados na figura 2 . Figura 2: Processo de laminação e capeamento de comprimidos. (Fonte: AULTON, 2005, p.435) Os aglutinantes podem ser adicionados à formulação de diferentes maneiras: como um pó seco antes da adição do líquido na granulação por via úmida, como uma solução durante o método de via úmida ou ainda como pó seco adicionado aos demais componentes da formulação e compactado diretamente (AULTON, 2005). A povidona é um aglutinante muito utilizado em formas farmacêuticas sólidas quando o processo indicado de compressão é a via úmida, pois necessita de solubilização prévia em meio líquido, seja este aquoso, alcoólico ou uma solução hidroalcoólica. Este aglutinante não é tóxico e não é absorvido no trato 21 gastrintestinal, não apresentando nenhum tipo de irritação ou hipersensibilidade quando adicionado à formulação (ROWE, 2009). Ao contrário da povidona, o amido pré-gelatinizado é um aglutinante é utilizado quando a compressão é direta ou por via seca, não descartando a possibilidade de utilizá-lo na granulação por via úmida. Nos processos secos o amido pré-gelatinizado também possui função lubrificante, mas algumas vezes é necessário adicionar outro lubrificante para que se obtenha um melhor fluxo dos pós. Também não é um excipiente tóxico e nem irritante, além de não apresentar incompatibilidades (LAMOLHA, 2007; ROWE, 2009). 4.3 DESINTEGRANTES Os desintegrantes compõem a formulação com o objetivo de acelerar a liberação do fármaco, aumentando a desagregação do comprimido, aumentando a área exposta e a penetração dos fluidos gastrointestinais, fazendo assim com que o comprimido se desintegre no meio líquido para que o fármaco seja absorvido (PRISTA et al, 2003). Prista e colab. relatam que o processo de desintegração dos comprimidos se dá em três partes: 1.º - inchando em contato com a água, o que permite uma penetração rápida do líquido e favorece a separação dos grãos constituintes do comprimido [...] 2.º - reagindo com a água ou com o ácido clorídrico do estômago e liberando gases, como o oxigênio ou o anidro carbônico [...] 3.º - dissolvendo-se [...] e abrindo, assim, canículos que facilitam a desagregação dos comprimidos [...] (PRISTA et al, 2003, p. 337) O processo de desagregação dos comprimidos intactos até partículas menores que serão absorvidas, de acordo com o aumento da superfície de contato do fármaco com os fluidos biológicos, pode ser observado na figura 3. 22 Figura 3: Processo desintegração até absorção dos fármacos. (Fonte: AULTON, 2005) A crospovidona é considerada um superdesintegrante sendo utilizada em qualquer método de compressão. Alguns estudos mostram seu grande potencial em desagregar comprimidos de analgésicos, exercendo grande influência em sua desintegração, como é o caso do ibuprofeno (LAMOLHA, 2007; ROWE, 2009). Este composto se mostra levemente higroscópico e deve ser conservado em local seco para garantir sua estabilidade. De acordo com as características dos excipientes, a crospovidona não é tóxica nem irritante, apresentando compatibilidade com a maioria dos componentes farmacêuticos, sendo estes orgânicos ou não (ANSEL 2005; ROWE, 2009). A croscarmelose sódica, um polímero similar ao desintegrante carboximetilcelulose sódica, também é um desintegrante utilizado tanto em compressões diretas como granulação por via úmida, podendo ser adicionada no próprio granulado ou depois da preparação do mesmo. Apesar de insolúvel em água, a croscarmelose sódica consegue absorver grande quantidade de água. Assim, esta se apresenta levemente higroscópica, mas é estável se bem armazenada, porém se for adicionada na formulação juntamente com outros materiais higroscópicos, como o sorbitol, sua eficácia pode ser levemente diminuída. Também não é tóxica nem irritante, porém se administrada em grande quantidade pode ter efeito laxativo, mas não no caso das formulações farmacêuticas já que a quantidade utilizada nas mesmas não é o suficiente para apresentar tal efeito (PRISTA et al, 2003; ROWE, 2009 ). 23 Como já foram citadas anteriormente com outras finalidades, a celulose microcristalina e o amido também podem atuar como desintegrantes na formulação, sendo que a celulose microcristalina deve estar em baixa quantidade, ao contrário do amido que é utilizado em concentração um pouco mais alta. Uma vantagem do amido é o custo, que é bem menor do que o da celulose microcristalina (LACHMAN, 2001). 4.4 LUBRIFICANTES, DESLIZANTES E ANTIADERENTES Essas três classes de excipientes são comumente apresentadas juntas visto que suas propriedades são frequentemente sobrepostas (LACHMAN, 2001). Lachman e cols. colocaram uma breve descrição das funções de cada um desses excipientes: [...] os lubrificantes são usados durante a ejeção dos comprimidos para reduzir a fricção entre os lados dos comprimidos e as paredes da matriz na qual o comprimido se formou. Os antiaderentes têm a finalidade de diminuir a adesão dos grânulos ou das partículas do pó às faces dos punções ou à parede da matriz, enquanto que, os deslizantes, são usados para promover o escoamento dos grânulos ou de pós por redução da fricção entre as partículas. (LACHMAN, 2001, p. 569) Estearato de magnésio é um excipiente empregado nas formulações farmacêuticas por apresentar característica lubrificante e antiaderente (ANSEL, 2005). Por ser de natureza hidrofóbica, algumas vezes o estearato de magnésio retarda a entrada de líquido no comprimido, retardando um pouco a desintegração do mesmo. Porém, tal propriedade pode ser contornada ao adicionar um agente molhante, ou seja, um tensoativo, ou adicionar outros compostos com características hidrofílicas, como um diluente hidrofílico. Apesar disso, possui inúmeras qualidades, sendo o que mais oferece vantagens como facilidade de preparo, dá brilho aos comprimidos e pode ser utilizado em preparações por via úmida ou compressão direta (AULTON, 2005; PRISTA et al, 2003; ROWE, 2009). O talco é o mais utilizado depois do estearato de magnésio e apresenta-se como deslizante e antiaderente, além de ser classificado como lubrificante e diluente por alguns autores (ANSEL, 2005; LACHMAN, 2001; ROWE, 2009). O dióxido de silício coloidal, mais conhecido como Aerosil®, é um potente deslizante muito utilizado na indústria farmacêutica. Apresenta-se como uma 24 substância higroscópica, porém é capaz de absorver grande quantidade de água sem liquefazer, sendo considerada estável se bem armazenada. É seguro, não tóxico e não irritante e pode ser utilizada na compressão direta, sendo misturada aos pós no final, ou por via úmida quando é adicionada quando o granulado já está seco e normalizado (ANSEL, 2005; ROWE, 2009). O lauril sulfato de sódio, que é utilizado como agente lubrificante e tensoativo ou molhante, também é utilizado nas preparações farmacêuticas. Apresenta toxicidade moderada e pode apresentar efeitos tóxicos agudos como irritação da pele e mucosas e não deve ser utilizado em preparações intravenosas (ROWE, 2009). Outros excipientes já mencionados também apresentam características de lubrificantes, deslizantes ou antiaderentes, como o amido que também é utilizado como lubrificante ou deslizante. As concentrações usuais dos principais excipientes citados podem ser observadas na tabela 1. Tabela 1: concentração de excipientes nas formulações farmacêuticas sólidas Excipiente Concentração % Diluentes Lactose 20-90 Celulose microcristalina 20-90 Amido 5-75 Talco 5-30 Aglutinantes Povidona 0,5-5 Amido pré-gelatinizado 5-20 Desintegrantes Crospovidona 2-5 Croscarmelose sódica 10-25 Celulose microcristalina 5-15 Amido 5-15 25 Lubrificantes, deslizantes e antiaderentes Estearato de magnésio 0,25-5 Talco 1-10 Dióxido de silício coloidal 1-2 Lauril sulfato de sódio 1-2 Fonte: ANSEL, 2005; ROWE, 2009. 5. MÉTODOS DE COMPRESSÃO Ao término da avaliação do fármaco e de acordo com os excipientes utilizados para aperfeiçoar a formulação, deve-se adequar o método de preparo quanto a forma de compressão dos comprimidos. Na literatura são descritas três principais formas de compressão: granulação por via seca, granulação por via úmida, que é a convencional, e compressão direta (BARACAT et al, 2001). 5.1 GRANULAÇÃO POR VIA SECA Na granulação por via seca, ou dupla compressão, o fármaco, juntamente com o diluente, aglutinante e desagregante, é primeiramente compactado e depois quebrado em grânulos, nem sempre regulares, então é adicionado o lubrificante e depois são comprimidos (ANSEL, 2005; LACHMAN, 2001; PRISTA et al, 2003). A granulação a seco não é muito utilizada na indústria farmacêutica, sendo empregada na compressão de substâncias altamente higroscópicas ou sensíveis ao calor, que é empregado na secagem do grânulo quando a via úmida é utilizada, e acabam se degradando na sua compressão (ANSEL, 2005; PRISTA et al, 2003). 5.2 GRANULAÇÃO POR VIA ÚMIDA A granulação por via úmida é muito utilizada na indústria quando o fármaco não permite uma compressão direta dos pós. Envolve o processo de preparação de uma massa úmida, no qual o aglutinante é adicionado para promover a adesão dos pós, com posterior granulação e secagem dessa massa úmida. Só após esses processos o granulado é normalizado, obtendo partículas de tamanhos semelhantes, 26 para depois se adicionar o lubrificante e seguir o processo de compressão. Lamolha relata em seus estudos que a produção de um granulado é significativa para obter um bom fluxo no alimentador da compressora além de evitar a inalação de pós pelos manipuladores (ANSEL, 2005; BARACAT et al, 2001; LAMOLHA, 2007; PRISTA et al, 2003). Vale ressaltar que esse tipo de compressão é indicado para substâncias que podem entrar em contato com água sem sofrer degradação, além disso, é necessário utilizar esse método quando a substância não possui características ideais para ser compactada diretamente e, mesmo com a utilização de alguns adjuvantes específicos, esses paramentos de compactação direta não são alcançados (BARACAT et al, 2001). 5.3 COMPRESSÃO DIRETA Esse método se baseia na tamisação dos pós inclusive do fármaco, mistura, adição e mistura de lubrificantes, antiaderentes e deslizantes e por fim a compactação formando o produto final (ANSEL, 2005; BARACAT et al, 2001). A compressão direta sem dúvida é o método mais fácil e rápido para a indústria, mas, como foi mencionado anteriormente, nem sempre algumas substâncias podem ser manipuladas por esse método, pois estas devem apresentar bom fluxo, boa compactabilidade e boa coesão das partículas. Se não apresentar essas propriedades, estas podem ser corrigidas com a adição de adjuvantes, que estão se mostrando cada dia mais eficazes, para melhorar esses aspectos de compressão (BARACAT et al, 2001; WANCZINSKI et al, 2002). Este método oferece muitas vantagens em relação aos outros processos de compressão como número de fases de processo inferior resultando num menor tempo de produção, facilidade de processo e consequentemente um menor custo de produção. Porém, também apresenta desvantagens como dificuldade de compressão de algumas substâncias, se a quantidade de fármaco for elevada e não tiver boa compactabilidade o produto final, junto com os excipientes para auxiliar o processo, pode ficar com dimensões difíceis de deglutir, além da tendência de agregação de partículas que não tem bom fluxo e formação de poeiras de pós finos que podem ser inaladas (ANSEL, 2005; BARACAT et al, 2001; LAMOLHA, 2007). 27 Ainda assim, a compressão direta é o processo que possui mais vantagens quando comparado aos demais. A compressão direta exige um cuidado maior ainda na escolha dos excipientes de acordo com o fármaco a ser comprimido para que as características de compressão sejam alcançadas e, com a maior pesquisa de adjuvantes que auxiliem essa compressão, esse processo pode vir a ter suas desvantagens diminuídas (BARACAT et al, 2001; LAMOLHA, 2007). 6. DISSOLUÇÃO Com a grande utilização de formas farmacêuticas sólidas, um aspecto importante para o sucesso terapêutico é a dissolução do fármaco. Então, com toda a tecnologia farmacêutica de excipientes, manipulação, compressão, entre outros, o objetivo de liberar do fármaco no meio deve ser atingido para que a biodisponibilidade não seja prejudicada, que é a principal meta do delineamento de formulações. Para que essa absorção aconteça, o comprimido se desintegra em partículas menores e posteriormente o fármaco é dissolvido no local de absorção em que as condições fisiológicas são mais favoráveis para suas características (ANSEL, 2005; CARDOSO, 2008). Com o estudo da dissolução dos fármacos, deve-se conhecer a velocidade de dissolução dos mesmos, que é descrita a partir da concentração do fármaco no meio em relação ao tempo. As reações mais comuns são a de ordem zero e a de primeira ordem (ANSEL, 2005). A reação de primeira ordem estabelece que a liberação do fármaco em relação ao tempo é proporcional à sua concentração, ou seja, se a quantidade de fármaco no organismo é grande a sua velocidade de liberação também será, sendo que a relação inversa também é válida. Já a reação de ordem zero determina que a velocidade de liberação é independente da quantidade de fármaco e é constante em relação ao tempo (ANSEL, 2005; BARCELLOS, 2011). Além dessas determinações de velocidade de reação, outra cinética de dissolução estabelecida é a condição sink que determina a utilização de um volume de pelo menos três vezes o volume necessário para formar uma solução saturada do fármaco, o que é importante para que a dissolução do fármaco, mesmo de ordem zero ou de primeira ordem, se dê de maneira contínua e possa ser quantificado até o final da sua dissolução (ROSA, 2005). 28 7. PERFIL DE DISSOLUÇÃO Depois de avaliar os excipientes da formulação proposta, deve-se avaliar também o melhor método de compressão, considerando os excipientes, o próprio fármaco, as características do fármaco e a dissolução da forma farmacêutica após produzir o medicamento, já que este tem que passar por testes que irão analisar suas características após o processo industrial. Um dos testes é o perfil de dissolução comparativo que, segundo a ANVISA, é definido como “[...] ensaio analítico com coletas em múltiplos pontos para a avaliação da dissolução de uma determinada substância ativa comparando duas formulações;” (BRASIL, 2010). Neste estudo do perfil de dissolução, a formulação desenvolvida irá ser comparada com outro medicamento, o de referência, e irá relacionar a porcentagem de fármaco liberada no meio aquoso, de pH e temperatura definidos, em função do tempo (AGUIAR et al, 2005; BRASIL, 2010). O perfil de dissolução deve ser baseado em documentos oficiais que determinam os métodos e especificações que devem ser seguidos e utilizados para a comparação do medicamento teste com o de referência (BRASIL, 2010). Para realização do teste, a ANVISA dispõe que a avaliação deve ser feita em algumas condições: [...] avaliação quantitativa da solubilidade da substância ativa na faixa de pH fisiológico (1,2 a 6,8), considerando a temperatura de 37°C ± 1°C [...]. A avaliação requer que quantidades crescentes da substância ativa sejam testadas em volume fixo de, pelo menos, três diferentes meios como, por exemplo, em pH 1,2; 4,5 e 6,8 [...] os tempos de coleta devem ser os mesmos para as duas formulações [...] o número de pontos de coleta deve ser representativo do processo de dissolução até que se obtenha platô na curva, sendo obrigatória a quantificação de amostras de, no mínimo, cinco tempos de coleta [...] excluindo o tempo zero [...] (BRASIL, 2010) Neste estudo de comparação, a curva como um todo é avaliada por meio do uso do Método Modelo Independente Simples, que emprega um fator de diferença (F1) e um fator de semelhança (F2). De acordo com a RDC nº 31 de 2010, avalia-se os perfis de dissolução comparativos usando somente o cálculo do fator de semelhança (F2) cujo valor corresponde a uma medida de semelhança entre as porcentagens dissolvidas de ambos os perfis (BRASIL, 2010). 29 O fator de semelhança (F2) é obtido por meio da fórmula: Em que : n = número de tempos de coleta considerados para fins de cálculo de F2; Rt = valor de porcentagem dissolvida no tempo t, obtido com o medicamento de referência ou comparador; Tt = valor de porcentagem dissolvida do medicamento teste ou da formulação alterada, no tempo t (BRASIL, 2010). Deve-se observar que apenas quando as condições do ensaio de dissolução forem as mesmas utilizadas na avaliação dos medicamentos teste e de referência deve-se calcular o fator de semelhança (F2) (BRASIL, 2010). Para a realização do estudo de perfil de dissolução comparativo, deve-se empregar doze unidades do medicamento teste e doze unidades do medicamento referência e calcular o fator F2, usando a fórmula demonstrada na Figura 3 (BRASIL, 2010). Para que dois perfis de dissolução sejam considerados semelhantes, os seguintes critérios devem ser atendidos: · O medicamento teste e o medicamento referência precisam possuir tipos de dissoluções correspondentes; · O valor do fator de semelhança (F2) necessita estar na faixa de 50 a 100; · Para as duas formulações, devem ser usados os mesmos tempos de coleta; · Obrigatoriamente, o estudo deve possuir no mínimo cinco tempos de coleta; · Ao calcular o fator de semelhança (F2), utiliza-se ao menos os três primeiros pontos de coleta, excluindo-se o tempo zero e inclui-se somente um ponto da curva após os medicamentos atingirem a média de 85% de dissolução; · Para que seja possível o uso de médias, os coeficientes de variação para os primeiros pontos de coleta não podem exceder 20%. Entretanto, os demais pontos não podem exceder 10% (BRASIL, 2010). 30 Após a realização do estudo comparativo, é importante avaliar os fatores que possivelmente podem acarretar em erro no teste, afetando a velocidade de dissolução in vitro e, posteriormente, in vivo. Alguns fatores importantes que devem ser observados são: · tamanho da partícula; · partículas sólidas com porosidade ideal para que o líquido possa entrar e promover a dissolução; · temperatura e pH do meio líquido; · natureza do fármaco e do meio de dissolução; · volume ideal do meio de dissolução, entre outros (AULTON, 2005). Ao final, com a correta produção do medicamento, com todos os estudos realizados, inclusive do perfil de dissolução e de controle de qualidade, já é possível seguir para os testes de equivalência farmacêutica, em que se estabelece novos parâmetros de comparação entre os medicamentos, além dos testes de bioequivalência, seguindo assim para uma aprovação para produção no mercado farmacêutico (ANSEL, 2005; AULTON, 2005; BRASIL, 2010). Então, o termo bioequivalência se refere à biodisponibilidade do fármaco in vivo, ou seja, a quantidade de fármaco que é absorvida e está disponível no sítio de ação, quando se compara dois medicamentos do mesmo fármaco e mesma forma farmacêutica. Assim, fármacos com biodispolibilidade equivalentes podem ser intercambiáveis entre si, já que os estudos in vitro e in vivo são semelhantes entre si e cumprem as mesmas especificações (ANSEL, 2005). 31 METODOLOGIA 1. MATÉRIAS-PRIMAS A proposta de formulação de ibuprofeno comprimido de 400mg foi realizada na Universidade Católica de Brasília no período de agosto a dezembro do ano de 2010. Foi iniciada com a compra do medicamento referência, Dalsy® do fabricante Abott (Lote: 830518F01; Validade 11/2011), e avaliação dos excipientes presentes na formulação de acordo com o medicamento referência. As matérias primas utilizadas na manipulação do medicamento teste foram: · ibuprofeno · celulose microcristalina; · croscarmelose sódica; · estearato de magnésio; · lactose; · lauril sulfato de sódio e; · talco. Também estava presente na formulação do medicamento referência a hipromelose e o opaspray branco, porém estes não foram utilizados no medicamento teste. Vale ressaltar que, de acordo com o laudo de certificação do ibuprofeno, o fármaco fornecido pela universidade apresentava teor de 90%, então a quantidade a ser pesada foi corrigida para que a formulação apresentasse 100% de ativo, obedecendo assim, a faixa da especificação. Para a realização do perfil de dissolução, foi utilizado 900mL de tampão fosfato pH 7,2 em cada cuba do dissolutor, sendo renovado a cada análise. Para que o tampão apresentasse tal pH, foi realizada a correção com hidróxido de sódio 1N. Também foi utilizada uma solução padrão, produzida a partir do ibuprofeno dissolvido inicialmente em acetona, por ser mais solúvel neste meio, e depois no mesmo tampão utilizado nas cubas. Vale ressaltar, que os parâmetros seguidos para realização do perfil de dissolução foram baseados na 4ª Edição da Farmacopéia Brasileira, já que os estudos de perfil de dissolução e equivalência 32 farmacêutica devem utilizar métodos analíticos farmacopéicos ou validados (BRASIL, 2010; FARMACOPÉIA BRASILEIRA, 1988). 2.EQUIPAMENTOS E ACESSÓRIOS Para a manipulação do piloto foi utilizado: · Balança analítica - schimadzu modelo AY 220; · Tamis de Malha 1,0mm e 2,0mm; · Misturador de pó em “V” P&D. · Analisador de umidade por infravermelho Gehaka modelo 300-2; · Compressora Lawes P&D 8 punções; · Durômetro Nova Ética- modelo 298; · Dissolutor Nova Ética. Além desses equipamentos, vidrarias e equipamentos básicos também foram utilizados, como béquer, espátula, funil de vidro, proveta, papel filtro, agitador, pipeta, entre outros. 3. PLANEJAMENTO ESTATÍSTICO DA FORMULAÇÃO E PERFIL DE DISSOLUÇÃO O processo de planejamento da formulação requer o estudo dos excipientes e do fármaco para que a formulação a ser produzida tenha as especificações mais próximas possíveis do medicamento referência, além de apresentar eficácia, qualidade e segurança comprovada. Inicialmente foi analisada a composição do medicamento referência e, a partir dos excipientes descritos em sua composição, uma nova formulação foi sugerida. Para iniciar a formulação foi realizado o peso médio dos comprimidos do medicamento referência para que fosse estabelecido o peso do núcleo. Após estabelecer esse valor, foi determinado que o peso médio do comprimido representaria 100% do valor do peso do fármaco e dos excipientes presentes em um comprimido, que estão representados pelas colunas de mg/cp e Medicamento Teste (%) na tabela 2. Então, como o medicamento deveria ter uma concentração de 33 400mg de ativo por comprimido, calculou-se a porcentagem que essa concentração representa diante do comprimido como um todo. Assim, a porcentagem de ativo foi estabelecida e a dos excipientes foi sugerida a partir de concentrações usuais descritas na literatura até que se fechasse 100% da formulação. Com as concentrações estabelecidas, foi definido um tamanho de lote piloto de 500g para que ficasse adequado à capacidade média dos equipamentos e então, calculou-se a quantidade (g) a ser utilizada de cada componente. Outro procedimento adotado foi a correção da quantidade de fármaco de acordo com o teor apresentado no laudo. A potência era de 90%, então 381,65g pesadas correspondiam a um teor de 90%, então foi realizada a correção para 100%, pesando 42,40g a mais de ibuprofeno e adicionado à formulação. As concentrações e as quantidades utilizadas dos excipientes podem ser observadas na Tabela 2. Tabela 2: Concentrações de ativo e excipientes Dalsy® 400mg Ibuprofeno 400mg Medicamento Teste (%) mg/cp Quantidades pesadas (g) Ibuprofeno Ibuprofeno 76,33 400mg 381,65+42,40g Celulose microcristalina Croscarmelose sódica Dióxido de silício Estearato de magnésio Celulose microcristalina Croscarmelose sódica Dióxido de silício Estearato de magnésio 5 26,2mg 25,00g 2 10,48mg 10,01g 1 5,24mg 5,15g 1 5,24mg 5,01g Hipromelose - - - - Lactose Lactose 12,67 66,39mg 63,40g Lauril sulfato de sódio Opaspray branco Lauril sulfato de sódio 1 5,24mg 5,00g - - - - Talco Talco 1 5,24mg 5,03g 100% 524mg 500g Total Para a realização do perfil de dissolução, as amostras foram preparadas de acordo com a diluição do comprimido, 400mg, em 900mL de tampão em cada cuba 34 e uma posterior diluição de 5mL de solução em balão volumétrico de 100mL com tampão fosfato, e com sucessivas diluições, resultando numa concentração de 0,022mg/mL. Para que o padrão apresentasse a mesma concentração, foi pesado 22mg de ibuprofeno e diluído em balão volumétrico de 100mL correspondente ao tampão. Para que o teor do padrão fosse de 100%, a quantidade a ser pesada também foi corrigida, de tal forma que foram pesados 25mg de ibuprofeno. As leituras foram realizadas com espectrofotômetro, em que o branco, utilizado para zerar o equipamento, foi o tampão fosfato utilizado nas diluições. 4.MÉTODOS A manipulação do lote piloto ocorreu no laboratório de Tecnologia Farmacêutica da UCB. Os excipientes e o fármaco foram selecionados e utilizou-se a seguinte técnica de manipulação: 1 – o fármaco e todos os excipientes foram pesados separadamente; 2 – o ibuprofeno, a lactose, a celulose microcristalina e o lauril sulfato de sódio foram tamisados em malha com 2,0mm de abertura; 2 – esta primeira mistura foi homogeneizada no misturador em “V” por dez minutos; 3 – após este tempo, foi adicionada à mistura o dióxido de silício previamente tamisado em malha 1,0mm e misturou-se por mais cinco minutos; 4 – o estearato de magnésio e o talco foram tamisados em malha 1,0mm e então adicionados à mistura final; 5 – misturou-se por mais três minutos e o processo de mistura foi finalizado. A umidade do pó foi analisada com o equipamento Analisador de Umidade Gewaka/modelo 300-2, uma balança acoplada ao infravermelho que quantifica porcentagem de água presente na amostra. Em seguida, com os parâmetros dentro da especificação, o processo de compressão foi iniciado. Logo após a manipulação do lote piloto a compressão foi iniciada. A compressora montada com punção circular de 10mm e ajustada com peso e dureza ideal, fazendo com que os primeiros comprimidos produzidos fossem descartados se 35 não estivessem dentro dos padrões estabelecidos e de acordo com as características físicas do medicamento referência. O controle de peso foi realizado durante o processo de compressão, assim como o controle da dureza. Ao final da compressão uma amostra também foi selecionada para realizar tais testes novamente. Para o perfil de dissolução foi utilizado dissolutor da marca Nova Ética, seguindo as especificações da farmacopéia brasileira, utilizando o aparato cesto, rotação 150rpm, 900mL de tampão fosfato pH 7,2 e foram coletadas amostras no tempo 0, 5, 8, 10, 15 e 30 minutos, tanto para o medicamento teste quando para o referência, já que a RDC 31 de 2010 dispõe que é necessário retirar amostras de pelo menos 5 tempos durante o perfil de dissolução, excluindo o tempo zero. Foram coletadas 10mL de cada amostra e inicialmente acondicionadas em becker com papel filtro para que nenhuma partícula interferisse no resultado. Depois foram pipetadas 5mL para um balão volumétrico de 100mL, seguida de diluições da amostra para obter a concentração final adequada e assim realizada a leitura da amostra. A leitura do padrão foi realizada no mesmo comprimento de onda das amostras para que depois fosse possível mensurar a quantidade de fármaco dissolvido em cada tempo (BRASIL, 2010; FARMACOPÉIA BRASILEIRA, 1988). Para cada amostra que foi retirada não houve reposição do volume em cada cuba, visto que, o cálculo desse desvio foi realizado com auxílio de uma planilha que fez correções teóricas automaticamente. Para fins de cálculo da variação entre as cubas, foi tomado o valor obtido da leitura de cada um dos 12 comprimidos que foi analisado em cada cuba no mesmo tempo, ou seja, em relação às 12 amostras analisadas em 5 minutos, por exemplo, foi calculada a liberação de cada comprimido e em seguida a variação de liberação do fármaco nesse tempo, e assim sucessivamente para os tempos seguintes. 36 RESULTADOS E DISCUSSAO 1.MANIPULAÇÃO O lote piloto produzido na UCB foi de 500g, em que cada excipiente se encontrava na sua concentração usual. O medicamento teste não apresentou os excipientes hipromelose e opaspray branco que são relacionados ao revestimento do núcleo, porém esse procedimento não foi realizado por falta de equipamento e excipientes necessários. A falta de tal procedimento não interfere no estudo de equivalência farmacêutica, visto que o estudo pode ser realizado com medicamento teste na forma de comprimido simples e o medicamento referência se apresentando na forma de comprimido revestido ou drágea, e vice versa. Esta intercambialidade pode ser realizada desde que o processo de revestimento ou drageamento não controle a liberação do ativo (BRASIL, 2010; ROWE, 2009; STORPIRTIS, et al 2004). A manipulação do medicamento teste foi baseada nas propriedades e finalidades dos excipientes utilizados, assim como os tempos de mistura foram estabelecidos de acordo com a manipulação de outros pilotos descritos na literatura. A mistura inicial teve como justificativa acrescentar o ativo e alguns excipientes e misturar por mais tempo para garantir a homogeneidade dos pós, garantindo uma boa uniformidade dos comprimidos posteriormente (ROWE, 2009; SILVA, F., 2009). A croscarmelose utilizada numa concentração de 2% tem função desintegrante enquanto 1% de dióxido de silício confere maior dureza ao comprimido, além de melhorar o fluxo e as propriedades antiaderentes do pó (ROWE, 2009). Por fim, misturando durante um tempo menor, três minutos, foi adicionado o estearato de magnésio e o talco, ambos numa concentração de 1%, que conferem ao pó um melhor fluxo desde que não estejam dentro da mistura, mas sim por fora das partículas para garantir essa lubrificação dos pós. De acordo com a literatura, a adição de estearato de magnésio na mistura inicial e sua mistura prolongada pode fazer com que o fármaco tenha uma liberação mais prolongada, devido à sua característica hidrofóbica, formando um filme que demora a ser dissolvido pelo meio (DIAS, 2005; ROWE, 2009). 37 Com o fim da manipulação, foi iniciado o teste de umidade com uma amostra do pó do medicamento teste. A mistura final dos pós do medicamento teste apresentou uma umidade de 2,5% e, de acordo com a literatura, uma umidade alta, maior que 5%, pode trazer alterações na formulação, podendo alterar tempo de desintegração, dureza, crescimento microbiológico, estabilidade do fármaco, entre outros parâmetros, fazendo com que uma umidade mais baixa seja o ideal para manipulação de comprimidos. Então o teste de umidade se encontra dentro das especificações (CHAUD, 2005, FARMACOPÉIA BRASILEIRA, 1988; MELO, et al, 2006). 2.COMPRESSÃO O núcleo produzido na UCB apresentou aspecto branco, sem sulcos e com 10mm de diâmetro e 9mm de altura, parâmetros que foram analisados com um paquímetro. Vale ressaltar, que ambos os comprimidos não apresentavam rugosidades ou imperfeições a olho nu e também não apresentaram tendência a desgaste das bordas ou mesmo tendência a capping ou laminação, devido à quantidade adequada de excipientes e boas características da mistura de pó, que apresentou bom fluxo em máquina e boa compressibilidade da mistura de matérias primas e do fármaco. 3. PESO MÉDIO A análise do peso médio foi realizada com 20 comprimidos do medicamento de referência e 20 comprimidos do medicamento teste. O peso médio do medicamento referência foi de 0,5244g com um desvio padrão de 0,0021, já o do medicamento teste foi de 0,5389g, porém com um desvio padrão de 0,0116, que é resultado da falta de alimentador da máquina compressora, o que dificulta o ajuste de peso dos comprimidos na máquina. As relações de peso médio podem ser observadas na tabela 3. 38 Tabela 3 Teste de peso (g) Dalsy® Ibuprofeno 1 – 0,5250 11 – 0,5292 1 – 0,5378 11 – 0,5327 2 – 0,5257 12 – 0,5249 2 – 0,5502 12 – 0,5447 3 – 0,5238 13 – 0,5280 3 – 0,5347 13 – 0,5251 4 – 0,5224 14 – 0,5242 4 – 0,5471 14 – 0,5294 5 – 0,5222 15 – 0,5242 5 – 0,5208 15 – 0,5541 6 – 0,5248 16 – 0,5268 6 – 0,5341 16 – 0,5276 7 – 0,5248 17 – 0,5241 7 – 0,5382 17 – 0,5315 8 – 0,5233 18 – 0,5232 8 – 0,5219 18 – 0,5459 9 – 0,5192 19 – 0,5245 9 – 0,5504 19 – 0,5522 10 – 0,5253 20 – 0,5232 10 – 0,5506 20 – 0,5372 Peso médio 0,5244 Peso médio 0,5383 Desvio padrão 0,0021 Desvio padrão 0,0116 Após obter o peso dos 20 comprimidos e a média, calculou-se a variação do medicamento referência e do medicamento teste. Tal desvio deveria estar numa faixa de 5% para mais ou para menos em relação ao peso médio do medicamento referência, ou seja, não poderia ser menor que 0,4981g nem maior que 0,5506g. Além disso, nenhum comprimido poderia estar abaixo ou acima do dobro desse limite de variação, ou seja, não poderia existir variação maior ou menor do que 10% (0,4719g a 0,5768g) em relação ao peso médio. Percebe-se então, que a variação do medicamento teste está de acordo com as especificações descritas na 4ª Edição da Farmacopéia Brasileira (FARMACOPÉIA BRASILEIRA, 1988). 4. DUREZA Com o ajuste de dureza feito na máquina compressora, será determianda a força com que um punção exercerá sobre o outro, sendo importante para determinar com que o pó fique mais ou menos compactado. Então, o teste de dureza mostra a resistência dos comprimidos ao esmagamento. Os resultados de tais testes evidenciaram que o medicamento referência apresentava menor dureza em relação 39 ao medicamento teste, como pode ser observado na tabela 4 (FARMACOPÉIA BRASILEIRA, 1988). Tabela 4 Teste de dureza Dalsy® 400mg (kgf) Ibuprofeno 400mg (kgf) 7,5 21,6 6,4 15,6 8,0 12,0 8,0 26,5 7,0 17,4 8,2 19,1 7,1 17,5 7,8 21,9 7,4 17,5 7,2 19,6 Máxima: 8,2 Máxima: 26,5 Mínima: 6,4 Mínima: 12,0 Média: 7,46 Média: 18,87 É importante ter cautela com este parâmetro, pois a especificação considera que os comprimidos possuem uma boa dureza quando ela está acima de 3kgf, porém esta pode alterar a desintegração e posteriormente o perfil de dissolução do fármaco no meio, já que estes parâmetros estão diretamente ligados à sua dureza. Por outro lado, uma alta dureza pode resultar em um comprimido menos friável, ou seja, com uma maior resistência ao atrito, o que é desejado em comprimidos revestidos que podem sofrer grande degradação de maneira geral. É visível que a dureza do medicamento teste está acima do medicamento referência, porém o comprimido ficou com uma altura maior em relação ao medicamento referência, o que justifica uma maior dureza para manter a boa compressibilidade dos pós, desde que não altere a dissolução final do comprimido (CHAUD, 2005; FARMACOPÉIA BRASILEIRA, 1988; MELO et al, 2006; SOUZA, 2005). 40 5. PERFIL DE DISSOLUÇÃO Ao final da manipulação, compressão e controle de parâmetros físicos foi realizado o perfil de dissolução com 12 comprimidos de cada medicamento, teste e referência. As condições analíticas e os aparatos em que a dissolução deveria acontecer foram selecionados de acordo com a 4ª edição da Farmacopéia Brasileira e podem ser observados na tabela 5 É válido ressaltar que as condições do perfil de dissolução foram exatamente as mesmas para o medicamento referência e o medicamento teste. Tabela 5 Dados experimentais e especificações de análise de acordo com a 4ª Edição da Farmacopéia Brasileira. Condições da Dissolução Meio de Dissolução: Tampão Fosfato pH 7,2 Volume do Meio: 900 mL Aparato: Cesta Rotação: 150rpm Tempo: 30 minutos Temperatura: 37°C Tempos de Coleta: 0, 5, 8, 10, 15 e 30 minutos Tolerância: Não menos que 70% de ibuprofeno se dissolve em 30 minutos Condições da Quantificação Método Espectrofotometria λ 221nm A leitura das amostras do medicamento teste variou de 0,614 a 0,874, a do Dalsy® variou de 0,402 a 0,867 e a leitura do padrão foi de 0,868, mostrando que em alguns casos a liberação foi maior que 100%, visto que, com a correção do ativo e com uma menor uniformidade do comprimido, isto pode ocorrer. Então, com as leituras obtidas de cada tempo, 5, 8, 10, 15 e 30 minutos, calculou-se a porcentagem 41 de fármaco liberado no meio de dissolução e posteriormente a média desses valores, obtendo um valor de liberação para cada tempo conforme descrito. Os valores descritos na tabela 6 demonstram que a liberação do fármaco nos respectivos tempos é semelhante, sendo que o medicamento teste apresentou maior liberação em todos os tempos, exceto no tempo de 10 minutos. Tabela 6: Média da porcentagem de fármaco liberada em cada tempo. Perfil de Dissolução Ibuprofeno 400mg Liberação do Fármaco (%) Tempo (min) Teste UCB Dalsy® 0 0,00 0,00 5 77,70 68,85 8 87,96 85,98 10 91,52 92,89 15 95,39 94,31 30 97,47 95,15 Com as médias estabelecidas, dois gráficos foram plotados referentes à curva de liberação do medicamento teste e do medicamento referência, para que fosse possível fazer uma comparação entre ambos. Através da figura 4 pode-se observar a liberação dos dois medicamentos, Dalsy® e teste. Tal característica do gráfico mostra que não há uma diferença significativa quando se compara somente os valores das médias das porcentagens de ibuprofeno dissolvido em função do tempo (minutos) em relação ao medicamento referência e medicamento teste. Assim, a avaliação dos perfis de dissolução obtidos a partir dos produtos em estudo indica que os medicamentos são semelhantes, ou seja, são equivalentes farmacêuticos (BRASIL, 2010). 42 Figura 4: Perfil de dissolução comparativo Além do perfil de dissolução comparativo, também foi calculado os valores de f1 e f2, que mostram a comparação em porcentagem das diferenças e semelhanças do comportamento de liberação dos medicamentos teste e referência. No caso do ibuprofeno, por apresentar alta solubilidade, este cálculo perde sua função comparativa e é dispensado quando o fármaco possui dissolução muito rápida, ou seja, mais de 85% do fármaco é liberado no tempo de 15 minutos, o que acontece com o medicamento teste e referência, que liberam 92,9% e 91,5% respectivamente (BRASIL, 2010). As comparações podem ser observadas na tabela 7. Tabela 7: avaliação dos resultados Avaliação da Semelhança x Diferença Parâmetros Critérios de Aceitação Resultados Status f1 Fator de Diferença (0 a 15) 3,57 De Acordo f2 Fator de Semelhança (50 a 100) 67,97 De Acordo Como mencionado, o ibuprofeno é classificado como medicamento de liberação imediata e, segundo a RDC 31 de 2010, quando o fármaco apresentar tal característica de dissolução muito rápida este não deve apresentar uma variação na 43 liberação do fármaco maior que 10% no tempo de 15 minutos. Além de seguir esta regra, devem seguir a regra geral de não apresentar variação maior que 20% nos três primeiros pontos de coleta. Com os resultados apresentados na tabela 8, é possível observar que o medicamento teste e o medicamento referência foram aprovados em todos os tempos, obedecendo todos os critérios de aceitação (BRASIL, 2003; BRASIL, 2010). Tabela 8: avaliação de variações Variação entre Cubas Critérios de aceitação Teste UCB Dalsy® Status 5 máx. 20% 7,66% 11,97 % De acordo 8 máx. 20% 3,36% 10,03% De acordo 10 máx. 20% 2,43% 2,53% De acordo 15 máx. 10% 1,72% 2,65% De acordo 30 máx. 10% 1,41% 2,56% De acordo Parâmetros Tempo de Coleta (min) Ao observar o gráfico, é possível visualizar que ambos os medicamentos foram capazes de liberar o fármaco nele contido, apresentando uma concentração de fármaco liberada durante um período de tempo muito parecido. Além disso, o medicamento teste e o medicamento referência mostraram uma cinética de liberação de primeira ordem, que define que a liberação do fármaco não depende do tempo, mas sim da concentração do mesmo. Ou seja, inicialmente a liberação do fármaco foi maior porque sua concentração também era maior e ao final atingiu um platô já que a velocidade de liberação e a sua concentração diminuíram. Tal modelo de liberação é característico de fármacos de liberação imediata, que é o caso do ibuprofeno (BORTOLUZI, 2008). Como foi citado anteriormente, há uma grande diferença entre os dois comprimidos respaldada pela legislação, em que o referência é revestido e o teste não. Tal característica do comprimido produzido na UCB não ocasionou uma discrepância significativa no perfil de dissolução comparativo, que pode ser justificada, por exemplo, pela dureza mais alta do comprimido teste que pode segurar mais a liberação do fármaco já que as partículas estão mais consolidadas do que no medicamento referência. Além disso, a lactose, utilizada em maior 44 quantidade com a função de diluente na formulação, é mais solúvel em água do que a celulose microcristalina, o que facilita a desintegração do comprimido no meio de dissolução (CHAUD, 2005). Esta semelhança do perfil também pode ser explicada pela quantidade de desintegrante que foi ideal para a liberação do fármaco, mesmo este apresentando uma maior dureza, já que a croscarmelose é considerada um super desintegrante (ROWE, 2009). Além disso, o opaspray branco, que é composto por álcool, dióxido de titânio e hiprolose, juntamente com a hipromelose compõe a solução de revestimento. O dióxido de titânio é utilizado no revestimento para conferir a cor branca ao produto, a hipromelose é um polímero usualmente utilizado no revestimento, para formação de filmes plásticos em volta do comprimido, enquanto sua utilização como agente modificador de liberação não é comum além de utilizar uma concentração muito grande desses polímeros na formulação em si, variando de 10 a 80%, e não no revestimento, em que forma somente uma película que logo é removida no meio de dissolução e o fármaco pode ser liberado. O mesmo é aplicado à hiprolose, outro polímero de celulose usado para revestimento ou durante o processo de manipulação para estender a liberação do fármaco (ROWE, 2009). Juntos, estes excipientes possuem a função de revestimento e proteção do fármaco além de mascarar o sabor, porém não controlam diretamente a sua liberação. Tal revestimento pode até segurar a liberação do fármaco nos primeiros minutos, mas depois de quebrada esta barreira o fármaco é liberado normalmente. Então este controle de liberação só ocorre quando a porcentagem de revestimento é muito grande, ou seja, o ganho de peso do comprimido com a solução de revestimento representa uma porcentagem significativa, para que forme uma camada grossa que interfira na liberação (ROWE, 2009). Então, com todas as especificações dentro dos limites aceitáveis, tanto dos parâmetros físico-químicos quanto do perfil de dissolução, o fármaco poderia ser submetido aos estudos de bioequivalência, para assegurar os ensaios de equivalência das amostras. Porém antes disso alguns testes ainda podem ser realizados para obter maior certeza de que o medicamento terá uma liberação in vivo parecida com o medicamento referência. Um exemplo de outro parâmetro a ser avaliado é a estabilidade do fármaco que permitirá a antecipação de possíveis reações de degradação, como hidrólise e oxidação, além de ajudar a estabelecer o 45 período de validade do medicamento. Então, um medicamento estável deve manter as concentrações e características iniciais do fármaco quando foi produzido por todo período de armazenamento ou uso (ANSEL, 2005). Assim, com a equivalência farmacêutica do medicamento aprovada, com os estudos de meios e em paralelo com os estudos de estabilidade o medicamento poderá ser encaminhado para os estudos de biodisponibilidade, verificando a velocidade e extensão de absorção do fármaco através da determinação da concentração na circulação sistêmica ou excreção urinária em função do tempo, demonstrando desta forma a sua biodisponibilidade, sendo liberado posteriormente para registro e venda (ANSE, 2005; STORPIRTIS, et al 2004). 46 CONCLUSÃO A formulação proposta para o ibuprofeno 400mg produzido na UCB foi condizente com o medicamento referência, apresentando os excipientes principais que acrescentaram características específicas à formulação. Ambos os medicamentos, teste e referência, apresentaram cinética de dissolução semelhante, caracterizando-se como medicamentos de liberação imediata. Com as concentrações dos excipientes utilizados, o bom preparo do lote piloto da formulação teste, com o perfil de dissolução realizado seguindo exatamente os parâmetros estabelecidos e de acordo com a literatura, o medicamento produzido na UCB possui grandes chances de ser bioequivalente em relação ao Dalsy ® por apresentar características semelhantes de perfil de dissolução estabelecido na Farmacopéia Brasileira. Testes de estabilidade e realização do perfil de dissolução em diferentes meios ainda precisam ser realizados para verificar o comportamento do medicamento e ter maior certeza desta equivalência farmacêutica, podendo encaminhar o medicamento para testes de bioequivalência (BRASIL, 2010). Além disso, outras formulações também podem ser testadas para verificar o comportamento do fármaco e dos excipientes em concentrações diferentes das utilizadas, assim como é importante rever a questão do revestimento e desenvolver novo produto que o mesmo esteja presente, para avaliar melhor sua interação na formulação, visto que não foi realizado neste trabalho. Também é importante considerar a realização de estudos de equivalência e bioequivalência farmacêutica para normatizar tais estudos e garantir a qualidade dos medicamentos, tanto os novos genéricos ou similares, quanto os medicamentos que estão passando por um processo de renovação de registro, que agora também precisam comprovar tal eficácia (BRASIL, 2000). 47 REFERÊNCIAS BIBLIOGRÁFICAS AGUIAR, G. et al. Avaliação biofarmacotécnica in vitro de formas farmacêuticas sólidas contendo doxiciclina. Revista Brasileira de Ciências Farmacêuticas, São Paulo, vol. 41, n. 4, out./dez. 2005. ANSEL, H.C.; POPOVICH, N.G.; ALLEN Jr.; L.V. Formas farmaceuticas & sistemas de liberação de fármacos , 8. ed. Premier, 2005. AULTON, M.E. Delineamento de Formas Farmacêuticas. 2. ed. Porto Alegre: Editora Artmed, 2005. BARACAT, M.M. et al. Estudo comparativo de excipientes em diferentes técnicas de preparação de comprimidos de cloridrato de propranolol. Semina: Ci. Biol. Saúde, Londrina, v. 22, p. 19-24, jan./dez. 2001 BARCELLOS, N.M.S. Farmacocinética. Universidade Federal de Ouro Preto. Minas Gerais. Disponível em: <http://www.farmacia.ufmg.br/cespmed/text7.htm>. Acesso em: 30 abr. de 2011. BORTOLUZI, P.; LAPORTA, L.V. Equivalência Farmacêutica e Estudo Comparativo dos Perfis de Dissolução de Medicamentos Contendo Cimetidina. Disc. Scientia. Série: Ciências da Saúde, Santa Maria, v. 8, n. 1, p. 21-38, 2008. BRASIL. Agência Nacional de Vigilância Sanitária. RE nº 1, de 29 de julho de 2005. Guia para a Realização de Estudos de Estabilidade. Diário Oficial da República Federativa do Brasil , 01 de agosto de 2005. Disponível em: <http://www.interfarma.org.br/site2/images/Site%20Interfarma/Informacoesdosetor/R E/Registro/2005/RE%2001-05.pdf>. Acesso em: 27 abr. 2011. BRASIL. Agência Nacional de Vigilância Sanitária. RDC nº 31, de 11 de agosto de 2010. Dispõe sobre a realização dos Estudos de Equivalência Farmacêutica e de Perfil de Dissolução Comparativo. Diário Oficial da República Federativa do Brasil. Brasília, 31 de ago. de 2010. BRASIL. Agência Nacional de Vigilância Sanitária. RDC nº 41, de 28 de abril de 2000. Determina que as entidades ou empresas que porventura pretendam cadastrar-se junto à ANVS/MS para se habilitarem à realização dos ensaios de equivalência farmacêutica, biodisponibilidade e/ou bioequivalência deverão proceder ao preenchimento de formulário específico disponível, via Internet, no endereço eletrônico http://anvs.saude.gov.br, seção da Rede Brasileira de Laboratórios, item cadastramento. Diário Oficial da República Federativa do Brasil. Brasília, 3 de mai. de 2000. 48 BRASIL. Agência Nacional de Vigilância Sanitária. RE nº 897, de 29 de maior de 2003. Guia para isenção e substituição de estudos de bioequivalência. Diário Oficial da República Federativa do Brasil. Brasília, 31 de mar. de 2003. BRASIL. Agência Nacional de Vigilância Sanitária. Recomendações para realização de ensaios de dissolução para formas farmacêuticas sólidas orais de liberação imediata (FFSOLI). Disponível em: <http://portal.anvisa.gov.br/wps/wcm/connect/cf7eb38040672857bdc4ff137b78f2dc/r ecomenda_dissolucao2.pdf?MOD=AJPERES>. Acesso em: 27 abr. 2011. BRASIL. Lei nº 5.991, de 17 de dezembro de 1973. Dispõe sobre o controle sanitário do comércio de drogas, medicamentos, insumos farmacêuticos e correlatos, e dar outras providências. Diário Oficial [da] República Federativa do Brasil, Brasília, 19 dez. 1973. Disponível em: <http://www.anvisa.gov.br/medicamentos/conceito.htm#1>. Acesso em: 10 out. 2010. BUSHRA, R. et al; Formulation Development And Optimization Of Ibuprofen Tablets By direct Compression Method. Brazilian Journal of Pharmaceutical Sciences, Pakistan,v. 21, n. 2, p. 113-120, 2008. BUSHRA, R. et al; Enteric coating of ibuprofen tablets (200 mg) using an aqueous dispersion system. Brazilian Journal of Pharmaceutical Sciences. Pakistan, v. 46, n. 1, jan./mar., 2010. CARDOSO, S.G.; CORREA, G.M.; BELLÉ, L.P. Desenvolvimento e Validação de Método de Dissolução para Deflazacorte em Comprimidos e Cápsulas Magistrais. Latin American Journal of Pharmacy, Florianópolis, v. 27, n. 5, p. 734-739, 2008. CHAUD, M.V. et al; Efeito da Força de Compressão e da Umidade no Perfil de Dissolução de Fármacos. Saúde Rev., Piracicaba, v. 7, n. 15, p. 39-43, 2005. DALSY: comprimidos revestidos. Responsável técnico Fabio Bussinger da Silva. Rio de Janeiro: Abbott, 2010. Bula de remédio. DIAS, A. et al; Sistema de liberação prolongada a partir de comprimidos matriciais bioadesivos vaginais contendo metronidazol. Rev. Ciênc. Farm. Básica Apl., v. 26, n.3, p. 217-220, 2005. 49 DRUGDEX® System [Internet database]. Greenwood Village, Colo: Thomson Reuters (Healthcare) Inc. Updated periodically. Disponível em: <http://www.thomsonhc.com/hcs/librarian/ND_T/HCS/ND_PR/Main/CS/4BCE1D/DU PLICATIONSHIELDSYNC/66F1E8/ND_PG/PRIH/ND_B/HCS/SBK/2/ND_P/Main/PF ActionId/hcs.common.RetrieveDocumentCommon/DocId/2472/ContentSetId/31/Sear chTerm/ibuprofen%20/SearchOption/BeginWith>. Acesso em: 15 set. 2010. FARMACOPÉIA BRASILEIRA. 4. ed. São Paulo: Atheneu, 1988. FERREIRA, A.O. Guia Prático da Farmácia Magistral. 2. ed. São Paulo: Pharmabooks, 2008. JAIN, S.K.; SHUKLA, M.; SHRIVASTAVA, V.; Development and in Vitro Evaluation of Ibuprofen Mouth Dissolving Tablets Using Solid Dispersion Technique. Chem. Pharm. Bull., v. 58, n. 8, 2010. KATZUNG, B.G.; Farmacologia Básica e Clínica. 9. ed. Rio de Janeiro: Guanabara Koogan, 2006. KÖHLER, L.F. et al. Avaliação biofarmacotécnica e perfil de dissolução de comprimidos de dipirona: equivalências farmacêutica entre medicamentos de referência, genéricos e similares. Rev. Bras. Farm., v. 90, p. 309-315, 2009. LACHMAN, l.; LIEBERMAN, H.A.; KANIG, J.L. Teoria e prática na indústria farmacêutica. Vol. I e II. Lisboa: Fundação Calouste Gulbenkian, 2001. LAMOLHA, M.A.; SERRA, C.H.R. Avaliação das propriedades de fluxo dos granulados e dissolução de comprimidos de hidroclorotiazida 50 mg obtidos por granulação úmida. Revista Brasileira de Ciências Farmacêuticas. São Paulo, v. 43, n. 3, 2007. LINSBINSKI, L.M.; MUSIS, C.R.; MACHADO, S.R.P. Avaliação da equivalência farmacêutica de comprimidos de captopril.Rev. Bras. Farm., Cuiabá, v. 89, n. 3, p. 214-219, 2008. LIMA A.C. de, et al. Força de Compressão e Umidade no Perfil de Dissolução da Hidroclorotiazida. Acta farmacéutica bonaerense. Araraquara, v. 25, n. 1, 2006. LUCIDA, H.; RAHMI, S. A Comparative Dissolution Test Between Generic and Branded Name of Furosemide Tablets. Journal Sains Teknologi Farmasi, v. 11, n. 2, 2006. 50 MAMEDE, L.C. et al. Comportamento térmico de alguns fármacos e medicamentos. Rev. Ciênc. Farm. Básica Apl., Franca, v. 27, n. 2, p.151-155, 2006. MELO, E.B. et al. Medicamentos Similares e Saúde Pública: Controle de Qualidade Físico-Químico de Comprimidos de Similar de Ácido Acetilsalicílico do Estoque da Farmácia Básica do Município de Cascavel, PR, Brasil. Acta Farm. Bonaerense, v. 25, n. 3, p. 344-350, 2006. O’NEIL, M.J. et al; The Merck Index – An Encyclopedia of Chemicals, Drugs, and Biologicals. New Jersey: Merck Sharp & Dohme Corp., 2006. PEREIRA, L.R.L.; FREITAS, O. A evolução da Atenção Farmacêutica e a perspectiva para o Brasil. Revista Brasileira de Ciências Farmacêuticas, São Paulo, v. 44, n. 4, dez. 2008. PEREIRA, D.G. Importância do Metabolismo no Planejamento de Fármacos. Quim. Nova, Campinas, v. 30, n. 1, p. 171-177, 2007. PITA, N.O.G.; PRATES, E.C.; FERRAZ, H.G. Avaliação do perfil de dissolução de comprimidos de ciprofloxacino 250 mg comercializados como similares no Brasil. Revista Brasileira de Ciências Farmacêuticas, v. 40, n. 3, 2004. PRISTA, L.N. et al. Tecnologia Farmacêutica. Vol. I 6. ed. Lisboa: Fundação Calouste Gulbenkian, 2003. ROSA, T.C.C. Dissolução Intrínseca de Hidroclorotiazida de Diferentes Granulometrias e sua Relação com a Dissolução do Ativo em Comprimidos. 2005. 81p. Tese (Mestre em Ciências Farmacêuticas) – Universidade Federal do Rio de Janeiro - UFRJ, Rio de Janeiro, 2005. Disponível em: <http://teses.ufrj.br/FF_M/TatianaCupelloColonesiDaRosa.pdf>. Acesso em: 30 abr. 2011. ROWE, R.C.; SHESKEY, P.J.; OWEN, S. Handbook of Pharmaceutical Excipients. 6. ed. United States of America: American Pharmaceutical Association and Pharmaceutical Press, 2009. SERRA, C.H.R.; STORPIRTIS, S.; Comparação de perfis de dissolução da cefalexina através de estudos de cinética e eficiência de dissolução (ED%). Revista Brasileira de Ciências Farmacêuticas, v. 43, n. 1, 2007. 51 SILVA, W. B. da. A emergência da Atenção Farmacêutica: Um olhar epistemológico e contribuições para o seu ensino. 2009.305p. Tese (Doutorado em Educação Científica e Tecnológica) – Universidade Federal de Santa Catarina – UFSC, Florianópolis, 2009. Disponível em: <http://www.ppgect.ufsc.br/teses2009/wellington_barros/tese.pdf>. Acesso em: 15 set. 2010. SILVA, F.E.B. da; ZIECH, C.; PAVONI, G.; PASQUALI. Desenvolvimento de Comprimidos Contendo Fluconazol por Compressão Direta. Latin American Journal of Pharmacy, Natal, v. 28, p. 604-608, 2009. SOUZA, T.P.DE; SPANIOL, B.; PETROVICK, P.R. Avaliação de Comprimidos Revestidos por Película contendo Alta Concentração de Produto Seco por Aspersão de Phyllanthus niruri. Acta farmacéutica bonaerense, v.24, n. 1, 2005. STORPIRTIS, S. et al. A Equivalência Farmacêutica no Contexto da Intercambialidade Entre Medicamentos Genéricos e de Referência: Bases Técnicas e Científicas. Anvisa, Brasília, 2004. Disponível em: < http://www.anvisa.gov.br/divulga/artigos/genericos_referencia.pdf>. Acesso em: 30 abr. 2011. STULZER, H.K.; SILVA, M.A.S.; Desenvolvimento e Avaliação de Comprimidos de Captopril de Liberação Prolongada. Latin American Journal of Pharmacy, Florianópolis, v. 26, p. 259-165, 2007. WANCZINSKI, B.J. et al. Desenvolvimento de comprimidos de AAS 500 mg: influência do Amido 1500® na compressão direta. Acta Scientiarum. Maringá, v. 24, n. 3, p. 649-655, 2002. 52 A – Frente da bula Dalsy® 400mg ANEXOS 53 B – Verso da bula - Dalsy® 400mg 54 C – Monografia Ibuprofeno comprimidos – Farmacopéia Brasileira 4ª Edição
Download