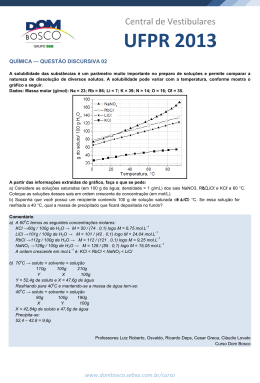
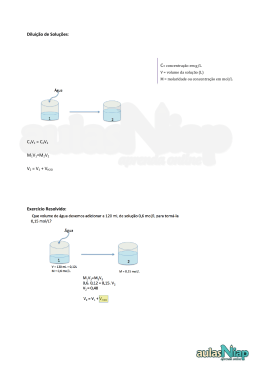
Química 4 aula 1 4. Ar, água de torneira e ouro 18 quilates representam soluções. Resposta correta: E COMENTÁRIOS – ATIVIDADES PARA SALA 5. 1. (V) (F) Existem diferentes métodos de separação. (V) (F) Uma solução pode ser incolor. (F) Não existem íons soltos em solução e, por conseguinte, mobilidade eletrônica. Na+ • Água em CaCA2 é uma solução líquido-sólido. • • • • CO2 em bebidas é uma solução gás-líquido. Naftaleno no ar é uma solução sólido-gás. Liga metálica é uma solução sólido-sólido. Ar atmosférico é uma solução gás-gás. 6. 5. 7. 8. 1. 2. Veja: I. C II. B III. D IV. B V. A VI. A VII. A VIII. B Partículas coloidais apresentam movimento contínuo e ordenado formando aglomerações. Resposta correta: C 3. (F) As dispersões coloidais não formam um sistema cristalino. (V) (V) (F) Coloides hidrofóbos não possuem afinidade por água. F V V V O chá apresenta as menores partículas (D = chá, 1,5 x 10 –3 nm) e o suco as maiores (A = suco, 1,5 . 10–4nm). Por fim, as partículas presentes na gelatina se adequam ao diâmetro das mesmas contidas no recipiente B (1,5 . 10–5nm) e o refresco às partículas contidas em C (1,5 . 10o A ). Resposta correta: B Resposta correta: D COMENTÁRIOS – ATIVIDADES PROPOSTAS I. II. III. IV. 1 9. Coloide Coloide Não é coloide Não é coloide Coloide A gema de ovo atua como emulsificador entre o azeite e o vinagre. Resposta correta: D (F) Nos surfactantes aniônicos, o grupo polar em solução aquosa ou em dispersões são carregados negativamente. (V) (V) (F) Nos surfactantes catiônicos, o grupo polar em solução aquosa ou em dispersão são carregados positivamente. I. II. III. IV. V. (hidrofílica) Resposta correta: A A porção hidrofílica (polar) é representada pela parte B da molécula, a porção hidrofóbica (apolar) é representada pela parte A da molécula. Resposta correta: A 4. Na+ Resposta correta: D Resposta correta: C 3. + (hidrofóbica) Resposta correta: V F V F F 2. O problema descreve situação típica de moléculas de sabão. Veja: (1) (2) (3) (4) (5) (6) (7) F – gás – sólido V F – líquido – sólido F – gasoso – gasoso V V F – líquido – líquido 10. Nessa situação, o disperso é gasoso e o dispergente sólido. Portanto, temos um aerosol. Resposta correta: C 11. O leite pasteurizado representa uma dispersão coloidal (atente para o diâmetro das partículas no disperso). Resposta correta: C 12. Perceba que o ar se "espalha" pelo creme de leite, portanto, este é o dispergente e aquele o disperso. Resposta correta: C 13. A tensão superficial é enfraquecida devido à presença do detergente, possibilitando a formação de uma dispersão coloidal. Resposta correta: D Resposta correta: B 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 1 14. Atentando para as propriedades estudadas na teoria, têm-se: A → solução B → dispersão coloidal C → dispersão grosseira Ou seja, as 150g de solução apresentam m = 0,5 . 100g = 50g de KNO3 e 100g de H2O. Após a perturbação 10g de KNO3 precipitam, restando 40g de KNO3 em 100g de H2O a T = 30°C. Dos gráficos, o representado na alternativa b traduz essa situação. Resposta correta: E Resposta correta: B 15. Dispersões coloidais do tipo sólido-líquido apresentam efeito Tyndall. 5. Resposta correta: B 16. Perceba que o disperso e o dispergente são separados de forma relativamente fácil, portanto, o material pode ser uma suspensão. As interações soluto-solvente nas moléculas do SO2 são mais intensas (apresenta maior solubilidade em água) e sua equação de dissolução é: SO2(g) + H2O → H2SO3(aq) Resposta correta: D COMENTÁRIOS – ATIVIDADES PROPOSTAS Resposta correta: C 17. Em se tratando da ação de filtros comuns, apenas as partículas do disperso em suspensões é retido. 1. a) O sistema I está em equilíbrio, veja: Vdissolução = Vprecipitação Resposta correta: B + Na(aq) + CA −(aq) NaCΡ(s) = aula 2 b) I. COMENTÁRIOS – ATIVIDADES PARA Continuará uma solução saturada com precipitado. II. Poderá haver a formação de um precipitado. III. Permanecerá insaturada. SALA 1. a) A formação de precipitado deve-se ao fato da diminuição da temperatura. A 40°C a solubilidade é 40g de KCΡ em 100g de H2O. A 20°C a solubilidade é 34g de KCΡ em 100g de H2O. A massa do precipitado: (40 – 34)g = 6g b) Dissolução endotérmica, o soluto é dissolvido recebendo calor do solvente. 2. Inicialmente, têm-se: T = 30°C 320g solução ⎯ 200g de sacarose 160g solução ⎯ Msa, Msa = 110g Portanto, existem M = 160 – 110 = 50g de H2O. Após o resfriamento, 180g sacarose ⎯ 100g H2O MSacarose ⎯ 50g H2O, Msacarose = 90g Por fim, Mcris = 110 - 90 = 20g 2. Resposta correta: A 3. Pontos situados sobre o gráfico representam soluções saturadas em KBr. Na região II, temos soluções instauradas e, por fim, na região III pode existir uma solução supersaturada, portanto, mono ou bifásica (dependendo do grau de agitação da solução). A ordem de polaridade das substâncias reflete o grau de G G G solubilidade em água. Sendo μI > μII > μIII temos: solubilidadeI > solubilidadeII > solubilidadeIII. Resposta correta: A 4. (F) À temperatura ambiente a solubilidade do NaNO3 é 90g/100g de H2O, enquanto que a do NaCΡ é 38g/100g de H2O. (F) Devido a maior solubilidade uma solução saturada de NaNO3 apresentará maior concentração de íons Na+ em relação a uma solução saturada de NaCΡ. (V) (V) (V) 5. O aumento de temperatura diminui a solubilidade dos gases (Lei de Henry) em especial do oxigênio contido na água do mar ou rio. Resposta correta: A 3. O maior rendimento para a purificação por recristalização é obtido com um solvente que dissolva mais soluto em um menor intervalo de temperatura. Resposta correta: B Resposta correta: C 6. 4. O enunciado nos diz que molalidade W = 5mol/L. Assim, 1000g H2O ⎧5 mol KNO3 ⎨ n 1000gH 2O, ⎩ a solução apresenta NNaI = n = 0,5mol KNO3 2 A substância presente em maior quantidade de matéria (número de mols) é o NaI. Veja: + – NaI → Na + I 170 ≅ 1,13mol 150 Resposta correta: C 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 7. 8. A massa da água necessária para os 14g de NaCΡ atingirem a máxima solubilidade é representada por: 35g NaCΡ ⎯ 100g H2O 14g ⎯ m m = 40g Como inicialmente tínhamos 200g de água, devem evaporar um volume referente a: ( 200 − 40 ) Δm ⇒V= = 160mL d= V 1 12. Uma substância pura apresenta apenas uma curva de solubilidade. Resposta correta: D 13. A massa de 17,5g do sal apresenta uma percentagem de: %Msal = Resposta correta: E poderia ser o Na2SO4. Em T = 50°C, temos: Resposta correta: C Msaca. + MH2O = 500g 260g sacarose ⎯ 100g H2O Msaca ⎯ MH2O T ≤ 40°C o Pb(NO3)2 é mais solúvel que o KNO3 (vide gráfico). Resposta correta: A 26(500 – Msaca ) = 10 Msaca ⇒ Msaca ≅ 361g e MH2O ≅ 139g Portanto, em T = 30°C 220g saca ⎯ 100g H2O M'saca ⎯ 139g ≅ 35% . A partir do gráfico, o sal 14. A alternativa incorreta encontra-se em a, pois para 26 . MH2O = 10 . Msaca 15. A partir de um procedimento análogo, temos apenas dois sistemas heterogêneos (ambos em T = 70°C). Veja: 60g sal ⎯ 100g H2O m M'saca ≅ 305,5g Por fim, Δm ≅ 361 – 305,5 ≅ 55,5g ⎯ 300g H2O, Msal = 180g < 200g (precipitação) Resposta correta: D 9. 17,5 ( 32,5 + 17,5 ) 60g sal ⎯ 100g H2O Em T = 50°C temos M0 = 0,108g = 108mg de Li2CO3 em 100g de H2O. Quando a temperatura passar a T = 20°C existirão M = 0,133g = 133mg de Li2CO3 em 100g de H2O. Por fim, irá precipitar Δm = 133 – 108 = 25mg de LiCO3. m ⎯ 500g H2O, Msal = 300g < 320g (precipitação) Resposta correta: B Resposta correta: D 10. Em T = 90°C têm-se: 80g K2Cr2O7 ⎯ 100g H2O m ⎯ 50g H2O 16. O processo de dissolução do NH4CΡ deve ser endotérmico e a sua solubilidade deve aumentar com a elevação da temperatura. m = 40g K2Cr2O7 Resposta correta: B A mistura apresenta 30g de K2Cr2O7, portanto, devemos buscar a temperatura na qual precipitarão 10g das 40g de K2Cr2O7 inicialmente dissolvidas em 100g de H2O. Assim: 30g K2Cr2O7 ⎯ 50g H2O m ⎯ 100g H2O m = 60g K2Cr2O7 No gráfico essa temperatura corresponde a 70°C. 17. O primeiro sal a precipitar deve ser o de menor solubilidade em água, sendo, portanto, o sulfato de cálcio (CaSO4). Resposta correta: B 18. Para temperaturas abaixo de T = 55°C (vide gráfico) o KNO3 Resposta correta: D decanta frente ao NaCΡ. 11. O procedimento III é o mais adequado, pois de acordo com o gráfico em T = 45°C a solubilidade do NaCΡ é menor que a do KCΡ e, portanto, uma solução se mostrará saturada e a outra insaturada. Resposta correta: E Resposta correta: C 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 3 net = det . Vet ⇒ net = 0,8g/mL . 0,05 . 350mL = 2,1g Por fim, 1 lata ⎯ 2,1g et n ⎯ 3g et, aula 3 COMENTÁRIOS – ATIVIDADES 1. PARA SALA A diferença em massa entre a dose fatal e a intoxicação é Δm = 0,007g – 0,003g = 0,004g de etanol. Sendo Vsangue = 6L = 6000mL, temos: n ≅ 1 lata Resposta correta: A 4. 0,004 etanol ⎯ 1mL sangue 30mg H2 PO4− ⎯ 1Ρ esgoto ⎯ 6000mL sangue, Met Semanalmente a estação trata: V = 7 . 5 . 104m3 = 35 . 104m3 = 35 . 107Ρ O enunciado nos diz que m Met = 24g e d = Met 24g ⇒ Vet = = 30mL Vet 0,8g /mL ⎯ 35 . 107Ρ esgoto, m = 1,05 . 107g. Por fim, A partir da eficiência de remoção, 7 6 m − = 0,9 . 1,05 . 10 g = 9,45 . 10 g = 9,45t 1mL uísque ⎯ 0,4mL etanol H2PO 4 ⎯ 30mL etanol Vuísque Por fim, da estequiometria da reação H2PO4 Mg(NH4)PO4 . 6H2O Vuísque = 75mL 97g/mol ⎯ 245g/mol 9,45t ⎯ m' m' ≅ 23,9t Resposta correta: A 2. A partir da concentração de etanol limite, Resposta correta: E 0,6g et ⎯ 1L sangue Met 5. ⎯ 5L sangue Met = 3g Volume da fase aquosa: A + 50mL (completar o volume) V = 26mL + 50mL = 76mL Uma lata de cerveja apresenta: Vet = 5%Vtotal ⇒ Vet = 0,05 . 350 = 17,5mL e M g det = et ⇒ Mwt = 0,8 .17,5mL = 14g Vet mL O enunciado nos diz que 15% ( M ) de álcool ingerido M fica no sangue, assim: Metno sangue = 0,15 . 14 = 2,1g. Por fim, 1 lata Resposta correta: A COMENTÁRIOS – ATIVIDADES PROPOSTAS 1. ⎯ 2,1g etanol n latas ⎯ 3g etanolm n = 1,5 (1 lata) 2. O problema nos diz que: 0,08 etanol ⎯ 100mL sangue Para não ultrapassar o limite estabelecido, o indivíduo deve apresentar uma massa de etanol equivalente a: 0,6g et ⎯ 1L sangue net ⎯ 5L sangue, Met ⎯ 6 . 103mL sangue, Met = 4,8g net = 3g Por fim, o número mínimo de doses ingeridas é: Por outro lado, cada lata de cerveja apresenta uma massa de etanol equivalente a: 4 Veja, C1(m/V) . V1 = C2(M/V) . V2 ⇒ 0,34 . 1 = 0,01 . V2 ⇒ V2 = 34L. Portanto, deverão ser acrescentados V' = 34 – 1 = 33L de água. Resposta correta: B Resposta correta: A 3. T = (A X 2) + 1 Para T = 53% → 53 = 2A + 1 → 2A = 52 → A = 26mL 3ª SÉRIE E EXTENSIVO OLÍMPICOS 1 dose ⎯ 20mL x (0,5) . (0,12) | VOLUME 1 | QUÍMICA 4 n Indivíduos próximos ao topo da cadeia, 15mg ⎯ 106g tecido 4,8 mL 0,8 ⎯ Nota: d = ⎯ 102g tecido M n = 5 doses M' = 1,5 . 10–3mg/g Met 4,8g ⇒ Vet = Vet 0,89 /mL Resposta correta: D Resposta correta: C 9. 3. A massa de açúcar é expressa por: Maçúcar = 331,2 – 316,2 = 15g. Por fim, Caçúcar = Maçúcar V C12H22O11 n= 15g = = 50g / A 0,3A NaCΡ Resposta correta: E 4. M= (m/V)% de água em álcool = 99% 1g de H2O em 99g de CH3CH2OH como dH2O = 1g/mL A concentração pode ser expressa em g/L 10g de H2O em 1000mL (1L) de solução. 10. A alternativa correta encontra-se em d, pois representa o limite de tolerância do SO23 − . Veja, 10ppm: 10mg ⎯ 106g ou 0,001g ⎯ 1kg O enunciado nos diz que: 5kg CuSO4 ⎯ 100L H2O Resposta correta: D M CuSO4 ⎯ 5L 11. Para uma pessoa de 60kg, têm-se: M = 0,25kg = 2,5 . 102g 1,2mg cálcio ⎯ 1kg MCa ⎯ 60kg Resposta correta: C 6. O enunciado nos diz que 1,5mg F − ⎯ 1L H2O n− ⎯ 104L H2O, F MCa = 72mg/dia n F− = 15g Por fim, 0,6g cálcio ⎯ 1L leite 0,072 cálcio ⎯ V, V = 0,12L/dia A partir do sal utilizado: 188g sal m ⎯ 6 . 19g F − ⎯ 15g F − , m = 24,7g sal Resposta correta: B 7. N M 0,585 = ⇒M= = 2 x 10 −2M V MM . V 58,5 . 0,5 Resposta correta: B Resposta correta: D 5. M M 0,171 e M= = = 1. 10 −3 M MM MM . V 342 . 0,5 Resposta correta: B 12. O enunciado nos diz que: 3 1g de extrato = 10 mg 100kg de H2O = 102kg 103 mg = 10mg / kg ppm = 102 kg 0,9mg flúor ⎯ 106g = 106mL H2O MF ⎯ 2 . 103mL H2O MF = 1,8mg Resposta correta: D 8. Veja: Indivíduos próximos a base da cadeia alimentar, Resposta correta: D 13. O enunciado nos diz que: 0,01mg ⎯ 106g tecido 20 . 10-3g Cr3+ ⎯ 10–3Ρ solução M ⎯ 102g tecido ⎯ 1Ρ solução M Cr3 + M = 1 x 10-6mg/g] M Cr3 + 3ª SÉRIE E EXTENSIVO OLÍMPICOS | = 20g VOLUME 1 | QUÍMICA 4 5 aula 4 Da estequiometria, CrCΡ3 . 6H2O → Cr3+ + 3CΡ– + 6H2O 266,5 ⎯ 52g M ⎯ 20g, COMENTÁRIOS – ATIVIDADES m = 102,5g 1. Resposta correta: D 14. O enunciado nos diz que: 0,0016g CaF2 ⎯ 100g solução = 100cm3 = 0,1L NaCA MCaF2 = 1,6 . 10 g m= Da estequiometria: CaF2 → Ca2+ + 2F– ⎯ 2 x 19g –2 F − Da solução inicial: m msol dsol = sol ⇒ 1,17g/mΡ = ⇒ Vsol 250mL msol = 292,5g e NaCA = 0,1 . 292,5 = 29,25g mfinal = 29,25 + 2,34 = 31,59g e –2 1,6 . 10 g ⎯ M SALA Após o acréscimo de 2,34g de NaCΡ fica: MCaF2 ⎯ 1Ρ solução, 78g PARA n m = ⇒ V MM . V m = 31,59 = 2,16M 58,5 . 0,25 2. Resposta correta: 9,98mol/kg; x1 = 0,15 3. Para manter-se a neutralidade da solução, é necessário que: , MF ≅ 0,008 ≅ 8mg Assim, o teor de fluoreto é cerca de oito vezes maior que o VMP íons positivos = íons negativos , ou seja, 0,1 . 1 + 0,15 . 2 + 0,2 . 3 = 0,2 . 2 + x ⇒ x = 0,6mol/L Resposta correta: B Resposta correta: E 15. I. Em um dia, temos o consumo de uma massa de água dada por: m = d . v e m1 dia = d . v . nhabitantes 1g . 500 . 103cm3 . 2 . 106 = 1 . 1010g m1diaH O = 2 cm3 II. De acordo com a O.M.S, temos: ⎧⎪1g flúor _____ 106 g H2O ⎨ _____ 1010 g H2O, mF = 1 . 104 g ⎪⎩mF Para massa de NaF em 1 ano: 100g NaF ––– 36,5g flúor 4. Teor = 3,4% (m/m) 3,4g de sais ou 3,4 X 10–3 kg de sais em 100g de H2O ou 1 . 10–1kg de H2O 1,5T de H2O = 1500kg de H2O Sais H2O 3,4 X 10–3kg ⎯ 10–1kg ⎯ 15 . 10–2kg x −2 15 . 10 X 3, 4 . 10 −3 = 51 . 10 −4 kg de sais x= 10 −1 5. Veja: Xmet = 0,25 e XH2O = 1 – 0,25 = 0,75 1 mNaF ––– 1 . 10 g flúor, mNaF = 106 g e 36,5 1 mNaF1ano = 365. .106 = 1 . 107 g = 1 . 109 kg 36,5 4 Assim, nmet ⎧ = 0,25 ⎪ Xmet = n 0,75 nH2O total ⎪ ⇒ = ⎨ n 0,25 nmet H2O ⎪X = = 0,75 H O ⎪⎩ 2 ntotal Resposta correta: C 16. Do enunciado: mH2O 5mg flúor ⎯ 1kg peso 3= MF ⎯ 70kg peso MF = 350mg flúor ⇒ 3= Por fim, 0,7g MMH2O mH2O MMmet . ⇒ 3= ⇒ mmet Mmet MMH2O MMmet ⎯ 103Ρ H2O ⇒ 0,35g ⎯ V mH2O 32 mH2O . ⇒ = 1,69 ⇒ mmet 18 mMet mmet 1 mmet 0,59 = = 0,59 ⇒ = ⇒ mH2O 1,69 mH2O + mmet 1 + 0,59 ⎛m ⎞ 0,59 ⇒ τ% ⎜ met ⎟ = = 0,37 ( 37% ) m ⎝ sol ⎠ 1,59 V = 500Ρ Resposta correta: B 6 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 COMENTÁRIOS – ATIVIDADES PROPOSTAS 1. 2. 7. Veja: M = n M 0,6 = ⇒ M = = 1,7.10 −2 m V MM.V 176.0,2 ou = = 17m . mol/L Resposta correta: B 8. solução x: C = 5,3% p/V MM Na2CO3 = 106g/mol 53g de Na2CO3 em 1000mL de solução Cg/L = 53g/L Cg/L = C mol/L . MMg/mol 53 = 0,5 mol/L C mol/L = 106 solução y: A partir da concentração, m= n ⇒ nNa2CO3 = 0,5mol V Da estequiometria, Na2CO3 . 10H2O → Na2CO3 + 10 H2O 0,5mol 0,5mol 5mol Por fim, m n= ⇒ mNa2CO3 .10H2O = 0,5.286 = 143g MM 50,5 = 0,5mol/L 101 = 0,5mol/L m m ⇒ 50,5g /L = ⇒ m = 5,05g V 0,1L n n III. m = ⇒ 0,5 = ⇒ n = 0,25mol V 0,5 II. VC = Resposta correta: D 9. O enunciado nos diz que: 0,124g de H3BO3 ⎯ 1L H2O Portanto, n m = ⇒ m= V MM . V m= 0,124 = 0,2M 61. 1 Resposta correta: A (Retificação do gabarito) A partir da concentração em ppm, fica: 200g CO2 ⎯ 103kg Ar nCO2 ⎯ 102kg Ar, nCO2 = 20g Da estequiometria da reação, ⎯ 1 mol CO2 1mol K2CO3 0,45mol K2CO3 ⎯ 20/44 = 0,45mol CO2 10. Procedendo de forma análoga, a água oxigenada apresenta maior concentração em mol/L, veja: ⎛ ⎞ 102 3g ⎯ 100g solução ⎜ V = 3 = 0,1L ⎟ ⎜ ⎟ 10 ⎝ ⎠ n m 3 m= = = = 0,88M V MM.V 34 . 0,1 Resposta correta: D 11. Veja: Por fim, n 0,45 M = ⇒ V= ≅ 1,0 A V 0,5 mC12H22O11 = m NaCA = Resposta correta: C (Retificação do gabarito) 5. . MM ⇒ Mx = I. V Resposta correta: C 4. Veja: Resposta correta: D Resposta correta: B (Retificação do gabarito) 3. Para a neutralidade da solução ser mantida, temos: 0,3 . 1 + 3 . x = 0,28 . 1 + 0,1 – 2 ⇒ x = 0,06mol/L mC12H22O11 MM . V = 0,171 = 1. 10 −3 M 342 . 0,5 mNaCA 0,585 = = 2 . 10 −2M MM V 58,5 . 0,5 Veja: M SO24 − M CA − = = n m = ⇒ V MM.V n' m' = ⇒ V MM'V M SO24 − M CA − = = 2,7 = 2,8 . 10 −3 M 96 . 1 19 = 5,3 . 10 −1M 35,5 Resposta correta: B 12. A partir da ingestão de 100g de sacarose, 80g sacarose ⎯ 1g de glicose 100 sacarose ⎯ mg, Resposta correta: E mg = 1,25g 6. Veja: AΡ2(SO4)3 → 2AΡ3+ + 3SO4 = 0,3M Por fim, Por fim, n m 1,25 ⇒ m = = 6,9 . 10 −3 mol/L m= = V MM . V 180 . 1 0,6M 0,9M n 3 M= ⇒ V = 5A V 0,6 Resposta correta: B (Retificação do gabarito) Resposta correta: C 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 7 13. C = 0,49g/L de H3PO4 Cg/L = Cmol/L . MMg/mol Cg /L C mol/L = MMg / mol MM H3PO4 = 98g/mol 18. Veja: C = d . T . 103 ⇒ C = 1,1 . 0,2 . 103 ⇒ c(g/L) = 220g/L Para molaridade, = Resposta correta: D 14. Veja, ⎧ ⎪ ⎨ ⎪ ⎩ ⎧ ⎪ ⎨ ⎪ ⎩ C n m = = V MM . V 0, 49 C mol/L = = 5 . 10 −3 98 ⇒ C= ⋅ MM ⇒ 220 ≅ 6M 36,5 Resposta correta: B 4 . 10 −3 = 2 . 10 −2M Na= 0,12 −3 −2 Na= 4 . 10 . 23 = 9,2 . 10 g Na= nNa . MM ⇒ CA = 19. Veja: = 2 . 10 −3 = 1. 10 −2M 0,2 CA = nCA . MM ⇒ CA = 2 . 10 −3 n m = V MM . V C ⇒ C= ⋅ MM ⇒ ⇒ C(g/L) 0,025 . 44 = 1,1g/L . 35,5 = 3,55 . 10 −2 g Resposta correta: D ⎛m⎞ 15. Uma solução 40% ( ⎜ ⎟ de metanal apresenta 4g de ⎝m⎠ metanal em 10g de solução (d = 0,92g/mL). aula 5 Resposta correta: D 16. O enunciado nos diz que: 3,2 . 10–4g SO2 ⎯ 103L Ar mSO2 ⎯ 1 L Ar COMENTÁRIOS – ATIVIDADES 1. mSO2 = 3,2 . 10–7g SALA A solução disponível apresenta 90%(m/m) assim, M d = sol ⇒ Msol = 1,81 . 0,5 . 103Ρ = 905g e Vsol MH2SO4 = 0,9 . 905 = 814,5g. A solução resultante deve Para molaridade, n m ⇒ m = = V MM . V PARA apresentar uma molaridade equivalente a: 10 MK = n ⇒ M = = 5M. Por fim, 2 n M 814,5 ⇒V= = 1,662A = 1662mL. M= = V MM.V 98.5 3,2 . 10 −7 = 5 . 10 −9 M m = 64 . 1 Para o número de moléculas, ⎯ 6 . 1023 moléculas 64g SO2 -7 3,2 . 10 gSO2 ⎯ N Portanto, devem ser acrescentados: V' = 1662 – 500 = 1660mL H2O N = 3 . 1015 moléculas Resposta correta: B e moléculas m3 = 3 . 1015 10 −3 = 3 . 1018 2. Resposta correta: E MKOH = 0,12 . 8,8 . 104 = 1,056 . 104g, a partir da solução a 44%, temos: M ' 1,5 . 103g/L = SO ⇒ Mso ' = 1,5 . 103Xg e X 100g solução ⎯ 44g KOH ⎯ 1,056 . 104g 1,5 . 103Xg 17. Veja: n m = m= V MM . V C ⇒ C = m . MM Assim, 10 . 2,6 m= = 0,3M 342 Para a normalidade, N = m . K, em que K = 2 . 3 = 6 (sal) N = 0,3 . 6 = 1,8N X ≅ 16L Por fim, VH2O = 80 − 16 = 64L Resposta correta: B Resposta correta: B e D 8 A solução resultante nos diz que: M d = sol ⇒ Msol = 1,1 . 103 . 80 = 8,8 . 104 g e Vsol 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4 3. Sendo τmm = 2. msoluto , temos: msolução m m + m1 m1 ⎧ ⎪0,1 = m + m → 10 = m = 1 + m → m1 = 9m ⎪ 1 ⎨ ⎪0,5 = m → 2 = m + m2 = 1 + m2 → m = 1m 2 ⎪⎩ m + m2 m m Portanto, Resposta correta: E m2 m 1 = = m1 9m 9 Resposta correta: Veja: m1V1 = m2V2 ⇒ 1,2 . 0,4 = 16 . V2 ⇒ V2 = 0,03L Por fim, Vacres. = 1,2 – 0,03 = 1,17Ρ 3. 1 9 Veja: m1V1 = m2V2 ⇒ 1 . 200 = 2 . 10–2 . V1 ⇒ V1 = 1 . 104mL = 10Ρ Por fim, Vevap. = 10 . 0,2 = 9,8Ρ Resposta correta: B 4. MM = 74,5g/mol–1 a) V = 10L –1 M = 0,05mol/L m=? 4. m n MM M= M= V V m = M . MM . V m = 0,05 . 74,5 . 10 = 37,25g Resposta correta: C 5. b) V = ? V0 = 500mL ou 0,5L –1 M0 = 0,05 mol/L –1 –3 M = 5 . 10 mol/L M0 . V0 = M . V M .V 5 . 10 −2 . 5 . 10 −1 V= 0 0 V= = 5L M 5 . 10 −3 –1 –1 5. MM= 74,5g mol A solução resultante apresenta molaridade equivalente a –1 C(g/L) m1 = n1 m1 C = ⇒ m1 = 1 V1 MM . C MM1 Veja: Solução 1 M V0 ⇒ Solução 2 M/5 V' Da diluição, M MV0 = V ' ⇒ V ' = 5V0 . 5 Por fim, deverão ser acrescentados: Vacres. = 5V0 – V0 = 4V0 de água destilada. n a) M = ⇒ V m m m= ⇒ 0,1 = ⇒ m = 2g MM.V 40.0,5 7. Veja: m1V1 = m2V2 ⇒ 0,5 . 2 = m2 . 1 ⇒ m2 = 1M. Da estequiometria, MgCΡ2 → Mg2+ + 2CΡ– 1M 1M 2M Resposta correta D 8. 2 . 100 = 0,4% 500 3ª SÉRIE E EXTENSIVO OLÍMPICOS 12,6 = 0,3M. 42 Resposta correta: A b) Veja: m1V1 = m2V2 ⇒ 0,1 . 25 = 200 . m2 ⇒ m2 = 1,25 . 10–2M c) Veja: n 1g dsol = sol ⇒ nsol = . 500cm3 = 500g Vsol cm3 % massa = m1 = Por fim, m1V1 = m2V2 ⇒ 0,9 . 200 = 0,3 . V2 ⇒ V2 = 600mL e Vacres. = 600 – 200 = 400mL de água. COMENTÁRIOS – ATIVIDADES PROPOSTAS 1. MM= 23g/mol–1 V0 = 1L C0 = 3,68g/L Diluição: V = 3L 1L + 3L = 4L 3,68 C mol/L = = 0,16mol / L 23 Considerando a diluição: 0,16mol / L = 0,04mol / L ou 40milimol / L 4 Resposta correta: D 6. –1 c) CgL = Mmol/L . MMg mol –1 –1 CgL = 0,1 x 74,5 = 7,45gL Veja: V1 τ1 = V2τ2 ⇒ 150 . 7% = V2 . 3% ⇒ V2 = 350mL e Vacres. = 350 – 150 = 200mL Veja: 20g 30 (diluição) ⇒ = 100 100 + m 2000 + 20m = 3000 ⇒ 20m = 1000 ⇒ m = 50g de H2O msoluto Nota: τ% = msolução Resposta correta: C (Retificação do gabarito) | VOLUME 1 | QUÍMICA 4 9 9. Veja: V1τ% = V2τ2% (diluição) ⇒ 1 . 80 = V2 . 50 ⇒ V2 = 1,6L = 1600mL e Vacres. = 1600 – 1000 = 600mL Resposta correta: C 10. Veja: m1V1 = m2V2 (diluição) ⇒ 50 . 0,1 = (150 + 50) . m2 ⇒ m2 = 0,025M Resposta correta: C 11. A solução resultante deve apresentar 0,75Ρ de soda. (7,5%). Para isso serão necessários, a partir da solução a 25%: 100Ρ solu. ⎯ 25Ρ soda VA ⎯ 0,75Ρ soda VA = 3A Por fim, deverão ser acrescentados: V = 10 – 3 = 7Ρ de H2O Resposta correta: B (Retificação do gabarito) 12. Veja: M1V1 = M2V2 (diluição) ⇒ 3 . 500 = 15 . V2 ⇒ V2 = 100mL Resposta correta: B 13. Veja: 0,8 . mH2SO4 msolução g → 2,21 3 = → d= V cm 103 cm3 mH2SO4 = 2,7 . 102 g Portanto, m0 = mH2SO4 V = 2,7.102 = 2,76M 98.1 e m0 . V0 = mF VF → 2,76 . 1 = mF . 5 → mF = 0,55M 14. V0 = 300mL C0 = 4ºGL V=? C = 0,5°GL C0 . V0 = C . V → 4.300 = 0,5 . V → V = 1200 = 2, 4mL 0,5 Resposta correta: E (Retificação do gabarito) 15. a) mNaCA = 0,9.msolução (no soro fisiológico) Portanto, msolução m NM NNaCA d= → 1g cm3 = NaCA = V 0,9. V 0,9 V M m 0,9 0,9 = = 1,5 × 10 −2 M MM → m = 0,9 MM 58,5 b) Veja: 1= ⎧⎪0,1 L ⎨ ⎪⎩ V _____ 0,9g NaCA _____ 27gNaCA V = 3L 10 -30/12/08 Rev.: Layana 3ª SÉRIE E EXTENSIVO OLÍMPICOS | VOLUME 1 | QUÍMICA 4
Download