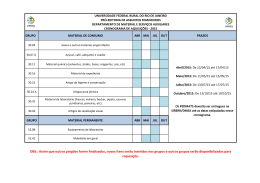
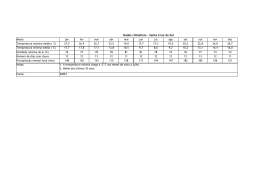
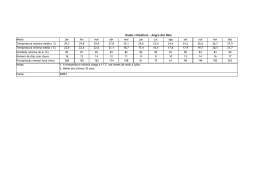
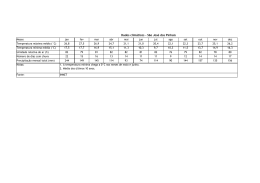
Faculdade de Medicina de Lisboa Ética e Deontologia Médica Prof. Doutor Miguel Oliveira da Silva Catarina Freitas; Milton Camacho; Priscila Araújo 18.Mai.10 II Guerra Mundial 1939-1945 Início da análise ética em experimentação Humana Desrespeito pela dignidade e integridade humana em prisioneiros de guerra. Código de Nuremberg 1947 Consentimento informado é absolutamente obrigatório; Pesquisadores qualificados utilizam protocolos de pesquisa apropriados; Relação risco/benefício favorável; Participante deve ter a liberdade para desistir do estudo em qualquer momento 18.Mai.10 II Guerra Mundial 1939-1945 Declaração de Helsínquia 1964 Código de Nuremberg 1947 O “bem-estar” do ser humano deve ter prioridade sobre os interesses da ciência e da sociedade; O consentimento deve ser dado por escrito; Utilização limitadade de placebo; Maior acesso aos benefícios. 18.Mai.10 II Guerra Mundial 1939-1945 Código de Nuremberg 1947 Declaração de Helsínquia 1964 Henry Beecher 1966 Estudos biomédicos com violação dos direitos dos sujeitos de investigação ausência de consentimento ou aprovação. 18.Mai.10 II Guerra Mundial 1939-1945 Código de Nuremberg 1947 Declaração de Helsínquia 1964 Henry Beecher 1966 Estudo da hepatite: Estudo da imunidade do cancro: Escola Estatual de Willowbrook – crianças com défice mental injecção de células hepáticas Injecçãocancerosas intencionalem VH para testar o uso de 22 sujeitos, não ausência gama-globulinas do seu conhecimento na prevenção e da infecção. aprovação. Utilizados na pesquisa de um tratamento eficaz, dado a maioria ter aquirido a doença. Pais foram “aliciados” a dar o consentimento. 18.Mai.10 Declaração de Helsínquia 1964 Código de Nuremberg 1947 Estudo de Tuskegee 1932 -1973 Estudo da história natural da sífilis, sem consentimento pelos sujeitos de investigação, mantendo-se mesmo após a descoberta da penicilina. 18.Mai.10 Declaração de Helsínquia 1964 Código de Nuremberg 1947 Relatório de Belmont 1979 Princípios éticos e directrizes para a protecção da pessoa humana nas pesquisas: Respeito pela pessoa Beneficiência Justiça 18.Mai.10 Declaração de Helsínquia 1964 Código de Nuremberg 1947 1993 Relatório de Belmont 1979 Directrizes éticas internacionais para pesquisa biomédica envolvendo sujeitos Humanos criadas pela CIOMS 18.Mai.10 • Não-maleficiência • Uma acção é julgada como certa ou errada na dependência exclusiva das suas consequênciais • Beneficiência • Autonomia • Justiça Principalismo Filosofias Utilitarismo Kantianas •Obrigação primária dos médicos é individual e não colectiva 18.Mai.10 Fase Préclínica •Estudos “in vitro” •Modelos animais • Seres Humanos Fase clínica • Fase I – voluntários saudáveis • Fase II – n.º limitado de doentes • Fase III – grande n.º de doentes • Fase IV – pós-comercialização 18.Mai.10 Vantagens Baixos custos Recurso facilitado a doentes “naive” Estruturas de controlo mais flexíveis Indivíduos mais vulneráveis à oferta de cuidados de saúde Difícil avaliação pelo país promotor do desenrolar da experimentação Mudança de perfil de doenças Argumentos Assistência médica dos participantes Treino das autoridades locais na pesquisa clínica Desenvolvimento de tratamentos acessíveis aos PED 18.Mai.10 Populações alvo PED Declaração de Helsíquia: o pesquisa deve suprir as necessidades da população onde foi realizado o estudo e beneficiá-la com os resultados Mais vulneráveis Facilmente pressionadas, na expectativa de acesso a assistência médica Exposição ao risco e poucos benefícios de resultados 18.Mai.10 Exploração Injustiça Violação do Princípio da Justiça Desrespeito pelo Direitos Humanos Prejuízo Diferenças na acessibilidade aos Resultados PD vs. PED 18.Mai.10 FALHAS APONTADAS: Ofertas coercívas Voluntário Omissão de dados relativos aos protocolos experimentais /Falhas na comunicação BARREIRAS CULTURAIS! Princípio Básico Dignidade individual e colectiva Isento de pressão e obrigação Violação da Autonomia 18.Mai.10 HIV - Caso Paradigmático 18.Mai.10 Cerca de 40 milhões de pessoas infectadas com HIV no mundo, sendo 90% dos PED. PED sem recursos económicos, sociais e biomédicos para lidar com esta problemática. Introduzidos em investigações de VIH/SIDA a fim de desenvolver terapêutica e prevenção Problemas Éticos 18.Mai.10 Pesquisas com redução de requisitos éticos Disponibilidade urgente de tratamentos ou métodos JUSTIFICA preventivos que mostraram eficácia. URGENTE pesquisar tratamentos e vacinas Facilitação de pesquisas não éticas Será que a URGÊNCIA justifica a realização de ensaios menos éticos? 18.Mai.10 Protocolo 076 1994 Estudo nos EUA com “dose longa” de Zidovudina para verificar se havia redução da transmissão materno-fetal do HIV. Houve redução da transmissão do HIV de 25,5% para 8%. (diminuiu a transmissão em 66%) MAS... Os custos da “dose longa” de AZT seriam insuportáveis para os PED. O QUE FAZER? Desenvolver um método mais barato A “dose curta” diminuía a transmissão em 40 a 50 % dos casos Estudos com “dose curta” de AZT na África Subsaariana e Tailândia Grupo controlo - placebo Grupo estudo - dose curta de Zidovudina. Violação do Princípio da Beneficiência MAS... Será que o grupo controlo deveria ter recebido tratamento médico? Em qualquer estudo (...) incluindo o grupo controlo (...) deve ser assegurado o melhor método comprovado de diagnóstico e terapêutica. Não importando se o método não está disponível no país onde se realiza o estudo. (declaração de Helsinquia 1996) 18.Mai.10 Justificação para o uso de placebo Não submeteram a população a mais riscos do que aqueles a que já estavam expostos Ensaios mais rigorosos, mais rápidos e com amostras menores “Dose longa” de AZT necessita de monitorização médica frequente Má tolerância da “dose longa” de AZT pelas grávidas dos PED Aprovação pelos Comités Éticos locais “Double standard” 18.Mai.10 Duas Perspectivas Divergentes Direitos Humanos Universais VS Relativismo cultural Defende Defende Utilização de placebos nos PED deveria submeter-se ás mesmas regras que nos PD. Desigualdades entre os países justificam as diferenças na condução dos estudos entre os mesmos. 18.Mai.10 Proposta de revisão à declaração de Helsínquia (1997) “(...) deve ser assegurado de que não lhes foi negado o acesso ao melhor método diagnóstico, profilático ou terapêutico que em qualquer outra situação estaria disponível para ele ou ela”. “Quando a medida do efeito não for morte ou incapacidade, placebo ou outros controlos sem tratamento poderão ser justificados baseados em sua evidência”. Os sujeitos não estariam mais assegurados de receber a melhor terapêutica comprovada. 18.Mai.10 REJEITADA E em 2000 nova revisão à D. Helsínquia reforçou ainda mais a ideia anterior 18.Mai.10 D. Helsínquia exige: • Aconselhamento educacional • Se infecção por VIH, investigadores têm de tratar com anti-retrovirais Dificulta a realização do estudo: • Eficácia do estudo diminui se cumprirem medidas de prevenção • Gastos elevados •Menor aprendizagem sobre as propriedades da vacina. 18.Mai.10 1º objectivo do estudo: Determinar de que modo as DSTs como a Sífilis aumentavam o risco de infecção pelo HIV-1 Um grupo tratado com AB para diminuir DSTs Conclusão do estudo: AB reduziu a prevalência de outras DSTs mas não a incidência de HIV-1 Grupo controlo sem AB 1º Erro ético: ausência de tratamento eficaz comprovado da Sífilis para o grupo controlo. 18.Mai.10 Nova experiência com 415 casais serodiscordantes no início do estudo 2º Erro ético: Sujeitos VIH+ foram observados mas não tratados influencia a transmissão do VIH-1 3º Erro ético: Não asseguraram que o parceiro VIH+ informasse o parceiro VIH- do risco de contaminação Conclusão _ Relação carga 4º Erro ético: Informação dos riscos de transmissão do vírus insuficiente Objectivo: verificar se a carga viral viral/transmissão de VIH-1 significativa Esta informação deveria estar contida no consentimento informado 18.Mai.10 Será possível a fiscalização ética a 100% de todos os ensaios clínicos? Não serão os objectivos dos investigadores urgentes o suficiente para ultrapassar a revisão ética dos protocolos? A ética não é algo mensurável e daí sempre questionável 18.Mai.10 Deve haver esforços para que a ciência seja eticamente responsável, e que a tecnologia esteja ao serviço da humanidade. 18.Mai.10 Smith Iltis, A. Research Ethics. Routledge, 2006. Brody, B. The Ethics of Biomedical Research, An International Perspective. Oxford 1998. Garrafa, V.; Pessini, L. Bioética: Poder e Injustiça. Edições Loyola, 2003. Steinbock, B. The Oxford Handbook of Bioethics. Oxford, 2007. Archer, L.; Biscaia, J.; Osswald, W. Bioética. Editorial Verbo. Beecher, H. Ethics and Clinical Research. NEJM. 1966; 24. Lurie, P.; Wolfe, S. Unethical Trials of Interventions to Reduce Perinatal Transmission of the Human Immunodeficiency Virus in Developing Countries. NEJM. 1997; 12. 337:853-856. Angell, M. The Ethics of Clinical Research in the Third World. NEJM. 1997;12. 337:847849. Angell, M. Investigators’ Responsabilities for Human Subjects in Developing Countries. NEJM. 2000; 13. 342:967-969. Rothman, D. The Shame of medical Research. The New York Review of Books. 2000, 30 de Novembro. 18.Mai.10 Lo, B.; Bayer, R. Establishing ethical trials for treatment and prevention of AIDS in developing countries. BMJ. 2003; 327; 337-339. Mills, E.; Singh, S. Designing research in vulnerable populations: lessons from HIV prevention trials that stopped early. BMJ. 2005; 331; 1403-1406. Diniz, D.; Corrêa, M. Declaração de Helsinki: Relativismo e Vulnerabilidade. Cad. Saúde Pública. 2001. Vol 17; nº3. Ethical aspects of clinical research in developing countries. Opinion of the European Group on Ethics in Science and New Technologies to the European Commission. 4 de Fevereiro de 2003. 18.Mai.10
Baixar