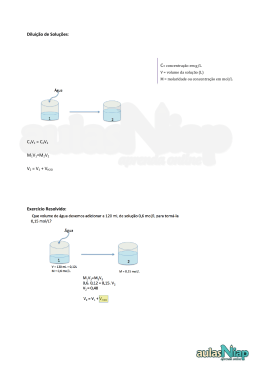
QUÍMICA - 2o ANO MÓDULO 04 SOLUCÕES: DILUIÇÃO Como pode cair no enem (UERJ) Diluição é uma operação muito empregada no nosso dia a dia, quando, por exemplo, preparamos um refresco a partir de um suco concentrado. Considere 100 ml de determinado suco em que a concentração do soluto seja de 0,4 mol x L-1. O volume de água, em ml, que deverá ser acrescentado para que a concentração do soluto caia para 0,04 mol x L-1 , será de: a) 1.000 c) 500 b) 900d) 400 Fixação ,1) (UERJ) Uma supensão de células animais em um meio isotônica adequado apresenta volume . igual a 1 L e concentração total de íons sódio a 3,68 g/L. A esse sistema foram acrescentados 3 L de água destilada. Após o processo de diluição, a concentração total de íons sódio, em milimol/L, é de: a) 13,0 c) 23,0 b) 16,0 d) 40,0 Fixação F 2) (CESGRANRIO) Para preparar 1,2 litros de solução 0,4M de HCl, a partir do ácido concen-3 trado (16M), o volume de água, em litros, a ser utilizado será de: u a) 0,03 a b) 0,47 b c) 0,74 c d) 1,03 d e) 1,17 e Fixação -3) Submetendo-se 3 litros de uma solução molar de cloreto de cálcio à evaporação até restar um volume de 400 ml, a concentração em mol/L da nova solução será: a) 3,00 b) 4,25 c) 5,70 d) 7,00 e) 7,50 Fixação F 4) (UNESP) Na preparação de 500 ml de uma solução aquosa de H2SO4 de concentração 35 mol/L, a partir de uma solução de concentração 15 mol/L do ácido, deve-se diluir o seguintec volume da solução concentrada: a) 10 ml d) 300 ml o b) 100 ml e) 450 ml a c) 150 ml b c d e Fixação 35) (UFRS) Uma solução aquosa de ácido sulfúrico (H SO ), para ser utilizada em baterias de 2 4 echumbo de veículos automotivos, deve apresentar concentração igual a 4 mol/L. O volume total de uma solução adequada para se utilizar nestas baterias, que pode ser obtido a partir de 500 ml de solução de H2SO4 de concentração 18 mol/L, é igual a: a) 0,50 L b) 2,00 L c) 2,25 L d) 4,50 L e) 9,00 L Fixação F 6) (UFF) A solução de um certo sal tem a concentração de 30% em peso. A massa de água7 necessária para diluí-la a 20% em peso é: s c a) 25 g d) 100 g c b) 75 g e) 150 g m c) 50 g a b c Fixação 7) (FAAP) Uma das maneiras de recuperar um soluto não volátil de uma solução aquosa, consiste no aquecimento da solução com o objetivo de evaporar mais rapidamente a água nela contida. Numa indústria um recipiente contém 500 litros de uma solução aquosa de NaCℓ de concentração 25,0 g/L. O volume dessa solução, expresso em litros, que deve sofrer aquecimento para propiciar a obtenção de 500 g de NaCℓ(s), é: a) 50,0 d) 200 b) 25,0 e) 500 c) 20,0 Fixação 8) (FUVEST) Se adicionarmos 80 ml de água a 20 ml de uma solução 0,1 molar de hidróxido de potássio, obteremos uma solução de concentração molar igual a: a) 0,010 d) 0,040 b) 0,020 e) 0,050 c) 0,025 Proposto 1) Calcule a concentração molar de uma solução obtida a partir de 1 L de solução de KNO3 0,3 mol/L, à qual são acrescentados 500 ml de água pura. Proposto 2) (UNICAMP) Um dos grandes problemas das navegações do século XVI referia-se à limitação de água potável que era possível transportar numa embarcação. Imagine uma situação de emergência em que restaram apenas 300 litros (L) de água potável (considere-a completamente isenta de eletrólitos). A água do mar não é apropriada para o consumo devido à grande concentração de NaCl (25g/L), porém o soro fisiológico (10g NaCl/L) é. Se os navegantes tivessem conhecimento da composição do soro fisiológico, poderiam usar água potável para diluir água do mar de modo a obter o soro e assim teriam um volume maior de líquido para beber. a) Que volume total de soro seria obtido com a diluição se todos os 300 litros de água potável fossem usados para este fim? b) Considerando-se a presença de 50 pessoas na embarcação e admitindo-se uma distribuição equitativa do soro, quantos gramas de NaCl teriam sido ingeridos por cada pessoa? c) Uma maneira que os navegadores usavam para obter água potável adicional era recolher água de chuva. Considerando-se que a água da chuva é originária, em grande parte, da água do mar, como se explica que ela possa ser usada como água potável? Proposto -3) (UFRRJ) Tem-se 50 ml de solução 0,1 M de nitrato de prata (AgNO3). Ao se adicionar 150 oml de água destilada à solução, esta passará a ter a concentração de: -a) 0,5 M b) 0,2 M mc) 0,025 M ed) 0,01 M e) 0,033 M l o Proposto 4) 300 ml de solução que contém 0,01 mol/L de sulfato cúprico são cuidadosamente aquecidos até que o volume da solução fique reduzido a 200 ml. A solução final tem concentração, em mol/L, igual a: a) 0,005 d) 0,016 b) 0,010 e) 0,018 c) 0,015 Proposto 5) (UFJF) Ácido muriático é o nome comercial do ácido clorídrico. Ele pode ser utilizado para limpeza de calçamentos em geral. A pessoa encarregada da limpeza recebeu 1,0 L de uma solução deste ácido, na concentração de 2,0 mol/L, e a orientação para diluí-la na proporção 1:100. Qual será a concentração da solução preparada para limpeza em g/L? a) 0,02 b) 2,0 c) 3,65 d) 0,365 e) 0,73 Proposto 6) (UNIFOR) Considere uma solução aquosa contendo 40 mg de AgNO3 por cm3 de solução. Por diluição, com água, pretende-se obter uma nova solução aquosa, agora contendo 16 mg de AgNO3 por cm3 de solução. Para isso, cada cm3 da solução original deve ser diluída a um volume de: a) 1,5 cm3 d) 3,0 cm3 3 b) 2,0 cm e) 5,0 cm3 c) 2,5 cm3 Proposto 7) (FUVEST-SP) Se adicionarmos 80 ml de água a 20 ml de uma solução 0,1 molar de hidróxido de potássio, obteremos uma solução de concentração molar igual a: a) 0,010 d) 0,040 b) 0,020 e) 0,050 c) 0,025 Proposto 8) (UNIOESTE) Que volume de HCl concentrado (16 mol/L) é necessário para preparar 2,0L de HCl 0,20mol/L? Proposto L9) (UFRJ) Para manter bem tratada a água de uma piscina, é necessário adicionar cloro, manter o pH neutro e filtrar a água diariamente. Um processo de cloração utilizado consiste na diluição de uma solução concentrada de hipoclorito de sódio. O íon hipoclorito é um oxidante de compostos orgânicos e possui ação bactericida. Suponha que, inicialmente, a piscina contenha 36.000 litros de água pura e que seja alimentada com uma solução de concentração 0,149g/l de NaOCl, até completar o volume total da piscina de 40.000 litros. Determine a concentração final de íons hipoclorito (em mol/l) na piscina supondo que não exista decomposição deste íon. Proposto 10) (UnB) A partir de uma solução de hidróxido de sódio na concentração de 25 g/L, deseja-se obter 125 mL dessa solução na concentração de 10 g/L. Calcule, em mililitros, o volume da solução inicial necessário para esse processo. Despreze a parte fracionária de seu resultado, caso exista. Proposto 11) (UNIFESP) No mês de maio de 2007, o governo federal lançou a Política Nacional sobre Álcool. A ação mais polêmica consiste na limitação da publicidade de bebidas alcoólicas nos meios de comunicação. Pelo texto do decreto, serão consideradas alcoólicas as bebidas com teor de álcool a partir de 0,5°GL. A concentração de etanol nas bebidas é expressa pela escala centesimal Gay Lussac (°GL), que indica a percentagem em volume de etanol presente em uma solução. Pela nova Política, a bebida alcoólica mais consumida no país, a cerveja, sofreria restrições na sua publicidade. Para que não sofra as limitações da legislação, o preparo de uma nova bebida, a partir da diluição de uma dose de 300 mL de uma cerveja que apresenta teor alcoólico 4°GL, deverá apresentar um volume final, em L, acima de a) 1,0 b) 1,4 c) 1,8 d) 2,0 e) 2,4 Proposto 12) (UFRJ) A eletrólise de soluções concentradas de cloreto de sódio (salmoura) produz cloro gasoso no eletrodo E1, gás hidrogênio e hidróxido de sódio em solução no eletrodo E2, restando uma solução diluída de NaCl cuja concentração é de 50 g/L, que é removida da célula eletrolítica. O esquema a seguir representa uma célula eletrolítica de membrana. C NaC E1 E2 NaC Calcule o volume de água, em litros, que deve ser removido de 1000 L da solução de NaCl a 50 g/L para que ela atinja a concentração de 250 g/L e possa ser reaproveitada no processo. Para efeito de cálculo, despreze a variação de densidade das soluções salinas. Proposto 13) (UNITAU) Deseja-se diluir um litro da solução de H2SO4, a 80% e de densidade 2,21g/cm3 -até o volume de cinco litros. As concentrações molares do H2SO4, antes e depois da diluição, são, respectivamente, em mols/litro: a) 10,1 e 5,2 b) 12,0 e 4,0 c) 4,0 e 11,3 d) 18,0 e 3,6 e) 22,5 e 10,5 l . Proposto 14) (UFSC) Qual a massa de Na2SO4, em gramas, necessária para preparar 100 mL de uma solução 3,50 molar? Qual o volume de água, em mL, necessário para diluir 10 mL desta solução, transformando-a em 1,75 molar? Dados: Massas molares (g/mol): Na = 23,0; S = 32,0; O = 16,0 Some as respostas por você encontradas e arredonde o resultado para o inteiro mais próximo.
Download