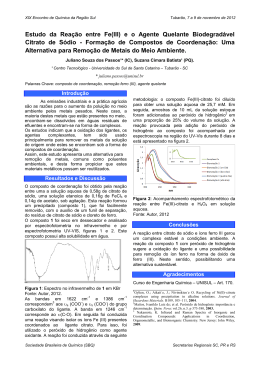
MARLENE DE SOUSA AMORIM AFERIÇÃO DO pH DE DIFERENTES SOLUÇÕES PARA CLAREAMENTO INTRACORONÁRIO Londrina 2014 MARLENE DE SOUSA AMORIM AFERIÇÃO DO pH DE DIFERENTES SOLUÇÕES PARA CLAREAMENTO INTRACORONÁRIO Trabalho de Conclusão de Curso apresentado ao Curso de Odontologia da Universidade Estadual de Londrina, como requisito parcial à obtenção de diploma de graduação. Orientador: Prof. Dr. Márcio Grama Hoeppner Londrina 2014 MARLENE DE SOUSA AMORIM AFERIÇÃO DO pH DE DIFERENTES SOLUÇÕES PARA CLAREAMENTO INTRACORONÁRIO Trabalho de Conclusão de Curso apresentado ao Curso de Odontologia da Universidade Estadual de Londrina, como requisito parcial à obtenção de diploma de graduação. BANCA EXAMINADORA ____________________________________ Profº. Dr. Márcio Gramma Hoeppner Universidade Estadual de Londrina ____________________________________ Profª. Dra. Adriana de Oliveira Silva Universidade Estadual de Londrina Londrina, 14 de novembro de 2014. “Viva como se fosses morrer amanhã. Aprenda como se fosses viver para sempre.” (Mahatma Gandhi) AGRADECIMENTOS Primeiramente agradeço à Deus por ter me dado saúde e força para superar todas as dificuldades que encontrei em meu caminho. À Universidade Estadual de Londrina, seu corpo docente e seus servidores que oportunizaram meu conhecimento, me ajudaram no crescimento pessoal e profissional e proporcionaram momentos amigáveis. Ao professor Dr. Márcio Grama Hoeppner, pela orientação, apoio e confiança. À professora Dra. Adriana de Oliveira Silva, pelo suporte no período de graduação e aceite na banca examinadora deste trabalho. A todos os professores que ajudaram em minha formação profissional e aos colegas Daniel Poletto e Fabio Martins Salomão pela contribuição na pesquisa para a realização deste. Agradeço aos meus pais, pelo esforço, amor e incentivo em minha carreira. À minha mãe que tantas vezes me fez companhia em noites de estudo e rezou por mim nas horas difíceis. Agradeço ao meu noivo, Anderson, por todas as vezes que me ajudou e incentivou nos momentos de desânimo e aos meus irmãos e sobrinhos, que tanto se orgulham de mim. E a todas as pessoas que direta ou indiretamente participaram da minha formação, o meu muito obrigada. AMORIM, Marlene de Sousa. Aferição do pH de diferentes soluções para clareamento intracoronário. 2014. 20 fls. Trabalho de Conclusão de Curso apresentado ao Curso de Odontologia da Universidade Estadual de Londrina, como requisito parcial à obtenção de diploma de graduação, Londrina, 2014. RESUMO O intuito desse estudo, foi avaliar as diferenças entre os pHs de diversos produtos clareadores, indicados no clareamento intracoronário, em elementos dentários tratados endodonticamente. Os produtos foram armazenados em frascos de filme fotográfico de cor escura para evitar quaisquer feixe de luz e observados em variados intervalos de tempo, iniciando em T0 (tempo inicial após a manipulação) até T3 (após 168 horas). Foram disjuntadas cinco amostras: G1 com água destilada; G2 com peróxido de hidrogênio a 30%; G3 com perborato de sódio e água destilada; G4 com perborato de sódio e peróxido de hidrogênio a 30%; G5 com percarbonato de sódio e água destilada e, G6, com percarbonato de sódio e peróxido de hidrogênio a 30%. O pH dessas substâncias foram estabelecidos por um pHmetro digital da marca Gehaka Modelo PG 1800. Para verificar o efeito do tempo em cada grupo foi aplicado o teste de Friedman e, os resultados, foram subjugados à análise estatística e a um teste de Kruskal-Wallis, seguido do teste de Mann Whitney e co-relacionados entre os grupos. Pode-se então comprovar que para o fator pH houve diferenças entre as substâncias avaliadas no período de análise, independentemente do grupo constatado. Palavras-chave: Clareamento Dental, Clareadores Dentários, pH. AMORIM, Marlene de Sousa. Measuring the pH of different solutions for whitening intracoronary. 2014. 20 fls. Completion of course work submitted to the School of Dentistry, State University of Londrina, as a partial requirement for obtaining a undergraduate degree. Londrina. 2014. ABSTRACT The purpose of this study was to assess the differences between the different pHs of bleaching products indicated in intravascular clearance in endodontically treated teeth . The products were stored in flasks in a dark color photographic film to avoid any beam of light is observed at varying intervals , starting at T0 (initial time after manipulation ) to T3 (after 168 hours) . Five samples were disjuntadas : G1 with distilled water ; G2 with hydrogen peroxide at 30 % ; G3 sodium perborate and distilled water ; G4 with sodium perborate and hydrogen peroxide at 30 % ; G5 sodium percarbonate and distilled water , and G6 with sodium percarbonate and hydrogen peroxide 30%. The pH of these substances were established by a digital pH meter brand Gehaka PG Model 1800 To check the effect of time in each group, Friedman test and the results were applied were subjected to statistical analysis and a Kruskal- Wallis , followed by the Mann Whitney test and co - related between groups . One can then prove that for the pH factor were no differences between the substances assessed in the review period, regardless of the group found. Key words: Tooth Bleaching, Tooth Bleaching Agents, Hydrogen-Ion Concentration. LISTA DE ILUSTRAÇÕES Figura 1 - Valores de pH obtido para os diferentes agentes clareadores em função do tempo ................................................................................................... 15 LISTA DE TABELAS Tabela 1 - Média dos valores de pH, em função do tempo, dos diferentes materiais ................................................................................................................ 15 LISTA DE QUADROS Quadro 1 - Grupos experimentais ...................................................................... 13 LISTA DE ABREVIATURAS E SIGLAS pH – potencial hidrogeniônico SUMÁRIO 1. INTRODUÇÃO .................................................................................................. 12 2. PROPOSIÇÃO .................................................................................................. 14 3. MATERIAIS E MÉTODOS ................................................................................ 15 4. RESULTADOS ................................................................................................. 17 5. DISCUSSÃO ..................................................................................................... 18 CONCLUSÃO ................................................................................................... 20 REFERÊNCIAS ................................................................................................ 21 12 1 INTRODUÇÃO Na sociedade ocidental, um sorriso estético e saudável, representado por dentes brancos, bem contornados e corretamente alinhados no arco dental, é de suma relevância nas relações interpessoais (HATTAB; QUDEIMAT; AL-RIMAWI, 1999, p. 291). A presença de dentes escurecidos, além de interferir na beleza, harmonia facial e comprometer a autoestima, justifica o aumento de intervenções clínicas por cirurgiões-dentistas em pacientes insatisfeitos com a aparência do sorriso (MANDARINO, 2003). As alterações cromáticas dentárias intrínsecas, em dentes sem vitalidade do tecido pulpar e tratados endodonticamente, podem ser decorrente a: 1) tratamento endodôntico mal realizado, quer seja por uma abertura inadequada de acesso ao conduto radicular, remoção parcial da polpa coronária, uso inapropriado de substâncias e/ou produtos como curativo de demora e obturação dos condutos radiculares, além da utilização de materiais metálicos para a restauração da face palatina; 2) traumatismo, e 3) hemorragia pulpar (PAIVA; ANTONIAZZI, 1998; PLOTINO et al., 2008). Para a resolução do problema estético, consequência da alteração da cor dos dentes, estão indicados o clareamento dentário com agentes oxidantes, procedimento conservador aos tecidos dentários, e/ou a realização de restaurações estéticas, conduta clínica mais invasiva, que implica no desgaste dos dentes comprometidos (SÁ; YUI; GOMES, 2007, p. 63). Os primeiros relatos de clareamento intracoronário, em dentes tratados endodônticamente, foram descritos no século 19 e, desde então, diferentes produtos são indicados, empregados de forma isolada ou em associação, potencializados por luz, calor ou corrente elétrica (PLOTINO et al., 2008; OLIVEIRA et al., 2006; SILVA et al., 2010; LEE et al., 2004; OLIVEIRA et al., 2007). Quanto aos efeitos adversos do uso de substâncias oxidativas no interior da câmara pulpar, na técnica do clareamento intracoronário, a literatura descreve a possibilidade de reabsorção radicular externa, cauterização dos tecidos moles após contato com agentes clareadores cáusticos, excesso no clareamento e/ou fratura do elemento dental (HELLER; SKRIBER, 1992, p. 145; OLIVEIRA et al., 2006). Embora o peróxido de hidrogênio, na sua forma liquida, seja o mais preconizado, em associação ao perborato de sódio, esse pode ser substituído pelo 13 percabonato de sódio, também conhecido como peróxido de hidrogênio sólido e carbonato de sódio peróxidrato (OLIVEIRA, 2007). Esse, por ser seco, é fácil de ser estocado e decompõe-se na água rapidamente, liberando oxigênio, água e sódio (OLIVEIRA, 2007). Embora muito empregado na indústria para a fabricação de produtos de limpeza, detergentes, clareadores de tecidos, limpa-móveis, branqueadores têxteis, limpa-carpetes, desinfetante caseiro, tratamento químico de águas servidas e agente gerador de oxigênio em primeiros socorros (OLIVEIRA, 2007), pouco é referenciado como agente clareador dentário intracoronário. Fato relevante para propor a realização deste experimento. 14 2 PROPOSIÇÃO O objetivo deste experimento foi avaliar o pH de diferentes substâncias e pastas passiveis de serem empregadas no clareamento intracoronário, em diferentes intervalos de tempos. 15 3 MATERIAIS E MÉTODOS O fator em estudo foi a avaliação do pH de duas substâncias (água destilada e peróxido de hidrogênio), isoladamente e em associação ao perborato de sódio ou percarbonato de sódio, em diferentes intervalos de tempo (T0- inicial, T1- 24 horas, T2- 48 horas e T3- 168 horas). Para cada grupo experimental (G) foram preparadas cinco amostras (N), conforme descrito no Quadro 1. Quadro1 - Grupos experimentais. Grupo G1 (controle) G2 N Materiais 5 Água destilada (25 ml/frasco) 5 Peróxido de hidrogênio a 30% (25 ml/frasco) Perborato de sódio (70 g) + água destilada (35 ml), divididos em cinco frascos Perborato de sódio (70 g) + peróxido de hidrogênio a 30% (35 ml), divididos em cinco frascos Percarbonato de sódio (70 g) + água destilada (35 ml), divididos em cinco frascos Percarbonato de sódio (70 g) + peróxido de hidrogênio a 30% (35 ml), divididos em cinco frascos G3 5 G4 5 G5 5 G6 5 Fator em estudo pH Os materiais avaliados foram acondicionados em frascos plásticos de armazenamento de filme fotográfico, com tampa e de cor escura, para evitar exposição à luz. Os mesmos foram previamente lavados com detergente neutro e água corrente, secos e identificados, de acordo com o grupo correspondente e, no grupo, por ordem de leitura do pH. Para a pesagem do perborato de sódio e percarbonato de sódio foi utilizada uma balança semianalítica, modelo BG 2000, da marca Gehaka, com precisão de um centésimo de grama. Enquanto que para a aferição do pH, em todos os intervalos de tempo, foi utilizado um pHmetro digital (Gehaka Modelo PG 1800), cuja calibração foi realizada com duas soluções eletrolíticas da marca Digimed (São Paulo, SP), respectivamente com pH 6,86 (DM-51A) e 4,0 (DM-51B). A cada intervalo de tempo, a aferição do pH foi realizada imergindo o bulbo do aparelho nas substâncias e pastas clareadoras. Após, o bulbo foi lavado com água deionizada, à temperatura ambiente. Nos intervalos entre as aferições, o bulbo do pHmetro digital 16 foi mantido submerso em solução de cloreto de potássio, para prevenir a sua descalibração. Os valores de pH para os diferentes materiais, em função do tempo, foram submetidos a análise estatística. O teste de Kruskal-Wallis, seguido do teste de Mann Whitney, foi aplicado para comparações múltiplas entre os grupos. Enquanto que o teste de Friedman foi aplicado para verificar o efeito do tempo em cada grupo. 17 4 RESULTADOS Os valores médios de pH aferidos dos diferentes materiais, em função do tempo, estão apresentados na Tabela 1. Tabela 1 - Média dos valores de pH, em função do tempo, dos diferentes materiais. Tempo Grupo T0 T1 T2 T3 G1 7,55±0,10 6,45±0,12 6,75±0,39 6,55±0,62 (controle) G2 6,12±0.02 5,93±0.01 6,06±0,09 5,77±0,09 G3 11.30±0,05 11,20±0,07 10,87±0,05 10,93±0,02 G4 7,08±0,01 8,08±0,04 9,48±0,02 9,76±0,01 G5 12,64±0,02 12,82±0,01 13,23±0,03 13,29±0,10 G6 10,87±0,04 11,64±0,03 12,28±0,20 13,09±0,02 Foi constatada variação estatisticamente significante entre os grupos em T0, T1, T2 e T3 (p=0,000). E em cada grupo, houve diferença do pH com o passar do tempo. No G1 o pH permaneceu próximo da neutralidade em todos tempos de avaliação do experimento. Por sua vez, o pH no G2 se manteve mais ácido durante toda a experiência. Diferentemente, houve aumento do pH no G3, G4, G5 e G6, conservando-se mais alcalino no decorrer do experimento (Figura 1). Figura 1 - Valores de pH obtido para os diferentes agentes clareadores em função do tempo 18 5 DISCUSSÃO No presente estudo, foi constatado diferença significativa do pH quando o perborato de sódio ou percarbonato de sódio foram misturados à agua destilada ou ao peróxido de hidrogênio a 30%. No G1 (grupo controle), o valores do pH permaneceram próximos da neutralidade, em todo os tempos de análise. Embora o pH da água destilada seja referenciado como neutro (pH=7), em relação a T0 foi verificado queda do pH no T1, T2 e T3. Isso pode ter ocorrido devido a absorção de dióxido de carbono (CO2) do ar, após a avaliação do pH, em T0. Por sua vez, os valor de pH obtidos no G2 indicam que o peróxido de hidrogênio se manteve ácido, durante todo o experimento. Entretanto, o pH, em cada tempo de avaliação, ficou acima do valor esperado e indicado para solução de peróxido de hidrogênio puro, que é de 3,0 aproximadamente (ROTSTEIN; FRIEDMAN, 1991, p. 376). Em pH maior, há aumento da decomposição do peróxido de hidrogênio, o que implica na diminuição do seu tempo de uso. Em todos os tempos de avaliação, os valores de pH obtidos quando da associação do peróxido de hidrogênio com perborato de sódio ou ao percarbonato de sódio, G4 e G6, respectivamente, indicam que a mistura é alcalina. Esses resultados são corroborados por outros experimentos (SÁ et al., 2007), que também evidenciaram aumento do pH na pasta obtida da mistura do perborato de sódio e peróxido de hidrogênio, em relação ao peróxido de hidrogênio a 30% isoladamente. Em comparação ao G2, os valores obtidos no G4 indicam que a associação do peróxido de hidrogênio com o perborato de sódio, resultou numa mistura com pH alcalino, com elevação dos valores médios a partir de T0. Isso pode ter ocorrido devido à decomposição do peróxido de hidrogênio em água e oxigênio, no decorrer do tempo, como também pela alcalinidade apresentada pelo perborato de sódio e pela sua reação de decomposição (ERHARDT; SHINOHARA; PIMENTA, 2003, p. 23; SÁ et al., 2007). O perborato de sódio, quando misturado a um veículo, se degrada em metaborato de sódio. Esse, por sua vez, em peróxido de hidrogênio que, na sequência, se dissocia em água e oxigênio (WEIGER; KUHN; LOST, 1994, p. 338). O pH das pastas clareadoras à base de perborato de sódio é alcalino, sendo que a alcalinidade tende a aumentar com o decorrer do tempo, independentemente 19 do diluente utilizado (ROTSTEIN; FRIEDMAN, 1991, p. 376), fato esse evidenciado no presente experimento, em relação ao G3 e G4. Assim como o perborato de sódio, o percarbonato de sódio, também referenciado como peróxido de hidrogênio carbonato de sódio, também libera oxigênio ativo quando colocado em meio aquoso, além de carbonato de cálcio (OLIVEIRA, 2007). Considerando que esse produto apresenta potencial branqueador, como o oferece o peróxido de hidrogênio, o mesmo foi considerado para avaliação nesse experimento. Além da elevada concentração do peróxido, o percarbonato de sódio tem uma consistência sólida que facilita a sua inserção na câmara pulpar e posterior selamento. Em relação à etiologia da reabsorção radicular externa, pós-clareamento, pode-se, com base nos valores médios de pH observados no G4 e G6, afirmar que, embora o peróxido de hidrogênio, isoladamente, tenha apresentado pH ácido, quando misturado ao perborato de sódio ou percarbonato de sódio, resultou numa mistura de valores médio de pH alcalino, para todos os tempos de avaliação. Assim, outras hipóteses devem ser relevadas quando da ocorrência de reabsorção radicular externa, em dentes tratados endodonticamente e submetidos a clareamento intracoronário com peróxido de hidrogênio associado ao perborato de sódio ou percarbonato de sódio, como: 1) Do uso de uma fonte geradora de calor para catalisar a reação de degradação do peróxido ou 4) Por consequência de uma reação inflamatória como resposta a um trauma mecânico (LADO; SRANLEY; WEISMAN, 1983, p. 78; LADO, 1988, p. 500; MONTOGOMERY, 1984, p. 203; ROTSTEIN; FRIEDMAN, 1991, p. 376; SÁ et al., 2007). 20 CONCLUSÃO Com base nos resultados obtidos, pode-se concluir que para o fator pH houve diferenças entre as substâncias avaliadas, independente dos grupos e no período de avaliação, sendo que, o peróxido de hidrogênio, foi o único produto que se manteve ácido durante todo o experimento. 21 REFERÊNCIAS ERHARDT, M. C. G.; SHINOHARA, M. S.; PIMENTA, A. L. Clareamento dental interno. RGO – Revista Gaúcha de Odontologia, Porto Alegre, v. 51, n. 1, p. 23-29, abr. 2003. Disponível em: <http://www.revistargo.com.br/ojs/index.php/revista/article/view/267>. Acesso em: 12 nov. 2014. HATTAB, F. N.; QUDEIMAT, M. A., AL-RIMAWI, H. S. Dental discoloration: an overview. Journal of Esthetic and Restorative Dentistry, Philadelphia, v. 11, n. 6, p. 291-310, nov. 1999. Disponível em: <http://www.readcube.com/articles/10.1111%2Fj.17088240.1999.tb00413.x?r3_referer=wol&show_checkout=1>. Acesso em: 12 nov. 2014. HELLER, D., SKRIBER, J., LIN, L. M. Effect of intracoronal bleaching on external cervical root resorption. Journal of Endodontics, Baltimore, v. 18, p. 145-148, abr. 1992. Disponível em: <http://www.jendodon.com/article/S0099-2399(06)81407X/abstract>. Acesso em: 12 nov. 2014. LADO, E. A. Bleaching of endodontically treated teeth: na update on cervical resorption. Journal General Dentistry, Chicago, v. 36, p. 500-1, nov. 1988. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed?linkname=pubmed_pubmed&from_uid=32717 33>. Acesso em: 12 nov. 2014. LADO, E. A., STANLEY, H. R., WEISMAN, M. I. Cervical resorption in bleached teeth. Oral Surgery, Oral Medicine, Oral Pathology, Gainesville, v. 55, n. 1, p. 7880, jan. 1983. Disponível em: <http://www.sciencedirect.com/science/article/pii/0030422083903109>. Acesso em: 12 nov. 2014. LEE, G. P. et al. Extraradicular diffusion of hydrogen peroxide and pH changes associated with intracoronal bleaching of discoloured teeth using different bleaching agents. International Endodontic Journal, Oxford, v. 37, n. 7, p. 500-506, jul. 2004. Disponível em: < http://onlinelibrary.wiley.com/enhanced/doi/10.1111/j.13652591.2004.00838.x/>. Acesso em: 12 nov. 2014. MANDARINO, F. Clareamento dental. 2003. Disponível em: <http://www.forp.usp.br/restauradora/dentistica/temas/clar_dent/clar_dent.pdf>. Acesso em: 12 nov. 2014. 22 MONTOGOMERY, S. External cervical resorption after bleaching a pulpless tooth. Oral Surgery, Oral Medicine, Oral Pathology, St. Louis, v. 57, p. 203-6, fev. 1984. Disponível em: <http://www.sciencedirect.com/science/article/pii/0030422084902135>. Acesso em: 12 nov. 2014. OLIVEIRA, D. P. et al. In vitro assessment of a gel base containing 2% chlorhexidine as a sodium perborate’s vehicle for intracoronal bleaching of discolored teeth. Journal of Endodontics, Nova Iorque, v. 32, p. 672-674, jul. 2006. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0099239906000033 >. Acesso em: 12 nov. 2014. OLIVEIRA, D. P. et al. Effect of intracoronal bleaching agents on dentin microhardness. Journal of Endodontics, Nova Iorque, v. 33, p. 460-462, abr. 2007. Disponível em: <http://www.sciencedirect.com/science/article/pii/S009923990600762X>. Acesso em: 12 nov. 2014. OLIVEIRA, J. M., SANTANA, L. F., PINTO, F. S. T. Metodologia para analisar percarbonato e perborato de sódio, 2007. PAIVA, J. G; ANTONIAZZI, J. H. Endodontia: bases para a prática clínica. 2. ed. São Paulo: Artes Médicas, 1998. PLOTINO, G. et al. Nonvital tooth bleaching: a review of the literature and clinical procedures. Journal of Endodontics, Roma, v. 34, n. 4, p. 394-407, abr. 2008. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0099239908000058>. Acesso em: 12 nov. 2014. ROTSTEIN, I., FRIEDMAN, S. pH variation among materials used for intracoronal bleaching. Journal of Endodontics, Jerusalém, v. 17, n. 8, p. 376-9, ago. 1991. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0099239906819886>. Acesso em: 12 nov. 2014. SÁ, P. M., YUI, K. C. K., GOMES, A. P. M. Avaliação do Ph de várias substâncias utilizadas no clareamento intracoronário. Brazilian Dental Science, São José dos Campos, v. 10, n. 3, p. 61-66, jul. 2007. Disponível em: <http://ojs.ict.unesp.br/index.php/cob/article/view/289>. Acesso em: 12 nov. 2014. 23 SILVA, C. H. V. et al. Clareamento de dentes não vitais empregando cristal de uréia. Dental Science Clínica e Pesquisa Integrada, v. 4, n. 11, p. 48-53, 2010. WEIGER, R., KUHN, A., LOST, C. In vitro comparison of various types of sodium perborate used for intracoronal bleaching of discolored teeth. Journal of Endodontics, Alemanha, v. 20, p. 338-4, jul. 1994. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0099239906800968>. Acesso em: 12 nov. 2014.
Download