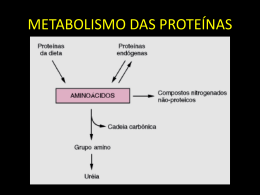
TIPOS DE PROCESSOS DE TRATAMENTO:
Classificados em função da natureza dos poluentes a serem removidos
e/ou das operações unitárias envolvidas:
Físicos: removem sólidos em suspensão, sedimentáveis e flutuantes. Ex:
Gradeamento,
Peneiramento,
Separação
de
óleos
e
gorduras,
Sedimentação e Flotação.
Químicos: utilizam produtos químicos e através de reações promovem a
remoção de poluentes ou condicionam o efluente a um tratamento
subseqüente. Ex: Clarificação,·Eletrocoagulação, Precipitação, Cloração,
Oxidação, Redução.
Biológicos: reproduzem os fenômenos naturais de autodepuração.
Removem a matéria orgânica, transformando-a em flocos biológicos ou
gases. Ex: ·
Lagoas anaeróbias e fotossintéticas, Processos aeróbios
por lodos ativados, Processos facultativos.
PROCESSOS FÍSICOS:
Separação água/óleo:
Ocorre por diferença de densidade, sendo normalmente as frações
oleosas mais leves recolhidas na superfície.
Este processo não é capaz de remover óleo emulsionado, sendo
utilizado na etapa preliminar dos sistemas de tratamento.
PROCESSOS FÍSICOS:
Gradeamento:
Remove sólidos grosseiros capazes de causar entupimentos e
aspecto desagradável nas unidades do sistema de tratamento.
O espaçamento entre as barras varia normalmente entre 0,5 e 2 cm.
Peneiramento:
Remove sólidos normalmente com diâmetros superiores a 1 mm,
capazes de causar entupimentos ou com considerável carga orgânica.
Limpeza: pode ser mecanizada (jatos de água ou escovas) ou estática.
Tratamento primário de efluentes
Equalização
Neutralização (correção do pH)
Coagulação e Floculação
Sedimentação
Precipitação química
Flotação
Clarificação
química.
Equalização do efluente
- Tanque de Equalização Como é feito:
Utiliza-se um tanque com um tempo de
residência relativamente alto.
Objetivo:
Impedir choques térmicos, de carga de
contaminante, de pH, de temperatura, etc.
Neutralização (correção do pH)
O pH do efluente é um fator controlado.
Valores de pH longes da neutralidade podem
prejudicar o tratamento secundário.
A coagulação possui um pH ótimo, que
depende do coagulante usado.
Na oxidação de cianetos o pH deve ser
mantido superior a 11,5 para evitar a
liberação de cloreto de cianogênio (ClCN),
gás extremamente tóxico.
Na redução de Cr6+ para Cr3+ o pH deve
ser inferior a 2,5.
Coagulação
Processo químico que se destina a reduzir as
forças de repulsão em colóides, facilitando o seu
agrupamento, e posterior floculação e
decantação dos flocos.
Colóides: matéria em suspensão que se mantém
dispersa devido a forças de repulsão.
Exemplo: sílica (dp = 10-5 mm) leva um ano
para decantar 1 mm.
Formas de desestabilização de um
colóide
Compressão da dupla camada.
Neutralização de cargas.
Aprisionamento em um precipitado.
Pontes entre partículas.
Dupla camada.
Velocidade de adição de
coagulantes
A adição de coagulantes, e de floculantes, deve
ser feita rapidamente e durante uma agitação
que permita a dispersão dos mesmos pelo
tanque todo.
Principais agentes coagulantes
Sulfato de alumínio – Al2(SO4)3x14H2O.
Hidroxicloreto de alumínio.
Cloreto férrico.
Sulfato férrico.
Taninos vegetais.
Reações químicas com o alumínio
Al2(SO4)3 ------>2Al3+ + 3SO2-4
(Dissociação)
Al3+ + 6H2O ------> Al(H2O)3+6
Complexo com número de
coordenação 6.
Reações de troca de ligantes
Al3+ + H2O Al(OH)2+ + H+
KAl(OH)c=10-5
7Al3+ + 17H2O Al7(OH)4+17 + 17H+
KAl7(OH)17c=10-48,8
13Al3+ + 34H2O Al13(OH)5+34 + 34H+
KAl13(OH)34c=10-97,4
Al(OH)3(s) Al3+ + 3OH-
KAl(OH)3=10-33
Pausa para respirar.
Vem um pouco de química
por
aí!
K
=10
Al(OH)3(s) + OH- Al(OH)-4
2Al3+ +2H2O Al2(OH)4+2 + 2H+
Al(OH)4c
1,3
KAls(OH)2c=10-6,3
[spAl] = [Al3+] + [Al(OH)2+] + 7[Al7(OH)4+17] + 13[Al13(OH)5+34] +
[Al(OH)-4] + 2[Al2(OH)4+2]
pH ótimo para a coagulação através
do Al2(SO4)3
[spAl] = KAl(OH)3 *δ3H*[H+]3/(δAl*K3W) +
KAl(OH)*KAl(OH)3*δ2H*[H+]2/(δAl(OH)*K3W) +
7KAl7(OH)17*KAl(OH)3*δ4H[H+]4/(δAl7(OH)17*K21W) + ........
Resolvendo-se essa equação pode-se obter o pH
ótimo para a coagulação com alumínio. Por
exemplo, para uma concentração de 140 mg/L de
sólidos em suspensão o pH ideal é 5,3.
Coagulação com sulfato ferroso
FeSO4 ---- Fe2+ + SO42-
Fe(OH)2(s) Fe2+ + 2OH-
KFe(OH)2 = 10-14,5
Fe(OH)2(s) FeOH+ + OH-
KFeOH = 10-9,4
Fe(OH)2(s) + OH- Fe(OH)3-
KFeOH3 = 10-5,1
Para 140 mg/L de SS o pH ótimo é 11,95.
Coagulação com íons férricos
FeCl3 ---- Fe3+ + Cl-
Fe2(SO4)3 --- 2Fe3+ + 3SO42Fe(OH)3(s) Fe3+ + 3OHFe(OH)3(s) FeOH2+ + 2OHFe(OH)3(s) Fe(OH)2+ +OH-
KFe(OH)2 = 10-16,74
Fe(OH)3(s) + OH- Fe(OH)4-
KFE(OH)4 = 10-5
Fe(OH)3(s) Fe2(OH)24+ + 4OH-
KFe(OH)2 = 10-50,8
Para 140 mg/L de SS o pH ótimo é 8,2.
Valores ótimos de pH
Coagulante pH ótimo
Al2SO4
5,32
Íon ferroso
11,95
Íon férrico
8,20
Valores para 25ºC e para
140 mg/L de SS.
Importância de testes de
jarro para escolha do pH!
Massa de lodo formado
O lodo é composto por água e sólidos.
Aproximadamente 99% do lodo é compsto
por água!
A alta formação de lodo é um dos maiores
pontos negativos do processo de coagulação.
PROCESSOS FÍSICOS:
Sedimentação:
É uma das etapas de clarificação, devendo ser aplicado conforme as
características de cada efluente e do processo de tratamento.
Essencial: deve-se evitar nos decantadores as condições para
ocorrência da atividade microbiana.
Formas construtivas: diversas, podem ser circulares ou retangulares.
Formas de remoção de lodo: com ou sem mecanização, com limpeza
de fundo por pressão hidrostática ou com remoção de lodo
mecanizada por raspagem ou sucção.
Como qualquer outra unidade de tratamento os tanques de
decantação são projetados para um equipamento específico ou
sistema de limpeza, não sendo viáveis alterações posteriores ao
projeto.
Precipitação Química
Adição de reagente, de modo a criar condições
para que os elementos (íons) em solução sejam
removidos após a formação de compostos
insolúveis. Tais compostos insolúveis,
representados pelos produtos da reação de
precipitação química, são partículas sólidas em
suspensão, destinadas `a remoção da água pelo
processo de clarificação.
Remoção de flúor
Os níveis de fluoretos nos efluentes são
controlados para o descarte, bem como deve-se
controlar os níveis de flúor enviados para o
tratamento secundário. Isso devido a influência
desse sobre os microorganismos responsáveis
pela depuração dos efluentes.
Remoção de flúor
CaO + 2HF CaF2 + H2O
Reação exotérmica.
Normalmente inicia-se com pH ácido (2 a 2,5),
adiciona-se cal até pH alcalino.
O fluoreto de cálcio é removido através de
coagulação/floculação.
Remoção de fósforo por
Precipitação Química
Por quê remover o fósforo de efluentes
industriais?
Eutrofização!
Exemplos:
Baia de Chesapeak, EUA
Gosto da água de POA no verão
Algas!
Remoção de fósforo
- Questões biológicas Atenção: O fósforo é um micro nutriente importante para processos
biológicos!!!
Remoção biológica - Uma importante opção!
Na remoção biológica de fósforo os microorganismos são
sujeitos a uma seqüência que compreende uma zona
anaeróbia seguida por uma zona aeróbia, devendo os valores
de pH situar-se na gama neutra.
Com a remoção biológica de fósforo pode-se atingir efluentes
com concentrações em torno de 0,5 mgP/l, embora seja mais
apropriado considerar-se um valor mais conservador de 1,0
mgP/l. O tratamento físico-químico após a remoção biológica
de fósforo pode gerar efluentes com concentrações da ordem
de 0,1 mgP/l.
Remoção de fósforo por
Precipitação Química
O fósforo (P) é um elemento classificado como “não
metal”, mais comumente encontrado nos estados de
oxidação -3, +3 e +5.
Trata-se de um micronutriente para plantas, e é
encontrado na natureza na forma de fosfatos
(ortofosfato, fosfatos condensados e fosfatos
orgânicos).
Remoção de fósforo por Precipitação
Química
Em efluentes industriais e em esgotos é
encontrado mas comumente como: fosfato de
sódio (Na3PO4), fosfato de sódio hidrogênio
(Na2HPO4), fosfato de sódio di-hidrogênio
(NaH2PO4) e fosfato de amônio hidrogênio
[(NH4)2HPO4].
Remoção de fósforo por Precipitação
Química
A reação mais usual para a remoção do fósforo é a
seguinte, com alumínio:
Al3+ + PO43- AlPO4(s)
AlPO4(s) Al3+ + PO43-
kAlPO4 = 10-21
(25ºC)
Nota: Para a reação acima é necessário que o fósforo
esteja disponível na forma do íon fosfato (PO43-).
Remoção de fósforo (Alumínio)
Existem três reações, em meio aquoso, que
consomem o PO3-4, produzindo compostos solúveis:
PO3-4 + H+
HPO42-
kHPO4= 10-12,3
HPO42- + H+ H2PO4-
kH2PO4= 10-7,2
H2PO4- + H+ H3PO4
kH3PO4= 10-2,1
Remoção de fósforo (cal)
5Ca2+ + 3PO43- + OH- Ca5(PO4)3OH(s)
Ca5(PO4)3OH(s) = mineral apatita
Kapatita = Kap = 10-55,9
Novamente existe a necessidade de que o fósforo se
encontre na forma de fosfato (apatita) para ser
removido, portanto a equação anterior ainda é
válida:
Remoção de fósforo (Sais de ferro)
Fe3+ + PO43- FePO4(s)
KFePO4 = 10-21,9
Seguindo o mesmo método aplicado para o equilíbrio dos íons
fosfatos na remoção de fósforo por alumínio e cal.
Considerando:
[PO3-4]={PO43-}/γPO4=KFePO4/γPO4{Fe3+}=KFePO4/γPO4γFeIII[Fe3+]
O que nos leva a:
Remoção de Flúor
O F em água potável deve permanecer na faixa
entre 0,5 e 1 ppm;
Muitos países possuem águas superficiais com
concentrações de flúor acima de 1,5 ppm;
Fluoretos em águas superficiais tem origem mineral
e nos efluentes de indústrias como na de aço,
alumínio, vidro e eletrônicos, além da agricultura;
Regiões no norte da África possuem concentrações
de flúor na água subterrânea acima de 20 ppm;
Tecnologias para a remoção de flúor dividem-se
entre precipitação e adsorção.
(Fan et all., 2003)
Remoção de Flúor
O
método de remover flúor como CaF2, através de
coagulação química já é utilizado a várias décadas;
Ksp = [F-]2[Ca2+] = 3,5*10-11
O uso de Ca2+ em excesso é capaz de reduzir a concentração
de F- para a faixa entre 10 e 20 ppm.
Essa concentração é reduzida até 2 ppm com a adição de
sais de alumínio, através da formação de sais insolúveis
como: AlFn3-n e Al(OH)3-mFm.
O uso de alumínio é necessário principalmente porque as
partículas de CaF2 são de pequeno diâmetro
Remoção de Cromo
A presença de metais pesados em corpos
aquáticos tem sido conhecida como a causa
de problemas de poluição ambiental, e a
maior fonte de metais pesados é a descarga
imprópria de vários efluentes industriais por
indústrias de galvanoplastia, eletrônicas,
metalúrgicas, de tratamento de madeira e
indústrias de curtimento de couros.
Remoção de Cromo
- Métodos de Remoção Métodos de Precipitação;
Redução fotocatalítica do
Métodos de Adsorção;
Troca Iônica;
Remoção de Cromo
- Método de Precipitação O cromo na forma hexavalente é solúvel em pH
ácido ou alcalino. Para que ocorra a sua remoção é
necessário que o mesmo seja reduzido para a
forma de cromo trivalente e precipitado como
hidróxido.
Remoção de Cromo
- Método de Precipitação No caso do íon cromato o Cromo +6 é reduzido
para o estado de oxidação +3 pela ação do dióxido
de enxofre ou compostos derivados (bissulfitos).
A redução do cromo ocorre em pH ácido, inferior a
2,5. A velocidade da reação diminui rapidamente se
o pH for superior a 3,5.
Problemas?
Remoção de Cromo
- Método de Precipitação -
Remoção de Cromo
- Método de Precipitação Pelas reações apresentadas 3 g de bissulfito de
sódio podem reduzir 1 g de cromo hexavalente.
Deve-se considerar o consumo de bissulfito devido
à presença de compostos orgânicos, o que na
prática pode aumentar em até 15 % o consumo
do bissulfito.
Remoção de Cromo
- Método de Precipitação -
Remoção de cromo
- Biossorção Os mecanismos pelos quais microrganismos removem
metais de solução são:
a) acumulação extracelular/precipitação;
b) sorção na superfície celular ou complexação;
c) acumulação intracelular.
Remoção de cromo
- Biossorção Para a implementação de uma nova tecnologia de acumulação
de metais pesados alguns requisitos devem ser satisfeitos:
- a biomassa deve ter uma capacidade de acumulação elevada,
da ordem de 70 a 100 mg metal/g biomassa seca;
- a biossorção e a dessorção devem ser rápidas e eficientes;
- o material biológico deve apresentar baixo custo;
- o material biológico deve ser reutilizável;
- o material biológico deve ser adaptável a diferentes
configurações de reatores;
- a separação do metal retido deve ser fácil e de baixo custo.
Remoção de cromo
- Biossorção de Cr6+ SHARMA & FORSTER (1993) avaliaram o comportamento da turfa
do musgo esfagno;
GUAN et al. (1993) estudaram a capacidade de adsorção de um
consórcio de bactérias desnitrificantes;
As cianobactérias Anabaena variabilis e Synechococcus PCC 6301
foram avaliadas quanto às suas capacidades em biossorver e reduzir
o íon cromato (WILHELMI & DUNCAN, 1995; GARNHAM & GREEN,
1995).
SARAVIA & TAVARES (1997) utilizaram Sargassum sp. para verificar
a possibilidade de utilização dessa alga no tratamento do efluente
de uma indústria de processamento de couro.
pH ótimo = 2,0
PROCESSOS FÍSICOS:
Flotação:
Processo muito utilizado para a clarificação de efluentes e a
conseqüente concentração de lodos.
Vantagem: necessidade reduzida de área.
Desvantagem: custo operacional mais elevado devido à mecanização.
Indicação: para efluentes com altos teores de óleos e graxas e ou
detergentes tais como os oriundos de indústrias petroquímicas, de
pescado, frigoríficas e de lavanderias.
A flotação não é aplicada aos efluentes com óleos emulsionados, a
não ser que os efluentes tenham sido coagulados previamente.
Baixar