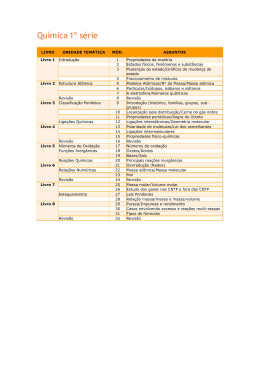
IQG 114 - Química Geral I Créditos: 04 Carga Horária Total: 60h Carga Horária Teórica: 60h Carga Horária Prática: 00 Requisitos: Obrigatório: --Recomendado: --- Tipo: Disciplina obrigatória para o curso de Engenharia Química. Ementa: Estequiometria. Teoria atômica. Classificação períodica dos elementos. Ligação química. Compostos de coordenação. Processos nucleares. Programa: 1. Estequiometria 1.1 - Lei das proporções definidas. Teoria Atômica de Dalton. 1.2 - Pesos atômicos 1.3 - Fórmulas empíricas e moleculares. Composição percentual 1.4 - Equilíbrio de equações simples. 1.5 - Cálculo de rendimento. 2. Teoria Atômica 2.1 - Natureza elétrica da matéria. Experiência de eletrólise. Tubos de descarga (raios catódicos e canais). 2.2 - Experiência de J.J. Thomson (e/m). 2.3 - Experiência de Millikan. 2.4 - Modelo Atômico de Thomson. 2.5 - Descoberta do Raio X. 2.6 - Radioatividade. 2.7 - Experiência de Rutherford (descoberta do núcleo). 2.8 - Espectro eletromagnético. 2.9 - Raio X e n0 Atômico (Moseley). 2.10- Descoberta do néutron, isótopos. 2.11- Comportamento peródico dos elementos. 2.12- Espectro Atômico. 2.13- Teoria Atômica de Bohr. 2.14- Difração e carácter ondulatório do elétron. (De Broglie). Princípio da Incerteza de Heisenberg. 2.15- Mecânica Ondulatória. 2.16- Átomo de Hidrogênio - Orbitais atômicos, Números Quânticos. 2.17- Spin do elétron e Princípio da Exclusão de Pauli. 2.18- Configuração eletronica dos elementos. Regra de Hund e tabela Periódica. 2.19- Diamagnetismo. Paramagnetismo e Ferromagnetismo. Susceptibilidade. Magnética e Lei de Curie. 3. Classificação Periódica 3.1 - Histórico. 3.2 - A Lei Periódica. 3.3 - Forma da Tabela Periódica e a estrutura eletrônica dos elementos. 3.4 - Propriedades Periódicas: Raio Atômico, Afinidade ao Elétron, Energia de ionização. 4. Ligação Química 4.1 - Estruturas de Lewis. Regra do octeto. 4.2 - Número de Oxidação. Carga Formal. 4.3 - Ligação iônica. Ciclo de Born-Harber. 4.4 - Exceções à Regra do octeto. 4.5 - Teoria da repulsão dos pares de elétrons. 4.6 - Teoria da ligação de valência. 4.7 - Orbitais Híbridos. 4.8 - Ligações multiplas. Ligações covalentes coordenadas. Ressonância. 4.9 - Escala de eletronegatividade de Pauli. Polarização das ligações. 4.10-Teoria de Orbitais Moleculares: Móleculas diatômicas homonucleares e heteronucleares. 4.11-Ordem de ligação e propriedades das ligações químicas: comprimento de ligação, energia de ligação e frequência de vibração. 4.12-Ligação metálica. teoria das bandas: condução elétrica e semicondutores. 4.13-Ligação hidrogênio. 4.14-Forças de London. 5. Compostos de Coordenação 5.1 - Nomenclatura. 5.2 - Ligação (Teoria: eletrostática, da ligação de valência). Noções do campo cristalino e do campo ligante. 5.3 - Propriedades magnéticas e espectrocópicas. 5.4 - Estereoquímica. 5.5 - Estabilidade. 5.6 - Aplicações. 6. Processos Nucleares 6.1 - Radioatividade natural. 6.2 - Séries radiotivas. 6.3 - Cinéticas da desintegração nuclear e datação radioquímica. 6.4 - Estabilidade nuclear: energia de ligação nuclear. 6.6 - Aplicações da radioatividade. Bibliografia: 1. BRADY, J. E. HUMISTON, G.E. “Química Geral”. Livros Técnicos e Científicos Editora, 1981. 2. RUSSEL, J.B. “Química Geral”. Editora McGray-Hill do Brasil Ltda, São Paulo, 1982. 3. QUAGLIANO, J.V. VALLARINO, L.M. “Química”. Editora Guanabara Dois S.A., 1973. 4. OHLWEILER, O.A. “Introdução à Química Geral”. Editora Globo, Porto Alegre, 1967. 5. BASALO, F. JOHSON, R. “Química de Los Compuestos de Coordinación”. Editora Reverté S.A, Barcelona, 1976. 6. COMPANION, A.L. “Ligação Química”. Editora Edgar Blucher Ltda, São Paulo, 1970.
Baixar