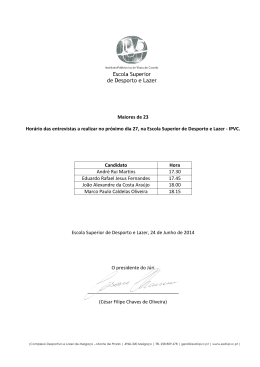
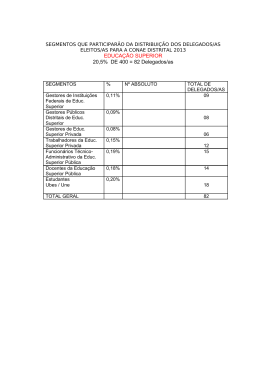
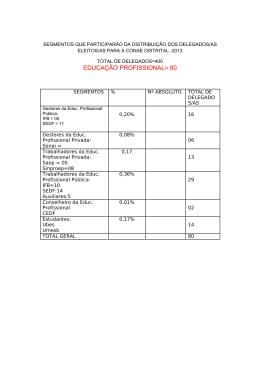
http://www.ese.ipvc.pt Cursos da Formação Inicial Tel.+351 258806200 Fax.+351 258806209 Educ. B á s ica Ges t . A rt is t . e C ul t . Educ. S oci a l Geront Educ. Infâ nc. EB 1 º C i clo Des p. La z er Port . Ingl ês Mat. C i enc. Educ. Fís ica Edu c . Visu al Te c n . Educ. M us i c. Port . Fra ncês Ensino Básico – Variantes Disciplina Ano do curso 1 QUÍMICA 1.º Ano Carga horária lectiva semanal Anual/Semestral 2 Docentes Horas Ext Gab Professor Responsável: Doutora Ana Peixoto [email protected] 150 108 Docentes: Lic. Sandra Ramalho [email protected] 150 108 @ese.ipvc.pt @ese.ipvc.pt 2 Resumo Nesta disciplina serão abordados assuntos do âmbito da Química Geral, nomeadamente relacionacionados com a análise quantitativa, a estrutura electrónica dos átomos, a ligação química, o equilibrio químico,as células electroquímicas, bem como os mecanismos reaccionais em Química Orgânica. As principais preocupações centram-se na aquisição de fundamentos básicos de uma sólida cultura científica, permitindo a interpretação de fenómenos químicos incluídos nos programas dos 1º e 2º Ciclos do Ensino Básico, suscitando ainda a apetência e o desenvolvimento de competências relativamente às actividades laboratoriais. 3 Resumo Inglês/Francês 4 Objectivos . Adquirir fundamentos básicos de uma sólida cultura científica . Permitir a interpretação científica de fenómenos e factos incluídos nos programas de 1º e 2º ciclos do Ensino Básico . Suscitar a apetência e desenvolver competências relativamente à prática laboratorial, tendo em vista o desenvolvimento de atitudes críticas face à Ciência e da autonomia dos estudantes. 5 Conteúdos / Actividades 1. Análise quantitativa 1.1. Interpretação de fórmulas químicas 1.2. Soluções 1.2.1. Noção de solução 1.2.2. Tipos de soluções 1.2.3. Composição quantitativa de soluções 1.2.4. Preparação de soluções 1.3. Cálculos estequiométricos 1.3.1. Estequiometria de uma reacção química 1.3.2. Reagente limitante 1.3.3. Grau de pureza 1.3.4. Rendimento de uma reacção 2. Estrutura electrónica dos átomos 2.1. Teorias atómicas. 2.1.1. Espectroscopia atómica 2.1.2. Números quânticos 2.1.3. Configurações electrónicas 2.2. Estrutura electrónica e propriedades periódicas 2.2.1. Localização dos elementos químicos na TP função da configuração electrónica 2.2.2. Raio atómico e raio iónico 2.2.3. Energias de ionização 2.2.4. Electronegatividade e afinidade electrónica 3. Ligação química 3.1. Tipos de ligação química 3.1.1. Ligações covalentes 3.1.2. Ligações metálicas 3.1.3. Ligações iónicas 3.2. Teoria do enlace de valência 3.3. Teoria das orbitais moleculares 3.4. Geometrias moleculares 4. Equilíbrio químico 4.1. Estado de equilíbrio 4.2. Constante de equilíbrio 4.3. Produto de solubilidade 4.4. Princípio de Le Chatelier 5. Células electroquímicas 5.1. Reacções de oxidação-redução 5.2. Potenciais de oxidação e de redução 5.3. Constituição das células electroquímicas 5.4. Equação de Nernst 5.5. Constante de Faraday 5.6. Força electromotriz 5.7. Aplicações 6. Mecanismos reaccionais em Química Orgânica 6.1. Grupos funcionais 6.2. Reacções de adição 6.3. Reacções de substituição 6.4. Reacções de eliminação 6 Metodologia A metodologia adoptada nesta disciplina será baseada em: . aulas teóricas de exposição, discussão e problematização das matérias de conhecimento. . aulas práticas de laboratório e aulas teórico-práticas de resolução de problemas numéricos. 7 Avaliação Na modalidade de avaliação periódica os alunos ficam sujeitos à realização de: . duas provas escritas (frequências) coincidentes com o final dos semestres; . relatórios das aulas práticas de laboratório.exposição, discussão e problematização das matérias de conhecimento; . aulas práticas de laboratório e aulas teórico-práticas de resolução de problemas numéricos. Cada prova escrita incidirá sobre a matéria leccionada efectivamente no respectivo semestre. No caso de o aluno obter nota inferior a sete valores na primeira prova escrita ficará sujeito a avaliação final. Uma nota inferior a sete valores na segunda prova escrita remete o aluno para exame na Época de Recurso, conforme o artigo 6º do capítulo III ponto 1.1.4 do Regulamento de Avaliação. A classificação final da disciplina para a avaliação periódica obter-se-á pela média aritmética ponderada das três notas (45% da 1ª prova escrita, 45% da 2ª prova escrita, 10% dos relatórios das aulas práticas). Ressalva-se que para ser aprovado na disciplina o aluno terá de obter média superior ou igual a 9,5 valores nas frequências independentemente da nota dos relatórios das aulas práticas. A modalidade de avaliação final, constará de um exame a ser realizado no final do período de leccionação da disciplina, contemplando toda a matéria dada, bem como, questões relativas às actividades laboratoriais realizadas durante o ano lectivo. Em caso de avaliação final apenas constará a nota de exame. Considera-se aprovado na disciplina o aluno que obtenha classificação final igual ou superior a 10 (dez) valores. 8 Bibliografia Essencial Alexéev, V. (1983) Análise Quantitativa. Lopes da Silva Editora. Arnaud, P. (1978). Curso de Química Orgânica (Ed. port.). Lisboa: Dinalivro. Chang, R. (1994). Química (5.ª Ed.). Alfragide: McGraw-Hill. Mahan, B. (1972) Química um curso universitário (2.ª Ed.). Editora Edgard Blucher Ltda. Moore, J., Davies, W. & Collins, R. (1978). Chemistry. International Student Education: Alfragide: McGraw-Hill. Para além das obras citadas, estão disponíveis numerosos manuais universitários de introdução à Química (alguns na biblioteca da Escola). Aprovado em Conselho Cientifico em : __________________________ O Docente Responsável da Disciplina : _________________________________________________
Baixar