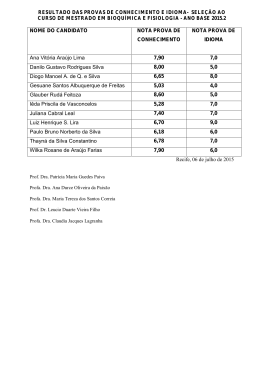
QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Patrícia Dantoni Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto ESTEQUIOMETRIA Estequiometria é uma palavra de origem grega que significa quantidade. Os cálculos decorrentes da estequiometria são importantes para quantificarmos reações químicas, ou seja, descobrirmos qual a quantidade de um produto formado ou qual a quantidade necessária de reagente que deve ser utilizada para produzir um produto. Antes de aprendermos sobre os cálculos é importante reconhecermos as reações químicas, que são representadas por equações químicas, e entendermos o amplo significado da simbologia nelas contidas. BALANCEAMENTO DE EQUAÇÕES QUÍMICAS: Reações Químicas e a Lei de Conservação da Matéria: Lavoisier encontrou que a massa é conservada em uma reação química. Equações Químicas como uma Representação de Reações Químicas: 2 H2(g) + O2(g) → 2 H2O(g) Reagentes 2 Al(s) + Fe2O3(s) → Al2O3(s) + 2 Fe(l) ∆ Produtos ou C12H22O11(s) H O 2 → C12H22O11(aq) símbolos que indicam o estado da matéria de cada componente da reação: s para sólido, l para líquido, g para gasoso e aq para aquoso A equação 2 H2(g) + O2(g) → 2 H2O(g), que representa uma reação química, pode, então, ser lida de duas formas: • Se, ou quando, hidrogênio reage com oxigênio, duas moléculas de hidrogênio e uma molécula de oxigênio são consumidas para produzir duas moléculas de água; • Se, ou quando, hidrogênio reage com oxigênio, dois mol de hidrogênio e um mol de oxigênio são consumidos para produzir dois mol de água. Se a equação está balanceada, a somatória das massas dos reagentes deve ser igual à somatória das massas dos produtos. Os números anteriores às fórmulas são os coeficientes estequiométricos. Não há uma seqüência de regras a seguir para balancear uma equação, nós devemos manipular os coeficientes de forma que o número de átomos de cada elemento seja igual nos reagentes e nos produtos. Março de 2006 1 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Patrícia Dantoni Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto CÁLCULOS ESTEQUIOMÉTRICOS: O objetivo destes cálculos (estequiométricos) é de o predizer a relação entre as quantidades de reagentes e produtos de uma reação química balanceada. Por exemplo, vamos encontrar a quantidade de oxigênio (O2) que deve ser inalada para consumir 10,0 g de açúcar (C12H22O11), a reação não-balanceada é: ____ C12H22O11(s) + ____ O2(g) → ____ CO2(g) + ____ H2O(l) Como fazer isso? 1º passo) Balancear a equação. C12H22O11(s) + 12 O2(g) → 12 CO2(g) + 11 H2O(l) 2º passo) Identificar o objetivo do problema. Encontrar a massa de gás oxigênio (O2). 3º passo) Relacionar os compostos necessários. C12H22O11 e 12 O2 4º passo) Encontrar a massa molar dos compostos escolhidos. M C12H22O11 = 342 g/mol e M O2 = 32 g/mol 5º passo) Calcular a quantidade de matéria do composto que possui dados para isso. m de C12H22O11 = 10 g quantidade de matéria = 0,029 mol 6º passo) Fazer a comparação entre eles (regra de três simples) - comparando o mol da reação balanceada, com o que existe realmente para a reação ocorrer - para encontrar o mol de O2 que será utilizado. C12H22O11 12 O2 1 mol ---- 12 mol 0,029 mol ---- x x = 0,348 mol de O2 7º passo) Transformar mol de O2 em gramas. Quantidade de matéria = 0,348 mol m de O2 = 11,14 g Portanto, são necessários 11,14 g de O2 para consumir 10,0 g de açúcar. Março de 2006 2 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Patrícia Dantoni Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto IMPORTANTE: PARA REALIZAR CORRETAMENTE QUALQUER CÁLCULO ESTEQUIOMÉTRICO É NECESSÁRIO SEMPRE GARANTIR QUE A EQUAÇÃO QUÍMICA ESTEJA BALANCEADA, PARA QUE SEJA POSSÍVEL FAZER AS COMPARAÇÕES NECESSÁRIAS. No caso acima só nos foi fornecido a massa de um dos reagentes por isso a relação entre o açúcar e o oxigênio foi estequiométrica. A partir da quantidade de açúcar poderíamos ter calculado as massas de CO2 e H2O formados. Se nós tivéssemos os dados das massas iniciais de açúcar e oxigênio e estas não obedecessem a estequiometria da reação (1:12) então precisaríamos descobrir qual é o reagente limitante e, a partir de sua quantidade, determinarmos as massas dos produtos. Vejamos, REAGENTE LIMITANTE é aquele que limita a quantidade de produto formado, ou seja, está em menor quantidade. Vejamos um exemplo: Para preparar 3,00 g de óxido de nitrogênio são necessárias 1,7 g de NH3 e 4,0 g de O2 , segundo a reação: 4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) Estas quantidades são estequiométricas. Observemos o gráfico para verificar o que aconteceria com a produção de NO se mantivéssemos a quantidade de O2 em 4,0 g e alterássemos a quantidade de NH3: A partir da observação podemos concluir que: 1. A quantidade de NO produzida é proporcional à quantidade de amônia, NH3; 2. O patamar indica que, mesmo que a quantidade de NH3 seja aumentada, não há mais oxigênio suficiente para aumentar a produção de NO. Portanto, neste caso, o O2 é o reagente limitante e o NH3 é o reagente em excesso. Março de 2006 3 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Patrícia Dantoni Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Muito bem, depois que entendemos estes cálculos é importante também calcularmos o rendimento da reação, ou seja, compararmos valores teóricos (obtidos através dos cálculos estequiométricos) com os valores realmente obtidos. RENDIMENTO DE REAÇÃO Qual teria sido o rendimento da reação de formação do monóxido de nitrogênio se houvesse a produção de 2,50 g ao invés dos 3,00 g esperados? 3,00 100% 2,50 x x = 83,3 % de rendimento CONCENTRAÇÕES DE SOLUÇÕES: Uma solução é uma mistura homogênea formada por um solvente e um soluto. O solvente é a substância que sempre está em maior quantidade e o soluto, ou solutos, são as substâncias dissolvidas no solvente. As soluções podem ser sólidas, líquidas ou gasosas e, quando líquidas, podem ser classificadas de acordo com o tipo de solvente, em aquosas (aquelas nas quais o solvente é a água) e não-aquosas (nas quais o solvente é um líquido orgânico). Para entendermos muitos dos fenômenos que vamos abordar em nossa disciplina vamos nos deter às soluções aquosas. O comportamento das soluções não depende apenas da natureza do soluto e do solvente, mas também da quantidade de soluto que está contida na solução. Esta quantidade de soluto em função da quantidade de solvente é chamada de concentração da solução e pode ser expressa de diversas formas. Vejamos algumas: CONCENTRAÇÃO COMUM (g/L): é expressa em gramas de soluto por litro de solução, C = m de soluto (g) V de solução (L) CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA (mol/L = mol.L-1): é expressa em quantidade de matéria de soluto por litro de solução, C = quantidade de matéria de soluto (mol) V de solução (L) Março de 2006 4 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Patrícia Dantoni Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto ppm = partes por milhão: é expressa em miligramas ( = 10 - 3 g) de soluto por litro de solução, ppm = m de soluto (mg) V de solução (L) ppb = partes por bilhão: é expressa em microgramas ( = 10 -6 g) de soluto por litro de solução, ppb = m de soluto (µg) V de solução (L) ppt = partes por trilhão: é expressa em nanogramas ( = 10 - 9 g) de soluto por litro de solução, ppt = m de soluto (ng) V de solução (L) REFERÊNCIAS BIBLIOGRÁFICAS: ATKINS, P.; JONES, L. Princípios de Química. Porto Alegre: Bookman, 2001. BROWN, T.L. et al. Química a Ciência Central. 9 ed. São Paulo: Pearson-Prentice Hall, 2005. KOTZ, J.C.; TREICHEL, P. Jr. Química Geral e Reações Químicas. 1 ed. São Paulo: Thomson Pioneira, Vol. 1., 2005. Março de 2006 5
Download