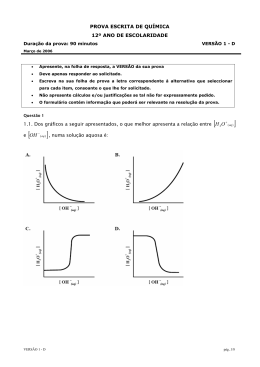
PROVA ESCRITA DE QUÍMICA 12º ANO DE ESCOLARIDADE Duração da prova: 90 minutos VERSÃO 1 - C Março de 2006 • Apresente, na folha de resposta, a VERSÂO da sua prova • Deve apenas responder ao solicitado. • Escreva na sua folha de prova a letra correspondente à alternativa que seleccionar para cada item, consoante o que lhe for solicitado. • Não apresente cálculos e/ou justificações se tal não for expressamente pedido. • O formulário contém informação que poderá ser relevante na resolução da prova. Questão 1 Um sistema tampão, existente na lagoa de Pataias, constituído pelas − espécies HCO3 ( aq ) e CO32− ( aq ) é representado pelo equilíbrio: para o qual a 25 ºC, Keq= 4,7x10-11 − 1.1. O gráfico que melhor representa a titulação do tampão HCO3 ( aq ) e CO32 − ( aq ) com NaOH (aq ) é: VERSÃO 1 - C pág..1/8 1.2. Quando a água da lagoa apresenta um pH= 6,0, o valor do quociente [HCO ] é: [CO ] − 3 2− 3 (apresente a opção correcta) (A) igual à unidade. (B) maior que a unidade. (C) menor que a unidade. (D) igual a zero. Questão 2 2.1. Os combustíveis gasosos apresentam-se normalmente liquefeitos, armazenados sob pressão em garrafas ou tanques, por serem facilmente compressíveis. Na sua fase gasosa, em determinadas condições podem ser considerados gases ideais. Relativamente aos gases ideais, qual das afirmações de (A) a (D) está correcta? (A) A pressão de um gás, a volume constante, diminui quando a temperatura aumenta. (B) A pressão constante, uma determinada quantidade de gás, duplica o seu volume quando a temperatura passa de 50 ºC para 100 ºC. Massas iguais de CO (g) e (C) N 2 (g) nas mesmas condições de pressão e temperatura, ocupam o mesmo volume. (D) Para qualquer gás, variando a temperatura, o produto PV é constante. Ar(C)= 12 Ar(O)= 16 Ar(N)= 14 2.2. Uma mistura gasosa ideal, de propano e butano, encontra-se encerrada num recipiente, de 40 litros de capacidade, à temperatura de 20 ºC e à pressão de 1,5 atm. Sabendo que 1,5 moles é a quantidade de propano existente, determine a quantidade de butano na mistura. Apresente todos os cálculos. Questão 3 A utilização de biodisel, como combustível alternativo, é uma forma de diminuir a poluição atmosférica, porque: (seleccione a afirmação correcta) (A) Liberta-se na sua combustão completa gases poluentes responsáveis pela destruição da camada de ozono. (B) Libertam-se, na sua combustão completa, hidrocarbonetos gasosos simples. (C) A quantidade de CO2 emitida na sua combustão é igual à quantidade de CO2 absorvida durante a sua formação. (D) Na sua composição prevalecem os ácidos carboxílicos de elevada massa molar. VERSÃO 1 - C pág..2/8 Questão 4 A figura, em baixo, representa esquematicamente um dos equipamentos utilizados, nas refinarias para efectuar a destilação fraccionada do petróleo. Seleccione, de entre as alternativas de A a D a que completa correctamente a frase: Questão 5 O esquema seguinte representa o conversor catalítico (considerado ideal) de um automóvel. Tendo em conta a composição da mistura gasosa, à entrada do conversor, indique, na sua folha de prova, o nome dos quatro gases de saída. VERSÃO 1 - C pág..3/8 Questão 6 Calcule o volume de CO 2 (g) libertado na combustão completa de 2,0 litros de octano líquido, C8H18, principal constituinte da gasolina, medido à pressão atmosférica normal e à temperatura ambiente (θambiente= 20,0 ºC). Explicite todos os cálculos e/ou raciocínios que efectuar. Dados: Constante dos gases ideais, r = 0,0821 atm.dm3.K-1.mol-1 = 8,314 J.K-1.mol-1 M(C8H18)= 114,0 g.mol-1 Massa volúmica do octano líquido, ρ= 0,70 g.cm-3 Questão 7 A gasolina é uma mistura de hidrocarbonetos diversos que apresenta, entre outros, os seguintes componentes: Os pares de componentes I - II e I - III apresentam isomeria plana, respectivamente, do tipo: (A) cadeia e cadeia. (B) posição e cadeia. (C) cadeia e posição. (D) posição e posição. Questão 8 Os motores de explosão são constituídos por um ou mais cilindros dentro dos quais se realiza a explosão de uma determinada mistura gasosa à base de gasolina. Explique sucintamente o problema que poderia resultar do abastecer de um automóvel, adaptado a gasolina 98 octanas, com gasolina 95 octanas. (Referir: poder detonante, índice de octanas e eficácia do motor) VERSÃO 1 - C pág..4/8 Questão 9 O carvão e o gás natural contêm quantidades pequenas de compostos de enxofre, os quais quando queimados, contribuem para o fenómeno da Chuva Ácida. Equações relacionadas com a Chuva Ácida 9.1. A expressão da constante de equilíbrio da reacção I é: 9.2. A base conjugada de H 2 SO3 ( aq ) é: VERSÃO 1 - C pág..5/8 Utilize a seguinte informação para responder à próxima questão A 900 K a constante de equilíbrio da reacção II é 13,0. As concentrações de equilíbrio são: 9.3. Com os valores dados anteriormente, a concentração de O 2 ( g ) , em equilíbrio é: 9.4. A sequência reaccional em baixo representa um procedimento moderno de eliminação do anidrido sulfuroso (SO2), que consiste na sua conversão em gesso. Calcule a massa de gesso, em gramas, que pode ser obtida a partir de 192 gramas de anidrido sulfuroso, considerando um rendimento de 100% no processo de conversão. Questão 10 Há quem afirme que as grandes questões da humanidade simplesmente se restringem às necessidades e à disponibilidade de energia. Podemos concordar que o aumento do consumo de energia é uma das principais preocupações actuais. De facto, o uso de motores de combustão continua a ser o responsável pelo enorme desenvolvimento tecnológico actual. Porém, os problemas ambientais inerentes a estes motores têm levado à busca de outras tecnologias. Uma alternativa promissora para os motores de combustão é a pilha de combustível que permite, entre outras coisas, rendimentos de até 50% e operação em silêncio. Uma das mais promissoras pilhas de combustível é a de hidrogénio, representada em baixo: VERSÃO 1 - C pág..6/8 Nesta, um dos compartimentos é alimentado por hidrogénio gasoso e o outro, por oxigénio gasoso. As semi-reacções que ocorrem nos eléctrodos são dadas pelas equações: − Ânodo: H2 (g) → 2H+ + 2 e − Cátodo: O 2 (g) + 4H+ + 4 e → 2H2 O 10.1. Por que se pode afirmar, do ponto de vista químico, que esta pilha de combustível é “não poluente”? Seja sucinto. 10.2. Qual dos gases deve alimentar o compartimento X? Justifique convenientemente. 10.3. Que proporção de massa entre os gases se deverá utilizar para alimentar esta pilha de combustível? Apresente os cálculos que efectuar. Questão 11 Indique, justificando, as orbitais híbridas dos átomos de carbono que mais directamente se ajustam à geometria molecular do: 11.1. metano, CH 4 . 11.2. eteno, C 2H 4 Questão 12 12.1. O principal componente do medicamento Xenical, utilizado no controle da obesidade, possui a fórmula estrutural condensada conforme se representa: Podemos identificar, nesta estrutura, a presença de, pelo menos, um grupo funcional característico da seguinte função orgânica: (seleccione a opção correcta) A) éter B) éster C) amina D) álcool. VERSÃO 1 - C pág..7/8 12.2. Indique para a molécula apresentada: 12.2.1.o número de ligações-pi existentes. 12.2.2. a fórmula molecular. Cotações: 1.1. 10 9.2. 5 1.2. 10 9.3. 10 2.1. 10 9.4. 15 2.2. 10 10.1. 10 3. 5 10.2. 10 4. 5 10.3. 12 5.. 8 11.1. 10 6. 15 11.2. 10 7. 10 12.1. 10 8. 10 12.2.1. 5 9.1. 5 12.2.2. 5 TOTAL 200 Bom trabalho, O professor, António Pedro VERSÃO 1 - C pág..8/8
Baixar