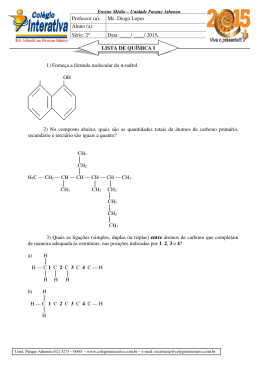
Dicas de Química ‐ Tasso Questão 01) Considere a reação química representada pela equação: 2Fe2S3(s) + 6H2O(l) +3O2(g) 4Fe(OH)3(s) +6S(s) Calcule a quantidade de (em mols) de Fe(OH)3 que pode ser produzida a partir de uma mistura que contenha 1mol de Fe2S3, 2mol de H2O e 3mols de O2. Gab: 1,33mol de Fe(OH)3 Questão 02) O carbono tem uma química muito mais extensa que a dos demais elementos da tabela periódica, exceto o hidrogênio. a) Comparado aos outros elementos do segundo período da tabela periódica, o carbono é aquele cujos átomos têm a capacidade de fazer o maior número de ligações simples. INDIQUE quantas ligações covalentes simples com átomos de hidrogênio podem ser formadas, em moléculas neutras, por um átomo de cada um destes quatro elementos: carbono, nitrogênio, oxigênio e flúor. b) JUSTIFIQUE a sua resposta ao item 1 desta questão, no caso dos átomos de carbono e nitrogênio, em termos da configuração eletrônica de valência desses átomos. c) Há numerosíssimos polímeros orgânicos com estruturas que apresentam ligações C–C em cadeia. Por outro lado, o silício, o vizinho mais próximo do carbono, na mesma coluna da tabela periódica, não forma polímeros importantes baseados numa estrutura com ligações Si–Si. De fato, as siliconas são polímeros baseados na repetição de ligações Si–O. Neste quadro, comparam‐se os valores das energias de ligação simples envolvendo átomos de silício e oxigênio. Ligação Energia Si – Si 226kj/mol Si – O 466 kj/mol Usando as informações desse quadro, EXPLIQUE a razão de os polímeros do silício apresentarem cadeias de ligações simples Si–O , e não Si–Si . Gab: a) Átomo C N O F Número de ligações 4 3 2 1 b) O carbono apresenta quatro elétrons de valência que estarão desemparelhados na formação das ligações com hidrogênio. O átomo de nitrogênio apresenta 5 elétrons de valência, sendo 3 elétrons desemparelhados. Ambos os átomos obedecem à regra do octeto. c) A energia de ligação Si‐O é maior que a energia de ligação Si‐Si. Portanto, as ligações simples Si‐O são mais difíceis de serem rompidas Questão 03) Dois eletrodos, E1 e E2, conectados a uma Lâmpada podem ser mergulhadas em diferentes soluções. Supondo que a distância entre os eletrodos e a porção mergulhada sejam sempre as mesmas, compare o brilho da lâmpada quando se usam as seguintes soluções: a) ácido acético 0,1 mol/l b) sacarose 0,1 mol/l c) cloreto de potássio 0,1 mol/l Gab: Cloreto de potássio > ácido acético > sacarose. Questão 04) Para a reação A + B C foram realizados três experimentos, conforme a tabela abaixo: Determine: a) a lei da velocidade da reação acima; b) a constante de velocidade; c) a velocidade de formação de C quando as concentrações de A e B forem ambas 0,50 M. Gab: a) V = k [A] . [B] b) 2,0 . 10–1 mol L–1.min–1 c) 5,0 . 10–2 mol L–1.min–1 Questão 05) –
Uma solução aquosa de iodo apresenta coloração marrom devido à formação de I 3 na solução {I2(aq) + I (aq)
I 3 (aq)}. Com a adição de excesso de zinco metálico, a coloração dessa solução desaparece devido a uma reação de óxido‐redução que leva ao consumo da espécie I2, que não mais estará disponível para a formação da espécie colorida. Considere o equilíbrio e as semi‐reações de óxido‐redução apresentados a seguir. 2+
–
Zn°(s) + I2(aq)
Zn (aq) + 2I (aq) marrom (devido ao I 3 ) incolor –
–
–
–
ClO (aq) + H2O(l) + 2e
Cl (aq) + 2OH (aq) E°= +0,84V –
I2(aq) + 2e–
2I (aq) E°= +0,54V a) Considerando que todo o iodo foi consumido e que o zinco restante foi separado da solução, o que –
acontecerá se a ela adicionarmos solução de hipoclorito (ClO )? Justifique apresentando seus cálculos. b) Com base nas informações fornecidas, o que aconteceria ao Zn° se ele fosse adicionado a uma solução aquosa de NaClO? Justifique sua resposta. Gab: a) haverá formação de I3–(aq) (marron), devido à reação: ClO (aq) H 2O(l) 2e
Cl (aq) 2OH (aq)
2I (aq)
I 2 (aq) 2e
E o 0,84V
E o 0,54V
----------------------------------------------------ClO (aq) 2I (aq) H 2O(l)
Cl (aq) I 2 (aq) 2OH (aq) E o 0,30V
b) haverá oxidação do zinco (dissolução do zinco) uma vez que o seu potencial de oxidação é o maior de todos. Questão 06) Como o vigia estava sob forte suspeita, nossos heróis resolveram fazer um teste para verificar se ele se encontrava alcoolizado. Para isso usaram um bafômetro e encontraram resultado negativo. Os bafômetros são instrumentos que indicam a quantidade de etanol presente no sangue de um indivíduo, pela análise do ar – 7
expelido pelos pulmões. Acima de 35 microgramas (7,6 x 10 mol) de etanol por 100 mL de ar dos pulmões, o indivíduo é considerado embriagado.Os modelos mais recentes de bafômetro fazem uso da reação de oxidação do etanol sobre um eletrodo de platina. A semi‐reação de oxidação corresponde à reação do etanol com água, dando ácido acético e liberando prótons. A outra semi‐reação é a redução do oxigênio, produzindo água. a) Escreva as equações químicas que representam essas duas semi‐reações. b) Admitindo 35 microgramas de etanol, qual a corrente i (em ampères) medida no instrumento, se considerarmos que o tempo de medida (de reação) foi de 29 segundos? Carga do elétron = 1,6 x 10–19 coulombs; Constante de Avogadro = 6 x 1023 mol–1; Q = i x t (tempo em segundos e Q = carga em coulombs). Gab: a) Oxidação do etanol C2H6O + H2O C2H4O2 + 4e– + 4H+ Redução do oxigênio +
–
O2 + 4H + 4e 2H2O Reação global C2H6O + O2 C2H4O2 + H2O –2
b) i = 1,0 . 10 A Questão 07) O leite de magnésia, utilizado para combater a acidez estomacal, é uma suspensão de hidróxido de magnésio (Mg(OH)2) em água. O hidróxido de magnésio é um composto pouco solúvel em água, que apresenta a constante do Produto de Solubilidade (KPS), a 25 ºC, igual a 3,2 10–11. a) Calcule a solubilidade do Mg(OH)2 em água pura, expressa em mol/L. Considere desprezível a concentração de íons OH– proveniente da dissociação da água e KPS = [Mg2+] [OH–]2. b) Explique, utilizando cálculos, o que acontece com a solubilidade do Mg(OH)2 em solução que apresente –
pH = 12. Admita que a concentração de íons OH da dissociação do Mg(OH)2 seja desprezível nesse valor de pH. Gab: a) 2,0 . 10–4molar b) diminui de 2,0 . 10–4molar para 3,2 . 10–7molar Questão 08) Quantos mols de ácido acético (HAc) precisam ser adicionados a 1,0 litro de água pura para que a solução resultante, a 25°C, tenha o pH igual a 4,0? Sabe‐se que nesta temperatura. HAc(aq) H+(aq) + Ac‐(aq) ; Kc = 1,8 x 10‐5 Deixe claro os cálculos efetuados, bem como eventuais hipóteses simplificadoras. [H ] . [Ac ]
10 4 10 4
1,8 x 10 5
[HAc]
[HAc]
Kc
[HAc] 5,6 x 10 4 molar
n
M n 5,6 x 10 4 mols do ácido
V
Questão 09) Um dos componentes da cera de abelhas é a substância A, representada pela fórmula estrutural: A: CH3(CH2)23CH2COOCH2(CH2)2CH3 Essa substância, quando hidrolisada, forma dois produtos, B e C: A + H2O B + C Considerando essas informações, faça o que se pede. a) REPRESENTE as fórmulas estruturais das substâncias B e C. b) IDENTIFIQUE, por nome ou estrutura, o grupo funcional presente em cada espécie – A, B e C. c) IDENTIFIQUE o nome da função orgânica a que pertence cada espécie – A, B e C. d) Uma das substâncias produzidas pode ser identificada pela reação com bicarbonato de sódio, com produção de gás carbônico e outros produtos. ESCREVA a equação química balanceada dessa reação. Gab: a) B: CH3(CH2)23CH2COOH C: CH3(CH2)26CH2OH b) A: Carboxilato B: Carboxila C: Hidroxila c) A: Éster B: Ácido carboxílico C: Álcool d) CH3(CH2)23CH2COOH + NaHCO3 CH3(CH2)23CH2COONa + CO2(g) + H2O Questão 10) Dois alquenos A e B, de fórmula C6H12, foram oxidados sob condições enérgicas, na presença de KMnO4, fornecendo diferentes produtos, conforme representação abaixo: A
B
[O]
[O]
O
2H3C - C - CH3
O
CH3(CH2)-C
-OH
2
+
O
CH -C -OH a) Qual é a estrutura de A Estrutura de B? b) Represente um composto de fórmula molecular C6H12 que não reagiria sob as mesmas condições de oxidação apresentadas. Gab: a) CH3C(CH3) = C(CH3)CH3……2,3‐Dimetil‐2‐buteno CH3(CH2)2CH = CHCH3……..2‐Hexeno b) O ciclo‐hexano, que devido às diferentes conformações (barco e cadeira) dificilmente apresentaria oxidação nas mesmas condições dos alcenos .
Download