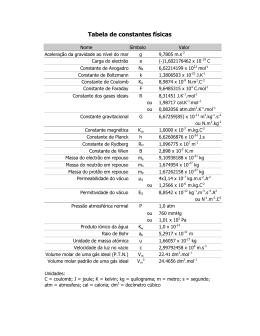
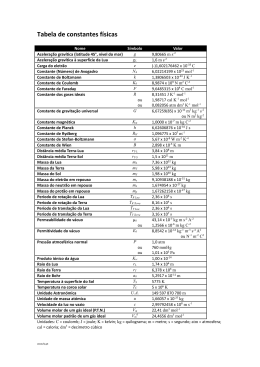
3 de março 2012 (Semifinal) Pergunta I II III IV Total Classificação Escola: ….…………………………………………………………………………… Nome: ….…………………………………………………………………………… Nome: ….…………………………………………………………………………… Nome: ….…………………………………………………………………………… Nota: Apresente todos os cálculos que efetuar Dados: Constante de Avogadro: NA = 6,022 x 1023 mol-1 Volume molar: Vm = 22,4 dm3 mol-1 Unidade astronómica: 1 UA = 1,50 x 1011 m Ano-luz: 1 a. l. = 6,31 x 104 UA Parsec: 1 pc = 2,06 x 105 UA Ar Ar Ar Ar Ar (H) = 1,0079 (O) = 15,999 (N) = 14,007 (C) = 12,011 (S) = 32,064 “2011 foi o ano internacional da Química. Esperamos que o interesse nesta ciência não tenha ficado só pelas comemorações que decorreram em 2011. Até porque a Química é a ciência que estuda a estrutura e composição dos materiais que constituem o Universo e as suas transformações. Utilizando a Química podemos modificar os materiais que nos rodeiam e criar novos materiais úteis. Mas para conseguir fazer isto é necessário dominar muito bem os conceitos fundamentais em que a Química se baseia. Por exemplo, conhecer a constituição dos átomos, saber como se ligam para formar moléculas, saber como ocorrem as transformações químicas, etc... Vamos ver se vocês já dominam suficientemente bem estes conceitos fundamentais. Se os dominarem, certamente no dia 5 de maio irão visitar a cidade de Aveiro. E daí quem sabe até onde podem chegar...” I Elementos Químicos – constituição do átomo e Tabela Periódica Isótopos estáveis do oxigénio Número atómico (Z) 8 8 Número de massa (A) 16 17 Abundância relativa 99,762 % 0,038 % Massa isotópica relativa 15,995 16,999 8 18 0,200 % 17,999 1.1- Represente simbolicamente o isótopo mais abundante do oxigénio. 1.2- Qual é a constituição atómica do isótopo menos abundante do oxigénio? 8 protões 9 neutrões 8 eletrões 1.3- Qual é a constituição do anião óxido representado simbolicamente por 8 protões 10 neutrões 10 eletrões 18 O2-? 1.4- Calcule a massa atómica relativa do oxigénio, Ar(O). Apresente o resultado com três algarismos significativos. = 1.5- , , + , , + , , <=> = , Indique a localização do elemento oxigénio na Tabela Periódica (TP) dos Elementos. Período 2 Grupo 16 1.6- Um determinado elemento tem a seguinte configuração eletrónica no estado fundamental: 1s2 2s2 2p6 3s2 3p6 3d3 4s2. Com base nesta configuração, indique: i) O bloco da TP a que pertence …d…. ii) O período da TP a que pertence …4… iii) O grupo da TP a que pertence ……5.. iv) A sua configuração eletrónica do cerne …1s2 2s2 2p6 3s2 3p6. v) A sua configuração eletrónica de valência …3d3 4s2 1.7- Associe a cada número da coluna I uma letra da coluna II e um número romano da coluna III de modo a ter considerações verdadeiras. 1 2 3 4 Coluna I A densidade do mercúrio é muito elevada O potássio reage violentamente com a água O raio iónico do brometo é de 196 pm O símbolo químico do hélio é He A B Coluna II Propriedade do elemento químico Propriedade da substância elementar I II III 1-B-III 2-B-I 3-A-I 4-A-III Coluna III Aumenta ao longo de um grupo Diminui ao longo de um grupo Não tem variação periódica II Palavras Cruzadas 1. Nome atribuído ao conjunto dos elementos do 1º grupo da tabela periódica. 2. Diz-se de uma solução em que é possível dissolver mais soluto. 3. Nome do elemento cujo símbolo químico é Cd. 4. Unidade de quantidade de matéria (ou de substância). 5. Partícula constituinte do átomo que possui carga e tem massa quase desprezável. 6. Massa de soluto máxima que é possível dissolver em 100 mL de solvente. 7. Número do grupo da tabela periódica a que pertence o flúor. 8. Nome do elemento cujo símbolo químico é Ba. 9. Substância maioritária numa solução. 10. Coeficiente que corresponde à proporção com que as espécies químicas reagem ou se formam. 11. Diz-se do reagente que se esgota se a reação química for completa. 12. Região do espaço onde se pode encontrar o eletrão no seu movimento e a que corresponde um nível de energia bem definido. 13. Estado de um eletrão que está no nível de energia mais baixo. 14. Ligação que se estabelece quando há partilha de pares de eletrões. 15. Que é emitida pelo sol. 16. Parte do átomo onde se concentra a maior parte da sua massa. 17. Escala logarítmica relativa à concentração de H+. 18. Átomo mais pequeno da tabela periódica. 19. Partícula subatómica com carga positiva. 20. Composto que pode ceder protões em meio aquoso. 21. Diz-se da concentração de uma solução expressa em termos de massa de soluto por 100 g de solução. 22. Transformar um átomo neutro numa espécie química com carga. 23. Diz-se de um eletrão depois de absorver radiação. 24. Nome dado ao ião NO3-. 25. Diz-se da mistura em que não é possível distinguir a fase dispersa da dispersante. 26. Fenómeno que ocorre sempre que um eletrão passa de um nível de energia mais baixo para um mais alto. 27. Propriedades que dependem do número de partículas em solução. 28. Elemento essencial à vida humana na Terra. 29. Grupo de átomos ligados entre si e que constituem uma espécie neutra. 30. Fenómeno em que há libertação de energia sob a forma de luz. 31. Diz-se dos eletrões que, efetivamente, participam numa ligação química. 32. Grupo/Classe de compostos a que pertence o NaCl (pl.). 33. Reação em que ocorre variação do número de oxidação. 34. Diz-se da reação química cuja energia dos seus produtos é maior que a de seus reagentes. 35. O seu número varia nos isótopos de um mesmo elemento químico (sgl.). 36. Camada gasosa que envolve a Terra. 37. Tipo de ligação que mantém unidos iões de carga oposta. 38. Substância produzida industrialmente por reação entre moléculas de azoto e hidrogénio. 39. Ciência que estuda, entre outras coisas, a estrutura, composição, propriedades, e processos de transformação dos materiais. 40. Que é constituído por dois monómeros. 41. Passagem do estado sólido ao estado líquido. 1 4 A 2 3 M 5 L I C O E 6 C N A L L S A S O L A 7 D E Z A S S E T E 11 L I M I T A N T E U N U B O R I S A L 15 D I R A D A D E 8 T 9 E I B R S S A O T 12 O R B I T A L 13 R 14 C O V A L E N T E F I V Q 16 N U C L E O E U N I N 18 20 A C I D O D Ç R 19 P R O T A O 21 M A S S I C A 22 I O N I Z A R A 17 D H H 28 C A R B O N O 30 E M I R H I 29 M O L E C U L A M L O 33 I O G R S A E T D A 38 A M O N I A C O 40 D I M E R O 25 O L 32 S A I S 36 A T M O S F E R A M 23 E X C I T A D O 24 N I T R A T O 31 V A L E N C I A V A 41 F U S A O O E E G E M 26 A B S O R Ç A O 27 T O 10 M X O G 34 E N D O T E R M I C A 35 N E U T R A O 37 E 39 Q U I M I C A O N I C A III Acertar equações químicas C2H6O(g) + 3 O2(g) 2 HCl(aq) + 2 Al(s) + → Zn(s) Fe2O3(s) → → 2CO2(g) + 3 H2O(g) ZnCl2(s) + Al2O3(s) + H2(g) 2 Fe(s) 2 KClO3(s) → 2 KCl(s) + 3 O2(g) H3PO4(aq) + 6 KOH(s) + 3 NaHO(aq) 3 Cl2(g) 3 Mg(s) + 2 FeCl3(s) + → Mn2O3(s) → Na3PO4(g) + 3 H2O(g) KClO3(s) + 5 KCl(s) + 3 H2O(g) → 3 MgO(s) + 2 Mn(s) Be3(PO4)2(s) → 3 BeCl2(s) + 2 FePO4(aq) 2 KMnO4(aq) + 5 K2C2O4(aq) + 8 H2SO4(aq) → 10 CO2(g) + 2 MnSO4(aq) + 6 K2SO4(aq) + 8 H2O(l) IV Moléculas na atmosfera 4.1- Sabendo que a massa de ozono existente por m3 de ar estratosférico é 2,0 2 x 10-7 kg, calcule o número correspondente de moléculas de ozono ozono. 2,0 x 10'( 6,022 x 10,48 <=> º é !" = 2,5 x 10/0 º é !" = 4.2-Calcule o calor libertado na reação: 2O3 3O2 sabendo que as energias de dissociação da ligação O-O no ozono e no oxigénio são, respetivamente, de 109 kJ mol-1 e 502 kJ mol-1. Calor libertado = energia libertada na formação de três ligações O=O no O2 menos a energia consumida na rutura de quatro ligações O-O em 2 moléculas de O3 = 3x 502 – 2x 2 x 109 1070 kJ mol-1 4.3-Escreva a fórmula de estrutura do ozono. 4.4-Complete o esquema seguinte: O que se pretende ilustrar com este esquema? Destruição do ozono provocada pelos CFC 4.5-A combustão completa de 11,2 dm3 (CNPT) de um alcano gasoso acíclico produziu 33,6 dm3 de CO2. A equação química da combustão pode ser representada da seguinte forma: CnH2n+2(g) + O2(g)[excesso] nCO2(g) + (n+1)H2O(g) em que n representa o número de átomos de carbonos na molécula do alcano. De acordo com os dados indique: i) A quantidade de alcano que reagiu Nas condições CNPT p = 1 atm, T = 273,15 K e VM = 22,4 dm3 mol-1 como n = V/VM n(alcano) = 11,2/22,4 = 0,500 mol ii) A quantidade de dióxido de carbono formado n(CO2) = 33,6/22,4 = 1,50 mol iii) O volume de vapor de água formado (CNPT) Pelos resultados anteriores n = 3 então 0,5 mol alcano dá 2 mol H2O Logo V(H2O) = 2x22,4 = 44,8 dm3 iv) O volume mínimo de oxigénio (CNPT) necessário à combustão completa Com o valor de n = 3 podemos acertar a equação e verificar que a quantidade mínima de O2 para que a reação seja completa é 5 vezes a quantidade de alcano Como temos 0,500 mol de alcano necessitamos de 2,50 mol de O2 V(O2) = 2,50x22,4 = 56,0 dm3 v) As fórmulas molecular e de estrutura do alcano Sabendo que n = 3 temos: vi) O nome do alcano segundo as regras de Nomenclatura da IUPAC propano
Baixar