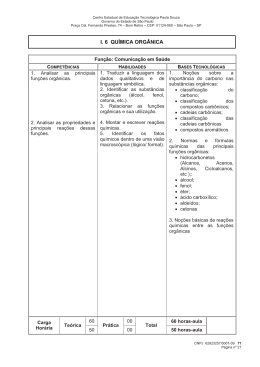
REAÇÕES QUÍMICAS ORGÂNICAS REAÇÕES QUÍMICAS ORGÂNICAS Como tudo começou? REAÇÕES QUÍMICAS ORGÂNICAS BERZELIUS "Somente os seres vivos podem transformar substâncias minerais em orgânicas." (Teoria da Força Vital) Jöns Jacob Berzelius (1779-1848) REAÇÕES QUÍMICAS ORGÂNICAS A Teoria da Força Vital Significou estagnação no desenvolvimento de novos materiais que hoje chamamos de compostos orgânicos. REAÇÕES QUÍMICAS ORGÂNICAS WHÖLLER Realizou a síntese da uréia (composto orgânico) a partir do cianato de amônio (composto inorgânico) em laboratório. (Derrubou a Teoria da Força Vital) Friedrich Wöhler (1800-1882) REAÇÕES QUÍMICAS ORGÂNICAS NH2 calor NH4CNO C = O NH2 Cianato de amônio (inorgânico ou “mineral”) uréia (orgânico) REAÇÕES QUÍMICAS ORGÂNICAS Conseqüências da Síntese de Wöhller Milhões de compostos podem ser sintetizados em laboratório, pois há mudança de paradigma. Surge a Síntese Orgânica ! REAÇÕES QUÍMICAS ORGÂNICAS Síntese Orgânica Graças aos avanços da Síntese Orgânica, hoje, obtêm-se compostos de alta complexidade. Qual o limite? Fórmula estrutural da palitoxina. REAÇÕES QUÍMICAS ORGÂNICAS Entendendo alguns mecanismos de RQO Chama-se mecanismo de uma RQO a descrição das várias etapas pelas quais ela passa, como . . . REAÇÕES QUÍMICAS ORGÂNICAS Entendendo alguns mecanismos de RQO 1. A ruptura das ligações. REAÇÕES QUÍMICAS ORGÂNICAS Entendendo alguns mecanismos de RQO 2. Os ataques radicalares, eletrofílicos e nucleofílicos ao reagente orgânico. REAÇÕES QUÍMICAS ORGÂNICAS Entendendo alguns mecanismos de RQO 3. A formação de novas ligações e de compostos intermediários, etc. Rupturas de ligações Nas reações orgânicas é muito comum a formação de grupos intermediários instáveis, sendo, portanto, de existência transitória, nos quais o carbono não tem efetuadas suas quatro ligações. Rupturas de ligações Estes grupos se originam da ruptura de ligações entre átomos, que pode ocorrer de modo homolítico ou heterolítico. Rupturas de ligações Ruptura Homolítica As rupturas homolíticas freqüentemente ocorrem em moléculas apolares ou com baixa diferença de eletronegatividade entre os átomos das ligações e exigem alta energia( luz / λ). Rupturas de ligações Ruptura Homolítica luz / λ Br · · Br Ruptura Br · + Radical livre · Br Rupturas de ligações Ruptura Homolítica H I H–C··H I H Ruptura H I H–C· I H + Radical livre ·H Rupturas de ligações Ruptura Heterolítica Quando a ruptura é feita de modo desigual, ficando o par eletrônico com apenas um dos átomos da ligação, temos uma ruptura heterolítica, resultando na formação de íons(presença de catalisador). CATALISADOR: É toda e qualquer substância que acelera uma reação, diminuido a Ea, diminuindo a energia do CA, sem ser consumido durante o processo...não altera o ∆H. Rupturas de ligações Ruptura Heterolítica As rupturas heterolíticas freqüentemente ocorrem em ligações polarizadas, em presença de CATALISADORES, à custa de pouca energia. Rupturas de ligações Ruptura Heterolítica Br · · Br Br+ + Ruptura Cátion Br – Ânion (+) POSITIVO = CÁTION = POBRE EM ELÉTRON = ELETRÓFILO = ÁCIDO DE LEWIS. São exemplos: H+ , Br+, CH3+, BF3, AlCl3 (-) NEGATIVO = ÂNION = RICO EM ELÉTRON = NUCLEÓFILO = BASE DE LEWIS. São exemplos: OH-, CN-,Cl- Rupturas de ligações Ruptura Heterolítica H I H–C··H I H Ruptura H I H – C: Θ I H Carbânion + H+ Cátion Rupturas de ligações Ruptura Heterolítica H I H – C · · Br I H Ruptura H I H–C I H Carbocátion + :Br- Ânion Tipos de reagentes X · Radical livre (produto da quebra homolítica). X+ Agente eletrófilo (produto da quebra heterolítica). X- Agente Nucleófilo (produto da quebra heterolítica). Tipos de reagentes X+ Agente eletrófilo Os eletrófilos são “deficientes de elétrons”, funcionam, portanto, como ácidos de Lewis. São exemplos: H+ , Br+, CH3+, BF3, AlCl3, carbocátions, etc. Tipos de reagentes X- Agente nucleófilo Os nucleófilos são “fornecedores de elétrons”, funcionam, portanto, como bases de Lewis. São exemplos: OH-, CN-,Cl-, carbo-ânions, etc. Tipos de reações orgânicas Podem ser por meio de : - Adição; - Substituição; - Eliminação; - Oxidação-redução, etc. Tipos de reações orgânicas Reação de adição Na presente apresentação, abordaremos apenas a reação de adição. Tipos de reações orgânicas Reação de adição Naturalmente que as demais, oportunamente, também serão estudadas. Tipos de reações orgânicas Exemplificando ... Uma reação de adição muito comum no laboratório é aquela que visa à identificação de alcenos. Tipos de reações orgânicas Exemplificando ... Consiste no borbulhamento de suposto alceno (CH2 = CH2) em solução* de bromo (Br2). * Br2 + CCl4 Tipos de reações orgânicas Exemplificando ... A cor avermelhada da solução de bromo desaparece, indicando a presença de insaturação. Testando alceno com solução de bromo. Tipos de reações orgânicas Exemplificando ... H I H I H–C=C–H H I + Br – Br H I H–C–C–H I I Br Br Tipos de reações orgânicas Exemplificando ... Outro exemplo de reação de adição muito importante, porém industrial, é a hidrogenação de óleos, visando à fabricação de margarinas. Margarina: produto da adição de hidrogênio a um lipídeo. Tipos de reações orgânicas Exemplificando ... As moléculas que compõem as margarinas pertencem à função éster. Especificamente são ésteres de ácidos graxos de cadeia longa e glicerol. Tipos de reações orgânicas Exemplificando ... As moléculas que compõem as margarinas pertencem à função éster. Especificamente são tri-ésteres de ácidos graxos de cadeia longa e glicerol (triglicerídeos). Tipos de reações orgânicas Exemplificando ... Por comodidade, representamos apenas os ácidos graxos, com destaque para as estruturas cis e trans. Tipos de reações orgânicas Exemplificando ... A presença de insaturação torna o óleo líquido. Para solidificá-lo, realiza-se reação de adição catalítica de hidrogênio (hidrogenação). Tipos de reações orgânicas Exemplificando ... H H O ...– C = C ...– C – O+ H H O ...– C – C ... – C – OH H Ni, pressão H–H Adição de hidrogênio Margarina (sólida) Tipos de reações orgânicas Mecanismos de reações de adição Pode ser adição eletrófila e adição nucleófila. Tipos de reações orgânicas Adição eletrófila É aquela em que o primeiro ataque ao átomo de carbono envolve a adição de reagente eletrófilo. Tipos de reações orgânicas Adição eletrófila H2C = CH2 + Br2 eteno bromo Br Br H2C – CH2 1,2 di-bromo-etano Tipos de reações orgânicas Adição eletrófila 1.ª etapa: o bromo sofre heterólise Br · · Br Br+ + Br – Tipos de reações orgânicas Adição eletrófila 2.ª etapa: ataque do reagente eletrófilo (Br+) ao átomo de carbono. H2C = CH2 + Br+ Br H2C – C+ – H H carbocátion Tipos de reações orgânicas Adição eletrófila Perceba que esta 2.ª etapa é a determinante do tipo de reação, isto é, adição eletrófila. Tipos de reações orgânicas Adição eletrófila 3.ª etapa: ataque do reagente nucleófilo (Br-) ao átomo de carbocátion. Br H2C – C+ – H + BrH carbocátion Br Br H2C – CH2 Tipos de reações orgânicas Adição eletrófila Esta 3.ª etapa, embora seja nucleófila, não determina o tipo de adição. Tipos de reações orgânicas Adição eletrófila Lembremo-nos que para ser adição nucleófila é necessário que haja ataque de reagente nucleofílico na 2.ª etapa. Tipos de reações orgânicas Concluindo As reações de adição não são únicos tipos. Antes de abordar os demais, achamos oportuno, agora, realizar os exercícios propostos pelo professor. Tipos de reações orgânicas Concluindo Assim que estivermos seguros em relação à abordagem introdutória que ora estamos concluindo, retornaremos aos outros tipos de reações orgânicas e seus respectivos mecanismos. FIM!
Download