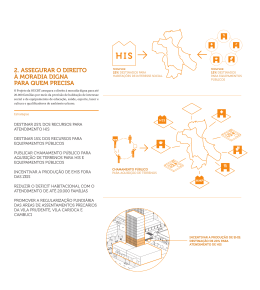
Estudos granulométricos e de ... 134 AVALIAÇÃO TEÓRICA DO PERFIL DE PROTONAÇÃO DA TRÍADE CATALÍTICA DA ACETILCOLINAESTERASE HUMANA E DE DROSOPHILA MELANOGASTER NAILTON MONTEIRO DO NASCIMENTO JÚNIOR1 CARLOS MAURICIO R. SANT’ANNA2 1. Bolsista de Iniciação Científica PIBIC/CNPq/UFRuralRJ, Discente do Curso de Química; 2. Professor do Departamento de Química, Instituto de Ciências Exatas,Universidade Federal Rural do Rio de Janeiro RESUMO: NASCIMENTO JÚNIOR, N. M., SANATANNA, C. M. R. Avaliação teórica do perfil de protonação da tríade catalítica da acetilcolinaesterase humana e de Drosophila melanogaster. Revista Universidade Rural: Série Ciências Exatas e da Terra, Seropédica, RJ: EDUR, v.23, n.1-2, p. 134-138, jan.- dez., 2004. Neste trabalho é apresentada a comparação do perfil de protonação das tríades catalíticas da acetilcolinaesterase humana e de Drosophila melanogaster na presença e na ausência de água, obtido por meio de cálculos de calor de formação com o método de orbital molecular semi-empírico. Não foi observada diferença significativa entre os modelos das duas enzimas. A importância do uso do modelo de solvente nos cálculos foi observada, pois houve modificação na ordem de estabilidade entre estados de protonação diferentes da tríade na presença e na ausência do solvente. Palavras chave: acetilcolinaesterase, hidrólise,semi-empírico. ABSTRACT: NASCIMENTO JÚNIOR, N. M., SANATANNA, C. M. R. Theoretical evaluation of the protonation profile in human and Drosophila melanogaster acetylcholinesterase catalytic triads. Revista Universidade Rural: Série Ciências Exatas e da Terra, Seropédica, RJ: EDUR, v.23, n.1-2, p. 134-138, jan.- dez., 2004. TThis work relates a comparison of the protonation profile of human and Drosophila melanogaster acetylcholinesterase in the presence and absence of water solvent, obtained with semiempirical molecular orbital calculations. No significant difference was observed between human and insect enzyme models. The importance of the solvent model during calculations was evidenced by a modification in the stability order of different protonation states of the catalytic triad. Key words: acetylcholinesterase, semiempirical, hydrolises. INTRODUÇÃO Desde as primeiras tentativas de cultivo de plantas e criação de animais, o homem tem se defrontado com a ação de pragas que reduzem a produtividade e a oferta de alimentos. Dos meios usados na busca do controle da ação de pragas, o uso de pesticidas é ainda o mais adequado para a produção em larga escala. A maior parte do mercado mundial de pesticidas pertence às classes químicas dos organofosforados e dos carbamatos [Casida e Quistad, 1998]. Os pesticidas destas classes agem por inibição da enzima acetilcolinaesterase (EC 3.1.1.7, AChE). A AChE catalisa a hidrólise do neurotransmissor acetilcolina (ACh), interrompendo a transmissão de impulsos nervosos nas sinapses dos neurônios colinérgicos do sistema nervoso. A principal unidade funcional da AChE é a chamada tríade catalítica, composta de um resíduo de serina (Ser203, na numeração da AChE humana), um de ácido glutâmico (Glu334) e um de histidina (His447). Na primeira etapa do mecanismo de hidrólise, His447 atua como uma base, desprotonando Ser203 e tornado-a mais nucleofílica frente à carbonila do substrato (Qian e Kovach, 1993), mas a função de Glu334 ainda não foi esclarecida. Glu334 pode atuar tanto por estabilização eletrostática, na forma de glutamato, da histidina protonada quanto como uma base, abstraindo o próton desse resíduo (Zhang et al., 2002). Após essa etapa de adição, o intermediário tetraédrico formado elimina o fragmento de colina e o resíduo Ser203 fica acetilado; o grupo acetil é eliminado na forma de ácido acético em uma segunda Rev. Univ. Rural, Sér. Ci. Exatas e da Terra. Seropédica, RJ, EDUR, v. 23, n. 1-2, jan.- dez., 2004. p. 134-138. Amaral Júnior, A. F., et al. etapa do mecanismo, liberando o resíduo de serina para reiniciar o processo. Tanto os organofosforados quanto os carbamatos são análogos do substrato natural, mas ligam-se de modo essencialmente irreversível ao resíduo de serina da tríade, inativando-a. Devido aos danos que os organofosforados e carbamatos causam à saúde humana, vem se buscando compostos que sejam mais seletivos contra as pragas e mais seguros para o homem. O objetivo do presente projeto é propor novos protótipos de pesticidas, mais ativos e com maior seletividade para as espécies alvo, usando a aproximação do planejamento racional de ligantes bioativos. Esta aproximação consiste no estudo por métodos de modelagem molecular do mecanismo de interação entre os pesticidas com seu alvo bioquímico. Como etapa prévia na busca deste objetivo, apresentamos neste trabalho um estudo preliminar com a comparação do perfil de protonação das tríades catalíticas da AChE humana (HuAChE) e de um inseto, D. melanogaster (DmAChE), obtido por meio de cálculos de calor de formação com o método quântico semi-empírico PM3 (Stewart, 1989). 135 o de ácido glutâmico na forma desprotonada (sistema 1, fig. 1). As coordenadas internas dos átomos das ligações peptídicas foram mantidas fixas para se evitar deslocamentos entre os aminoácidos durante a otimização das estruturas. Com o programa Mopac 2002 (Stewart, 2002), foram realizados cálculos com o método semi-empírico PM3 (Stewart, 1989) da transferência de próton entre os aminoácidos. A influência de água foi avaliada com o método COSMO, que considera o sistema molecular imerso em um contínuo com constante dielétrica igual a da água. O H NH N O O Ser Glu His Sistema 1 O H N N H O O Ser Sistema 2 O Glu His HN O N O H Ser Glu Sistema 3 His MATERIAL E MÉTODOS Foram utilizadas duas estruturas cristalográficas depositadas no Protein Data Bank, 1QO92 para DmAChE e1B411 para a HuAChE . Selecionamos com o programa Rasmol 2.7.2.1 (Sayler) os resíduos Ser203, His447 e Glu334 para HuAChE e Ser238, His480 e Glu367 para DmAChE. Esses arquivos foram convertidos em arquivos de entrada para os cálculos semi-empíricos com o programa Babel 1.6 (Walters e Stahl, 1996), com adição de átomos de hidrogênio, considerando-se inicialmente os resíduos de serina e de histidina no estado neutro e Figura 1. Mecanismo de transferência de próton avaliado neste trabalho. Variou-se o comprimento da ligação OH da serina com passos de 0,1 Å até que o próton fosse transferido para o Ng da histidina (sistema 2, fig. 1). O mesmo foi feito com a ligação Ne-H da histidina até que o próton se ligasse ao glutamato (sistema 3, fig. 1). Os três sistemas foram reotimizados até um gradiente menor do que 0,1 kcal/( Å ou rad). Rev. Univ. Rural, Sér. Ci. Exatas e da Terra. Seropédica, RJ, EDUR, v. 23, n. 1-2, jan.- dez., 2004. p.134-138. Estudos granulométricos e de ... 136 RESULTADOS E DISCUSSÃO HuAChE DmAChE -365 -370 ∆Hf (kcal/mol) Nas figuras 2 e 3 são apresentados os perfis calculados da entalpia da transferência de próton na ausência de solvente e, nas figuras 4 e 5, na presença de água. -375 -380 -385 -390 -240 1,6 1,4 1,2 1,0 Distância H(Ser)----N(His) Angstrom Figura 4. Perfil de ∆H f para a transferência de próton entre a Ser e a His, em água. -245 -250 ∆Hf (kcal/mol) 1,8 HuAChE DmAChE -255 -260 -265 HuAChE DmAChE -270 -350 -275 -355 -280 1,8 1,6 1,4 1,2 1,0 ∆Hf (kcal/mol) Distância H(Ser)----N(His) Angstrom Figura 2. Perfil de ∆Hf para a transferência de próton entre a Ser e His. -360 -365 -370 -375 -380 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Distância N(His)----H(His) Angstrom HuAChE DmAChE -238 Figura 5. Perfil de ∆Hf para a transferência de próton entre His e Glu, em água. -240 -242 Os valores de ∆Hf para os sistemas reotimizados estão apresentados nas Tabelas 1 (sem solvente) e 2 (em água). ∆Hf (kcal/mol) -244 -246 -248 -250 -252 -254 -256 -258 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Tabela 1. Cálculos para os três estados de protonação referentes a AChE sem a presença de solvente. Distância N(His)----H(His) Angstrom Figura 3. Perfil de DH f para a transferência de próton entre His e o Glu. ∆Hf (kcal/mol) Sistema HuAChE DmAChE 1 -274,2 -276,3 2 -246,2 -247,1 3 -256,0 -254,8 Rev. Univ. Rural, Sér. Ci. Exatas e da Terra. Seropédica, RJ, EDUR, v. 23, n. 1-2, jan.- dez., 2004. p. 134-138. Amaral Júnior, A. F., et al. 137 Tabela 2. Cálculos para os três estados de protonaçâo referentes a AchE com a presença de solvente . aminoácidos dos sítio ativo da AChE no atual modelo. Estudos envolvendo estes aminoácidos estão em andamento. ∆Hf (kcal/mol) Sistema HuAChE DmAChE 1 -386,6 -386,4 2 -375,9 -374,5 3 -368,6 -367,9 REFERÊNCIAS BIBLIOGRÁFICAS 1 CASIDA, J. E.; QUISTAD, G. B. Golden age of insecticide research: Past, present and future. Ann. Rev. Entomol., v. 43, p. 116, 1998. 2 Pode ser observado que a transferência do hidrogênio de Ser para o nitrogênio de His é um processo endotérmico tanto para a enzima humana como para a de D. melanogaster . Na presença de solvente, o processo continuou sendo endotérmico, porém houve uma significativa queda nos valores de entalpia, o que se deve à estabilização das cargas no sistema 2 pelo dielétrico. Na transferência do próton de His para Glu o processo foi exotérmico para HuAChE e para DmAChE na ausência e endotérmico na presença de solvente. CONCLUSÃO O estado entalpicamente mais estável da tríade catalítica previsto é com a serina protonada (sistema 1). Os resultados mostram que a presença do modelo do solvente altera significativamente os valores de entalpia calculados, o que deve estar associado à diferença na distribuição de carga entre os 3 estados da tríade catalítica. Na presença do solvente, o modelo não prevê a transferência do próton entre His e Glu como favorável, o oposto do observado na ausência do solvente. Não foi obsevada uma mudança significativa quanto ao perfil de protonação na comparação entre a tríade catalítica de HuAChE e de DmAChE, mas isso pode ser resultado da ausência dos demais QUIAN, N. F.; KOVACH, I. M. Key activesite residues in the inhibition of acetylcholinesterase by Soman. Febs Letters, v. 336, p. 263-266, 1993. 3 ZHANG, Y.; KUA, J.; MCCAMMON, J. A. Role of the catalytic triad and oxyanion hole in the acetylcholinesterase catalysis: An ab initio QM/MM study. J. Am. Chem. Soc., v. 124, p. 10572-10577, 2002. 4 HAREL, M.; KRYGER, G.; ROSENBERRY, T. L.; MALLENDER, W. D.; LEWIS, T.; FLETCHER, R. J.; J. M. GUSS, I.SILMAN, J. L.SUSSMAN. Threedimensional structures of Drosophila melanogaster acetylcholinesterase and of its complexes with two potent inhibitors. Protein Sci. V. 9, p. 1063-1072, 2000 5 KRYGER, G., HAREL, M., GILES, K., TOKER, L., VELAN, B., LAZAR, A., KRONMAN, C., BARAK, D., ARIEL, N., SHAFFERMAN, A., SILMAN, I., SUSSMAN, J. L.: Structures of Recombinant Native and E202Q Mutant Human Acetylcholinesterase Complexed with the Snake-Venom Toxin Fasciculin-II. Acta Crystallogr., Sect.D, v. 56, p. 13851394, 2000. 6 SAYLE, R., Glaxo Wellcome Research and Development, Stevenage, Hertfordshire, UK, 1993. 7 WALTERS, P.; STAHL, M., University of Rev. Univ. Rural, Sér. Ci. Exatas e da Terra. Seropédica, RJ, EDUR, v. 23, n. 1-2, jan.- dez., 2004. p.134-138. Estudos granulométricos e de ... 138 Arizona, Arizona, USA, 1996 8 STEWART, J. J. P., Fujitsu Ltd, Japão, 2002. 9 STEWART, J. J. P., Optimization of parameters for semiempirical methods. J. Comp. Chem., v. 10, p. 209-220, 1989. Rev. Univ. Rural, Sér. Ci. Exatas e da Terra. Seropédica, RJ, EDUR, v. 23, n. 1-2, jan.- dez., 2004. p. 134-138.
Baixar