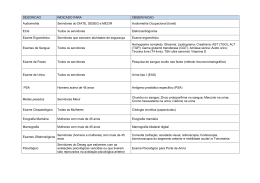
FACULDADE TECSOMA Curso de Bacharelado em Biomedicina Patrícia Cristina Nunes Pereira IDENTIFICAÇÃO LABORATORIAL DE Escherichia coli COMO AGENTE CAUSADOR ETIOLÓGICO DE INFECÇÃO DO TRATO URINÁRIO Revisão Bibliográfica Paracatu-MG 2012 Patrícia Cristina Nunes Pereira IDENTIFICAÇÃO LABORATORIAL DE Escherichia coli COMO AGENTE CAUSADOR ETIOLÓGICO DE INFECÇÃO DO TRATO URINÁRIO Revisão Bibliográfica Monografia apresentada ao Curso de Biomedicina da Faculdade Tecsoma, como requisito parcial para a obtenção do título de bacharel em Biomedicina. Orientação metodológica: Geraldo B. B. de Oliveira Orientação temática: Márdem Mattos Paracatu-MG 2012 Pereira, Patrícia Cristina Nunes, Identificação laboratorial de Escherichia coli como agente etiológico de infecções do trato urinário: Revisão Bibliográfica/ Patrícia Cristina Nunes Pereira. Paracatu, 2012. 00f Orientador: Márdem Mattos. Trabalho de Conclusão de Curso (graduação) – Faculdade Tecsoma. Curso de Biomedicina. 1.Escherichia coli. 2. Infecções do Trato Urinário 3.Identificação I. Silva, Cláudia Peres Silva. II. Faculdade Tecsoma. Curso de Biomedicina. III. Título. CDU: 579.61 Patrícia Cristina Nunes Pereira IDENTIFICAÇÃO LABORATORIAL DE Escherichia coli COMO AGENTE CAUSADOR ETIOLÓGICO DE INFECÇÃO DO TRATO URINÁRIO Revisão Bibliográfica Monografia apresentada à disciplina de Trabalho de Conclusão de Curso II da Faculdade Tecsoma como requisito para obtenção do título de Bacharel em Biomedicina. _______________________________________________ Márdem Mattos Orientadora Temático _______________________________________________ Geraldo Benedito Batista de Oliveira Orientador Metodológico _______________________________________________ Mestre Cláudia Peres Silva Coordenadora do Curso de Biomedicina Paracatu, 06 de Julho de 2012 AGRADECIMENTOS Agradeço primeiramente a Deus por me dar força e energia para que eu consiga viver cada dia. Aos meus pais, Sebastião Valadão e Joana Pereira, por lutarem sempre ao meu lado como também os meus irmãos João H. Nunes e Fernando Nunes. Um obrigada muito grande ao meus queridos professores da faculdade, por terem paciência comigo e por passarem conhecimentos e valores inestimáveis que levarei por toda minha vida. Com um carinho maior aos professores Rita de Cassia Medeiros, Flavio Simplicio,Hélica Macedo, Talita Faria e Stela Melo, esses que, tenho certeza que tiveram que ter muita paciência comigo. Agradeço aos meus velhos companheiros e aos meus novos amigos por todos os momentos vividos, tanto bons como ruins. Em especial ao Alison Borges, Douglas G. Pereira, a Cintia B. Sousa e ao Wanderson Guimarães, este que mesmo não estando mais entre nós, me da força de alguma forma todos os dias. Não tem como esquecer um grande amigo que me ajudou em muitos momentos de dificuldade, que sempre esteve lá quando precisei, por isso é que declaro o meu amor: Te amo Google. Muito obrigada a todos que fazem parte da minha vida, e tenha certeza que levarei todos os momentos, as lembranças com muito carinho dentro do coração! Prefiro andar com os loucos do que com os falsos. (Autor desconhecido). RESUMO As Infecções do Trato Urinário (ITU) são definidas pela colonização do trato urinário humano por algum tipo de agente etiológico, na maioria das vezes bactérias. Dentre estas, destaca-se como principal bactéria isolada desse sítio anatômico Escherichia coli. O diagnóstico laboratorial destas infecções pode ser realizado por uma variedade enorme de metodologias, sendo que os meios de cultura são os mais empregados na rotina. Para a realização deste estudo analítico-descritivo selecionou-se diversos livros acadêmicos sobre o tema e artigos científicos publicados em meios eletrônicos públicos. Pelo levantamento desses dados, possibilitou-se verificar que as infecções são indicadas inicialmente pela análise de amostras de urina, por meio dos exames físico, químico e da análise microscópica do sedimento urinário. Após isso, empregase outras formas diagnósticas, como os meios de culturas. Sugere-se levar em consideração os seguintes aspectos antes da escolha do meio: facilidade de aquisição dos meios, custo, tamanho da demanda para este tipo de exame, presença de postos de coleta remotos. Acredita-se que a utilização de meios combinados é uma opção que permite uma melhor distinção dos possíveis uropatógenos e também dos contaminantes. PALAVRAS-CHAVE: Escherichia coli.ITU. Identificação. ABSTRACT The Urinary Tract Infections (UTI) are defined by the human urinary tract colonization by some type of etiologic agent, most often bacteria. Among these, stands out as the main bacteria isolated anatomical site of Escherichia coli. Laboratory diagnosis of these infections may be accomplished by a wide variety of methods, and the culture media are the most widely used in routine. To carry out this analytical-descriptive study was selected several books on the subject of academic and scientific articles published in electronic media audiences. From these survey data, allowed to verify that the infections are indicated initially by the analysis of urine samples by means of physical examination, chemical and microscopic analysis of urine sediment. After this, is employed other diagnostic, such as culture media. It is suggested to consider the following before selecting from among: ease of acquisition of resources, cost, size of the demand for this type of examination, presence of remote collection stations. It is believed that the use of combination means an option allowing a better distinction of uropathogens and also possible contamination. KEYWORDS: Escherichia coli. ITU. Identification. LISTA DE SIGLAS ITU – Infecção do Trato Urinário pH – potencial hidrogeniônico E. coli – Escherichia coli Bfp - bundle-forming LISTA DE FIGURAS Figura 01 – Patogênese de ITU provocada por E. coli uropatogênica..............15 Figura 02 – Variantes da coloração urinária e causas mais freqüentes..........23 Figura 03 - Escherichia coli sobre ágar de MacConkey com Colônia de pigmento rosa é devido à lactose fermentação.................................................42 Figura 04 - E. coli ágar sangue..........................................................................43 Figura 05 – E. coli em ágar CLED.....................................................................44 Figura 06 – Meio ágar EMB com E. coli............................................................47 SUMÁRIO 1 INTRODUÇÃO................................................................................................11 1.1 Justificativa................................................................................................15 2 OBJETIVOS...................................................................................................17 2.1 Geral............................................................................................................17 2.2 Específicos.................................................................................................17 3 MATERIAIS E MÉTODOS.............................................................................18 3.1 Delineamento do estudo...........................................................................18 3.2 Fonte de dados..........................................................................................18 3.3 Critérios de inclusão e exclusão..............................................................18 3.4 Desenvolvimento do Estudo.....................................................................19 3.4.1 Fluxo dos artigos....................................................................................19 3.4.2 Construção do texto...............................................................................19 4 EXAME DE URINA TIPO I OU ROTINA DE URINA – URINÁLISE..............20 4.1 Coleta de amostra urinária........................................................................20 4.2 Exame físico...............................................................................................22 4.3 Exame químico...........................................................................................25 4.4 Análise microscópica do sedimento urinário.........................................29 5 URUCULTURA...............................................................................................39 5.1 Histórico.....................................................................................................39 5.2 Definição.....................................................................................................39 5.3 Classificações............................................................................................39 5.4 Cultura de urina ou urocultura.................................................................40 5.5 Diagnostico laboratorial da Escherichia coli..........................................47 CONCLUSÃO....................................................................................................51 REFERÊNCIAS BIBLIOGRÁFICAS.................................................................52 10 1 INTRODUÇÃO A Infecção do Trato Urinário (ITU) é uma doença multifatorial de grande incidência em todo o mundo e está entre as infecções mais comumente encontradas na prática médica. Pode ser considerada a segunda infecção que mais afeta o indivíduo, levando em consideração o estado gripal como a infecção mais frequente, onde elas representam aproximadamente 150 milhões de casos por ano em todo o mundo. (HENRY, 2008; SILVA, 2008). O trato urinário é usualmente um ambiente estéril, excetuando-se a uretra distal que apresenta, naturalmente, microrganismos residentes. A manutenção deste ambiente ocorre devido à presença de uma serie de mecanismos que atuam na prevenção das ITU. As propriedades antibacterianas da urina, como a alta osmolaridade, baixo potencial hidrogeniônico (pH), presença de ácidos orgânicos e concentração de ureia, além do fluxo e produção constantes, os quais possibilitam a eliminação mecânica de microrganismos, são alguns destes. Devem ser consideradas ainda as barreiras de defesa das mucosas e a imunocompetência sistêmica do hospedeiro. (BARSANTI, 1998; BARTGES, 2004; BLANCO e BARTGES, 2001). Para Martine e outros (2011), a ITU é caracterizada pela presença de microrganismos na maioria das vezes bactérias, que se replicam no trato urinário, podendo ser uma doença sintomática ou assintomática, acometendo pessoas de qualquer faixa etária, hospitalizada ou não; com dois fatores concomitantes: a ruptura nos mecanismos de defesa do organismo e a presença de um número suficiente de microrganismos virulentos capaz de aderir, multiplicar e persistir em uma porção do trato urinário. (BATGES, 2004). As infecções do trato urinário podem ser complicadas ou não complicadas, sendo que as não complicadas como as cistites, tendem ao maior risco de falha terapêutica, sendo associadas a fatores que favorecem a ocorrência da infecção. Já a infecção urinária complicada como as pielonefrites, ocorre quando o aparelho urinário possui alterações estruturais ou funcionais. Tanto a infecção urinária baixa como a alta podem ser agudas ou crônicas e sua origem pode ser oriunda da comunidade ou hospitalar. (SILVA, 2008). 11 Durante a infância, o quadro clínico apresenta-se inespecífico, o que dificulta o diagnostico. A manifestação mais comum é a febre e os sinais de localização da infecção como dor hipogástrica, disúria, policiúria, retenção urinária, mas que não aparecem antes dos 3 a 4 anos de vida. (MACHADO et al, 1995). As mulheres apresentam maior suscetibilidade às ITUs devido às condições anatômicas, como a uretra mais curta e maior proximidade da vagina com o ânus. Fatores como gestações, diabetes, higiene deficiente, pacientes que tiveram episódios breves de cistite, pacientes com condições socioeconômicas baixas e obesidade podem favorecer o surgimento. (SILVA, 2008; MARTINE et al, 2011). Nos indivíduos adultos do sexo masculino, fatores que podem favorecer as ITUs são o uso de instrumentos nas vias urinarias, como o cateterismo vesical, sendo elevadas as taxas de infecções urinarias em idosos e em pacientes hospitalizados. Em homossexuais existe uma alta taxa, pelo fato da realização de pratica sexual não protegida. (SILVA, 2008). Nas infecções urinarias agudas sintomáticas existe uma nítida predominância de Escherichia coli, respondendo por quase 75% dos casos das ITU, enquanto nas infecções crônicas ou adquiridas em ambientes hospitalar ou relacionadas com anomalias estruturais do trato urinário existe uma incidência mais equitativa das diferentes enterobactérias, com o aumento da prevalência de infecções causadas por Klebsiella sp., Proteus sp., Pseudomanas sp., Enterobacter sp., e por gram-positivos, como Enterococos e Staphylococcus. (BARSANTI,1998; MARTINI et al, 2011). Desde a sua descoberta, no final do século XIX pelo pediatra Theodor Escherich, a Escherichia coli tornou-se o organismo mais bem estudado, tanto pelo seu papel como “modelo” em estudos de biologia molecular, mas também por sua versatilidade como patógeno, ocasionado infecções nas mais variados sítios anatômicos. (HACKER; BLUM-OEHLER, 2007). O Escherichia coli (abrevia-se E. coli) é um grupo grande e diverso de bactérias do bacilo Gram negativo, anaeróbio facultativo, fermentadores e oxidase negativo, sendo o gênero mais comum e importante da família Escherichia. MARCO ANTONIO FRANCO) Atlas de Parasitologia Humana 2ª/2012 É o principal organismo anaeróbio facultativo presente no trato 12 intestinal da maioria das espécies de animais de sangue quente, na proporção de 107 a 109 microrganismos por grama de fezes. (GYLES; FAIRBROTHER, 2004). Embora a maioria das variedades de Escherichia coli seja inofensivas, outras podem provocar doenças. Alguns tipos de Escherichia coli podem causar diarreia, enquanto outros provocam infecção urinária, doença respiratória, pneumonia e outras doenças. Há ainda outros tipos de Escherichia coli que são usados como marcadores de contaminação na água. (MURRAY et al, 2009). A E. coli está presente em grande numero no trato gastrointestinal, podendo se tornar uma bactéria oportunista. É uma das bactérias mais relacionadas com doenças gastrointestinais e extra-intestinais porque possuem fatores de virulência específicos codificados nos plasmídeos, no DNA de bacteriófagos ou nas ilhas de patogeniciadade. É responsável por 80% das infecções do trato urinário adquiridas na comunidade, sendo que, na maioria das infecções com exceção da gastroenterite e meningite neonatal, é endógena, isto é, a bactéria faz parte da microbiota normal do paciente, sendo capaz de causar infecção quando a defesa do organismo do individuo estão comprometidas. (MURRAY et al, 2009; HENRY, 2008). A classificação tradicional de amostras de E. coli baseia-se na determinação de antígenos somáticos, polissacarídeos capsulares e flagelares, permitindo a diferenciação entre as amostras patogênicas das comensais. Assim as patogênicas possuem fatores de virulência específicos, podendo ser separados em duas categorias principais: as adesinas e as exotoxinas. (GYLES; FAIRBROTHER, 2004). A adesina é uma organela filamentosa denominada pili ou fímbrias, ou moléculas monoméricas ou multiméricas ancoradas na parede celular bacteriana, capaz de permanecer no trato urinário ou gastrointestinal conseguindo aderir às células desses locais evitando a eliminação pela ação de descarga da micção ou da motilidade intestinal. Cepas de e. coli possuem diversas adesinas altamente especializadas. Estas incluem antígenos de fatores de colonização, fimbrias de adesão agregativa, bundle- formingpili(bfp),intimina, pili P(que também se liga a antígenos do grupo 13 sanguíneo P) e fimbrias Dr (que se ligam a antígenos do grupo sanguíneo Dr). (MURRAY et al, 2009). Existem evidencias que algumas adesinas atuam como uma invasiva, toxina que impede a divisão celular sem interferir na replicação do ácido nucléico formando células dez vezes maiores e com vários núcleos. Sua interação com receptores da membrana do hospedeiro desencadeariam vários sinais, entre eles o rearranjo do citoesqueleto da célula eucariótica, que culminaria com a internalização da bactéria. (BOWER; ETO; MULVEY, 2005). As exotoxinas (lipopolissacarídeo) é um componente essencial e característico da membrana externa das bactérias Gram-negativas, responsável por diversos efeitos biológicos, incluindo inflamação e a resistência ao soro. Estas incluem as toxinas Shiga (Stxi-1 e Stx-2), toxinas termoestáveis (Sta e Stb) e toxinas termo lábeis (Lt-1 e Lt2). Além disso hemolisinas (HlyA) são consideradas importantes na patogênese da doença causada por e coliuropatogênica. (MURRAY et al, 2009). Os bacilos Gram negativos E. coli que causam ITU habitam normalmente o cólon, que contaminam a uretra e ascende até a bexiga, podendo chegar até os rins ou próstata, como mostra o esquema da figura 1. A adesão se faz pelas adesinas que são capazes de se ligarem as células que revestem a bexiga e o trato superior, sendo que, essa aderência faz com que esse microrganismo não seja eliminado durante a micção, e produzem a hemolisina HlyA, que lisa as hemácias e outros tipos celulares fazendo, assim liberando citosinas e estimulando uma resposta inflamatória (Figura 01). (MURRAY et al, 2009). 14 Figura 01 – Patogênese de ITU provocada por E. coli uropatogênica Fonte: MURRAY et al, 2009. 1.1 Justificativa Para a realização da urocultura nos laboratórios, emprega-se a metodologia que consistena inoculação da urina em meiosde cultura já consagrados como oÁgar CLED (cistina - lactose – eletrólito- deficiente), Ágar sanguee MacConkey (meio seletivo parabacilos gram negativos), tendo posteriormente sua identificação bacteriana baseadaem provas bioquímicas. Esse processo leva no mínimo48 horas para identificar o patógenoe realizar o antibiograma.Em alguns casos, para a identificação do patógeno, requer a utilização de provas adicionais para confirmação do uropatógeno, assim demorando até 72 horas para a identificação e liberação do laudo. (OLIVEIRA et al, 2006; HÖRNER et al, 2011). Atualmente, para a realização da urocultura, existe uma novametodologia, utilizando meios cromogênicos, que permitema identificação 15 direta dos principais patógenos causadores de ITUs (Escherichia coli, Proteusmirabilis e Enterococcusspp.) em um período de 24 horas após incubação. (OLIVEIRA et al, 2006). A identificação presuntiva dos meios cromogênicosébaseada nas diferentes colorações que colônias bacterianas produzem no meio, que são causadas pelas reações enzimáticas que, espécieou gênero específico comsubstratos incorporados no meiode cultura, necessitando apenasde poucas provas adicionais confirmatórias. Por exemplo, no meio cromogênico, a E.coliproduz uma enzima chamada deß-glucuronidase, além de ser negativopara ß-glucosidase. A coloraçãorosa que é formada, já é suficiente para asua confirmação, sem necessidadede nenhuma prova adicional. (OLIVEIRA et al, 2006). Pelo o que foi destacado acima, a realização de levantamento bibliográfico acerca de tal assunto propiciará aos analistas clínicos conhecer as características dos diferentes meios disponíveis para a identificação laboratorial de Escherichia coli, o que, teoricamente, facilitará a escolha do método mais preciso e rápido, o que contribui diretamente no controle e/ou erradicação de Infecção do Trato Urinário. 16 2 OBJETIVOS 2.1 Geral Realizar levantamento bibliográfico sobre os métodos de diagnostico das Infecções do Trato Urinário provocadas por Escherichia Coli. 2.2 Específicos Caracterizar Infecção do Trato Urinário. Analisar os métodos disponíveis para o diagnóstico das ITU provocadas por Escherichia Coli Caracterizar bioquimicamente os diferentes meios disponíveis para a identificação laboratorial de Escherichia Coli causadora de ITU. Identificar as vantagens e desvantagens de cada metodologia empregada para detecção de ITUs. Comparar os resultados disponíveis na literatura médica. Divulgar os resultados obtidos pela pesquisa sob a forma de monografia a fim de se obter o título de Bacharel em Biomedicina pela Faculdade Tecsoma. 17 3 MATERIAIS E MÉTODOS 3.1 Delineamento do estudo Trata-se de um estudo analítico-descritivo, retrospectivo, não amostral. Para Pereira (1995), as investigações epidemiológicas, de cunho descritivo, têm a finalidade de informar sobre a distribuição de um evento, na população, em termos quantitativos. “O termo ‘retrospectivo’ tem a conotação de utilização de dados do passado”. Quanto à abordagem, a combinação dos métodos quantitativo e qualitativo produz a triangulação metodológica, que, numa relação entre contrários complementares, busca a aproximação do positivismo e do compreensivismo. Assim, a triangulação é uma tática de pesquisa que contribui para alargar o conhecimento sobre determinado tema, alcançar os objetivos traçados, observar e compreender a realidade estudada. (BRUGGEMANN; PARPINELLI, 2007). 3.2 Fonte de dados Os artigos selecionados para a efetuação do presente trabalho foram pesquisados em revistas eletrônicas públicas, a saber: SCIELO e PUBMED. A seleção dos artigos obedecerá à busca pelos seguintes descritores: INFECÇÃO DO TRATO URINARIO – Escherichia coli – IDENTIFICAÇÃO. 3.3 Critérios de inclusão e exclusão Para a seleção dos artigos, serão adotados como critérios de inclusão: Artigos científicos publicados em revistas eletrônicas públicas; Seleção que obedecer aos descritores pré-definidos; Os critérios de exclusão serão: Artigos científicos publicados em período inferior ao ano de 2000; Estudos que não obedecerem à pesquisa através dos descritores. 18 3.4 Desenvolvimento do Estudo A opção por realizar este estudo se dá pela necessidade deconhecer a prevalência de ITU por Escherichia coli diagnosticadas por diferentes metodologias. Surgiu, então, a necessidade de realizar levantamento bibliográfico acerca do assunto para verificartais diferenças, a fim de torná-los públicos e instigar os profissionais envolvidos em análises clínicas a selecionarem meios mais seguros para a identificação de tal microrganismo. 3.4.1 Fluxo dos artigos Os artigos selecionados para a elaboração do trabalho serão provenientes de revistas eletrônicas públicas. Sendo assim, serão feitas visitas aos mesmos, respeitando os critérios de inclusão e exclusão. 3.4.2 Construção do texto Após a seleção e leitura acurada dos artigos, dar-se-á atenção à construção do texto final. Para a consolidação dos objetivos do estudo, o corpo do texto será elaborado conforme os seguintes itens: 1. Epidemiologia das Infecções do Trato Urinário por Escherichia coli. 2. Caracterização dos meios disponíveis para a identificação laboratorial de Escherichia coli. 3. Comparação da eficácia entre os meios disponíveis para a identificação laboratorial de Escherichia coli. 19 4 EXAME DE URINA TIPO I OU ROTINA DE URINA - URINÁLISE O exame de urina ou urinálise ou uranálise é o teste que determina o conteúdo da urina a qual remove as toxinas e o excesso de líquido do corpo, os quais podem possuir importantes informações. A urInálise pode ser usada para diagnosticar alguns tipos de doenças, particularmente, distúrbios metabólicos e doenças dos rins. (STRASINGER; DI LORENZO, 2009). Esse exame fornece uma ampla variedade de informações úteis no que concernem as doenças envolvendo os rins e o trato urinário inferior, foi introduzida na pratica em Paris no ano de 1837 por François Rayer e Eugene N Vigla, passando pra fase microscopia em 1982 por Fairley e Birch. Pode ser utilizado para avaliação diagnóstica de distúrbios funcionais e estruturais dos rins e trato urinário inferior, bem como para acompanhamento e obtenção de informações prognósticas. (HENRY, 2008). A urinálise corresponde ao exame físico, químico e microscópico da urina, onde para se realizar uma interpretação semiológica correta, torna indispensável uma coleta que ofereça amostra representativa, obedecendo a uma série de preceitos com colheita, conservação e transporte de material.(STRASINGER; DI LORENZO, 2009). 4.1 Coleta da amostra urinaria Na colheita o ideal é o jato intermediário, porem em casos especiais pode se indicar cateterismo uretral ou punção vesical suprapúbica. (KONEMAN et al, 2010). A urina do jato médio é a amostra mais representativa da bexiga, sendo o método mais utilizado para obtenção da amostra para a realização da urinálise e urocultura. A coleta deve ser instruída por um profissional habilitado, e sua coleta deve, preferencialmente, ocorrer no laboratório para minimizar os riscos de contaminação da amostra. O primeiro jato é desprezado, pois este ajuda a eliminar os contaminantes presentes na uretra e intróito vaginal. (CARVALHAL; ROCHA; MONTI, 2006). Em mulheres, primeiramente, é feita uma higienização com água e sabão na vulva e meato uretral. Na hora da coleta, os grandes lábios são 20 afastados. Nos homens, retrai-se o prepúcio, fazendo assim a higiene da glande. Em pacientes que apresentam neuropatias e em crianças, como é difícil a obtenção da amostra adequada do jato médio através da micção espontânea, utiliza-se o saco coletor aderido à pele, o que pode causar contaminação, o cateterismo uretral ou a punção suprapúbica. O resultado obtido por esse método de coleta deve ser valorizado quando se apresentar negativo, pois exclui uma infecção do trato urinário do que propriamente para o seu diagnostico. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). A utilização de cateter para obtenção da urina em pacientes do sexo masculino geralmente é desnecessária, pois, apresenta menor risco de contaminação na coleta da amostra pelo jato médio. Já em alguns pacientes do sexo feminino, a coleta por cateterismo uretral estéril pode ser desejável. Realizar uma antissepsia no intróito vaginal e meato uretral se faz importante, além de desprezar o primeiro jato de urina colhida. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). Esse tipo de coleta pode apresentar riscos, como introduzir germes no trato urinário e de contaminação da urina potencialmente estéril. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010; STRASINGER; DI LORENZO, 2009). A punção suprapúbica faz necessária em algumas situações clinicas. Em crianças pequenas e neonatos, como é difícil a obtenção de amostra de urina segundo as técnicas atuais, pois as crianças não têm momento certo para urinar. Em pacientes imunossuprimidos, que, a introdução de microrganismos podem gerar novas infecções, está técnica se torna adequada. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010; STRASINGER; DI LORENZO, 2009). Deve-se realizar a antissepsia da pela antes da coleta. A bexiga deve-se encontrar cheia antes da punção, o que pode ser feita pela ingestão de liquidos, ou hidratação parenteral no caso se o paciente estiver recebendo soro intravenoso, ou mesmo uso de diuréticos em alguns casos. Geralmente, a punção é realizada na linha media entre a sínfise púbica e a cicatriz umbilical, onde pelo toque dá para sentir a bexiga. Aplica-se anestesia ao nível da pele. Em crianças pequenas, a bexiga é mais facilmente acessível devido a sua 21 posição abdominal. Já em adultos, muitas vezes utiliza-se agulhas mais longas, como as utilizadas em punção lombar pois a bexiga deve-se encontrar distendida. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010; STRASINGER; DI LORENZO, 2009). Coleta-se geralmente, 15 ml de urina para a urinálise e 5 ml de urina para a cultura. Como a urina retirada da bexiga se encontra estéril, qualquer achado de microrganismos pode indicar uma infecção do trato urinário. (CARVALHAL; ROCHA; MONTI, 2006). 4.2 Exame físico A urinálise corresponde ao exame físico que analisa o volume, a cor, o aspecto e a densidade; químico focado ao pH, as proteínas, a glicose, as cetonas, a bilirrubina, o sangue, o urobilinogênio, os nitritos e os leucócitos; e o microscópico com exame qualitativo e quantitativo do sedimento urinário. (CARVALHAL; ROCHA; MONTI, 2006). A cor da urina pode variar de tonalidades, desde incolor à preta, sendo que essas variações podem ocorrer de funções metabólicas normais, atividade física, ingestão de substancias ou condições patológicas (Figura 02). 22 Figura 02 – Variantes da coloração urinária e causas mais frequentes COR CAUSA MAIS FREQÜENTE Amarela Urocromo, urobilina e uroeritrina. Amarelo Pálido Urina muito diluída Amarelo Âmbar Urina muito concentrada. Marrom Presença de bilirrubina ou biliverdina em grande quantidade. Produtos resultantes da oxidação de hemoglobina e mioglobina, metronidazol, porfirinas. Laranja Excreção de urobilina em grande quantidade ou presença de fenazopirimidima (Pyridium), nitrofurantoína, riboflavina, corantes de alimentos. Rosa Presença de sangue, uratos, porfirinas. Vermelho opaco Presença de sangue (hemácias) em grande quantidade, porfirinas. Vermelho Hemoglobina livre, fenotiazina, antraquinona, brilhante fenolftaleína ingestão de beterraba, ingestão de amoras (betacianina). Vermelho Mioglobina escuro/marrom Vermelho Porfirinas, corantes de alimentos, aminopirina, metildopa, escuro/púrpura fenotiazina. Verde/azul Azul de metileno, biliverdina, pseudômonas (piocianina), indometacina, síndrome da infusão de porfobol. Preta Ácido homogentísico, melanina, mioglobina, porfirinas, bilirrubina, fenol, cloroquina, levodopa, metronidazol, metildopa, hidroquinona. Púrpura Sulfato de Indoxil (Klebsiella, Providencia), ingestão de beterraba, ingestão de amoras (betacianina). Branca Lipúria, leucocitúria intensa, fosfatúria. Fonte: STRASINGER e DI LORINZO, 2009. 23 Para descrever a cor normal da urina pode variar de laboratório para laboratório, mas deve ser consistente dentro do laboratório. As descrições mais comuns são amarelo-clara, amarela, amarelo-escura e âmbar. A cor amarela da urina é devido a um pigmento, o urocromo que é um produto do metabolismo endógeno, que, em condições normais, o corpo o produz em taxa constante e sua quantidade depende do estado metabólico do corpo. Os pigmentos uroeritrina e urobilina também são encontradas na urina em quantidades menores, contribuindo pouco para a cor normal da urina. (STRASINGER; DI LORENZO, 2009). A urina pode apresentar cor anormal, como amarela escura/âmbar/laranja, que pode ser causada pela presença anormal de pigmento de bilirrubina. Quando a urina se apresenta vermelha/rósea/marrom, pode indicar presença de sangue na urina. (STRASINGER; DI LORENZO, 2009). Os rins tem a capacidade de reabsorver seletivamente substancias químicas essenciais para o corpo e água do filtrado glomerular, assim sendo uma das funções mais importantes do corpo. A gravidade especifica da urina é uma densidade de substancia químicas na urina, e está sob a influencia do numero de partículas presentes e pelo seu tamanho. (STRASINGER; DI LORENZO, 2009). O refratômetro determina a concentração de partículas dissolvidas na amostra de urina. A densidade é normalmente determinada empregando-se o refratômetro, o qual mede o índice de refração, que é uma comparação da velocidade da luz noa r com a velocidade da luz na urina. A concentração de partículas suspensas na urina determina a velocidade e o ângulo pelo qual a luz se dissipa nesta solução. (STRASINGER; DI LORENZO, 2009). Os refratômetros clínicos utilizam um prisma que permite dirigir um comprimento de onda especifico (monocromático) de luz do dia contra uma escala de gravidade especifica. Utiliza-se o refratômetro colocando uma gota de urina sobre o prisma, e focalizá-lo em uma boa fonte de luz fazendo assim a leitura diretamente na escala de gravidade especifica. Para a calibração do aparelho, utiliza-se uma gota de água destilada, que deve dar um resultado de 1.000. (STRASINGER; DI LORENZO, 2009). 24 Apesar de não ter muito significado clinico na rotina do exame de urina, o odor é uma das propriedades que precisa ser observada. A urina que é expelida recentemente possui um odor aromático, mas com o tempo, a uréia vai se degradando e o cheiro de amônia torna-se mais evidente. Algumas causas podem levar a um odor incomum da urina, como infecções bacterianas, cetose diabética, defeitos graves no metabolismo e ingestão de alguns tipos de alimentos. (STRASINGER; DI LORENZO, 2009). 4.3 Exame químico Para o exame químico da urina utiliza-se as fitas reagentes, que permitem a analise rápida e simples de parâmetros significativos no exame químico de urina. Consiste em almofadas absorventes impregnadas de substancias químicas fixadas em uma tira de plástico, que reagem quando a almofada entra em contato com a amostra de urina, onde sua leitura é realizada com uma tabela fornecida pelo fabricante. Deve-se então, mergulhar as almofadas de forma homogênea e eliminar o excesso da amostra, e esperar um tempo adequado para realizar a leitura sob uma boa fonte de luz. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). O pH urinário auxilia na detecção de doenças sistêmicas ácido-básico de origem respiratória e metabólica. Quando o paciente apresenta acidoses metabólicas ou respiratórias que não são relacionadas com a função renal, a ruína se apresenta ácida. Mas, se o paciente apresenta quadro de alcalose respiratória ou metabólica, a urina é alcalina. (STRASINGER; DI LORENZO, 2009). Quando produtos químicos inorgânicos dissolvidos na urina se precipitam, isso pode gerar cálculos renais e cristais, sendo que, para que ocorra essa precipitação, dependo do pH urinário. Por exemplo, um componente freqüente nos cálculos renais, o oxalato de cálcio, somente se forma em urina ácida, e não em urina alcalina. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). O pH urinário também auxilia no tratamento de infecções do trato urinário causado microrganismos metabolizadores de uréia. Em um pH ácido, esses microrganismo não conseguem se multiplicar tão facilmente. Esse pH é 25 controlado principalmente pela dieta do paciente, mas, medicamentos também podem ser utilizados para esse controle. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). Em algumas marcas de fitas reativas, medem o pH entre 5 a 9, e utilizam, para o sistema indicador duplo, utilizando vermelho de metila (pHs entre 5 a 6) quando mergulhada na urina, e o azul de bromotimol (pHs entre 6 a 9). (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). Dos exames químicos realizados na rotina de urina, a determinação de proteínas é o exame mais indicativo de doença renal. Em uma urina norma, há entre 10mg/dL ou 100mg por 24 horas, sendo assim uma quantidade muito pouca de proteínas. Essas proteínas possuem baixo peso molecular que foram filtradas pelos glomérulos ou proteínas produzidas pelo trato geniturinário. Sendo assim, que a albumina séria é a proteína mais comumente encontrada, e em uma urina normal, ela se mantem em concentrações baixas. Quando há uma proteinúria, nem sempre significa doença renal, mas, em sua presença, necessita-se fazer testes adicionais para se determinar que essa proteinuria é patológica ou não. Essa proteinuria pode ser agrupada em três categorias, a proteinúria pré renal, a proteinúria renal e a proteinúria pós renal. (CARVALHAL; ROCHA; MONTI, 2006). A proteinúria pré renal é causada por condições que afetam o plasma antes de atingir os rins, e não indica doença renal, sendo essa condição, na maioria das vezes transitória e é causada pelo aumento de proteínas no sangue, como a hemoglobina, mioglobina e proteínas de fase aguada que estão relacionadas em quadros de inflamação e infecção. A proteinúria renal esta associada a doença renal verdadeira, que pode ser oriunda de dano tubular ou glomerular.Já a proteinúria pós renal se dá quando a urina passa através das estruturas do trato urinário inferior, onde são adicionadas proteínas à urina. Quando o trato urinário (ureteres, bexiga, uretra, próstata, vagina) apresenta infecções bacterianas e fúngicas, há a formação de exsudatos com proteínas do fluido intersticial. A presença de fluido prostático e grande quantidade de espermatozóides também possuem grande quantidade de proteínas. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). Nas tiras reativas para o exame químico da urina, muitos fabricantes utilizam a albumina como indicador, porque ela contem mais grupo amino para 26 receber íons de hidrogênio do que as outras proteínas. Muitos fabricantes das tiras reativas utilizam para a área de proteínas o azul de tetrabromofenol ou 3’, 3’,5’,5’’-tetraclorofenol-3,4,5, 6-tetrabromossulfonftaleína e um tampão para deixar o pH constante. (CARVALHAL; ROCHA; MONTI, 2006; KONEMAN et al, 2010). A glicose é um exame mais realizado na urina na detecção de e acompanhamento da diabetes mellitus, pois, em circunstâncias normais, a glicose é quase totalmente absorvida durante a filtragem pelos rins, mas quando os níveis de glicose estão elevados no sangue (hiperglicemia), a reabsorção tubular para e assim a glicose aparece na urina. Isso se dá como resposta do organismo, pois, a necessidade de manter a concentração de glicose equilibrada no corpo. (CARVALHAL; ROCHA; MONTI, 2006). A hiperglicemia pode ser de origem não diabética, isso acontece em transtornos associadas a doenças relacionadas com funções hormonais, pancreatite, câncer prostático, acromegalia, entre outros.Nas tiras reagentes, utilizam dois procedimentos, o da glicose oxidase que é especifico para a glicose, onde as fitas são impregnadas com a mistura de glicose oxidase, peroxidase, cromógeno e um tampão para produzir uma reação enzimática dupla sequência. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Cetonas representa o três produtos oriundos do metabolismo da gordura, acetona, ácido beta-hidroxibutírico e ácido acetoacético, e geralmente não aparecem na urina, pois toda a gordura que é metabolizada é decomposta em dióxido de carbono e água.Mas, quando o estoque de carboidratos do corpo está comprometida, o organismo começa a utilizar a gordura para gerar energia, então, as cetonas são detectadas na urina. Quadros clínicos como diabetes mellitus, perda de carboidratos pelo vomito,ingestão inadequada de hidratos de carbono associadas com jejum prolongado e má absorção, podem aumentar o metabolismo do lipídio.Nas tirar reagentes, para a detecção da cetona, utiliza-se o nitroprussiato de sódio (nitroferricianeto), pois, o ácido acetoacético reage com o nitroprussiato de sódio em meio alcalino, gerando assim a cor púrpura. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). O sangue pode ser encontrado na urina na forma de glóbulos vermelhos intactos (hematúria) ou na forma de hemoglobina, quando as hemácias são destruídas (hemoglobinúria). As hemácias integras causam turvação vermelha 27 na urina, já a hemoglobina se apresenta na cor vermelha límpida.A presença de hemácias, hemoglobina ou mioglobina nas fitas reativas de urina, dão significados clínicos diferentes entre elas. A presença de hematúria pode indicar doenças de origem renal ou traumas na região geniturinário que podem gerar sangramentos. As causas mais comuns de hematúria são cálculos renais, tumores, traumatismos, pielonefrites, terapias com anticoagulantes, doenças glomerulares e substancias tóxicas. A hematúria não patológica pode ocorrer durante a menstruação ou associada a exercícios extenuante. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). A hemoglobinúria ocorre na lise das hemácias especialmente na urina alcalina e diluída, ou quando há hemólise intravascular. A mioglobina aparece na urina quando se há suspeita do paciente apresentar distúrbios associados com a destruição muscular (rabdomiólise). Traumas, síndrome de esmagamento, coma prolongado, convulsões, esforço intenso, também podem fazer com que apareça mioglobina na urina.Nas tiras reativas, utiliza-se peróxido, tetrametilbenzidina e um tampão na almofada do teste de sangue. Quando há presença de hemoglobina/mioglobina, a cor da almofada que é amarela quando negativo, passa para cor verde azulado que indica resultado positivo para presença de hemoglobina livre/mioglobina na amostra de urina. Já quando os eritrócitos estão intactos, quando entram em contado com a almofada, geram pontilhados verde azulado na almofada. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). A presença de bilirrubina na urina pode ser um indicio de doença hepática precoce, muitas vezes é detectada antes do paciente apresentar icterícia.Nas tiras reagentes, a bilirrubina reage com o sal2,4-dicloroanilina diazônio ou com o 2,6-diclorobenzeno-diazônio-tetrafluoroborato em meio ácido para gerar um azodye, que produz cores que variam em grau de castanho amarelado ou rosa até violeta. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). O aumento de urobilinogênio é detectado na doença hepática e nos transtornos hemolíticos. Pode ser útil para avaliar doença renal precoce, mas estudos mostram que em pacientes hospitalizados (9%) e na população não hospitalizada (1%) podem apresentar resultados elevados, causado por constipação.Os fabricantes das tiras reativas utilizam o p28 dimetilaminobenzaldeído (Ehrich reagente) que juntamente com o Urobilinogênio, gera uma cor que pode variar de rosa-claro a rosa-escuro. Utiliza-se também a reação de diazo, que baseia-se na reação do urobilinogênio com 4-metoxibenzeno-diazônio-tetrafluoroborato, que produz uma cor que varia do branco ao rosa. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). O teste de nitrito pode oferecer uma analise rápida para a presença de infecção do trato urinário.Nas tiras reativas, o teste do nitrito baseia-se na capacidade de determinadas bactérias de reduzir o nitrito pra nitrato. Utiliza-se então a reação de Greiss, onde o nitrito reage em pH ácido com uma amina aromática (ácido para-arsanílico ou sulfanilamida) para gerar um composto diazônio, no qual reage com os compostos de tetrahidrobenzoquinolina, assim produzindo a cor rosa. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Detecta a presença de um grande numero de leucócitos , o que exige a realização do exame microscópico do sedimento urinário para sua confirmação. Em uma urina normal, conta-se de 0 a 2 ou 0 a 5 leucócitos por campo de alto aumento. Um grande número de leucócitos na urina pode indicar ITU, sendo os neutrófilos as células mais frequentemente encontradas.Nas tiras reativas, utiliza-se um éster embebido na almofada reagente para catalisar a esterase leucocitária, para assim produzir um composto aromático e acido. Esse composto então se liga com um sal diazônio, assim produzindo uma cor púrpura. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). 4.4 Análise microscópica do sedimento urinário A microscopia do sedimento urinário se constitui, historicamente, no procedimento laboratorial importante e mais utilizado, do exame de urina, no diagnóstico de doenças do trato urinário. É chamado de sedimento urinário qualquer material encontrado em suspensão na urina após homogeneização. (CARVALHAL; ROCHA; MONTI, 2006). O exame microscópico do sedimento urinário tem a finalidade de detectar e identificar os elementos insolúveis que acumulam na urina durante o processo de filtração glomerular e a passagem do líquido através dos túbulos renais e trato urinário inferior. O material em suspensão pode ser constituído de 29 células epiteliais, hemácias, leucócitos, bactérias, cilindros, cristais, grânulos, leveduras, muco e, ainda, várias outras estruturas. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). A amostra de urina deve ser concentrada com a finalidade de garantir a observação microscópica das estruturas menos abundantes presentes na amostra. A concentração da amostra de urina é realizada através da centrifugação de uma determinada alíquota de uma amostra de urina homogeneizada. O volume da alíquota pode ser de 15, 12 ou 10 mililitros, sendo a concentração da amostra de 15:1, 12:1, 10:1 ou 10:0,5 dependendo do que determina a normatização de realização do exame de urina em cada país. No caso do Brasil a NBR 15268 determina que o volume da alíquota seja de 10 mililitros e que a concentração da amostra seja de 10:0,2. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Conforme determina a NBR 15268, validada em 30/11/2005 na preparação do sedimento urinário para observação entre lâmina e lamínula e cálculo para expressão dos resultados por mililitro de urina se deve seguir o procedimento conforme padronizado (STRASINGER; DI LORENZI, 2009; ABNT, 2005): Homogeneizar a amostra de urina e transferir para um tubo de centrifugação 10 mililitros de urina; Centrifugar a 1500 a 2000 rotações por minuto ou 400 X g durante 5 minutos; retirar 9,8 mililitros do sobrenadante, cuidadosamente, para que o sedimento não ser ressuspendido, deixando no tubo 0,20 mililitros; Ressupender o sedimento; Transferir 0,020 mililitros (20 microlitros) do sedimento ressuspendido para uma lâmina de microscopia; Colocar sobre o sedimento que se encontra na lâmina uma lamínula 22 X 22 mm; Examinar o sedimento por pelo menos dez campos microscópicos, bem distribuídos na lamínula; 30 Para expressar o resultado por campo, examinar as células epiteliais e os cilindros do sedimento urinário em aumento de 100X e as hemácias e leucócitos em aumento de 400X; Calcular a média de cada elemento do sedimento contado; Expressar o resultado como número de elementos por campo; Para expressar o resultado por mililitro examinar as células epiteliais e os cilindros do sedimento urinário em aumento de 100X e as hemácias e leucócitos em aumento de 400X; Calcular a média de cada elemento do sedimento contado; Multiplicar a média por 5.040; Expressar o resultado como número de elementos por mililitro; O fator 5.040 foi obtido a partir dos dados fixos, padronizados para um volume de urina centrifugada de 10 mililitros, volume final do sedimento de 0,20 mililitros de volume total do sedimento observado de 0,020 mililitros, cujas dimensões adicionais são (ABNT, 2005): diâmetro do campo microscópico = 0,35 mm; área do campo microscópico = 0,096 mm2; área da lamínula 22 X 22 mm = 484 mm2; 484 : 0,096 = 5.040 campos sob lamínula; colocar 0,020 mililitros do sedimento homogeneizado na lamínula. O exame microscópico do sedimento urinário é um procedimento complexo e de custo elevado considerando o tempo consumido pela sua execução. A realização do exame microscópico na rotina do laboratório exige profissionais qualificados, bem treinados que possuam habilidade e experiência em microscopia. Além disso, eles devem conhecer procedimentos de microscopia como: campo claro, contraste de fase e luz polarizada, bem como saber como utilizar os microscópios que possibilitam estes tipos de microscopia. (ABNT, 2005). O exame microscópico da urina é, geralmente, realizado através de microscopia de campo claro. O modo de preparação material, entre lâmina e 31 lamínula e, na prática diária, não inclui a utilização de corantes, o que dificulta a observação das diferentes estruturas do sedimento organizado ou inorganizado que podem ser encontradas no sedimento urinário. Em vista da dificuldade em observar diversos tipos de estruturas que podem ser encontradas no sedimento urinário, outras técnicas de microscopia como contraste de fase e luz polarizada podem ser utilizadas para facilitar a sua identificação. Além destas técnicas microscópicas, na microscopia de campo claro podem ser incluídas técnicas de coloração para facilitar a observação e identificação de diferentes estruturas. (STRASINGER; DI LORENZI, 2009; HENRY, 2008; ABNT, 2005). As estruturas do sedimento urinário podem pertencer ao que denominamos de organizado (biológico) ou inorganizado (químico). O sedimento organizado inclui células epiteliais escamosas (uretra), células de epitélio de transição (bexiga e ureter), células de epitélio tubular renal (túbulos contornados proximais, distais, alça de Henle), leucócitos, hemácias, bactérias, cilindros (com ou sem inclusões), leveduras, gotículas de gordura, espermatozoides e parasitas ou ovos de parasita. Entre as estruturas químicas, algumas podem ser observadas no sedimento urinário, sem indicarem a ocorrência de qualquer patologia seja ela do trato urinário ou não (cristais de oxalato de cálcio, ácido úrico, urato de sadio, urato amorfo, fosfato amorfo, urato de amônia, fosfato amoníaco magnesiano ou fosfato triplo, carbonato de cálcio, fosfato de cálcio, etc.). (STRASINGER; DI LORENZI, 2009; HENRY, 2008). As células epiteliais podem pavimentosas ou escamosas, de transição ou renais. No exame microscópico de uma amostra de urina normal, adequadamente colhida e concentrada 10X podem ser observadas raras células pavimentosas, de transição e tubulares renais. O resultado do exame microscópico relativo à observação de células epiteliais pavimentosas e de transição é, geralmente, expressado como: raras, poucas e muitas, podendo ser realizada a observação de que as células se encontram agrupadas, quando for o caso. Em relação às células tubulares renais observadas no sedimento urinário recocondamos que estas sejam contadas e o resultado expressado da mesma forma que os leucócitos e as hemácias. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). 32 Os leucócitos têm, aproximadamente, 12 μm de diâmetro, seu citoplasma apresenta granulações finas e o núcleo é lobulado. As granulações podem se apresentar mais densas quando já se verifica certo grau de degeneração dos leucócitos. Essa degeneração é comumente observada em urinas diluídas e alcalinas e em aproximadamente 50% das amostras que são examinadas 3 horas depois de realizada sua colheita caso a mesmas não tenham sido submetida à refrigeração. A observação de poucos leucócitos no sedimento urinário (< 5 por campo) em aumento de 400X, quando a amostra é concentrada 10:1, é considerada normal. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Entretanto, esses valores de referência dependem da padronização empregada na execução do exame de urina. Os leucócitos observados no sedimento urinário são, geralmente, polimorfonucleares neutrófilos, mas, a verificação da presença de linfócitos, eosinófilos e monócitos também ocorre e é de grande importância no diagnóstico. Contudo, através da realização do exame microscópico sem a utilização de métodos de coloração esta identificação e/ou diferenciação não é possível. (STRASINGER; DI LORENZI, 2009; HENRY, 2008; ABNT, 2005). A observação de leucocitúria no exame microscópico do sedimento urinário constitui em indicação de ocorrência de patologia inflamatória do trato urinário ou mesmo do trato 42genital. No caso de doença inflamatória do trato urinário a leucocitúria verificada é, geralmente, acentuadamente menor que nos processos infecciosos. Nos processos infecciosos do trato urinário alto (pielonefrite) a leucocitúria observada é geralmente mais intensa que nas infecções do trato urinário baixo (cistite). Essa diferença é decorrente, pelo menos em parte, pelo fato de os rins serem órgãos, extremamente, mais vascularizados que a bexiga, pois a migração dos leucócitos para o espaço tubular ou para a bexiga ocorre por diapedese. Nos processos infecciosos os leucócitos podem ser observados distribuídos de forma dispersa nos campos microscópicos ou na forma de aglomerados. As aglomerações de leucócitos são associadas com infecções agudas do trato urinário. (STRASINGER; DI LORENZI, 2009). Embora, nos processos infeciosos do trato urinário, a bacteriúria sejam freqüentemente acompanhados de leucocitúria, nas infecções do trato urinário 33 baixo causadas por Chlamidiatrachomatis é freqüente se verificar pacientes com disúria cujo exame de urina revela a ocorrência de leucocitúria ou leucocitúria e hematúria estéreis, isto é sem bacteriúria. (MAGOT, 1992). Além disso, também se tem verificado casos de pacientes que apresentam sintomatologia de infecção do trato urinário em que se verifica intensa bacteriúria sem leucocitúria. (RINGSRUD; LINÉ, 1995). O exame de urina permite diferenciar as pielonefrites das cistites. As pielonefrites são caracterizadas por se verificar, geralmente, além de leucocitúria, proteinúria moderada (++), bacteriúria e cilindrúria (cilindros granulosos, hialinos e leucocitários). Nas cistites, por sua vez, se verifica apenas leucocitúria variável e bacteriúria, podendo, eventualmente, se verificar leve proteinúria (vestígios)), embora ocorrência desta última seja por vezes contestada. Nas pielonefrites se verifica, também, freqüentemente, que as amostras de urina apresentam densidades próximas do limite inferior de normalidade, ou mesmo inferiores ao normal. (STRASINGER; DI LORENZI, 2009). A diminuição da densidade é decorrente do comprometimento da reabsorção tubular renal de água. Nas cistites não se verifica o comprometimento da reabsorção tubular de água, por isto, a densidade das amostras de urina é freqüentemente superior a 1.020. Contudo é importante ressaltar que a densidade da amostra de urina é, em condições normais, reflexo da hidratação do paciente. Os leucócitos presentes no sedimento urinário podem apresentar movimento browniano de inclusões citoplasmáticas e são denominados de células de Sterheimer-Malbin ou células brilhantes. (STRASINGER; DI LORENZI, 2009). Leucócitos com essas características são observados em urinas hipotônicas e por isto observação era, antigamente, relacionada à pielonefrite. Em urinas hipotônicas os leucócitos absorvem água e aumentam de volume em conseqüência da expansão do citoplasma. A expansão do volume citoplasmático tem como conseqüência, no início, a desestabilização das inclusões citoplasmáticas. Com a contínua absorção de água, os leucócitos podem até triplicar o seu volume e se observam espaços vazios no citoplasma dos mesmos. (STRASINGER; DI LORENZI, 2009). 34 As hemácias apresentam forma discoide com diâmetro de aproximadamente 7 μm, são células anucleadas e não apresentam inclusões citoplasmáticas. A observação de diferentes ângulos permite a sua visualização sob diferentes formas. Depois da forma discóide a mais frequentemente observada é a de duplo prato. A ausência de inclusões citoplasmáticas confere às hemácias aparência lisa quando observadas por microscopia de campo claro. Na microscopia de campo claro as hemácias podem ser confundidas com gotículas de gordura, ou óleo, bolhas de ar cristais ovais de oxalato de cálcio (monohidratado) e leveduras. No exame microscópico do sedimento urinário podemos encontrar três tipos de hemácias: normais, fantasma e dismórficas.As hemácias normais apresentam coloração laranja pálido e podem ser encontradas em urinas recém-emitidas e isotônicas, isto é, que apresentam densidade próxima de 1.010. Hemácias íntegras são observadas, principalmente, no sedimento urinário de amostras obtidas de pacientes cuja hematúria é decorrente de lesão mecânica (ex.: litíase renal, acidente) e amostras contaminadas com fluxo menstrual, pois essas células sofrem rápida degradação de sua morfologia em doenças renais com retenção urinária e em amostras não analisadas logo após sua colheita, conforme recomendado. (STRASINGER; DI LORENZI, 2009). Em urinas hipotônicas podem ser observadas hemácias que apresentam diâmetro bem maior que 7 μm porque elas se encontram inchadas devido a difusão de grande volume de água para o seu interior. Devido a essa difusão as hemácias podem, até mesmo, se romper, principalmente, quando o pH da urina é alcalino, levando à observação do que se denomina de “hemácias fantasma” e nas quais se observa apenas a membrana celular, porque a hemoglobina foi perdida. Quando a urina é hipertônica seu diâmetro geralmente é menor que o normal e sua forma muitas vezes é crenada devido à perda de água. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). A presença de pequena quantidade (<2 por campo) de hemácias na urina é normal (Strassinger, 1996). Entretanto os valores utilizados para a definição de hematúria são controvertidos, até mesmo porque para a realização do exame de urina não existe uma padronização única ou uma padronização universalmente aceita conforme descrito anteriormente. Enquanto para alguns autores hematúria é a verificação de mais de 5 (cinco) hemácias por campo 35 microscópico em aumento de 400X ou mais de 5.000/ml (PENIDO, 1995; BASTOS, 1998), outros consideram hematúria quando o número de hemácias é superior a 10 (dez) por campo microscópico nesse aumento. Os valores de referência em número de elementos por campo dependem da padronização empregada na execução do exame de urina. (STRASINGER; DI LORENZI, 2009). A hematúria pode ter origem ao longo do trato urinário e indicar a ocorrência de patologia severa. As hematúrias podem ser classificadas de acordo com a intensidade, freqüência e repercussão clínica. Quanto à intensidade do sangramento podem ser macroscópicas, quando a cor da urina sugere a presença de hemácias em grande quantidade, ou microscópicas, quando a presença de hemácias pode ser detectada apenas através da microscopia. (STRASINGER; DI LORENZI, 2009). Em relação à frequência, elas podem ser isoladas, permanentes e recorrentes. Nas hematúrias isoladas e permanentes a presença de hemácias no sedimento urinário é verificada em episódio único (amostra isolada) ou constantemente (amostras consecutivas), respectivamente, enquanto nas hematúrias recorrentes se verificam períodos de remissão do sangramento. (STRASINGER; DI LORENZI, 2009). Quanto à repercussão clínica elas podem ser assintomáticas e sintomáticas (BASTOS, 1998). As hematúrias podem, também, ser classificadas quanto à sua localização ou origem, como de trato urinário alto ou renal e trato urinário baixo ou pós-renal. As hematúrias do trato urinário alto podem, por sua vez, ser classificadas como glomerulares e não glomerulares. Os cilindros são as únicas estruturas observadas no exame microscópico do sedimento urinário cuja origem é exclusivamente renal, e sua observação tem, importante, significado clínico. Eles são formados, principalmente, na luz dos túbulos contorcidos distais e dos ductos coletores a partir solidificação (coagulação ou precipitação) de proteínas que aí se encontram durante o período de concentração da urina, ou êxtase ou ainda, quando o pH da urina esta muito ácido. (BASTOS; AURAZO; MOSCOSO, 1998). A base dos cilindros é a proteína de Tamm Horsfall, uma glicoproteína, que é secretada pelas células do ramo descendente da alça de Henle, mas, 36 também proteínas plasmáticas podem constituir a matriz protéica. A presença de proteínas plasmáticas no filtrado presente nos túbulos renais aumenta a possibilidade de formação de cilindros. A observação de cilindros no sedimento urinário está associada com a ocorrência de proteinúria. (STRASINGER; DI LORENZI, 2009; BASTOS, 1998). A formação de cilindros está associada, também, a concentração dos solutos, além do pH ácido do filtrado, razão pela qual, provavelmente, sua observação não ocorre em urinas diluídas e/ou urinas alcalinas. (STRASINGER; DI LORENZI, 2009; BASTOS, 1998). Quando o pH da amostra de urina se torna alcalino se verifica que os cilindros desaparecem. É isso que ocorre quando o exame de urina é realizado depois do tempo preconizado pela normatização desse exame ou ainda em conseqüência de seu armazenamento inadequado. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Os cilindros, além das proteínas, podem conter, ainda células renais, hemácias, leucócitos, grânulos, bactérias, gotículas de gordura e outras estruturas presentes no filtrado no momento de sua formação e se constituem em um retrato das condições do néfron. Sua denominação depende da presença ou não de inclusões bem como do tipo de inclusão(ões) presente(s). Assim eles podem ser denominados de: hialinos, epiteliais, granulosos, hemáticos ou eritrocitários, céreos, leucocitários, bacterianos, adiposos e de cristais (identificar o tipo). (STRASINGER; DI LORENZI, 2009; BASTOS, 1998). Quanto à forma, os cilindros podem ser denominados de largos. A largura dos cilindros está relacionada com a localização de sua formação (túbulos ou ductos) ou ainda em decorrência da distensão de túbulos renais, que ocorre quando se verificar acentuada êxtase do fluxo urinário. Contudo, o registro da observação de cilindros no resultado do exame microscópico do sedimento urinário deve ser realizado seguindo a usual classificação dos cilindros de acordo com a morfologia tal como, por exemplo: hialino, leucocitário, eritrocitário, eptelial, granuloso, céreo, gorduroso, bacteriano e pigmentado.(STRASINGER; DI LORENZI, 2009; HENRY, 2008). A presença de cristais no sedimento urinário é denominada de cristalúria. Os cristais e outras estruturas amorfas são também, denominadas 37 de sedimento amorfo e sua observação no exame microscópico do sedimento urinário, geralmente, tem significado clínico menor que, por exemplo: células renais, hemácias, leucócitos e cilindros. A presença de cristais no sedimento urinário nem sempre é decorrente de patologias existentes. Entretanto, o reconhecimento e a identificação dos cristais presentes no sedimento urinário são importantes, ainda que a sua presença não esteja relacionada a qualquer patologia e sua descrição de origem patológica e importante conhecer a sua morfologia. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). 38 5 URUCULTURA 5.1 Histórico Até cerca de 1880 os microrganismos eram cultivados em meios líquidos, quando Robert Koch e sua equipe introduziram os meios de cultura sólidos, os quais permitiram o estudo de espécies isoladas (culturas puras), separando-as de espécies contaminantes.Os meios de cultura utilizados para o crescimento de microrganismos são compostos de nutrientes como peptonas, aminoácidos, extratos de carne e leveduras, sais minerais e vitaminas, substanciam inibidoras do crescimento, agentes solidificantes e sistemas de reações bioquímicas. (TSORAEVA; MARQUES, 2005). 5.2 Definição Meios de cultura consistem da associação qualitativa e quantitativa de substâncias que fornecem os nutrientes necessários ao desenvolvimento (cultivo) de microrganismos fora do seu meio natural. Tendo em vista a ampla diversidade metabólica dos microrganismos, existem vários tipos de meios de cultura para satisfazerem as variadas exigências nutricionais. Além dos nutrientes é preciso fornecer condições ambientais favoráveis ao desenvolvimento dos microrganismos, tais como pH, pressão osmótica, umidade, temperatura, atmosfera (aeróbia, micro aeróbia ou anaeróbia), dentre outras. (TSORAEVA; MARQUES, 2005). 5.3 Classificações Os meios de cultura são classificados quanto ao estado físico em sólidos, quando contém agentes solidificantes, principalmente ágar (cerca de 1 a 2,0 %); semi-sólidos, quando a quantidade de ágar e ou gelatina é de 0,075 a 0,5 %, dando uma consistência intermediária, de modo a permitir o crescimento de microrganismos em tensões variadas de oxigênio ou a verificação da motilidade e também para conservação de culturas; e líquidos, sem agentes 39 solidificantes, apresentando-se como um caldo, utilizados para ativação das culturas, repiques de microrganismos, provas bioquímicas, dentre outros. A identificação dos microrganismos por meios tradicionais, ocorre por reações bioquímicas como variação de pH do meio devido à descarboxilação ou desaminação de aminoácidos e fermentação de açucares; produção de gás a partir da fermentação de açucares; hidrolise de carboidratos, aminoácidos, aminas ou proteínas; ou produção de gás sulfídrico. 5.4 Cultura de urina ou urocultura A urocultura, também chamada de urinocultura, ou ainda, cultura de urina, é o exame indicado para o diagnóstico da infecção urinária, identificando a presença de microrganismos localizados na urina, uretra e nos rins. A urocultura é feita através da colocação da urina em um meio propício à reprodução de microrganismos, chamado meio de cultura. Caso a urina contenha germes, em 48 horas será possível identificar a formação de colônias de bactérias, considerado positivo quando são isolados 100.000 colônias de microrganismos por 1ml de urina e dessa forma constatar à infecção do Trato Urinário. (STRASINGER; DI LORENZI, 2009; HENRY, 2008; SILVA, 2008). Neste exame podemos diagnosticar a infecção do Trato Urinário das vias baixas (Uretrite – doença inflamatórias e infecciosas da uretra; e Cistite – doença inflamatórias e infecciosas da bexiga) e das vias urinárias altas (Pielonefrite – doença infecciosa do trato urinário ascendente que atingiu a 'pielo' (pelve) do rim). (STRASINGER; DI LORENZI, 2009). Várias de meios de cultura são usados. No entanto, o laboratório deve padronizar aqueles meios que melhor se adequem à sua rotina. Assim podemos listar alguns, como: Ágar MacConkey, Ágar Sangue, Ágar Cled, Ágar Chapman, Ágar EMB Teague, Ágar EMB Levine, meios cromogêneos e fluorogênicos. (OPLUSTIL et al, 2010; ANVISA, 2003). O Ágar MacConkey é um meio seletivo (pela presença de sais biliares, cristal violeta e NaCl) para o isolamento de bacilos Gram negativos, principalmente as enterobactérias (Salmonellas, Shigellas e bactérias coliformes). Diferencia as bactérias fermentadoras de lactose (colônias vermelho tijolo a rosa, opacas se o crescimento for denso, podem estar 40 rodeadas por zonas de precipitado de bile; possibilidades: E.coli, Klebsiellaspp, GrupoEnterobacterspp) das não fermentadoras de lactose (colônias transparentes a incolores, observadas melhor a luz transmitida; possibilidades: Salmonellaspp, Shigellaspp, Proteusspp e Edwardsiella) pela presença de lactose e vermelho neutro na composição do produto. (OPLUSTIL et al, 2010; ANVISA, 2003). Figura 03 - Escherichia coli sobre ágar de MacConkey com Colônia de pigmento rosa é devido à lactose fermentação Fonte: LABORATOY HANDBOOK ON MASTITIS, 2012. Agar Sangue meio utilizado para a maioria dos materiais clínicos. Permite o crescimento de grande parte dos patógenos não fastidiosos ou que requerem incubação especial. Devido a adição de sangue de carneiro desfibrinado proporciona a leitura das hemólises causadas pelo gênero Streptococcus spp. (OPLUSTIL et al, 2010; ANVISA, 2003). Ele é usado para estudos de Escherichia coli irradiadas e fagos de Clostridium perfringens. Este meio pode ser usado com a adição de fosfato de fenolftaleína para a detecção de Staphylococcus produzindo fosfatase, com adição de sal e Agar para avaliação da contaminação de superfície de equipamentos e carcaças de porcos e para determinar a faixa de salinidade de flavobactérias marinhas . Foi usado para preparação de antígenos de Salmonella sorotipo Typhi. Este meio pode ser mais enriquecido com a adição de soro ou sangue. Com a adição de sangue este meio é adequado para a detecção de reações hemolíticas típicas. Entretanto, reações hemolíticas dependem do sangue animal usado. Sangue de carneiro fornece melhores 41 resultados para Streptococcus Grupo A. Quando sangue de cavalo é usado, colônias de Haemophilushaemolyticus produzem hemólise e mimetizam Streptococcuspyrogenes. Norton descobriu que pH levemente ácido (6.8 ± 0.2) favorece reações hemolíticas distintas e é vantajoso para o cultivo de Streptococcus e Pneumococcus. O pH baixo auxilia na estabilização de corpúsculo do sangue vermelho e favorece a formação de zonas de hemólise transparentes. (OPLUSTIL et al, 2010; ANVISA, 2003). Figura 04 - E. coli ágar sangue Fonte: LABORATOY HANDBOOK ON MASTITIS, 2012 Em 1960, Sandys referiu o desenvolvimento de um novo método para evitar a proliferação de Proteus em meios sólidos, limitando os eletrólitos no meio de cultura que foi posteriormente modificado para ser utilizado em culturas de urina. Este meio foi designado como meio de cistina lactose deficiente em eletrólitos (CLED) e demonstrou ser ideal para técnicas de imersão do inoculo e para a bacteriologia urinária em geral. (OPLUSTIL et al, 2010; ANVISA, 2003). Os nutrientes no BD CLED Agar são fornecidos pelas peptonas de caseínas e gelatina e extrato de carne de vaca. A lactose foi incluída para fornecer uma fonte de energia para os organismos com capacidade para utilizá-la através de um mecanismo fermentativo. É utilizado o azul de 42 bromotimol como um indicador de pH para diferenciar os fermentadores da lactose dos não fermentadores da lactose. Os organismos que fermentam a lactose irão reduzir o pH e alterar a cor do meio de verde para amarelo. A cistina permite o crescimento de bactérias coliformes "de colónias anãs". As fontes de eletrólitos são reduzidas para minimizar a proliferação de espécies de Proteus. Deste modo, o meio permite a determinação quantitativa de agentes patogénicos urinários incluindo o Proteus quando são utilizadas ansas calibradas para inoculação. (OPLUSTIL et al, 2010; ANVISA, 2003). Figura 05 – E. coli em ágar CLED Fonte: MIRA IMAGES, 2012. Ágar Chapman é usado para isolamento de Staphylococcusspp através da fermentação do manitol e produção de gelatinase pela presença de manitol e gelatina em sua formulação.O Mannitol Salt Agar é uma formulação 43 concebida por Chapman para a diferenciação de estafilococos com resultados positivos para a coagulase (por exemplo, Staphylococcusaureus) dos estafilococos com resultados negativos para a coagulasse. (OPLUSTIL et al, 2010; ANVISA, 2003). O Mannitol Salt Agar é utilizado para o isolamento de estafilococos provenientes de amostras clínicas, de cosméticos e nos testes de limite microbiano. O Mannitol Salt Agar contém peptonas e extrato de bovino, que fornecem nutrientes essenciais. O cloreto de sódio a uma concentração de 7,5% resulta numa inibição parcial ou completa de outros organismos bacterianos que não os estafilococos. A fermentação com manitol, conforme indicada por uma alteração no indicador vermelho de fenol, ajuda na diferenciação das espécies de estafilococos. Os estafilococos com resultados positivos para a coagulasse (por exemplo,Staphylococcus aureus) produzem colónias amarelas e um meio amarelo circundante ao passo que os estafilococos com resultados negativos para a coagulasse produzem colónias vermelhas e nenhuma alteração na cor do indicador vermelho de fenol. (OPLUSTIL et al, 2010; ANVISA, 2003). O agar EMB Teague baseia-se numa formulação descrita inicialmente por Holt-Harris e Teague em 1916, para isolamento e diferenciação de bacilos entéricos e Enterobacteriaceae. Diferencia as bactérias capazes de fermentar a sacarose / lactose com correspondente absorção do corante eosina e azul metileno, pela presença deste componente em sua formulação. (OPLUSTIL et al, 2010; ANVISA, 2003). A formulação original de Holt-Harris e Teague foi modificada por Levine. A principal diferença entre as duas consiste na inclusão de sacarose no meio de Holt-Harris e Teague. A sacarose é fermentada por determinados organismos entéricos de forma mais rápida do que a lactose. O BD EMB Agar, Modified contém corantes de eosina Y e azul-de-metileno que inibe as bactérias gram-positivas num determinado grau. Os corantes funcionam também como indicadores de diferenciação em resposta à fermentação da lactose e/ou sacarose por microorganismos. Os coliformes produzem colónias pretas-azuladas, enquanto as colónias de Salmonella e Shigella são incolores ou têm uma cor âmbar transparente. As colónias de Escherichia coli poderão apresentar um reflexo verde metalizado característico, devido à rápida 44 fermentação da lactose. O agar EMB (com ou sem sacarose) é incluído no conjunto de meios de isolamento de selectividade reduzida para a Salmonella de amostras fecais e de outro tipo. As bactérias gram-positivas como, por exemplo, estafilococos, leveduras e estreptococos fecais, poderão desenvolver-se neste meio e formar colónias punctiformes ou poderão ficar inibidas. (OPLUSTIL et al, 2010; ANVISA, 2003). O Agar EMB foi desenvolvido por Levine e é usado para diferenciação de Escherichia coli e Enterobacteraerogenes e também para rápida identificação de Cândida albicans. Este meio é recomendado para detecção, enumeração e diferenciação de membros do grupo de coliformes pela Associação de Saúde Pública Americana. (OPLUSTIL et al, 2010; ANVISA, 2003). Ele também foi recomendado para detecção e estimação de bactérias em gêneros alimentícios e Escherichia coli de alimentos e água. Eosina-Y e azul metileno tornam o meio levemente seletivo e inibitório para certas bactérias gram-positivas. Estas pigmentações diferenciam entre fermentadores de lactose e não fermentadores. Algumas bactérias gram-positivas tais como Streptococcus fecais e leveduras crescem neste meio e formam colônias tipo ponto. Weld propôs o uso de Agar EMB, com hidrocloreto de clorotetraciclina, para a identificação rápida de Cândida albicans em espécimes clínicos. Uma identificação positiva de Cândida albicans pode ser feita após 24-48 horas de incubação a 35-37°C em atmosfera com dióxido de carbono 10%, de espécimes como excreções fecais, orais e vaginais e raspas de unhas e pele. Entretanto, a aparência típica é variável. (OPLUSTIL et al, 2010; ANVISA, 2003). 45 Figura 06 – Meio ágar EMB com E. coli Fonte: DIFFERENTIAL MEDIA, 2012. Os meios de cultura cromogênicos para o isolamento de uropatógenos, estão no mercado mundial desde 1989, são excelentes alternativas para se fazer uma adequada urocultura. Em geral estes meios utilizam substratos cromogênicos combinados, sobre uma base nutricionalmente rica, favorecendo a multiplicação dos principais uropatógenos e, ainda, possibilitando o reconhecimento precoce de vários grupos e espécies. Várias formulações diferentes encontram-se no mercado, mas o princípio bioquímico das reações envolvidas quase sempre éo mesmo: liberação de radicais cromogênicos (coloridos) após a clivagem do seu sal (incolor) por via enzimática. (OPLUSTIL et al, 2010; ANVISA, 2003). Desde a década de 70, são realizadas pesquisas especiais no sentido de identificar os microrganismos de interesse que levaram ao desenvolvimento dos meios cromogênicos e fluorogênicos. Nesses meios, as colônias, dependendo das enzimas bacterianas q atuam sobre os substratos presentes, adquirem cores ou fluorescências características capazes de identificar os microrganismos. 46 O primeiro pesquisador a propor o uso de substratos fluorogênicosprar detecção de enzimas bacterianas foi Dyer em 1970. Posteriormente, Dahlén e Linde (1973) descreveram o ágar com substrato fluorogênicos 4-UM. Bascmb (1987) descreveu detalhadamente as propriedades dos substratos cromogênicos e fluorogênicos e sai aplicabilidade nos estudos de enzimas microbianas. Mas foi em 1989 que Alain Rambach, pioneiro no desenvolvimento e na utilização dos meios cromogênicos, desenvolveu um meio de cultivo especifico para a detecção e a identificação de Salmonellassp. (RAMBACH, 1989; TSORA; MARQUES, 2005). Os meios podem ser usados diretamente ou após um cultivo primário, suprimindo a necessidade de longos procedimentos de isolamento e identificação. O uso de substratos sintéticos permite que varias reações possam ser analisadas simultaneamente em uma mesma placa (BASCOMB, 1987; WATSON, 1976). Neles os grupos cromóforos e fluoróforos são associados a diferentes tipos de substratos de origem proteica, glicosídica, alcoólica entre outras, comparativamente aos meios tradicionais, confere aos meios cromogênicos e fluorogênicos uma maior exatidão diagnostica. (MANAFI, 1991; OLIVEIRA, 2011). Não há uma obrigatoriedade de se usar esta ou aquele meio na rotina laboratorial de uroculturas. No entanto, devem-se levar em consideração aspectos importantes como: facilidade de aquisição dos meios, custo, tamanho da demanda para este tipo de exame, presença de postos de coleta remotos.A utilização de meios combinados é uma opção que permite uma melhor distinção dos possíveis uropatógenos e também dos contaminantes. 5.5 Diagnostico laboratorial da Escherichia coli A infecção urinária pode apresentar-se de várias formas clínicas. Pode ser assintomática e só ser diagnosticada mediante a realização de exames laboratoriais, apresentando bacteriúria. Esta forma de infecção representa uma “colonização” das vias urinárias baixas. Por outro lado, as bactérias podem penetrar nas camadas mais profundas da bexiga, levando à febre baixa, micção freqüente e dor na micção, isto é, disúria. Estas são as manifestações clínicas da cistite. (KUNIN,1997). 47 Por ser a Escherichia coli o maior agente causador das infecções do trato urinário, torna-se necessário um estudo mais aprofundado sobre esta bactéria. Germano e Germano (2003) afirmam que esta bactéria Foi descrita pela primeira vez, no final do século XIX, como Bacterium coli devido ao fato de ser um microrganismo encontrado no cólon, é extremamente comum nos animais e homem. Durante a maior parte do século XX, ela foi relacionada com a prática insatisfatória de higiene - contaminação de origem fecal. Todavia, nas últimas décadas comprovou-se que eram altamente patogênicas para o homem e podiam provocar infecções graves, levando os pacientes ao óbito. Isto ocorreu devido ao aprofundamento dos estudos e à identificação de diferentes cepas de E.coli associadas a quadros clínicos de colite hemorrágica, disenteria, cistite, nefrite, infecção diferida cirúrgicas, septicemia e especialmente da síndrome uremia – hemolítica. (GERMANO; GERMANO,2003). A E.coli possui fímbrias ou pili (pêlos), são apêndices filamentosos menores e mais curtos que os flagelos e se fixa na parede do trato urinário para não ser arrastada pelo fluxo urinário, a E.coli na flora intestinal não causa dano algum, pois faz parte da microbiota intestinal, mas, se alcançar as vias urinárias, causa infecção por ser um patógeno agressivo no trato urinário. As enterobactérias são diferenciadas por seu comportamento bioquímico. (MURRAY et al. 2006; TORTORA; FUNKE; CASE, 2008; TRABULSI; ALTERTHUM, 2008). O diagnóstico das ITU geralmente é baseado em sintomas como micção dolorosa ou sensação de que a bexiga não se esvazia, mesmo após a infecção. A urina pode estar turva ou ter uma leve coloração sanguinolenta. (TORTORA; FUNKE; CASE, 2005). O diagnóstico das infecções por E. coli é baseado na cultura da urina, seguida do isolamento e identificação bioquímica da bactéria. A urina na bexiga é normalmente estéril, mas a contaminação geralmente é frequente, mesmo quando a coleta é realizada cuidadosamente, ou quando é obtida, por exemplo, por cateterização. Antes da coleta e particularmente em mulheres, deve – se fazer assepsia da genitália com sabonete e água, descartando – se o primeiro jato e coletando – se o segundo. Além disso, a urina deve ser processada imediatamente ou cultivada dentro de oito horas se for mantida sob refrigeração a 4°C. (MURRAY et al. 2006; TORTORA; FUNKE; CASE, 2008; TRABULSI; ALTERTHUM, 2008). 48 O diagnóstico é sempre realizado com a orientação tradicional de que a urina contendo mais de 100 mil bactérias por mililitro é uma indicação de infecção urinária, sendo aquela modificada, contagens tão baixas quanto 1000/ml de qualquer tipo bacteriano único, ou deaté 100/ ml de coliformes (bactérias intestinais como E.coli), são agora consideradas uma indicação de infecção significativa, especialmente se houver leucócitos na urina (piúria). Antes da terapia ser iniciada a cultura das bactérias da urina é feita para determinar a sensibilidade ao antibiótico. (TORTORA, FUNKE; CASE, 2009). Como critérios de avaliação de bacteriúria considerável, utilizam-se, na prática, dois critérios: o de Kass e o de Stamm. Segundo Kass, são consideradas amostras compatíveis com ITU aquelas com contagem de colônias igual ou maior a 100.000 UFC/mL (Unidades formadoras de colônia por mililitro de urina). Já, segundo Stamm, são consideradas amostras compatíveis com ITU aquelas com contagem de colônias igual ou maior a 100 UFC/mL. Sendo a urina um elemento estéril, a simples presença de bactérias, independente de sua quantidade, deveria indicar ITU, o que, na prática, não se demonstra. Deve-se considerar a possível contaminação da amostra através da microbiota vaginal, o que aumentaria muito o número de resultados falsopositivos, se o critério utilizado for o de Stamm. Porém, como veremos adiante, este critério se adequa melhora a realidade pediátrica, na qual, muitas vezes, os critérios de Kass são pouco sensíveis a determinadas situações clínicas. (MURRAY et al. 2006; TORTORA; FUNKE; CASE, 2008; TRABULSI; ALTERTHUM, 2008). O critério de Stamm auxilia a diferenciar casos de contaminação dos casos de ITU, porém, o critério não é, atualmente, muito apreciado pelos microbiologistas devido ao elevado índice de resultados falso negativos, demonstrando a alta especificidade, e, também, a baixa sensibilidade. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Utilizando somente os critérios de Kass, o número de mulheres com cistite aguda e microbiota inferior a 100.000 UFC/mL foi altíssimo; sendo assim, foram interpretados como “não infectadas”, segundo tais critérios. Já no caso de utilização dos critérios de Stamm, para estes mesmos casos, o número de 49 culturas ditas positivas foi de 36%. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). Demonstra-se, através desta discussão, que ambos os critérios deverão ser utilizados, sempre acompanhados de dados clínicos compatíveis para que se diagnostique ITU. Atualmente, os critérios de Stamm são utilizados para crianças e mulheres jovens. Bactérias da família Enterobacteriaceae estão envolvidas em quase todas as uretrocistites não gonocócicas, sendo a Escherichia coli identificada como o agente causal de aproximadamente 80 % dos casos na comunidade, entre mulheres na idade fértil.Prostatite bacteriana, crônica é uma doença comum no homem. É de difícil cura e é, frequentemente, responsável por infecções recidivas no trato urinário. A prostatite é, geralmente, causada por bacilos gram-negativos, com E. coli presente em 80% dos pacientes.Na pielonefrite aguda, até 90% dos paciente têm E. coli como agente etiológico. A incidência de E. coli, como agente etiológico na pielonefrite crônica, vem diminuindo, mas permanece ainda como o agente mais comum. Infecções mistas podem ocorrer, quando há obstrução do trato urinário ou o uso de cateteres. (STRASINGER; DI LORENZI, 2009; HENRY, 2008). 50 CONCLUSÕES Pelo presente levantamento de dados sobre as infecções do trato urinário provocadas por Escherichia coli verificou-se que este é o principal agente etiológico deste tipo de patologia, devido a seus diversos mecanismos patogênicos e pela facilidade de proliferação no sistema urinário humano. Outro ponto importante é a alta taxa de prevalência destas infecções em mulheres. Com relação ao diagnóstico laboratorial, observou-se que existem uma enorme variedade de testes que permitem detectar tal bactéria. Acredita-se que deve-se levar em consideração aspectos importantes quanto à escolha da metodologia, como: facilidade de aquisição dos meios, custo, tamanho da demanda para este tipo de exame, presença de postos de coleta remotos.A utilização de meios combinados é uma opção que permite uma melhor distinção dos possíveis uropatógenos e também dos contaminantes. Assim, acredita-se que o estudo contribuiu de forma positiva para a caracterização deste tema no meio científico, através da síntese dos tópicos abordados e sugestões para o diagnóstico diferencia e seguro destas infecções. 51 REFERÊNCIAS BIBLIOGRÁFICAS AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Descrição dos meios de cultura empregados nos exames microbiológicos. Módulo IV. 4 ed. 2003 ASSOCIAÇÃO BRASILEIRA DE NORMAS E TÉCNICAS (ABNT). NBR 15268 de 30 de novembro de 2005 – Laboratório Clínico: Requisitos e recomendações para exame de urina.Rio de janeiro: ABNT, 2005. BARSANTI, J. A. Genitourinary infections. In: Greene, C. E. Infections diseases of the dog and cat. 2 ed. Philadelfia: WB Saunders; 1998 BARTGES, J. W. Diagnosis of urinary tract infections. Disponivel em: <http://www.ncbi.nlm.nih.gov/pubmed/15223209>. Acesso em: 12 de maio di 2012. BASTOS, R.K.X.; AURAZO, M.C.; MOSCOSO, J.C. Evaluacion de laremoción d enteroparasitosenlas lagunas de San Juan de Miraflores. In: CONGERSO INTERAMERICANO DE INGIENERIA SANITARIA Y AMBIENTAL XXVI, Lima, Peru. Proceedings. AIDIS, Lima , Peru, 1998. BOWER, J.M., ETO, D.S., MULVEY, A. Convert operation of uropathogenic Escherichia coli wihin the urinary tract. Traffic. 2005. BRUGGEMANN, Odaleia Maria; PARPINELLI, Mary Ângela. Utilizando as abordagens quantitativas e qualitativas na produção de conhecimento. Disponivel em <http://www.scielo.br/pdf/reeusp/v42n3/v42n3a20.pdf>. Acesso em:12 de maio de 2012. CARVALHAL, Gustavo F.; ROCHA, Luiz Carlos A.; MONTI, Paulo R. Urocultura e exame comum de urina: considerações sobre sua coleta e interpretação. Revista da AMRIGS, Porto Alegre, v. 50, n. 1, p. 59-62, janeiro/março, 2006 Dicionário Médico Stedman - Stedman - 27 ª Edição, Editora: Guanabara Koogan,Edição: 2003. DIFFERENTIALMEDIA. Eosin Methilene Blue Agar (Levins’s Formutation). Disponivel em <HTTP://www.jlindquist.net/generalmicro/defemb.html> . Acesso em :12 de maio de 20012. FRANCO, Marco Antônio. Atlas de Parasitologia Humana.2 ed. 2012. GERMANO, Pedro. GERMANO; Maria I. S. Higiene e Vigilância Sanitária de Alimentos. São Paulo: Varela, 2003. GYLES, C.L; FAIRBROTHER, J.M. Escherichia coli. In:GYLES, C.L.; PRESCOTT, J.F.; SONGER, J.G.; THOEN, C.O. (Ed.). Pathogenesis of bacterial infections in animals. Ames, Iowa: Iowa StateUniversity Press, 2004 52 HACKER, J; BLUM-OELHER, G. In appreciation of Theodor Escherich. Nat. Revista Microbiologic, 2007. HENRY, John Bernard. Diagnósticos clínicos e tratamento por métodos laboratoriais. 20 ed. Tradução: Ida Cristina Gubert. Baruri: Manole, 2008. HÖRNER, Rosmari et al. Comparação de método de triagem para detecção de bacteriúria em amostras do bairro Maringá e do Hospital Universitário de Santa Maria. Disponível em: http://w3.ufsm.br/revistasaude/2008/34a%2812%2916-21,%202008.pdf. Acesso em: 19 de Outubro. 2011. KONEMAN, Elmer W. et al. Diagnóstico microbiológico: texto e atlas colorido. 6 ed. Rio de Janeiro: Guanabara Koogan, 2010. LABORATOY HANDBOOK ON MASTITIS. Photographs from National Mastitis Council publication. Disponível em : <http://www.nmconline.org/ecoli.htm>. Acesso em 12 de maio de 2012. MACHADO, B. M. et al. Análise dos métodos diagnósticos para infecção urinária. Jornal Brasileiro de Pediatria, São Paulo, v. 17, n. 1, p. 42-46, janeiro, 1995. MARTINI, Rosiéli et al. Caracterização de culturas de urina realizadas no laboratório de análises clínicas do hospital universitário de Santa Maria – Santa Maria, RS, no período de 2007 a 2010. 2011. Manual de referências bibliográficas. Disponível em: http://www.newslab.com.br/newslab/revista_digital/100/artigo-4.pdf. Acesso em: 19 de Outubro. 2011. MAGOT, M., et al. Desulfovibriolongus sp. nov., a sulfate-reducing bacterium isolated from an oil-producing well. Int J SystBacteriol, v. 42, p. 398–403, 1992. MITRA IMAGES. Cysteine Lactose Electrolyte Deficient Agar. Disponível em :<http://images.mitrasites.com/cysteine-lactose-electrolyte-deficient-agar.html>. Acesso em: 12 de maio de 2012. MURRAY, Patrick R et al. Microbiologia Médica. 7 ed. São Paulo: Elsevier, 2009. OLIVEIRA, Bernardo Gabriel et al. A Identificação Direta Pelos Meios Cromogênicos é Confiável a Ponto de Dispensar as Provas Bioquímicas?. Disponível em: http://www.newslab.com.br/ed_anteriores/75/art03.pdf. Acesso em: 22 de Novembro. 2011. OPLUSTIL, Carmem Paz et al. Procedimentos Básicos em Microbiologia Clínica.3 ed. São Paulo: Sarvier, 2010. 53 PEREIRA, Maurício Gomes. Epidemiologia: Teoria ePrática. Rio de Janeiro: Guanabara Koogan. 1995. RINGSRUD, K. M.; LINNÉ, J. J. Urinalysis and body fluids: a color text and atlas. Sant. Louis: Mosby, 1995. SILVA, Carlos Henrique Pêssoa de Meneses. Protocolos de Microbiologia Clínica: urocultura. NewsLab, edição 88, 2008 SILVA, F. F. P. et al. Resistência a antimicrobianos de Escherichia coli isolada de dejetos suínos em esterqueiras. Arquivo Brasileiro de Medicina Veterinária e Zootencnia, Porto Alegre, v.60, n.3, p.762-765, 2008. STRASINGER, Suzan K.; DI LORENZI, Marjorie S. Urinálise e fluídos corporais. 5 ed. São Paulo: Livraria Médica Paulista, 2009. TORTORA, Gerard J. FUNKE, Berdell R.; CASE, Christine L. Microbiologia.8 ed. Tradução: Roberta Marchiori Martins. Porto Alegre: Artmed, 2005. TRABULSI, Luiz Rachid; ALTERTHUM, Flávio. Microbiologia. 5 ed. São Paulo: Atheneu, 2008. TSORAEVA, Anna; MARQUES, Paula Forjas. Meios cromogênicos e fluorogênicos: uma nova realidade. Disponivel em: <http://www.biocendobrasil.com.br/%5Cdocumentos%5Ccromogenicos.pdf>. Acesso: 12 de maio de 2012. 54
Download