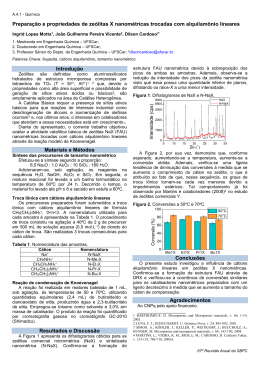
Estrutura de cristais iônicos Regras de Pauling Estabilidade energética Por que os íons preferem ficar juntos, formando um cristal, do que moléculas isoladas? formar A Constante de Madelung é uma definição precisa da energia de uma particular estrutura cristalina com relação ao mesmo número de moléculas isoladas. constante de Madelung representa a energia eletrostática do cristal, com relação à energia do mesmo número de moléculas individuais. A Constante de Madelung é uma medida da estabilização eletrostática para cristais estáveis tem valor 1 Tipo da estrutura Sal de Rochele 1,748 Cloreto de Césio 1,763 Zinc Blend ( ZnS ) 1,638 Wurtzita ( ZnS ) 1,641 Fluorita 2,519 Corindum 4,040 CRISTAIS IÔNICOS • Mínima energia eletrostática é atingida quando a atração cátion-ânion é maximizada e a repulsão eletrostática minimizada • Íons de uma determinada carga preferem ter o máximo número de vizinhos de carga oposta • Frequentemente os íons grandes forma a estrutura CFC ou HC e os interstícios são ocupados por íons de cargas opostas de uma maneira ordenada •Qualquer arranjo deve satisfazer a neutralidade elétrica local, que quando estendida ao longo do cristal, mantém a estequiometria ou razão cátion/ânion Neutralidade elétrica: - A carga total deve ser zero. Estabilidade da estrutura: - Máximo número de vizinhos com carga oposta Regras de Pauling para o empacotamento dos cristais • Permite entender como a estrutura iônica é formada • Podem ser utilizadas para prever a estrutura que um determinado composto irá se cristalizar Baseadas na estabilidade geométrica do empacotamento de íons de diferentes tamanhos, combinado com os argumentos de estabilidade eletrostática Primeira Regra Estabelece que cada cátion será coordenado por um poliedro de ânions, sendo que o número de íons é determinado pela relação dos seus raios O número de ânions que envolve um cátion central num sólido iônico é denominado Número de Coordenação A estabilidade será maior quanto maior for o número de ânions que envolvem um cátion Razão Rc/Ra – pode-se determinar o maior poliedro tal que o cátion preencha completamente o interstício. Ex: Determine o número de coordenação nos sólidos iônicos CsCl e NaCl Dados: raios iônicos Cs+=0,170nm; Na+=,0,102nm e Cl-= 0,181nm Segunda Regra Esta regra garante que o poliedro básico de coordenação tem um arranjo tridimensional de maneira a preservar a neutralidade elétrica “Força de ligação” cátion-ânion – definida como a valência do íon dividida pelo seu número de coordenação A valência do cátion é dividida igualmente entre o número de ligações com os ânions vizinhos, o número dessas ligações depende totalmente da coordenação do cátion A soma de todas as forças de ligação que atingem o íon deve ser igual à sua valência Ex: NaCl Ex: CaF NC=6 – coordenação octaédrica NC = 8 Força de ligação (FL) = Carga/NC = 1/6 Força de ligação (FL) = Carga/NC = 1/6 Por outro lado, o ânion deve ser coordenado com cátions suficientes para satisfazer sua valência, ou seja: “ A soma de todas as forças de ligações que atingem o íon deve ser igual a sua valência” Exemplos: MgO NC = 6 SiO2 NC = 4 Em compostos multicomponentes um ânion poder ser coordenado por mais de um tipo de cátion, sendo que cada cátion tem uma força de ligação diferente Importante para entender a coordenação dos cátions ao redor dos ânions, bem como a dos ânions ao redor dos cátions Terceira Regra vértices – arestas - faces Essa regra é baseada no fato de que os cátions preferem maximizar sua distância dos outros cátions para minimizar a repulsão eletrostática Quarta regra • Poliedros formados ao redor de cátions de baixo número de coordenação e alta carga tendem a ser ligados através dos vértices • Numa estrutura contendo diferentes cátions, aqueles com alta carga e baixo número de coordenação tendem a não compartilhar elementos do poliedro Quinta Regra • Estruturas simples são preferidas com relação a arranjos mais complexos • Por exemplo: quando cátions de tamanhos semelhantes e valência iguais são incorporados numa rede, eles freqüentemente ocupam o mesmo tipo de lugar, mas são distribuídos de uma maneira aleatória formando solução sólida. • Quando a diferença entre os cátions é muito grande, eles podem possuir coordenação diferente e a complexidade da estrutura aumenta. Mesmo em estruturas complexas, os elementos químicos ocupam posições estruturais específicas Número de constituintes diferentes em uma estrutura tende a ser pequeno Substâncias tendem a reter a menor energia potencial possível e um grande número de constituintes gera estrutura complexa, onde a presença de descontinuidades e tensões internas aumentarão a energia potencial, resultando em instabilidade.
Baixar