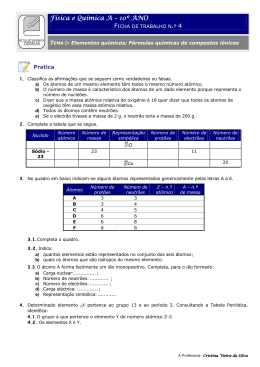
Átomos, elementos químicos, número atómico e número de massa Em cada átomo, há um núcleo central com partículas com carga elétrica positiva (protões) e partículas neutras (neutrões, partículas sem carga elétrica) — exceto num tipo de átomos de hidrogénio, que têm apenas um protão e um eletrão. 1H Raio atómico: uma característica dos elementos químicos http://www.nist.gov/cnst/epg/atom_manipulation_stm.cfm O raio dos átomos varia entre um mínimo de 31 pm e um máximo de 298 pm (ver tabela em baixo). A unidade pm, picómetro, é a unidade de comprimento mais utilizada para exprimir esse raio. O picómetro (pm) é a milionésima de milionésima do metro (1 pm = 10–12 m). Podemos, pois, dizer que o raio dos átomos varia entre a dezena e a centena de picómetros. Fotos de átomos do elemento químico cobalto, Co. 152 pm = 0,152 nm 1 n = 10−9 0,000 000 001 m = O prefixo “nano”, símbolo “n”, representa 10–9 1 p = 10 Utiliza-se também, frequentemente, o nanómetro, que é igual a 1000 picómetros. Em nanómetros, o raio dos átomos varia de 0,031 nm até 0,298 nm. 1 1 m= m = 10−9 m = 1 nm 1 000 000 000 109 (nanómetro) 1 1 0,000 000 000 001 m = m= m = 10−12 m = 1 pm 1 000 000 000 000 1012 −12 2H Modelos de átomos de três isótopos de hidrogénio: 1H, 2H e 3H. Apenas os isótopos hidrogénio 1 e hidrogénio 2 existem na Natureza. O termo isótopo é formado a partir das raízes gregas isos (“igual”) e topos (“lugar”) e refere-se ao “mesmo lugar” na tabela periódica. número de massa Representação dos três isótopos de H, com indicação do número de massa e do número atómico. Como se “fotografam” os átomos Tubo com elétrodo (ponta) 2 53 2 112 Controlo do tubo Ponta 18 167 4 Amplificador Milionésima do metro (micrómetro) 1 3 3 H 1 número atómico Milésima do metro (milímetro) H 2 H 1 Note-se que “1” e “2” são o número de partículas no núcleo dos átomos (o chamado número de massa) de cada isótopo de hidrogénio: 1 protão + 0 neutrões no isótopo 1H e 1 protão + 1 neutrão no isótopo 2H. A massa dos átomos do isótopo 1H é, evidentemente, menor do que a massa dos átomos do isótopo 2H. Milésima de milionésima do metro (nanómetro) 1 1 nm = nm = 10–3 nm 1000 103 hidrogénio 1 H 1 Por exemplo: na Natureza há apenas dois isótopos de hidrogénio: hidrogénio 1 e hidrogénio 2, que são representados por 1H e 2H. Milionésima de milionésima do metro (picómetro) 1 nm = 1000 pm = 103 pm 1 3H Mas os átomos de um mesmo elemento químico podem ter número diferente de neutrões. Por exemplo, há átomos de cloro com 18 neutrões e outros como 20 neutrões. Utiliza-se o termo isótopo para designar átomos de um mesmo elemento mas com diferente número de neutrões. Há mais de 300 isótopos naturais e milhares de isótopos artificiais (muitos são utilizados em medicina). (picómetro) O prefixo “pico”, símbolo “p”, representa 10–12 1 pm = O número de protões é uma característica de cada elemento químico e é designado por número atómico do elemento. Representa-se por Z. 13 5 número atómico 14 15 67 7 87 6 16 56 8 17 48 9 Ponta 31 Amostra Tensão elétrica He hélio 42 10 Processamento dos dados e imagem 38 raio atómico em pm Li lítio Be B berílio boro http://en.wikipedia.org/wiki/Atomic_radius#Calculated_atomic_radii sódio Mg magnésio N nitrogénio 13 118 14 111 15 11 190 12 145 Na C carbono 3 4 5 6 7 8 9 10 11 12 Al alumínio Si silício O oxigénio 98 16 P fósforo F flúor 88 17 S enxofre Cl 19 243 20 194 21 184 22 176 23 171 24 166 25 161 26 156 27 152 28 149 29 145 30 142 31 136 32 125 33 114 34 103 35 K potássio Ca cálcio Sc escândio Ti titânio V vanádio Cr cromo Mn manganês Fe ferro Co cobalto Ni níquel Cu cobre Zn zinco Ga gálio Ge germânio As arsénio Se selénio néon 79 18 cloro Br 71 Ar árgon 94 36 bromo 88 Kr crípton 37 265 38 219 39 212 40 206 41 198 42 190 43 183 44 178 45 173 46 169 47 165 48 161 49 156 50 145 51 133 52 123 53 115 54 108 Rb rubídio Sr estrôncio Y ítrio 55 298 56 253 57-71 Cs césio 87 Fr frâncio 28 Ba bário 88 Ra rádio lantanídios Zr zircónio Nb nióbio Mo molibdénio tecnécio Ru ruténio Rh ródio Pd paládio Ag prata Cd cádmio In índio Sn estanho Sb antimónio Te telúrio I iodo 72 208 73 200 74 193 75 188 76 185 77 180 78 177 79 174 80 171 81 156 82 154 83 143 84 135 85 Hf háfnio 89-103 104 actinídios rutherfórdio Ta tântalo 105 dúbnio W tungsténio 106 seabórgio Re rénio 107 bóhrio Os ósmio 108 hássio Ir irídio 109 meitnério Pt platina Au ouro Hg mercúrio 110 111 112 darmstácio roentgénio copernício Tl tálio 113 http://passarolafq.pt Pb chumbo 114 Bi bismuto 115 Po polónio 116 At ástato 117 Amostra Ne Xe xénon 86 120 Rn rádon 118 Raios atómicos dos diversos elementos químicos, em picómetros. O elemento que tem átomos de menor raio é o hélio (grupo 18, 1.º período) e o que tem átomos de maior raio é o césio (grupo 1, 6.º período). YouTube: “A Boy And His Atom: The World's Smallest Movie” Os átomos podem “ser vistos” usando microscópios de varrimento por efeito túnel (em inglês STM, «Scanning Tunneling Microscope»). Estes microscópios usam uma sonda extremamente fina, de dimensões atómicas, na extremidade. Esta sonda é colocada por cima do material que se pretende “fotografar”. A ponta da sonda fica a uma tensão elétrica extremamente elevada, de modo que possa atrair os eletrões da superfície do material examinado (a ponta tem de estar muito perto da superfície mas não pode encostar!). Os eletrões «saltam», então, do material para a ponta. O microscópio diz-se de varrimento porque, por meio de um braço mecânico (como o de um robô), consegue–se colocar a ponta sucessivamente em vários sítios, “varrendo” a superfície do material que está a ser observado. Saltam mais ou menos eletrões conforme eles forem mais abundantes ou mais escassos: por isso, o que se tem no final do varrimento é uma imagem da distribuição eletrónica. Essa imagem é tratada em computadores e pode ser pintada com cores «falsas». Nessas imagens vê-se como é a matéria: os eletrões distribuem-se principalmente em certos sítios, que são os átomos. Vê-se perfeitamente a forma regular como os átomos estão dispostos. Nota: os valores dos raios atómicos podem diferir de fonte para fonte, devido aos diferentes métodos de cálculo utilizados. http://www.youtube.com/watch?v=oSCX78-8-q0 http://passarolafq.pt 29
Baixar