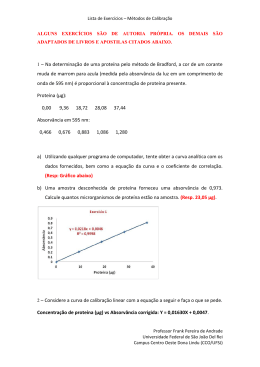
Lista de Exercícios –Espectrometria Atômica ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS CITADOS ABAIXO. 1 – No intuito de se determinar a pureza do sal Na2HPO4, 2,469 g de amostra foi pesada, dissolvida e diluída num balão volumétrico de 100 mL. Então, realizou-se a determinação de fósforo por espectrometria de absorção atômica por chama, onde a solução resultante forneceu uma absorvância de 0,135. DADOS: MMsal = 142 g/mol ; MMP = 31,0 g mol. a) Utilizando qualquer programa de computador, obtenha as curvas analíticas com os dados fornecidos, bem como as respectivas equações e coeficientes de correlação. (Resp: Gráfico abaixo). ppm P ABS 2130 0,048 4260 0,110 6400 0,173 8530 0,230 b) Determine a pureza do sal. (Resp: 90,9% de pureza). Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica 2 –Na determinação de Mn em água do mar, dois pesquisadores utilizaram GF AAS. Os metais traços presentes na amostra foram separados da matriz complexa e rica em sal por meio de coprecipitação com Fe3+, da seguinte maneira: uma alíquota de 5,0 mL de Fe3+ 2000 ppm foi adicionado a 1,0 mL de amostra e o pH foi ajustado para 9,00 com hidróxido de amônio. Após a separação por filtração dos elementos, os pesquisadores adicionaram ao filtrado 2,0 mL de HNO3 e ajustaram o volume para 50,0 mL. Então, para determinar o Mn2+, eles diluíram 1,0 mL desta solução em um balão de 100 mL. As medidas foram realizadas com uma curva de adição-padrão. Os dados encontramse na tabela abaixo. Descrição ABS 2,5 µL de amostra + 2,5 µL de solução padrão de Mn2+ 0,00 ppb 0,223 2,5 µL de amostra + 2,5 µL de solução padrão de Mn2+ 2,50 ppb 0,294 2,5 µL de amostra + 2,5 µL de solução padrão de Mn2+ 5,00 ppb 0,361 a) Utilizando qualquer programa de computador, obtenha as curvas analíticas com os dados fornecidos, bem como as respectivas equações e coeficientes de correlação. (Resp: Gráfico abaixo). Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica b) Determine a concentração de Mn2+ (em ppb) na amostra. (Resp: 40,5 ppb de Mn2+). c) Explique a necessidade do procedimento de coprecipitação nesta análise e cite outra possibilidade de se determinar a analito sem a coprecipitação. d) Em determinadas condições, é possível obter um LD de 0,10 ppm de Mn no F AAS. Fale sobre a possibilidade de se utilizar esta técnica para a determinação deste analito, apresentando as vantagens e desvantagens. e) Suponha que você fosse o responsável pela análise e tem disponível em seu laboratório ICP OES. Você adotaria esta técnica para a determinação deste constituinte? Explique. f) Agora, suponha que você tenha disponível os seguintes equipamentos: F AAS, GF AAS e ICP OES. Suponha ainda que você deve fazer a determinação de Mn 2+ e dos demais elementos coprecipitados em aproximadamente 70 amostras. Qual das técnicas vocês adotaria? Explique. 3 – a) Diga a função de cada constituinte enumerado na Figura abaixo. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica b) Se fosse necessário fazer a determinação de Zn em hortaliças e Al (elemento refratário) em solo, diga e explique qual seria a mistura necessária para a chama. (Resp: C2H2/ar para Zn e C2H2/N2O para Al). 4 – Um estudante de doutorado necessitava avaliar efeitos de matriz num método desenvolvido para a determinação de Cd, Co, Cr e Pb por F AAS. Nesta avaliação, era necessária a construção de uma curva analítica em meio ao branco do método e outra curva analítica em meio a matriz. Faça o que se pede: a) Sabendo que em cada nível de concentração das curvas, era necessário um mínimo de 95% de branco ou matriz, sugira uma maneira de preparar adequadamente uma curva multivariada, nos dois meios, de modo a atende as concentrações listadas na tabela abaixo. Considere que os padrões de cada analito seja de 1,000 g/L. Tabela: Níveis de concentração para as curvas analíticas. Volume final = 25,0 mL. Ponto Cd (ppm) Co (ppm) Cr (ppm) Pb (ppm) 1 0,00 0,00 0,00 0,00 2 0,25 0,50 0,75 0,50 3 0,50 1,00 1,50 1,00 4 0,75 1,50 2,25 1,50 5 1,00 2,00 3,00 2,00 6 1,25 2,50 3,75 2,50 b) Sabe-se que o método proposto é uma digestão de 2,00 g de amostra cujo volume final é ajustado para 30,0 mL. Diga qual é a massa de amostra necessária para obtenção de digeridos suficientes para a construção de três curvas matrizadas. Diga quantas digestões seriam necessárias para a obtenção de três curvas em meio ao branco do método. (Resp: 150 g de amostra e quinze digestões). c) Diga quais os parâmetros devem ser avaliados para a determinação do efeito de matriz. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica 5 – Considere os dados apresentados na tabela abaixo, obtidos para a determinação de potássio a 404,3 nm. Amostra (µg K/mL) Intensidade de emissão Branco 6 5 130 10,0 249 20,0 492 30,0 718 Amostra desconhecida 423 a) Utilizando qualquer programa de computador, obtenha as curvas analíticas com os dados fornecidos, bem como as respectivas equações e coeficientes de correlação. (Resp: Gráfico abaixo). b) Determine a concentração de potássio. (Resp: 17,3 µg/mL). 6 – Uma amostra desconhecida de Cu2+ forneceu absorvância de 0,262 em uma análise por absorção atômica. A seguir, 1,00 mL de solução contendo 100,0 ppm de Cu 2+ foi misturado com 95,0 mL da amostra desconhecida e a mistura foi diluída a 100,0 mL. A absorvância da nova solução foi de 0,500. Qual é a concentração de cobre na solução? (Resp: 1,04 µg/mL). Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica 7 – Na determinação de um analito X por F AAS, adotou-se o seguinte procedimento: 10,0 mL da amostra foram pipetados para balões de 50,0 mL. Nestes balões, adicionou-se diferentes volumes de padrão contendo 12,2 ppm do analito e o volume foi ajustado. Os dados obtidos encontram-se na tabela abaixo. Amostra, mL Padrão, mL Absorvância 10,0 0,00 0,201 10,0 10,0 0,292 10,0 20,0 0,378 10,0 30,0 0,467 10,0 40,0 0,554 a) Utilizando qualquer programa de computador, obtenha as curvas analíticas com os dados fornecidos, bem como as respectivas equações e coeficientes de correlação. (Resp: Gráfico abaixo). b) Determine a concentração do analito. (Resp: 5,60 µg/mL). Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios –Espectrometria Atômica DADOS Referências 1. Harvey, D. Modern Analytical Chemistry. 1a ed. McGraw-Hill Higher Education. 2000 2. Harris, D. C. Explorando a Química Analítica. 4ª ed. LTC – Livros Técnicos e Científicos Editora, Rio de Janeiro, 2011. 3. Harris, D. C. Análise Química Quantitativa. 6ª ed. LTC – Livros Técnicos e Científicos Editora, Rio de Janeiro, 2005. 4. Skoog, D. A.; West, D. M.; Holler, F. J.; Crouch, S. R. Fundamentos de Química Analítica. 8ª ed. Pioneira Thomson Learning, São Paulo, 2006. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ)
Baixar