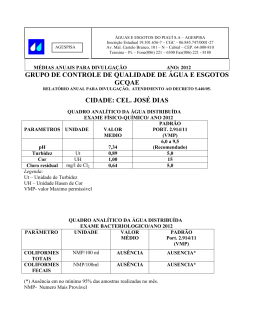
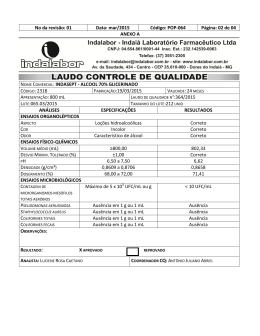
20-10-2010 Curso de Especialização Tecnológica em Qualidade Ambiental Manual de monitorização microbiológica ambiental 2.Qualidade microbiológica da água Unidade de formação: Monitorização ambiental | microbiologia Manuela Abelho Manuela Abelho Manual de monitorização microbiológica ambiental 2.Qualidade microbiológica da água Índice 1.Qualidade da água ........................................................................................................ 5 O conceito de qualidade da água ................................................................................ 5 O conceito de poluição/contaminação da água .......................................................... 6 2. Microrganismos e qualidade da água ......................................................................... 7 Os microrganismos como poluentes .......................................................................... 7 Microrganismos como indicadores de poluição ......................................................... 7 3. Água destinada ao consumo humano....................................................................... 10 Legislação aplicável ................................................................................................... 10 Localização dos pontos de amostragem .................................................................... 11 Qualidade microbiológica: valores paramétricos ...................................................... 11 Controlo da qualidade ................................................................................................12 Métodos analíticos de referência (Decreto-Lei 306/2007) ......................................12 Bactérias coliformes e Escherichia coli (E. coli): norma ISO 9308-1 ............................................... 12 Enterococos: norma ISO 7899-2 ......................................................................................................... 12 Pseudomonas aeruginosa: norma EN ISO 12780 ............................................................................. 13 Enumeração de microrganismos viáveis — número de UFC a 22°C e a 37ºC: norma EN ISO 6222 ............................................................................................................................................................... 13 Clostridium perfringens (incluindo esporos) ..................................................................................... 13 4. Águas para produção de água para consumo humano, para suporte de vida aquícola e águas de rega ................................................................................................14 Legislação aplicável ....................................................................................................14 Águas doces superficiais e subterrâneas destinadas à produção de água para consumo humano.......................................................................................................14 Águas para suporte de vida aquícola ......................................................................... 15 Águas de rega .............................................................................................................16 Métodos analíticos de referência (Decreto-Lei 236/98) ...........................................16 Coliformes totais, coliformes fecais e estreptococos fecais ................................................................ 16 Salmonelas ............................................................................................................................................ 17 2 Manuela Abelho Ovos de parasitas intestinais ............................................................................................................... 17 5. Águas balneares ......................................................................................................... 17 Legislação aplicável .................................................................................................... 17 Ponto de amostragem, recolha e conservação das amostras ................................... 18 Métodos analíticos de referência (Decreto-Lei 135/2009) ...................................... 18 Enterococos intestinais: normas ISO 7899-1 ou ISO 7899-2 ............................................................ 18 Escherichia coli: normas ISO 9308-3 ou ISO 9308-1 ........................................................................ 19 6. Métodos gerais de análise microbiológica ................................................................19 Inoculação de tubos múltiplos e determinação do NMP ......................................... 20 Filtração por membrana ............................................................................................21 7.Protocolos específicos ................................................................................................ 22 Protocolo 7.1 Recolha de amostras de água ............................................................ 22 Norma aplicável: EN 25667-2 | ISO 5667-2:1991 .............................................................................. 22 Recolha de amostras de água de uma torneira ................................................................................... 22 Recolha de amostras de água de um curso de água, de um reservatório ou de uma praia .............. 23 Protocolo 7.2 Enumeração de microrganismos cultiváveis: contagem de colónias por sementeira em meio extracto de levedura agar ................................................. 23 Norma aplicável: EN ISO 6222 | ISO 6222:1999 ............................................................................... 23 Primeiro tempo: elaboração do meio de cultura ................................................................................ 23 Meio agar extracto de levedura............................................................................................................ 23 Segundo tempo: recolha, diluição, sementeira e incubação das amostras ....................................... 24 Terceiro tempo: contagem das colónias .............................................................................................. 24 Protocolo 7.3 Detecção e enumeração de Escherichia coli e de bactérias coliformes pelo método da filtração por membrana .................................................................. 25 Norma aplicável: EN ISO 9308-1 | ISO 9308-1:2000 ....................................................................... 25 Primeiro tempo: elaboração de meios de cultura ............................................................................... 25 Meio agar de lactose TTT com heptadecilsulfato de sódio ................................................................. 25 Caldo de triptofano:.............................................................................................................................. 26 Meio agar triptonado de soja (TSA): ................................................................................................... 26 Segundo tempo: recolha, filtração e incubação das amostras ........................................................... 26 Terceiro tempo: exame e repicagem.................................................................................................... 27 Quarto tempo: diferenciação e contagem ........................................................................................... 27 Protocolo 7.4 Detecção e enumeração de enterococos intestinais pelo método da filtração por membrana ............................................................................................ 28 Norma aplicável: EN ISO 7899-2 | ISO 7899-2:2000 .......................................................................28 Primeiro tempo: elaboração de meios de cultura ............................................................................... 29 Meio Slanetz e Bartley .......................................................................................................................... 29 Meio bílis-esculina-azida agar/1000 mL: ........................................................................................... 29 3 Manuela Abelho Segundo tempo: recolha, filtração e incubação das amostras ........................................................... 29 Terceiro tempo: confirmação e contagem ...........................................................................................30 Protocolo 7.5 Detecção e enumeração de coliformes totais, coliformes fecais e Escherichia coli pelo método do Número Mais Provável (NMP) ............................ 30 Primeiro tempo: elaboração de meios de cultura ............................................................................... 31 Caldo bílis verde brilhante ................................................................................................................... 31 Caldo peptonado ................................................................................................................................... 32 Segundo tempo: recolha das amostras e teste presuntivo ................................................................. 32 Terceiro tempo: verificação da existência de coliformes e teste final ............................................... 32 Quarto tempo: verificação da existência de coliformes fecais e de E. coli ........................................ 33 Protocolo 7.6 Detecção e enumeração de estreptococos fecais pelo método do Número Mais Provável (NMP) ................................................................................. 33 Primeiro tempo: elaboração de meios de cultura ............................................................................... 33 Meio Bagg ............................................................................................................................................. 33 Segundo tempo: recolha das amostras e incubação ........................................................................... 33 Terceiro tempo: verificação da existência de estreptococos fecais .................................................... 34 Protocolo 7.7 Detecção e enumeração de Clostridium perfringens (incluindo esporos) ........................................................................................................... 34 Decreto-Lei 306/2007 ......................................................................................................................... 34 Primeiro tempo: elaboração de meios de cultura ............................................................................... 34 Meio m-CP agar .................................................................................................................................... 34 Segundo tempo: recolha das amostras e incubação ........................................................................... 35 Terceiro tempo: diferenciação ............................................................................................................. 35 Referências citadas ....................................................................................................... 35 4 Manuela Abelho 1.Qualidade da água A água é um recurso essencial à vida, indispensável para a humanidade mas também para os outros organismos e para a manutenção das funções e da integridade dos ecossistemas (Mendes, 2010). A água é um elemento fundamental para o desenvolvimento sustentável dos países, pelo que a falta de água ou a falta de água com qualidade diminuem a qualidade de vida das populações. Devido ao aumento da população humana as necessidades de água têm vindo a aumentar; no entanto, as actividades humanas directa ou indirectamente podem diminuir a qualidade da água, tornando-a imprópria para determinados fins, ou seja, podem diminuir a quantidade de água com qualidade para ser utilizada nalgumas actividades. Na União Europeia, a legislação regula a gestão das águas superficiais, designadamente as águas interiores, de transição e costeiras, e das águas subterrâneas, de forma a: a) evitar a continuação da degradação e proteger e melhorar o estado dos ecossistemas aquáticos e também dos ecossistemas terrestres e zonas húmidas directamente dependentes dos ecossistemas aquáticos, no que respeita às suas necessidades de água; b) promover uma utilização sustentável de água, baseada numa protecção a longo prazo dos recursos hídricos disponíveis; c) obter uma protecção reforçada e um melhoramento do ambiente aquático, nomeadamente através de medidas específicas para a redução gradual e a cessação ou eliminação por fases das descargas, das emissões e perdas de substâncias prioritárias; d) assegurar a redução gradual da poluição das águas subterrâneas e evitar o agravamento da sua poluição; e) mitigar os efeitos das inundações e das secas; f) assegurar o fornecimento em quantidade suficiente de água de origem superficial e subterrânea de boa qualidade, conforme necessário para uma utilização sustentável, equilibrada e equitativa da água; g) proteger as águas marinhas, incluindo as territoriais; h) assegurar o cumprimento dos objectivos dos acordos internacionais pertinentes, incluindo os que se destinam à prevenção e eliminação da poluição no ambiente marinho (Lei nº58/2005). O conceito de qualidade da água O conceito de qualidade da água é relativo, já que depende do uso a que se destina ou do objectivo do seu utilizador. Assim, a qualidade da água pode ser definida, para fins específicos, como o conjunto de características físicas, químicas e biológicas adequadas à sua utilização para determinado uso. Para cada uso da água é pois necessário estabelecer as exigências relativas à sua qualidade, isto é, definir parâmetros de qualidade e estabelecer os seus valores-limite (Mendes, 2010). 5 Manuela Abelho O Decreto-Lei 236/98, de 1 de Agosto define quatro tipos principais de utilização da água: águas para consumo humano, águas para suporte de vida aquícola, águas balneares e águas de rega. As águas para consumo humano são águas doces que podem ter origem em águas superficiais, em águas subterrâneas ou em águas de abastecimento. As águas para suporte de vida aquícola são águas superficiais, doces ou salobras, continentais ou litorais, destinadas à produção de peixe (águas piscícolas) ou de bivalves (águas conquícolas). As águas balneares são águas doces lóticas e lênticas, comummente designadas de correntes e paradas, assim como a água do mar e as águas estuarinas, que se encontrem classificadas como águas balneares ou, não estando classificadas, onde o banho não esteja interdito e seja habitualmente praticado por um número considerável de banhistas (aproximadamente 100/dia, durante a época balnear). A água de rega é água superficial ou subterrânea ou água residual, que vise satisfazer ou complementar as necessidades hídricas das culturas agrícolas ou florestais (artigo 3º do Decreto-Lei 236/98). Os limites paramétricos estabelecidos na legislação são principalmente desenvolvidos para a prevenção da ocorrência de surtos sanitários, fornecendo uma informação limitada sobre a protecção do ambiente e da saúde. Os limites paramétricos podem definir-se como (i) a concentração de uma substância ou organismo que não representa um perigo significativo para a saúde de um número significativo de utilizadores; (ii) as condições nas quais a exposição a essa substância ou organismo não são prováveis, ou (iii) uma combinação de ambos (Mendes, 2010). Assim, são normalmente impostos na legislação dois limites paramétricos, o valor máximo recomendável (VMR) e o valor máximo admissível (VMA). O VMR é o valor de norma de qualidade que não deverá ser ultrapassado (Decreto-Lei 236/98) e garante a manutenção da saúde do consumidor e a cobertura das suas necessidades alimentares. O VMA é o valor da norma de qualidade que, de preferência, deve ser respeitado ou não excedido (Decreto-Lei 236/98); ou seja, como nem sempre os valores obtidos são ≤ VMR, toma-se em conta o VMA, na perspectiva de que nesse intervalo de valores (VMR-VMA) não se verificarão riscos significativos para a saúde dos consumidores. O conceito de poluição/contaminação da água A poluição da água pode ser definida como: (i) a inadequação da sua aplicabilidade para algum objectivo considerado, (ii) qualquer modificação natural ou artificial que directa ou indirectamente modifique, altere ou destrua o equilíbrio dos ecossistemas e dos recursos naturais de tal modo que traga perigo para a saúde pública, diminua a sua adequabilidade ou eficiência e o bem-estar do Homem e das suas comunidades, ou (iii) a alteração da composição ou do estado da água de tal forma que se torne menos adequada para todas ou algumas das funções e fins a que pode ser adequada 6 Manuela Abelho no seu estado natural. O conceito de contaminação é definido como a introdução ou descarga na água de organismos patogénicos ou de substâncias tóxicas que a tornem imprópria para consumo público e/ou usos domésticos, ou seja, a contaminação pode ser considerada um aspecto específico da poluição. 2. Microrganismos e qualidade da água Os microrganismos como poluentes Os poluentes podem ser inorgânicos, organismos e biológicos, incluindo-se os microrganismos neste último grupo. Os perigos mais significativos da poluição biológica por microrganismos devem-se à contaminação das águas por resíduos fecais ou urinários, provenientes do metabolismo dos animais homeotérmicos1. Embora muitos microrganismos associados a este tipo de resíduos sejam inofensivos para pessoas saudáveis, alguns são agentes patogénicos2. Quando existe contaminação da água por fezes, as bactérias de origem fecal (associadas às fezes) são uma causa potencial de várias doenças que podem ocorrer sob a forma epidémica – doença que afecta simultaneamente muitos indivíduos, por contágio – ou sob a forma endémica – doença que se verifica permanentemente numa dada região. Para além das bactérias fecais, outros microrganismos presentes na água – vírus, helmintas, protozoários, … – podem representar perigos para as populações humanas, mas não fazem em geral parte da análise sistemática incluída nas normas legais da maioria dos países não tropicais. Microrganismos como indicadores de poluição O número de microrganismos presentes nos materiais fecais é muito elevado, cerca de 109 (i.e., 10 000 000 000) de cada um dos grupos pesquisados por cada grama de 1 Animais homeotérmicos (também chamados animais de sangue quente) são aqueles que mantêm a sua temperatura corporal constante, independentemente da temperatura ambiente (e.g., mamíferos e aves). Pelo contrário, os animais poiquilotérmicos (também designados por animais de sangue frio) não conseguem manter a temperatura corporal constante e aquecem ou arrefecem com as alterações da temperatura ambiente (e.g., répteis e anfíbios). 2 Agentes patogénicos são organismos capazes de causar doenças infecciosas nos seus hospedeiros. 7 Manuela Abelho material fecal, dos quais apenas alguns são patogénicos (Mendes, 2010). Ou seja, juntamente com os microrganismos patogénicos são libertados microrganismos não patogénicos ou de patogenia limitada, pelo que a presença ou ausência desses microrganismos numa amostra indica se a água em questão foi ou não contaminada por fezes, isto é, se apresenta o perigo de conter microrganismos fecais patogénicos. Os microrganismos não patogénicos ou de patogenia limitada são indicadores de contaminação fecal e são utilizados para monitorizar as águas para a contaminação por fezes (Mendes, 2010). A escolha dos indicadores de qualidade microbiológica da água obedece a vários critérios (Mendes, 2010): 1. A concentração do microrganismo indicador na água contaminada deve ter uma relação directa com o grau de contaminação; 2. O microrganismo indicador deve ser suficientemente conhecido, de forma a permitir a atribuição de valores-limite; 3. A análise do microrganismo indicador deve ter uma metodologia padronizada e específica para o microrganismo em causa (i.e., a presença de outros microrganismos não deve gerar resultados positivos) e suficientemente sensível para detectar níveis baixos do indicador; 4. A análise do microrganismo indicador deve ser rápida, inequívoca e de baixo custo; 5. O microrganismo indicador deve estar presente sempre que microrganismos fecais patogénicos estejam também presentes, e em quantidade superior aos patogénicos; 6. O microrganismo indicador deve ser mais resistente aos agentes desinfectantes que os microrganismos patogénicos (i.e., deve sobreviver mais tempo); 7. O microrganismo indicador não deve reproduzir-se na água (para não causar sobre-estimativas da poluição) 8. O microrganismo indicador deve distribuir-se de forma aleatória na massa de água; 9. O microrganismo indicador deve ser propício para a análise de todos os tipos de água: torneira, rios, subterrânea, barragens, estuários, oceanos, águas residuais… (i.e., deve ser capaz de sobreviver nos vários tipos de água); 10. O microrganismo indicador deve ser inofensivo para o ser humano. Os indicadores clássicos de contaminação fecal são (i) o grupo dos coliformes fecais e não fecais, (ii) o grupo dos enterococos fecais, (iii) Clostridium perfringens; e (iv) o número de UFC a 22ºC e a 37ºC. 8 Manuela Abelho O grupo dos coliformes é constituído por bactérias da família Enterobacteriaceae, habitantes do aparelho intestinal do homem e de outros animais homeotérmicos. São bactérias Gram-negativas, em forma de bacilo e anaeróbias facultativas. Algumas são oxidase-positivas e crescem em condições aeróbias em meio de cultura selectivo contendo sais biliares; outras são capazes de fermentar lactose a 37ºC com libertação de gás e de ácido e outras são capazes de fazer a fermentação a 44.5ºC. A fermentação da lactose a 44.5ºC permite distinguir os coliformes não fecais (37ºC) dos coliformes fecais (44.5ºC). Nos coliformes fecais inclui-se, por exemplo, a bactéria Escherichia coli (Mendes, 2010). Os enterococos fecais são caracterizados pela capacidade de crescerem entre 10 e 45ºC, a pH 9.6, em meio de cultura contendo 6.5% de cloreto de sódio (NaCl), na presença de 40% de sais biliares e em concentrações de azida inibidoras do crescimento dos coliformes. São bactérias Gram-positivas que reduzem azul-demetileno em 0.1% de leite e conseguem sobreviver a 60ºC durante 30 minutos. Nos enterococos fecais inclui-se, por exemplo, Enterococcus faecalis (Mendes, 2010). Clostridium perfringens é uma bactéria anaeróbia, esporulada, redutora de sulfito, Gram-positiva, em forma de bacilo, habitante do intestino do homem e de outros animais homeotérmicos. Esta bactéria tem interesse como indicador de poluição fecal antiga, devido ao seu longo tempo de permanência na água e à grande capacidade de sobrevivência dos seus esporos (Mendes, 2010). O número de UFC a 22ºC e a 37ºC não é um indicador específico de poluição fecal mas sim de enriquecimento por matéria orgânica facilmente degradável. As contagens de colónias são úteis para a avaliação do estado da água e dos processos de tratamento utilizados, por exemplo, nas ETARs. O principal interesse da contagem de colónias reside na possibilidade de detectar as alterações em relação ao histórico, baseando-se num controlo frequente e a longo prazo. A ocorrência de um aumento repentino do número de UFC pode significar que existe um foco de poluição. Devido ao aprofundamento dos estudos microbiológicos, actualmente utilizam-se, em substituição ou em adição aos indicadores clássicos, outros microrganismos, chamados novos indicadores. A bactéria Escherichia coli substituiu, na legislação actual, os coliformes fecais como indicadores de contaminação fecal. Esta bactéria apresenta uma grande diversidade de adaptações ao meio, podendo causar várias doenças que originam diarreias (Mendes, 2010). A bactéria Pseudomonas aeruginosa é outro dos chamados novos indicadores. Não é um habitante específico do intestino mas aparece em 12% da população. É uma bactéria oportunista, aeróbia, Gram-negativa, patogénica e com elevada resistência a antibióticos (Mendes, 2010). 9 Manuela Abelho Existem outros microrganismos presentes na água que podem representar perigo para as populações humanas, como os vermes helmintas, alguns protozoários (e.g., Giardia, Cryptosporidium, Entamoeba, Acanthamoeba,…) e vírus, mas a legislação actual não prevê a sua análise de rotina (Mendes, 2010). 3. Água destinada ao consumo humano Legislação aplicável Decreto-Lei 306/2007, de 27 de Agosto | http://dre.pt/pdf1sdip/2007/08/16400/0574705765.pdf Estabelece o regime da qualidade da água destinada ao consumo humano, procedendo à revisão do Decreto-Lei 243/2001, de 5 de Setembro, que transpôs para o ordenamento jurídico interno a Directiva 98/83/CE, do Conselho, de 3 de Novembro, tendo por objectivo proteger a saúde humana dos efeitos nocivos resultantes da eventual contaminação dessa água e assegurar a disponibilização tendencialmente universal de água salubre, limpa e desejavelmente equilibrada na sua composição. Define como água destinada ao consumo humano: (i) Toda a água no seu estado original, ou após tratamento, destinada a ser bebida, a cozinhar, à preparação de alimentos, à higiene pessoal ou a outros fins domésticos, independentemente da sua origem e de ser fornecida a partir de uma rede de distribuição, de um camião ou naviocisterna, em garrafas ou outros recipientes, com ou sem fins comerciais; (ii) Toda a água utilizada numa empresa da indústria alimentar para fabrico, transformação, conservação ou comercialização de produtos ou substâncias destinados ao consumo humano, assim como a utilizada na limpeza de superfícies, objectos e materiais que podem estar em contacto com os alimentos, excepto quando a utilização dessa água não afecta a salubridade do género alimentício na sua forma acabada. Define os métodos de controlo da qualidade da água, estabelecendo a localização dos pontos de amostragem, as frequências mínimas de amostragem (variáveis consoante o volume de água fornecida; Anexo II do Decreto-Lei 306/2007), estabelecendo um controlo de rotina e um controlo de inspecção da qualidade da água. 10 Manuela Abelho Localização dos pontos de amostragem A localização dos pontos de amostragem depende da proveniência da água (artigo 10º, número 2): No caso da água fornecida a partir de uma rede de distribuição, no ponto em que, no interior de uma instalação ou estabelecimento, sai das torneiras normalmente utilizadas para consumo humano; No caso da água fornecida a partir de fontanários não ligados à rede de distribuição, no ponto de utilização; No caso da água fornecida por entidades gestoras em alta, nos pontos de amostragem dos pontos de entrega aos respectivos utilizadores; No caso da água fornecida a partir de camiões, navios--cisterna e reservatórios não ligados à rede de distribuição, no ponto de utilização; No caso da água destinada à venda em garrafas e outros recipientes, com ou sem fins comerciais, no fim da linha de enchimento; No caso da água utilizada numa empresa da indústria alimentar, no ponto de utilização. Qualidade microbiológica: valores paramétricos Os valores paramétricos e os parâmetros microbiológicos que a água destinada ao consumo humano deve respeitar são divididos em duas partes, uma relativa à água fornecida por redes de distribuição, fontanários, camiões ou navios-cisterna, reservatórios e utilizada na indústria alimentar (Tabela 3.1) e outra relativa à água colocada à venda em garrafas ou noutros recipientes (Tabela 3.2). Tabela 3.1. Parâmetros microbiológicos e valores paramétricos para a água fornecida por redes de distribuição, fontanários, camiões ou navios-cisterna, reservatórios e água utilizada na indústria alimentar (Decreto-Lei 306/2007, anexo I, parte I). Parâmetro Escherichia coli (E. coli) Enterococos Valor paramétrico 0 0 Unidade Número/100 mL Número/100 mL Tabela 3.2. Parâmetros microbiológicos e valores paramétricos para a água colocada à venda em garrafas ou outros recipientes (Decreto-Lei 306/2007, anexo I, parte I). Parâmetro Escherichia coli (E. coli) Enterococos Pseudomonas aeruginosa Nº UFC a 22ºC Nº UFC a 37ºC Valor paramétrico 0 0 0 100 20 Unidade Número/250 mL Número/250 mL Número/250 mL Número/mL Número/mL 11 Manuela Abelho Controlo da qualidade Os parâmetros microbiológicos a analisar nos controlos de rotina são os constantes da Tabela 3.3. No controlo de inspecção devem ser analisados os parâmetros constantes da tabela 3.1 ou 3.2, consoante a proveniência da água. Tabela 3.3. Parâmetros microbiológicos a analisar nos controlos de rotina (Decreto-Lei 306/2007, anexo II). Controlo de rotina 1 Bactérias coliformes Escherichia coli (E. coli) Controlo de rotina 2 Clostridium perfringens, incluindo esporos Número de colónias a 22°C Número de colónias a 37°C Pseudomonas aeruginosa Métodos analíticos de referência (Decreto-Lei 306/2007) Bactérias coliformes e Escherichia coli (E. coli): norma ISO 9308-1 Filtração por membrana, em duplicado, seguida de incubação em meio TTC Chapman agar durante 213 horas a 362ºC (coliformes) e 444ºC (E. coli). As colónias que crescem a 36ºC são consideradas coliformes fecais e as colónias que crescem a 44ºC são consideradas E. coli. Após a incubação, as colónias de várias espécies diferentes apresentam diferentes características: E. coli e Citrobacter spp. apresentam colónias amarelas com centro laranja; Enterobacter spp. forma colónias vermelhas ou amarelo-escuro com o centro laranja e o meio de cultura amarelo; Klebsiella spp. forma colónias vermelhas ou amarelas, sem coloração diferenciada no centro e o meio de cultura amarelo; As bactérias que não fermentam lactose formam colónias púrpuras e alteram a cor do meio de cultura para azul. Enterococos: norma ISO 7899-2 Filtração por membrana, em duplicado, seguida de incubação em meio de bílis azida agar durante 213 horas a 352ºC. As colónias de enterococos aparecem rodeadas de uma cor castanha. Transferência dos filtros com as colónias, sem inverter, para uma caixa de Petri com meio agar de bílis azida pré-aquecido a 44ºC e incubação a 440.5ºC durante 2 horas para confirmação imediata. As colónias que apresentem meio com coloração castanha-negra em seu redor são confirmadas como enterococos. 12 Manuela Abelho Pseudomonas aeruginosa: norma EN ISO 12780 Filtração por membrana, em duplicado, seguida de incubação em meio CN agar durante 24-48 horas. Contagem de todas as colónias que apresentem cor azulesverdeada como sendo Pseudomonas aeruginosa. Exame das membranas sob radiação ultravioleta e contagem de todas as colónias que não sejam azul-esverdeadas mas que emitam fluorescência como possíveis P. aeruginosa. Contagem de todas as colónias avermelhadas que não emitam fluorescência como possíveis P. aeruginosa. Para confirmação, repicagem das colónias que necessitam de confirmação para meio agar nutritivo durante 222 horas a 362ºC. Teste da oxidase a todas as colónias que eram inicialmente avermelhadas. Repicagem das colónias com reacção oxidasepositiva para meio B King agar durante 213 horas (mas o período de incubação pode prolongar-se por um máximo de 5 dias) a 362ºC. O crescimento das colónias é observado diariamente sob radiação ultra-violeta (UV). A presença de colónias de Pseudomonas aeruginosa revela-se, sob a radiação UV, pela emissão de fluorescência. Enumeração de microrganismos viáveis — número de UFC a 22°C e a 37ºC: norma EN ISO 6222 Diluições decimais seguidas de inoculação por incorporação, de caixas de Petri, em quadruplicado, com meio de extracto de levedura agar. Incubação de duas caixas a 20-22ºC durante 3 dias e das outras duas a 37ºC durante 44 horas. Contagem de UFC. Clostridium perfringens (incluindo esporos) Filtração em membrana, em duplicado, seguida de incubação anaeróbia da membrana em m-CP agar a 44°C ± 1°C durante 21 ± 3 horas. Contagem das colónias amarelas opacas que passam a rosa ou vermelho após exposição, durante vinte a trinta segundos, a vapores de hidróxido de amónio. 13 Manuela Abelho 4. Águas para produção de água para consumo humano, para suporte de vida aquícola e águas de rega Legislação aplicável Decreto-Lei 236/98, de 1 de Agosto | http://dre.pt/pdf1sdip/1998/08/176A00/36763722.pdf Estabelece normas, critérios e objectivos de qualidade com a finalidade de proteger o meio aquático e melhorar a qualidade das águas em função dos seus principais usos: utilização da água para consumo humano, para suporte de vida aquícola, para efeitos balneares (que passou a ser regulamentada pelo Decreto-Lei 135/2009, de 3 de Junho) e para rega. No que respeita à utilização da água para consumo humano, consideram-se três tipos: (i) águas doces superficiais destinadas à produção de água para consumo humano; (ii) águas subterrâneas destinadas à produção de água para consumo humano e (iii) águas de abastecimento para consumo humano (que passaram a ser regulamentadas pelo Decreto-Lei 306/2007). Águas doces superficiais e subterrâneas destinadas à produção de água para consumo humano As águas superficiais destinadas à produção de água para consumo humano são classificadas nas categorias A1, A2 e A3, de acordo com as normas de qualidade fixadas no anexo I do Decreto-Lei 236/98 (Tabela 4.1), a que correspondem esquemas de tratamento tipo distintos, definidos no anexo II do mesmo Decreto-Lei, para as tornar aptas para consumo humano: classe A1-tratamento físico e desinfecção, classe A2-tratamento físico e químico e desinfecção, classe A3tratamento físico, químico de afinação e desinfecção. 14 Manuela Abelho Tabela 4.1 Parâmetros microbiológicos e valores máximos recomendáveis para as águas doces superficiais destinadas à produção de água para consumo humano (Decreto-Lei 236/98, anexo I). Parâmetro3 Coliformes totais Coliformes fecais Estreptococos fecais Salmonelas Unidade Número/100 mL Número/100 mL Número/100 mL Valor máximo recomendável A1* A2 A3 50 5000 50000 20 2000 20000 20 1000 10000 0 / 5000 mL 0 / 1000 mL - * Categoria também aplicável à qualidade das águas subterrâneas utilizáveis para produção de água para consumo humano. Consideram-se aptas para poderem ser utilizadas como origem de água para a produção de água para consumo humano as águas subterrâneas que apresentem qualidade superior ou igual à da categoria A1 (Tabela 4.1) das águas doces superficiais destinadas à produção de água para consumo humano, correspondendo-lhes o esquema de tratamento indicado no anexo II do Decreto-Lei 236/98 para aquela categoria de águas, com as devidas adaptações. Águas para suporte de vida aquícola Do conjunto de águas para suporte de vida aquícola (águas doces superficiais lóticas e lênticas - piscícolas; águas do litoral e salobras - conquícolas e píscicolas), apenas estão definidas normas de qualidade microbiológica para as águas do litoral e salobras com fins conquícolas (Tabela 4.2), controlo a exercer de no mínimo de três em três meses, não na água mas no corpo do molusco. As normas de qualidade das águas do litoral e salobras para fins aquícolas — águas conquícolas têm por finalidade proteger e melhorar a qualidade dessas águas a fim de permitir a vida e o crescimento de moluscos (bivalves e gastrópodes), equinodermes, 3 Na legislação mais recente relativa à qualidade microbiológica de outros tipos de águas, os estreptococos fecais foram substituídos pelos enterococos – um subgrupo mais resistente às condições do meio, nomeadamente a salinidade, os coliformes fecais foram substituídos por Escherichia coli e os coliformes totais deixaram de ser considerados indicadores específicos de poluição fecal e apenas são considerados indicadores de poluição. No entanto, a avaliação da qualidade microbiológica deste tipo de águas continua a ser ainda regulada pelo Decreto-Lei 236/98. 15 Manuela Abelho tunicados e crustáceos, contribuindo para a boa qualidade dos produtos conquícolas passíveis de consumo pelo homem. Tabela 4.2 Parâmetros microbiológicos e valores máximos recomendáveis para o corpo dos moluscos e para o líquido intervalar (Decreto-Lei 236/98, anexo II). Parâmetro Coliformes fecais Unidade Número/100 mL VMR 300 Águas de rega Os critérios e normas de qualidade das águas de rega visam proteger a saúde pública, a qualidade das águas superficiais e subterrâneas, as culturas que podem ser afectadas pela má qualidade das águas de rega e os solos cuja aptidão para a agricultura pode ser degradada pelo uso sistemático de águas de rega de má qualidade. Nas águas de rega, os parâmetros microbiológicos a considerar são os indicados na Tabela 4.3. Tabela 4.3 Parâmetros microbiológicos e valores máximos recomendáveis para a água de rega (Decreto-Lei 236/98, anexo XVI). Parâmetro Coliformes fecais Ovos de parasitas intestinais Unidade Número/100 mL Número/L VMR 100 - VMA 1 Métodos analíticos de referência (Decreto-Lei 236/98) Coliformes totais, coliformes fecais e estreptococos fecais Podem usar-se dois métodos analíticos: filtração por membrana ou inoculação de tubos múltiplos. A temperatura de incubação é 37ºC 1ºC para os coliformes totais e para os estreptococos fecais e 44.5ºC 0.5ºC para os coliformes fecais. Na filtração por membrana, a inoculação é feita em meio sólido específico adequado para o efeito e contagem das colónias (UFC). As amostras devem ser diluídas ou, quando apropriado, concentradas a fim de que o número de colónias fique compreendido entre 10 e 100. Na inoculação de tubos múltiplos, para os coliformes totais e fecais utiliza-se o método de diluição com fermentação em substratos líquidos em pelo menos três tubos em 3 diluições, com subcultura dos tubos positivos em meios de confirmação e contagem em número mais provável (NMP). Para os estreptococos fecais, utiliza-se o método de diluição em caldo de azoteto de sódio em pelo menos três tubos para cada uma das três diluições e contagem em NMP. 16 Manuela Abelho Salmonelas Concentração por filtração (através de membrana ou filtro apropriado). Sementeira em meio de pré-enriquecimento. Enriquecimento, subcultura em meio de isolamento. Identificação. Ovos de parasitas intestinais Contagem ao microscópio 5. Águas balneares Legislação aplicável Decreto-Lei 135/2009, de 3 de Junho | http://dre.pt/pdf1sdip/2009/06/10700/0346003468.pdf Estabelece o regime jurídico de identificação, gestão, monitorização e classificação da qualidade das águas balneares e de prestação de informação ao público sobre as mesmas, transpondo para a ordem jurídica interna a Directiva n.º 2006/7/CE, do Parlamento Europeu e do Conselho, de 15 de Fevereiro, relativa à gestão da qualidade das águas balneares, e complementando a Lei da Água, aprovada pela Lei 58/2005, de 29 de Dezembro. Define como águas balneares as águas superficiais, quer sejam interiores, costeiras ou de transição, tal como definidas na Lei da Água, aprovada pela Lei n.º 58/2005, de 29 de Dezembro, em que se preveja que um grande número de pessoas se banhe e onde a prática balnear não tenha sido interdita ou desaconselhada de modo permanente. A monitorização das águas balneares deve ser efectuada no prazo máximo de quatro dias a contar da data indicada no calendário de amostragem, o qual é estabelecido pelo INAG para cada época balnear, antes do seu início. O ponto de amostragem é estabelecido no local onde: (i) se preveja maior afluência de banhistas; ou (ii) de acordo com o perfil das águas balneares, onde exista maior risco de poluição, entendida como a presença de contaminação microbiológica ou outros organismos ou resíduos que afectem a qualidade das águas balneares e constituam um risco para a saúde dos banhistas. A monitorização deve ser efectuada com a frequência especificada no anexo II do Decreto-Lei 135/2009, sendo os resultados dessa monitorização utilizados na constituição dos conjuntos de dados sobre a qualidade das águas balneares. 17 Manuela Abelho Os parâmetros microbiológicos a avaliar na avaliação da qualidade das águas balneares são os mesmos para as águas interiores (Tabela 5.1.) e para as águas costeiras e de transição (Tabela 5.2), mas os valores diferem entre os dois tipos de água. Tabela 5.1 Valores paramétricos microbiológicos a observar na avaliação da qualidade das águas balneares interiores (Decreto-Lei 135/2009, anexo I). Parâmetro Enterococos intestinais Escherichia coli Unidade Número/100 mL Número/100 mL Qualidade Excelente Boa Aceitável 200 400 330 500 1000 900 Tabela 5.2 Valores paramétricos microbiológicos a observar na avaliação da qualidade das águas balneares costeiras e de transição (Decreto-Lei 135/2009, anexo I). Parâmetro Enterococos intestinais Escherichia coli Unidade Número/100 mL Número/100 mL Excelente 100 250 Qualidade Boa Aceitável 200 185 500 500 Ponto de amostragem, recolha e conservação das amostras As amostras deverão ser recolhidas 30 cm abaixo da superfície das águas e onde a sua profundidade seja no mínimo de 1 m. Os frascos a utilizar devem ser de material transparente e incolor (vidro, polietileno ou polipropileno), com capacidade mínima de 250 mL e devem encontrar-se estéreis. As amostras devem ser claramente identificadas com tinta indelével na amostra e no formulário relativo à amostra. As amostras de água devem, em todas as fases do transporte, ser protegidas da exposição à luz, em especial à luz directa do sol e conservadas a uma temperatura de cerca de 4ºC até à sua análise. Se for provável que o transporte para o laboratório demore mais de quatro horas, é obrigatório o transporte em frigorífico. O período de tempo decorrido entre a recolha da amostra e a realização da análise deve ser o mais curto possível, sempre que possível no mesmo dia e no prazo máximo de vinte e quatro horas. Métodos analíticos de referência (Decreto-Lei 135/2009) Enterococos intestinais: normas ISO 7899-1 ou ISO 7899-2 Consultar a secção relativa à análise das águas destinadas ao consumo humano, para as quais é referido o mesmo método. 18 Manuela Abelho Escherichia coli: normas ISO 9308-3 ou ISO 9308-1 Consultar a secção relativa à análise das águas destinadas ao consumo humano, para as quais é referido o mesmo método. 6. Métodos gerais de análise microbiológica Para a pesquisa de coliformes, coliformes fecais, Escherichia coli e estreptococos/enterococos fecais existem dois métodos básicos de referência: o método da inoculação de meio líquido em tubos múltiplos com leitura do Número Mais Provável (NMP) e o método da filtração por membrana com inoculação de meio sólido. Na legislação portuguesa mais antiga o método de referência era o dos tubos múltiplos, mas na legislação mais recente o método de referência passou a ser o da filtração por membrana. Apesar desta alteração das normas legais, ambos os métodos possuem vantagens e desvantagens (Tabela 6.1). Tabela 6.1 Vantagens e desvantagens da filtração por membrana em relação à inoculação de tubos múltiplos e determinação do NMP Vantagens da filtração por membrana 1. Tem boa reprodutibilidade 2. Os resultados são relativamente rápidos 3. Os filtros podem ser transferidos para diferentes meios de cultura 3. Permite o processamento de grandes volumes de amostra de forma a aumentar a sensibilidade do teste 4. As filtrações podem ser efectuadas no local de recolha da água 5. É um método mais económico que o NMP Desvantagens da filtração por membrana 1. As amostras com água muito turva impedem a filtração de grandes volumes 2. Quando existe grandes populações de outras bactérias, o crescimento pode ser demasiado elevado para permitir a contagem 3. Se existirem metais e fenóis presentes na amostra, podem adsorver aos filtros e inibir o crescimento bacteriano 19 Manuela Abelho Inoculação de tubos múltiplos e determinação do NMP O método da inoculação de tubos múltiplos e determinação do número mais provável (NMP) pode ser usado para estimar o número de microrganismos viáveis presentes numa determinada população. A amostra é diluída (diluições sucessivas ou inoculação de volumes 10 vezes inferiores para a mesma quantidade de meio 4) inoculando-se um meio de cultura líquido, específico para o microrganismo a pesquisar, com um volume preciso dessas diluições. Desta forma, presume-se que os meios de cultura inoculados com as últimas diluições não vão apresentar qualquer crescimento (resultados negativos) e que ocorrerá crescimento nos tubos que tenham, pelo menos, um microrganismo viável. Se a amostra e as diluições forem homogéneas e se houver um número suficiente de repetições, é possível tratar estatisticamente os resultados e generalizá-los à amostra inicial. Por cada diluição da amostra inoculam-se, geralmente, 3, 5 ou 10 séries de tubos com o referido meio de cultura (repetições). A própria designação do método aponta claramente para o carácter probabilístico que lhe deve ser atribuído. O número de tubos positivos – nos quais ocorreu crescimento – em cada diluição é utilizado para determinar o Número Mais Provável (NMP) desse microrganismo na amostra de água analisada, consultando uma tabela estatística (tabela de McGrady) semelhante à Tabela 6.2. Tabela 6.2 Tabela de McCrady para a determinação do número mais provável (NMP) de microrganismos com base em 5 repetições de cada diluição Número de tubos positivos nas diluições 10 mL 1 mL 0.1 mL 0 0 0 0 0 1 0 0 2 0 1 0 0 1 1 0 0 2 0 2 0 0 2 1 0 3 0 1 0 0 4 NMP / 100 mL de amostra 0 2 4 2 4 6 4 6 6 2 Número de tubos positivos nas diluições 10 mL 1 mL 0.1 mL 4 0 0 4 0 1 4 0 2 4 0 3 4 1 0 4 1 1 4 1 2 4 2 0 4 2 1 4 2 2 NMP / 100 mL de amostra 13 17 20 25 17 20 25 20 25 30 A utilização de inóculos de 10 mL, 1 mL e 0.1 mL é semelhante a inocular a amostra e duas diluições decimais sucessivas dessa amostra 20 Manuela Abelho Número de tubos positivos nas diluições 10 mL 1 mL 0.1 mL 1 0 1 1 0 2 1 0 3 1 1 0 1 1 1 1 1 2 1 2 0 1 2 1 1 2 2 1 3 0 1 3 1 1 4 0 2 0 0 2 0 1 2 0 2 2 0 3 2 1 0 2 1 1 2 1 2 2 2 0 2 2 1 2 2 2 2 3 0 2 3 1 2 4 0 3 0 0 3 0 1 3 0 2 3 1 0 3 1 1 3 1 2 3 1 3 3 2 0 3 2 1 3 2 3 3 3 0 3 3 1 3 4 0 3 4 1 3 5 0 NMP / 100 mL de amostra 4 6 8 4 6 8 6 8 10 8 10 11 5 7 9 12 7 9 12 9 12 14 12 14 15 8 11 13 11 14 17 20 14 17 20 17 20 20 25 25 Número de tubos positivos nas diluições 10 mL 1 mL 0.1 mL 4 3 0 4 3 1 4 3 2 4 4 0 4 4 1 4 4 2 4 5 0 4 5 1 4 5 2 5 0 0 5 0 1 5 0 2 5 0 3 5 0 4 5 1 0 5 1 1 5 1 2 5 1 3 5 1 4 5 2 0 5 2 1 5 2 2 5 2 3 5 2 4 5 2 5 5 3 0 5 3 1 5 3 2 5 3 3 5 3 4 5 3 5 5 4 0 5 4 1 5 4 2 5 4 3 5 4 4 5 4 5 5 5 0 5 5 1 5 5 2 5 5 3 5 5 4 5 5 5 NMP / 100 mL de amostra 25 35 40 35 40 45 40 50 55 25 30 45 60 75 35 45 65 85 115 50 70 95 120 150 175 80 110 140 175 200 250 130 170 225 275 350 425 250 350 550 900 1600 1800+ Filtração por membrana O método da filtração por membrana é efectuado através da filtração de um volume conhecido de amostra através de um filtro de 0.45 m, que retém os microrganismos na sua superfície. A membrana é depois colocada num meio sólido e levada a incubar. O sucesso do método depende na utilização de um meio diferencial ou selectivo, efectivo para o microrganismo que se quer pesquisar. 21 Manuela Abelho 7.Protocolos específicos Protocolo 7.1 Recolha de amostras de água Norma aplicável: EN 25667-2 | ISO 5667-2:1991 As mãos e a roupa dos intervenientes na colheita devem estar limpas. Os recipientes para colheita das amostras de água devem ser de material transparente e incolor (vidro, polietileno ou polipropileno) e estar esterilizados mediante: esterilização em autoclave (mínimo de quinze minutos a 121ºC), esterilização a seco (mínimo uma hora a 160ºC - 170ºC) ou ser constituídos por recipientes irradiados recebidos directamente do fabricante. As amostras devem ser claramente identificadas com tinta indelével no recipiente e no formulário relativo à amostra. A amostra de água deve ser colhida obedecendo aos cuidados de assepsia, deve ser representativa das características microbiológicas do material a analisar e deve ter volume suficiente para permitir, se necessário, a repetição dos testes. O recipiente para a colheita da amostra deve permanecer fechado até ao momento da colheita; nessa altura enche-se sem enxaguar com a água a analisar e fecha-se imediatamente, tendo cuidado para não contaminar durante estas operações as superfícies interiores da rolha ou tampa. O frasco não deve ficar completamente cheio, pois algum espaço vazio no seu interior facilitará a agitação e mistura da amostra antes de se efectuarem as análises. Após a colheita, as amostras de água devem, em todas as fases do transporte, ser protegidas da exposição à luz, em especial à luz directa do sol e devem ser mantidas a uma temperatura de cerca de 4ºC até ao seu processamento. Recolha de amostras de água de uma torneira 1. Lavar e desinfectar as mãos (ou usar luvas estéreis); 2. Retirar qualquer filtro e deixar correr o tempo necessário (1-2 minutos) para esgotar a água que tenha estado parada na canalização; 3. Fechar a torneira e desinfectar o interior e o exterior com álcool; 4. Abrir a torneira com cuidado e deixar a água correr um pouco; 5. Abrir o frasco esterilizado só neste momento e colher a água mantendo-o inclinado para evitar a sua contaminação pelo ar. Manter a rolha na mão esquerda virada para baixo e nunca tocar no interior da rolha ou no gargalo do frasco; 6. Recolher a amostra de água mantendo o frasco inclinado para evitar a sua contaminação pelo ar e sem encher completamente o frasco; 7. Fechar imediatamente o frasco; 8. Identificar a amostra; 22 Manuela Abelho 9. Transportar as amostras em caixa isotérmica com placas acumuladoras térmicas congeladas (4ºC) e realizar a análise nas 4 horas seguintes à colheita. Recolha de amostras de água de um curso de água, de um reservatório ou de uma praia 1. Lavar e desinfectar as mãos (ou usar luvas estéreis); 2. Segurar o frasco numa zona perto da sua base e mergulhá-lo na massa de água com a boca virada para baixo. Deve mergulhar-se até cerca de metade da altura da coluna líquida ou pelo menos até cerca de 20 cm abaixo da superfície da água; 3. Virar o frasco até que o gargalo aponte ligeiramente para a superfície e a boca esteja voltada contra a corrente. Se não existir qualquer corrente (por exemplo, no caso de um reservatório) empurrar o frasco horizontalmente; 4. Recolher a amostra e fechar imediatamente o frasco; 5. Seguir os passos 8-9 indicados para a água recolhida de uma torneira. Protocolo 7.2 Enumeração de microrganismos cultiváveis: contagem de colónias por sementeira em meio extracto de levedura agar Norma aplicável: EN ISO 6222 | ISO 6222:1999 Consiste na enumeração de microrganismos cultiváveis5, por contagem de UFC em meio extracto de levedura agar após incubação aeróbia a 22 e a 36ºC, em águas destinadas ao consumo humano. Faz-se a inoculação de um volume conhecido de amostra ou suas diluições, por homogeneização com um meio de cultura específico em caixas de Petri, com incubação de um conjunto a 36ºC durante 44 horas e de outro conjunto a 22ºC durante 68 horas. No final contam-se as colónias das caixas contáveis e faz-se o cálculo do número de UFC por mililitro da amostra. Primeiro tempo: elaboração do meio de cultura Meio agar extracto de levedura Triptona: 6.0 g Extracto de levedura: 3.0 g 5 Todas as bactérias aeróbias, leveduras e bolores capazes de formar colónias no meio especificado e nas condições de ensaio. 23 Manuela Abelho Agar: 15.0 g Água destilada: 1000 mL pH 7.20.2 a 25ºC; 1. Adicionar todos os ingredientes ou seguir as instruções do preparado em pó (consultar o Protocolo 1.1 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 2. Esterilizar em autoclave em tubos de 15-20 mL (volume para uma caixa de Petri); 3. Conservar no frigorífico até à utilização. Segundo tempo: recolha, diluição, sementeira e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 2. Fundir o meio de cultura no autoclave ou no microondas, deixar arrefecer e manter a 451ºC num banho de água; 3. Se necessário (isto é, se o tipo de água fizer prever um grande conteúdo microbiano que provoque a coalescência das colónias), fazer diluições decimais sucessivas da amostra (consultar o Protocolo 1.4 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 4. Incorporar um inóculo de 1 mL (da amostra ou das suas diluições) em 15-20 mL do meio de cultura fundido (consultar o Protocolo 1.5 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 5. Inocular no mínimo duas caixas de Petri por cada temperatura de incubação; 6. Deixar solidificar, inverter e incubar um conjunto a 362ºC durante 444 h e o outro conjunto a 222ºC durante 684 h. Terceiro tempo: contagem das colónias 1. Observar as caixas assim que terminar o tempo de incubação ou armazená-las a 53ºC e fazer a observação num período de 48h; 2. Contar as colónias observadas em cada caixa (com um número contável de colónias) e calcular o número de UFC presentes num mililitro da amostra para cada temperatura de incubação (consultar o Protocolo 1.8 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 3. Se não existirem colónias nas caixas inoculadas com a amostra não diluída, exprimir os resultados como não detectados num mL; 4. Se existirem mais de 300 colónias nas caixas inoculadas com a diluição maia alta utilizada, exprimir os resultados como> 300. 5. O relatório deve incluir a referência à norma de referência, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio 24 Manuela Abelho e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 7.3 Detecção e enumeração de Escherichia coli e de bactérias coliformes pelo método da filtração por membrana Norma aplicável: EN ISO 9308-1 | ISO 9308-1:2000 Consiste na detecção e na enumeração de Escherichia coli, que normalmente habita o intestino do homem e de outros animais homeotérmicos, indicando a contaminação fecal da água, e de outros coliformes. A presença de coliformes, embora não prove de forma conclusiva a contaminação fecal da água – visto que algumas destas bactérias não de origem intestinal, vivendo no solo e em águas superficiais – pode indicar falhas no tratamento e na distribuição da água destinada ao consumo humano. O método está dividido em duas partes, um ensaio standard de referência (que permite enumerar separadamente E. coli e outras bactérias coliformes) e um ensaio rápido opcional (que permite enumerar E. coli), que podem ser efectuados em paralelo. Neste protocolo apenas abordaremos o ensaio standard de referência. Primeiro tempo: elaboração de meios de cultura Meio agar de lactose TTT com heptadecilsulfato de sódio Meio de base agar de lactose: 1. Lactose: 20 g Peptona: 10 g Extracto de levedura: 6 g Extracto de carne: 5 g Azul de bromotimol: 0.05 g Agar: 15-25 g Água destilada: 1000 mL pH 7.20.2 a 25ºC Adicionar todos os ingredientes ou seguir as instruções do preparado em pó (consultar o Protocolo 1.1 da Parte 1 do Manual de Monitorização Microbiológica Ambiental) e esterilizar em autoclave; Solução TTT: 2. Dissolver 0.05 g de cloreto de 2,3,5-trifeniltetrazolio (TTT) num pequeno volume de água, perfazer até 100 mL, esterilizar por filtração (0.2 m); Solução heptadecilsulfato de sódio: 3. Dissolver 0.2 g de heptadecilsulfato de sódio (Tergitol 7) num pequeno volume de água, perfazer até 100 mL, esterilizar em autoclave; 4. Fundir o meio de base e esperar que arrefeça até 50ºC; 25 Manuela Abelho 5. Adicionar a 100 mL de meio de base, 5 mL da solução TTC e 5 mL da solução de heptadecilsulfato de sódio; 6. Misturar completamente evitando que se formem bolhas; 7. Repartir por caixas de Petri (camada de cerca de 5 mm=cerca de 15 mL/caixa); 8. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Caldo de triptofano: Digestato tríptico de caseína: 10 g L-triptofano: 1 g Cloreto de sódio: 5 g Água destilada: 1000 mL pH 7.50.1 a 25ºC; 9. Repartir em tubos de vidro (cerca de 10 mL em cada tubo) e esterilizar em autoclave; 10. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Meio agar triptonado de soja (TSA): Digestato tríptico de caseína: 15 g Peptona de soja: 5 g Cloreto de sódio: 5 g Agar=15-25 g Água destilada: 1000 mL pH 7.20.1 a 25ºC; 11. Esterilizar e repartir por caixas de Petri (camada de cerca de 5 mm=cerca de 15 mL/caixa); 12. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Segundo tempo: recolha, filtração e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 2. Filtrar 100 mL (ou 250 mL no caso de águas engarrafadas) através do filtro de membrana (pelo menos dois filtros/amostra); 26 Manuela Abelho 3. Colocar o filtro sobre a caixa de Petri com meio agar de lactose TTT com heptadecilsulfato de sódio; 4. Incubar a 362ºC durante 213 h Terceiro tempo: exame e repicagem 1. Examinar a membrana e contar as colónias que apresentem uma cor amarela no meio por baixo da colónia (colónias lactose-positivas6); 2. Repicar todas essas colónias (ou no mínimo 10) para caixas com meio TSA e para tubos com caldo de triptofano; 3. Incubar o meio TSA a 362ºC durante 21 h2 h; 4. Incubar os tubos com caldo de triptofano a 440.5ºC durante 21 h3 h Quarto tempo: diferenciação e contagem 1. Preparar o reagente do teste da oxidase, adicionando 0.1 mg de tetrametil-pfenilendiamina a 10 mL de água destilada; 2. Efectuar o teste da oxidase nas colónias incubadas mo meio TSA: Colocar sobre um papel de filtro duas ou três gotas do reagente da oxidase; Utilizando uma vareta de vidro ou de plástico, retirar uma parte da colónia e depositá-la sobre o papel de filtro molhado; Considerar que ocorreu uma reacção positiva quando se desenvolve uma cor azul/violeta escuro em 30 segundos. 3. Efectuar o teste da produção da formação de indol nos tubos com caldo de triptofano: Adicionar ao tubo 0.2 a 0.3 mL do reagente de Kovacs; Considerar que ocorreu a formação do indol quando se desenvolve uma cor roxaavermelhada na superfície do meio. 4. Considerar todas as colónias com reacção negativa ao teste da oxidase como bactérias coliformes; 6 Bactérias capazes de formar colónias em aerobiose a 362ºC num meio selectivo e diferencial com lactose, com produção de ácido. 27 Manuela Abelho 5. Considerar todas as colónias com reacção negativa ao teste da oxidase e com produção de indol como E. coli. 6. O relatório deve incluir a referência à norma, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 7.4 Detecção e enumeração de enterococos intestinais pelo método da filtração por membrana Norma aplicável: EN ISO 7899-2 | ISO 7899-2:2000 Consiste na detecção e na enumeração de enterococos7 intestinais, nomeadamente Enterococcus faecalis, E. faecium, E. durans e E. hirae. Eventualmente também se poderão enumerar outras espécies de enterococos e algumas espécies de estreptococos, em particular Streptococcus bovis e S. equinus. Os enterococos podem considerar-se como indicadores de contaminação fecal, embora alguns possam ter outras proveniências. A enumeração dos enterococos intestinais baseia-se na filtração de um volume conhecido de amostra, colocando-se o filtro sobre um meio sólido selectivo que contém azida de sódio (a azida de sódio inibe o crescimento das bactérias Gram-negativas) e cloreto de 2,3,5-trifeniltetrazolio, um composto incolor que se reduz a formazão, de cor vermelha, pela acção dos enterococos intestinais. No meio crescem colónias típicas, de cor vermelha, castanha ou rosa, total ou no centro da colónia. Se se formarem colónias típicas, a confirmação é feita por transferência da membrana para agar de bílis de esculina e azida, previamente aquecido a 44ºC. Neste meio os enterococos intestinais hidrolisam a esculina em 2 horas produzindo 6,7dihidroxicumarina que se combina com os iões ferro para formar um composto de cor castanha ou negra que se difunde pelo meio. 7 Microrganismos capazes de reduzir o cloreto de 2,3,5-trifeniltetrazolio (TTC) a formazão e de hidrolisar a esculina a 44ºC sobre os meios especificados nesta norma. 28 Manuela Abelho Primeiro tempo: elaboração de meios de cultura Meio Slanetz e Bartley Meio de base: 1. Triptose: 20 g Extracto de levedura: 5 g Glucose: 2 g Hidrogenosulfato de di-potássio (K2HPO4): 4 g Azida de sódio (NaN3): 0.4 g Agar: 8-18 g Água destilada: 1000 mL pH a 7.20.1 a 25ºC Dissolver todos os componentes levando à fervura, esterilizar em autoclave; 2. Deixar arrefecer até 50-60ºC; Solução TTC: 3. Dissolver 1 g de cloreto de 2,3,5-trifeniltetrazolio (TTC) num pequeno volume de água, perfazer até 100 mL, esterilizar por filtração (0.2 m); 4. Juntar 10 mL da solução TTC a 1000 mL do meio base arrefecido a 50-60ºC; 5. Repartir por caixas de Petri (cerca de 20 mL/caixa); 6. Guardar no frio e no escuro e utilizar no prazo máximo de 15 dias. Meio bílis-esculina-azida agar/1000 mL: Triptona=17 g Peptona=3 g Extracto de levedura=5 g Bílis desidratada=10 g Cloreto de sódio=5 g Esculina=1 g Citrato de ferro (III) e amónia=0.5 g Azida de sódio=0.15 g pH 7.10.1 a 25ºC; 7. Esterilizar em autoclave e repartir por caixas de Petri (cerca de 15 mL/caixa) 8. Guardar no frio e no escuro e utilizar no prazo máximo de 15 dias. Segundo tempo: recolha, filtração e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 29 Manuela Abelho 2. Filtrar 100 mL (ou 250 mL no caso de águas engarrafadas) através do filtro de membrana (pelo menos dois filtros/amostra); 3. Colocar o filtro sobre a caixa de Petri com meio Slanetz e Bartley; 4. Incubar a 362ºC durante 444 h. Terceiro tempo: confirmação e contagem 1. Examinar as membranas e contar todas as colónias que apresentem uma coloração vermelha, castanha ou rosa, no centro ou em toda a colónia; 2. Colocar a membrana numa caixa de Petri com meio bílis-esculina-azida agar, previamente aquecida a 44ºC; 3. Incubar a 440.5ºC durante 2 h; 4. Considerar um resultado positivo todas as colónias que apresentem, no meio circundante, uma coloração castanha ou negra e contá-las como enterococos intestinais 5. O relatório deve incluir a referência à norma, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 7.5 Detecção e enumeração de coliformes totais, coliformes fecais e Escherichia coli pelo método do Número Mais Provável (NMP) O teste completo permite enumerar os coliformes totais e os coliformes fecais (mas não especificamente E. coli) para o que são necessárias três fases: teste presuntivo, teste confirmativo e teste final. s No teste presuntivo (verificação da produção de gás) inoculam-se volumes apropriados da amostra em séries de tubos contendo meio de cultura apropriado, e a incubam-se a 370,5º C, durante 242 horas. Se findo esse período não tiver havido formação de gás em nenhum tubo, prolonga-se a incubação até às 483 horas. O meio de cultura inibe o crescimento dos microrganismos Gram-positivos e encoraja o crescimento dos microrganismos coliformes. Os coliformes usam o oxigénio presente no meio e através da fermentação produzem ácido e gás sob condições anaeróbias. Se não existir produção de gás o resultado do teste é negativo, estabelecendo-se que não existem coliformes na amostra. A formação de gás (resultado positivo) determina a presença de coliformes na amostra. O número de tubos positivos em cada diluição é utilizado para calcular o NMP de microrganismos coliformes na amostra de água. 30 Manuela Abelho No teste confirmativo (confirmação dos resultados) todos os tubos positivos às 24 horas são repicados para um apropriado, incubados a 37ºC e lidos nas condições anteriormente descritas. A formação de gás confirma a presença de coliformes na amostra. Este teste confirma os resultados uma vez que a formação de gás no teste presuntivo pode ter sido devida à actividade de microrganismos não coliformes, como por exemplo Clostridium perfringens, uma bactéria Gram-positiva. No teste final (verificação da presença de coliformes fecais), repete-se o procedimento utilizado no teste confirmativo mas a incubação é feita a 44.5ºC durante 24 a 48 horas. A formação de gás determina a presença de coliformes fecais na amostra. Se não existir formação de gás a 44.5ºC mas existir a 37ºC determina-se que existem coliformes mas que não são fecais. O NMP de coliformes fecais é determinado com base no número de tubos positivos em cada diluição. Um teste adicional permite determinar se a presença ou ausência de E. coli na amostra. Adiciona-se aos tubos inoculados para o teste final reagente de Kovacs (teste do indol). Uma reacção positiva (formação de um anel cor-de-rosa) mostra a presença de E. coli. Uma reacção negativa (formação de um anel da cor do meio) mostra que E. coli não faz parte da população de coliformes fecais presentes na amostra. Primeiro tempo: elaboração de meios de cultura Caldo bílis verde brilhante 1. Seguir as instruções do preparado em pó (consultar o Protocolo 1.1 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 2. Colocar tubos Durham invertidos8 dentro de tubos de ensaio pequenos (10 mL) e distribuir 10 mL de meio em cada tubo de ensaio; 3. Preparar meio com dose dupla (isto é, duas vezes a quantidade indicada na embalagem para a mesma quantidade de água) numa quantidade igual a 1/3 da quantidade de meio simples; 8 Os tubos Durham são semelhantes a pequenos tubos de ensaio; acumulam o gás produzido pelos coliformes permitindo assim a detecção da sua presença numa dada amostra de água; a presença de gás nos tubos Durham é um resultado positivo para coliformes. 31 Manuela Abelho 4. Colocar tubos Durham invertidos dentro de tubos de ensaio grandes (20 mL) e distribuir 10 mL de meio de concentração dupla em cada tubo de ensaio; 5. Esterilizar em autoclave. Caldo peptonado Peptona: 18 g Extracto de carne: 6 g Cloreto de sódio: 6 g Água destilada: 1000 mL 6. Distribuir 10 mL de meio em cada tubo de ensaio; 7. Esterilizar em autoclave. Segundo tempo: recolha das amostras e teste presuntivo 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 2. Inocular 5 tubos contendo 10 mL de meio verde brilhante duplo com 10 mL da amostra; 3. Inocular 5 tubos contendo 10 mL de meio verde brilhante simples com 1 mL da amostra; 4. Inocular 5 tubos contendo 10 mL de meio verde brilhante simples com 0.1 mL da amostra; 5. Incubar a 370.5º C durante 242 horas ou 483 horas. Terceiro tempo: verificação da existência de coliformes e teste final 1. Verificar a produção de gás nos tubos, anotando o número de tubos positivos em cada conjunto de 5 tubos de cada diluição; 2. Usar esses algarismos para determinar o NMP de microrganismos coliformes na amostra (para evitar falsos positivos, porque a formação de gás no teste presuntivo pode ter sido devida à actividade de microrganismos não coliformes, deveria ser feito o teste confirmativo, mas neste protocolo vamos saltar esse passo); 3. Repicar com uma ansa os tubos positivos para novos tubos contendo 10 mL de meio verde brilhante (cor verde) e para novos tubos contendo meio peptonado (cor amarela); 4. Levar a incubar a 44.5ºC durante 24+24 horas 32 Manuela Abelho Quarto tempo: verificação da existência de coliformes fecais e de E. coli 1. Verificar a produção de gás nos tubos com meio verde brilhante, anotando o número de tubos positivos em cada diluição; 2. Usar esses algarismos para determinar o NMP de coliformes fecais na amostra; 3. Adicionar uma gota de reagente de Kovacs a cada um dos tubos com meio peptonado (cor amarela); 4. A formação de um anel cor-de-rosa é um resultado positivo que indica a presença de E. coli na amostra; 5. O relatório deve incluir a referência à norma e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos com os tubos, o NMP de microrganismos coliformes, coliformes fecais e E. coli na amostra e qualquer ocorrência particular observada durante o decorrer da análise. Protocolo 7.6 Detecção e enumeração de estreptococos fecais pelo método do Número Mais Provável (NMP) Primeiro tempo: elaboração de meios de cultura Meio Bagg 1. Seguir as instruções do preparado em pó (consultar o Protocolo 1.1 da Parte 1 do Manual de Monitorização Microbiológica Ambiental) e distribuir 10 mL deste meio em tubos de ensaio pequenos (10 mL); 2. Preparar meio com dose dupla (isto é, duas vezes a quantidade indicada na embalagem para a mesma quantidade de água) numa quantidade igual a 1/3 da quantidade de meio simples e distribuir 10 mL deste meio em tubos de ensaio grandes (20 mL); 3. Esterilizar em autoclave. Segundo tempo: recolha das amostras e incubação 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 2. Inocular 5 tubos contendo 10 mL de meio bagg duplo com 10 mL da amostra; 3. Inocular 5 tubos contendo 10 mL de meio bagg simples com 1 mL da amostra; 4. Inocular 5 tubos contendo 10 mL de meio bagg simples com 0.1 mL da amostra; 5. Incubar a 370.5º C durante 242 horas ou 483 horas. 33 Manuela Abelho Terceiro tempo: verificação da existência de estreptococos fecais 1. Verificar a alteração da cor do meio de cultura de roxo-violeta para amarelo (resultado positivo para a presença de estreptococos); 2. Usar esses algarismos para determinar o NMP de estreptococos fecais na amostra; 3. O relatório deve incluir a referência à norma e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos com os tubos, o NMP de enterococos na amostra e qualquer ocorrência particular observada durante o decorrer da análise. Protocolo 7.7 Detecção e enumeração de Clostridium perfringens (incluindo esporos) Decreto-Lei 306/2007 Primeiro tempo: elaboração de meios de cultura Meio 1. m-CP agar Triptose: 30 g Extracto de levedura: 20 g Sacarose: 5 g Hidrocloreto de L-cisteína: 1g MgSO4.7H2O: 0.1 g Púrpura de bromocresol: 40 mg Agar: 15 g Água destilada: 1000 mL Adicionar todos os ingredientes ou seguir as instruções do preparado em pó (consultar o Protocolo 1.1 da Parte 1 do Manual de Monitorização Microbiológica Ambiental); 2. Ajustar o pH a 7.6 e esterilizar em autoclave; 3. Deixar arrefecer e adicionar: D-ciclocernina: 400 mg Sulfato de B-poliximina: 60 g dissolvidos em 8 mL de água destilada e esterilizada Solução de 0.5% de difosfato de fenolftaleína: 20 mL filtrados e esterilizados Solução 4.5% de FeCl3.6H2O: 2 mL 34 Manuela Abelho 4. Distribuir por caixas de Petri (cerca de 15 mL/caixa) e guardar no frio até à sua utilização. Segundo tempo: recolha das amostras e incubação 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 7.1; 5. Filtrar 250 mL através do filtro de membrana (pelo menos dois filtros/amostra); 6. Colocar o filtro sobre a caixa de Petri com meio m-CP; 7. Incubar a 441ºC durante 213 h. Terceiro tempo: diferenciação 1. Examinar as colónias, identificando aquelas que se apresentam com cor amarela opaca; 2. Expor as colónias a vapores de hidróxido de amónio durante 20-30 segundos (com cuidados – por exemplo, numa hotte - para não inalar os vapores); 3. Contar todas as colónias anteriormente identificadas que passaram a rosa ou vermelho após a exposição aos vapores de hidróxido de amónio; 4. O relatório deve incluir a referência à legislação e a classificação da qualidade da água em função da sua utilização e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos e qualquer ocorrência particular observada durante o decorrer da análise. Referências citadas Mendes, B. (2010). Microbiologia da água. Páginas 506-522 in Ferreira, W.F.C, Sousa, J.C.F. & Lima, N. (coords.). Microbiologia. Lidel-Edições técnicas, Lda. Lisboa. 622 páginas. ISBN 978-972-757-515-2. 35
Download