QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto REAÇÕES QUÍMICAS INTRODUÇÃO A Química tem sido vista como vilã por muitos dos segmentos sociais que a desconhecem. Enquanto ciência, ela contribui para compreendermos as propriedades dos materiais, suas transformações e suas estruturas em um nível de organização inacessível aos nossos sentidos. Já os químicos, desempenham um papel importante na construção do conhecimento sobre processos e produtos que servem ao bem estar das pessoas. Alimentos, roupas, medicamentos, habitações são alguns exemplos de segmentos da indústria e da agropecuária, nos quais o conhecimento químico é fundamental. É fato também que os impactos causados pelas atividades humanas no meio ambiente têm sido cada vez mais graves. O aumento do efeito estufa e a redução da camada de ozônio são exemplos de atividades que dependem da transformação dos materiais. Ainda assim, a Química não é a responsável por esses fenômenos indesejáveis. O conhecimento produzido pelos químicos é um dos instrumentos determinantes para aprofundar ou diminuir os impactos causados pelas atividades humanas no meio ambiente. Saber aplicar esses conhecimentos a partir de critérios e valores definidos pela sociedade é um dos principais instrumentos para tomar decisões sobre o controle dessas atividades e também para equacionar a complexa relação bem-estar social e meio ambiente. Os conhecimentos aqui abordados visam fornecer uma visão geral da fenomenologia das transformações químicas, suas interpretações em termos de modelos microscópicos e suas representações simbólicas. Conhecer as transformações significa também saber utilizá-las para nosso próprio bem-estar. Assim, é importante conhecer aspectos quantitativos das transformações para evitar desperdícios, utilizar racionalmente a energia envolvida no processo, controlar a rapidez da transformação e seu rendimento. Estudar as propriedades das substâncias e interpretá-las em termos dos modelos de ligação química também contribui para evitar riscos à saúde e à contaminação ambiental e para compreender os processos de produção de novos materiais e medicamentos. Defendemos o estudo da Química que não seja memorístico. Como alternativa, convidamos você a compreender processos químicos e estabelecer relações entre o conhecimento científico, suas aplicações e implicações sociais, econômicas, ambientais e políticas. A abordagem sobre reações químicas em alguns livros didáticos permanece com uma classificação antiga, distinguindo os fenômenos em reversíveis (físicos) e irreversíveis (químicos). Isso porque os fenômenos físicos são considerados “superficiais”, transformações ligeiras, e os fenômenos químicos “profundos”, transformações mais definitivas. Essa diferenciação mostra-se equivocada, porque a reversibilidade não é um critério científico de distinção dos diferentes fenômenos. Dobrar uma barra de ferro ou rasgar uma folha de papel, por exemplo, não são atos que impliquem a constituição de novas substâncias e tampouco são reversíveis. Por outro lado, a reação química H2(g) + I2(g) → 2 HI(g) – Calor, a coloração muda de castanho → incolor e tem sua reversão com a variação da temperatura facilmente observada, já que é endotérmica, isto é, absorve energia do sistema. Outra forma que muitos livros didáticos utilizam para distinguir fenômenos físicos e química é a variação de propriedades macroscópicas das substâncias. Também aí podemos encontrar problemas. A vaporização da água e a dissolução de açúcar em água acarretam grandes diferenças nas propriedades macroscópicas e no entanto não costumamos classificar as mudanças de fase e as dissoluções como fenômenos químicos. Se essas e outras formas de classificação se mostram equivocadas, porque nos prendemos a elas? Deixamos de perceber que, mesmo do ponto de vista energético, os limites entre os fenômenos comumente classificados como físicos e químicos não são nada rígidos. Por exemplo, o processo de hidratação do sulfato de cobre, em que há passagem do branco ao azul intenso, é um fenômeno físico ou químico? CuSO4(s) + 5 H2O(l) → CuSO4 . 5 H2O(s) branco azul Além do mais, de maneira geral trabalhamos com processos tradicionalmente classificados tanto como químicos quanto como físicos, muitas vezes acontecendo conjuntamente. Na reação do hidróxido de sódio sólido com ácido clorídrico aquoso há dissolução, reação e hidratação de íons. Em outros processos também ocorrem, paralelamente, mudanças de fase. 1 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Assim sendo, torna-se mais importante a compreensão sobre a multiplicidade de fenômenos com que trabalhamos, sabendo reconhece-los, descrevê-los e explicá-los com base em modelos científicos, ao invés de se prenderem a classificações mecânicas Com esses pressupostos, podemos compreender que na ciência contemporânea a reação química não é apenas o fenômeno químico que ocorre naturalmente, produzindo novas substâncias: é também um programa artificial de produção de novas substâncias. O químico pesquisa quais reações serão capazes de produzir substâncias com as propriedades desejadas. O processo reacional só pode ser compreendido mais claramente se associamos as transformações das substâncias às trans-formações energéticas, de forma dinâmica, evitando a abordagem mecânica - mero jogo de armar que normalmente conferimos ao ensino das reações através de suas representações: as equações químicas. A queima de uma vela, a obtenção de álcool etílico a partir de açúcar e a oxidação (enferrujamento) de um pedaço de ferro são exemplos de transformações onde são formadas substâncias com propriedades diferentes das substâncias que interagem. Tais transformações são chamadas reações químicas, onde as substâncias que interagem são chamadas reagentes e as formadas, produtos. Historicamente, no final do século XVIII, estudos experimentais levaram os cientistas a concluir que as reações químicas obedecem a certas leis. Estas leis são de dois tipos: • Leis ponderais: tratam das relações entre as massas de reagentes e produtos que participam de uma reação; • Leis volumétricas: tratam das relações entre volumes de gases que reagem e são formados numa reação. 1. LEIS PONDERAIS DAS REAÇÕES QUÍMICAS Lei da conservação das massas (lei de Lavoisier) Esta lei foi elaborada, em 1774, pelo químico francês Antoine de Laurent Lavoisier. Os estudos experimentais realizados por Lavoisier levaram-no a concluir que numa reação química, que se processa num sistema fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos: Σmreagentes = Σmprodutos Assim, por exemplo, quando 2 g de hidrogênio reagem com 16 g de oxigênio verifica-se a formação de 18 g de água; quando 12 g de carbono reagem com 32 g de oxigênio ocorre a formação de 44 g de dióxido de carbono. Lei das proporções constantes (lei de Proust) Esta lei foi elaborada, em 1797, pelo químico Joseph Louis Proust. Ele verificou que as massas dos reagentes e as massas dos produtos que participam de uma reação química obedecem sempre a uma proporção constante. Esta proporção é característica de cada reação e independente da quantidade das substâncias que são colocadas para reagir. Assim, para a reação entre hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos: Experimento hidrogênio (g) oxigênio (g) água (g) I 10 80 90 II 2 16 18 III 1 8 9 IV 0,4 3,2 3,6 Observe que para cada reação, a massa do produto é igual à massa dos reagentes, o que concorda com a lei de Lavoisier; as massas dos reagentes e do produto que participam das reações são diferentes, mas as relações massa de oxigênio/massa de hidrogênio, massa de água/massa de hidrogênio e massa de água/massa de oxigênio são sempre constantes. 2 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Experimento moxigênio/mhidrogênio mágua/mhidrogênio mágua/moxigênio I 8/10 = 8 90/10 = 9 90/80 = 1,125 II 16/2 = 8 18/2 = 8 18/16 = 1,125 III 8/1 = 8 9/1 = 9 9/8 = 1,125 IV 3,2/0,4 = 8 3,6/0,4 = 9 3,6/3,2 = 1,125 No caso das reações de síntese, isto é, aquelas que originam uma substância, a partir de seus elementos constituintes, o enunciado da lei de Proust pode ser o seguinte: A proporção, em massa, dos elementos que participam da composição de uma substância é sempre constante e independe do processo químico pelo qual a substância é obtida. As leis ponderais e a teoria atômica de Dalton Na tentativa de explicar as leis de Lavoisier e Proust, em 1803, Dalton elaborou uma teoria atômica, cujo postulado fundamental era que a matéria deveria ser formada por entidades extremamente pequenas, chamados átomos. Estes seriam indestrutíveis e intransformáveis. A partir dessa idéia, Dalton conseguiu explicar as leis de Lavoisier e Proust: Numa reação química a massa se conserva porque não ocorre criação nem destruição de átomos. Os átomos são conservados, eles sofrem apenas um rearranjo. Os agregados atômicos dos reagentes são desfeitos e novos agregados atômicos são formados. Equações químicas Os químicos utilizam expressões, chamadas equações químicas, para representar as reações químicas e, para se escrever uma equação química é necessário: • saber quais as substâncias são consumidas (reagentes) e quais são formadas (produtos); • conhecer as fórmulas dos reagentes e dos produtos; • escrever a equação sempre da seguinte forma: reagentes => produtos Quando mais de um reagente, ou mais de um produto, participarem da reação, as fórmulas das substâncias serão separadas pelo sinal "+"; se for preciso, colocar números, chamados coeficientes estequiométricos, antes das fórmulas das substâncias de forma que a equação indique a conservação dos átomos. Esse procedimento é chamado balanceamento ou acerto de coeficientes de uma equação. Utilizando as regras acima para representar a formação da água temos: Reagentes: Produto: Fórmulas das substâncias: Equação química: Equação química que representa a reação: Hidrogênio e oxigênio Água Hidrogênio: H2; oxigênio: 02; água: H20 H2+02 → H2O (não balanceada) 2 H2 + 02 → 2 H20 Duas moléculas de hidrogênio reagem com uma molécula de oxigênio para formar duas moléculas de água. 2. LEI VOLUMÉTRICA DAS REAÇOES QUÍMICAS Estudos realizados por Gay-Lussac levaram-no, em 1808, a concluir: os volumes de gases que participam de uma reação química, medidos nas mesmas condições de pressão e temperatura, guardam entre si uma relação constante que pode ser expressa através de números inteiros e simples. Assim, por exemplo, na preparação de dois litros de vapor d’água devem ser utilizados dois litros de hidrogênio e um litro de oxigênio, desde que os gases estejam submetidos às mesmas condições de pressão e temperatura. A relação entre os volumes dos gases que participam do processo será sempre: 2 volumes de hidrogênio; 1 volume de oxigênio; 2 volumes de vapor d’água. A tabela a seguir mostra diferentes volumes dos gases que podem participar desta reação. 3 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto hidrogênio + oxigênio → Vapor d’água 20 cm3 10 cm3 20 cm3 180 dm3 90 dm3 180 dm3 82 mL 41 mL 82 mL 126 L 63 L 126 L Observe que nesta reação o volume do produto (vapor d’água) é menor do que a soma dos volumes dos reagentes (hidrogênio e oxigênio). Esta é uma reação que ocorre com contração de volume, isto é, o volume dos produtos é menor que o volume dos reagentes. Existem reações entre gases que ocorrem com expansão de volume, isto é, o volume dos produtos é maior que o volume dos reagentes, como por exemplo na decomposição do gás amônia: Amônia → Nitrogênio 2 NH3(g) N2(g) 2 volumes 1 volume + Hidrogênio + 3 H2(g) 3 volumes Em outras reações gasosas o volume se conserva, isto é, os volumes dos reagentes e produtos são iguais. E o que acontece, por exemplo, na síntese de ácido clorídrico: Hidrogênio + Cloro → Ácido clorídrico H2(g) Cl2(g) 2 HCl(g) 1 volume 1 volume 2 volumes Hipótese de Avogadro Em 1811, na tentativa de explicar a lei volumétrica de Gay-Lussac, Amadeo Avogadro propôs que amostras de gases diferentes, ocupando o mesmo volume e submetidas às mesmas condições de pressão e temperatura, são formadas pelo mesmo número de moléculas. Tomando-se como exemplo a formação de vapor d’água (todos os gases submetidos às mesmas condições de pressão e temperatura) temos: Hidrogênio + Oxigênio → Vapor d’água Dados experimentais 2 volumes 1 volume 2 volumes Hipótese de Avogadro 2x moléculas x moléculas 2x moléculas 2 moléculas 1 molécula 2 moléculas dividindo por x ou seja, a relação entre os volumes dos gases que reagem e que são formados numa reação é a mesma relação entre o número de moléculas participantes. A hipótese de Avogadro também permitiu a previsão das fórmulas moleculares de algumas substâncias. E o que foi feito, por exemplo, para a substância oxigênio. Como uma molécula de oxigênio, ao reagir com hidrogênio para formar água, produz o dobro de moléculas de água, é necessário que ela se divida em duas partes iguais. Portanto, é de se esperar que ela seja formada por um número par de átomos. Por simplicidade, Avogadro admitiu que a molécula de oxigênio deveria ser formada por dois átomos. 4 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Raciocinando de maneira semelhante ele propôs que a molécula de hidrogênio deveria ser diatômica e a de água triatômica, formada por dois átomos de hidrogênio e um de oxigênio. Estas suposições a respeito da constituição das moléculas de água, oxigênio e hidrogênio concordam com as observações experimentais acerca dos volumes dessas substâncias que participam da reação. Atualmente, sabe-se que a hipótese levantada por Avogadro é verdadeira, mas, por razões históricas, sua proposição ainda é chamada de hipótese. Outra decorrência da hipótese de Avogadro é que os coeficientes estequiométricos das equações que representam reações entre gases, além de indicar a proporção entre o número de moléculas que reage, indica, também, a proporção entre os volumes das substâncias gasosas que participam do processo, desde que medidas nas mesmas condições de pressão e temperatura. Podemos exemplificar este fato com as equações das reações descritas anteriormente: Síntese de vapor d’água: 2 H2(g) + 02(g) → 2 H2O(g) Decomposição da amônia: 2 NH3(g) → N2(g) + 3 H2(g) Síntese de ácido clorídrico: H2(g) + Cl2(g) → 2 HCl(g) Massas relativas de átomos e moléculas A hipótese de Avogadro permitiu, mesmo sendo impossível determinar a massa de uma molécula, comparar as massas de várias moléculas. Em outras palavras a hipótese de Avogadro permitiu calcular quantas vezes uma molécula é mais leve ou mais pesada do que a outra. Vejamos como isso pode ser feito. Sabe-se que 10 litros de gás hidrogênio, submetido a 0 ºC e 1 atm, apresentam massa igual a 0,892 g e que o mesmo volume de oxigênio, nas mesmas condições de pressão e temperatura, massa igual a 14,3 g. Como, tanto os volumes dos gases, como as condições de pressão e temperatura em que se encontram são iguais, as amostras gasosas são formadas pelo mesmo número de moléculas. Podemos, então, escrever: massa de uma molécula de oxigênio massa de uma molécula de hidroxigên io = 14,3 g = 16 0,893 g indicando que uma molécula de oxigênio é 16 vezes maior que uma molécula de hidrogênio. TRANSFORMAÇÕES QUÍMICAS E ENERGIA1 Considerando-se que as transformações químicas envolvem energia, se pudermos prever as quantidades de reagentes e produtos que participam de uma reação, poderemos prever, também, a quantidade de energia liberada ou absorvida numa transformação química. Além de energia térmica – que você já conhece das reações de combustão – as transformações podem fornecer energia elétrica, como nas pilhas elétricas. Podem também ser provocada pela energia elétrica, como é o caso da obtenção de alguns metais pelo processo da eletrólise. Pode-se, ainda, obter energia a partir de processos que ocorrem no núcleo de alguns átomos. Historicamente, para os homens das cavernas, que dispunham, inicialmente, apenas de sua força muscular, o controle e o uso do fogo, produzido a princípio pela combustão da madeira, significou uma ruptura definitiva com a vida animal. As transformações químicas, como a cocção de alimentos, a produção de utensílios cerâmicos, metais (como o ferro) e ligas metálicas (como o bronze), só se tornaram possíveis com a energia calorífica do fogo. A utilização do fogo e da tração animal na agricultura desencadeou um processo de sedentarização, que culminou com a instalação de grandes impérios, aprofundando a divisão do trabalho e da sociedade em classes. A energia da mão-de-obra escrava passou a ser responsável pela manutenção da economia, mesmo entre povos como os gregos, que dispunham de tecnologia capaz de explorar outras fontes – eólica e hidráulica, por exemplo. Durante a Idade Média, generalizou-se o uso de rodas d’água, de moinhos de vento e da tração animal na agricultura. 1 Texto adaptado de GEPEQ. Interações e Transformações I Química para o Ensino Médio. São Paulo: EDUSP, 2003. 5 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto O alto-forno a carvão vegetal, já no século XIV, permitiu a fabricação de instrumentos agrícolas, que proporcionavam maior produtividade, aumentando o consumo energético. Para alimentar o alto-forno, as florestas foram sendo dizimadas, e o carvão mineral, um recurso esgotável, substituiu o vegetal. Com o advento da máquina a vapor, no século XVII, a chamada Revolução Industrial ganhou impulso. A máquina passa a ser o principal instrumento de trabalho nas fábricas, embora ainda coexistindo com formas de produção artesanal. As diferenças sociais e o consumo energético aumentam. A grande transformação ocorre na indústria têxtil, com o tear a vapor, e nos transportes, com a locomotiva. O petróleo, embora conhecido desde a Antiguidade, foi obtido pela primeira vez através de perfuração de poços em 1859. Utilizado na solução do problema de iluminação urbana, é hoje um dos responsáveis pela movimentação de motores de explosão, devido às características de seus derivados. Os fenômenos elétricos já eram conhecidos desde o século VI a.C., mas a produção de corrente elétrica de forma controlada só foi obtida a partir dos trabalhos de Luigi Galvani (1737-1798), físico e médico, e Alessandro Volta (1745-1827), físico, ambos italianos. Volta descobriu que a corrente elétrica poderia se manifestar na interação de metais e soluções, construindo, em 1800, uma pilha. Michael Faraday (1791-1867), mais tarde, verifica relações de proporcionalidade entre quantidade de matéria e corrente elétrica. Dos estudos de Faraday e de outros cientistas, pôde-se concluir que as transformações poderiam gerar corrente elétrica e esta poderia gerar transformações. Atualmente, o grande uso das transformações químicas que geram energia elétrica está na fabricação de diversos tipos de pilhas e baterias. Muitos produtos, como os metais, são obtidos a partir de transformações que consomem energia elétrica. A energia nuclear passa a ser difundida após o final da Segunda Grande Guerra, pretensamente como substituta às fontes não renováveis. É possível obter energia elétrica a partir de transformações nucleares. No entanto, problemas decorrentes dessa fonte de “energia do futuro”, como proliferação de armas, problemas ambientais, a questão do lixo atômico e os riscos de acidentes, ainda não foram equacionados. Algumas fontes de energia no Brasil podem ser observadas na Tabela 1. Tabela 1. Fontes de energia no Brasil. Não renovável Petróleo Carvão Gás natural • Refinaria • Siderurgia • Gasômetro • GLP • Carvão metalúrgico • Gás • Querosene • Carvão-vapor Urânio enriquecido • Gasolina Termoelétrica • Diesel ELETRECIDADE • Óleo comestível Renovável Lenha Cana Biomassa Carvoaria Destilaria Biodigestor Carvão vegetal Álcool Biogás Lenha Bagaço Sol, vento, mar Quedas d´água Ao aquecer o sistema sua temperatura aumenta; portanto, o sistema recebe “algo”. Ao se resfriar, o sistema entrega “algo”. Este “algo” foi chamado calor. Galileu (1613) admitia o calor como matéria. Esta matéria é extraordinária, é capaz de penetrar em todo corpo e sair dele. A substância (corpo ou fluido) termógena não é gerada nem destruída e sim redistribuída entre os corpos. Ao aumentar a quantidade de fluido termógeno ou calorígeno no corpo, a temperatura aumenta; diminuindo-a a temperatura também diminui. Quando não existe praticamente substância termógena, a temperatura atinge o valor mínimo possível, ou seja, o zero absoluto. 6 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Francis Bacon (1620), baseando-se na observação de que um pedaço de ferro se aquece quando submetido a fortes golpes de um martelo (fato conhecido por qualquer ferreiro) e também no fato de ser possível gerar fogo por atrito, concluiu: o calor é o resultado do movimento das partículas que constituem um corpo e a temperatura é determinada pela velocidade com que estas partículas se movimentam. Desde que o homem primitivo aprendeu a utilizar o fogo para o seu benefício (aquecer-se, defender-se, cozinhar alimentos), a obtenção de energia a partir de transformações químicas, em especial as combustões, tem exercido papel fundamental nas sociedades. Durante muitos séculos, a combustão da madeira e de outros materiais como óleos e gorduras foi utilizada como fonte de energia. Álcool, gasolina, óleo diesel, lenha, carvão mineral, gás liquefeito de petróleo e querosene são exemplos de combustíveis atualmente utilizados em diferentes setores de atividades do homem. Nossa própria vida depende da energia proveniente da combustão da glicose em nossas células. Foguetes são colocados em órbita terrestre graças à combustão de materiais apropriados, como o gás hidrogênio. Também nas usinas termelétricas, o calor produzido em combustões é transformado em energia elétrica. Muitas interpretações têm sido propostas para as manifestações de energia, como luz e calor, observadas nas transformações químicas e em especial nas combustões, como a teoria do flogístico e a idéia sobre o calórico admitida por Lavoisier e Dalton. Nenhuma dessas teorias, no entanto, esclareceu a origem do calor, de onde ele vem, porque se manifesta. Considere as informações sobre algumas transformações químicas, contidas na tabela a seguir (Tabela 2): Tabela 2. Transformações químicas com suas respectivas condições de ocorrência e efeitos energéticos. Transformação Condições para ocorrer a reação 2 Mg(s) + O2(g) → 2 MgO(s) Os reagentes recebem energia inicial de uma chama ou de uma faísca elétrica. A reação se desenvolve com produção de luz e 1204 kJ de energia, na forma de calor, por 2 mols de Mg. C2H6O(l) +3 O2(g) → 2 CO2(g) + 3 H2O(l) Os reagentes recebem energia inicial de uma chama ou de uma faísca elétrica. Apesar da energia inicial, a reação se desenvolve com produção de 2800 kJ/ mol de glicose, na forma de calor. Fe2O3(s) +3 CO(g) → 2 Fe(s) + 3 CO2(g) Fornecimento contínuo de calor. 6 H2O(l) + 6 CO2(g) → C6H12O6(s) + 6 O2(g) N2(g) + 3 H2(g) → 2 NH3(g) Envolve energia? A reação absorve 128,4 kJ de energia na forma de calor por mol de Fe2O3(s) consumido. A reação ocorre através da absorção de luz solar – energia radiante. São formados no interior das células vegetais, hidratos de carbono e gás oxigênio, com absorção de 2800 kJ de calor. A reação ocorre a cerca de 500 °C e sob pressão de 200 a 300 atm. A reação ocorre com absorção de 46 kJ de energia por 2 mols de amônia. Os dados da tabela 2 mostram que as transformações químicas são sempre acompanhadas de efeitos energéticos, podendo ocorrer com produção ou absorção de energia. Reações que produzem energia são chamadas exotérmicas e as que a absorvem são chamadas endotérmicas. A combustão do etanol (C2H6O) e a oxidação do metal magnésio são exemplos de transformações exotérmicas, pois se realizam com liberação de energia, na forma de luz e calor. Por outro lado, a obtenção de metais como o ferro e a fotossíntese são exemplos de transformações endotérmicas, pois se realizam com fornecimento contínuo de energia. O calor associado a uma transformação química é chamado calor de reação e recebe o nome da transformação ao qual corresponde. Se a transformação envolve a formação de uma substância, ele é chamado calor de formação. Se envolver a combustão, é chamado calor de combustão etc. 7 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto A quantidade de calor mobilizada numa transformação química pode ser incluída na equação que a representa, como um reagente, no caso de absorção de calor, ou como produto, no caso de liberação de calor. Essa quantidade de calor relaciona-se, proporcionalmente, às massas dos reagentes e produtos envolvidos nessa transformação. A energia associada a uma transformação, quando reagentes e produtos estão à mesma pressão, é denominada entalpia de reação ou calor de reação, sendo representada pelo símbolo ∆H (variação de entalpia). Sendo assim, uma outra forma de expressar a energia mobilizada numa transformação é usar a notação ∆H (lembrando que também se pode expressá-la incluindo-a na equação que a representa, como já visto). Convencionou-se que o sinal positivo que precede o valor do ∆H significa calor fornecido e o sinal negativo, calor produzido. Considerando que nas transformações exotérmicas o conteúdo de energia decresce quando os reagentes se transformam em produtos, o sinal negativo do ∆H significa também decréscimo do conteúdo de energia, ocorrendo o oposto no caso das transformações endotérmicas. Veja os exemplos abaixo: N2(g) + 3 H2(g) ↔¨2 NH3(g) H2O(g) ↔¨H2(g) + ½ O2(g) Fe2O3(s) +3 CO(g) + → 2 Fe(s) + 3 CO2(g) Formação da amônia: Decomposição da água: Obtenção de ferro metálico: ∆H = - 46 kJ ∆H= + 241,6 kJ ∆H = - 128,4 kJ É importante observar que podem ocorrer reações químicas em qualquer estado de agregação dos compostos (sólido, líquido ou gás). No entanto, vamos nos deter às reações em meio aquoso, nas quais a água é um dos reagentes, porque estas ocorrem em abundância tanto em nosso organismo como no cotidiano. Vejamos o exemplo de uma reação química que explica a formação de cavernas de calcário: CaCO3(s) + H2O(l) + CO2(g) → Ca(HCO3)2(aq) Reagentes Produto Lembre-se que o CaCO3 é um composto iônico, formado pelo íon Ca2+ e pelo ânion CO32- (que tem natureza covalente...) Ao ler esta reação verificamos que ocorreu a dissolução do carbonato de cálcio (CaCO3) pela água (H2O), que contém CO2. Desta forma, é possível a afirmar que o sal, carbonato de cálcio, reagiu com o ácido água e o óxido dióxido de carbono, para formar o sal bicarbonato de cálcio. E agora, como reconhecer estas substâncias? De uma forma muito simples podemos inferir o seguinte: SAL é uma espécie de elevado caráter iônico. ÓXIDO é um composto binário de oxigênio. ÁCIDO uma espécie que apresenta um comportamento químico ácido. BASE uma espécie que apresenta um comportamento químico básico. Estes dois são FUNÇÕES INORGÂNICAS porque possuem comportamentos que podem ser descritos por uma ou mais teorias. Há controvérsias na literatura sobre considerar sais e óxidos como funções. COMPORTAMENTO QUÍMICO ÁCIDO OU BÁSICO Os ácidos e as bases são tão importantes para o desenvolvimento tecnológico da humanidade que a quantidade de ácidos e bases produzida por uma nação é uma das formas de medir-se o seu desenvolvimento econômico. Existem sete teorias para explicar o comportamento dos ácidos e das bases, destas, três são muito utilizadas e adequadas para entendermos a maioria das reações químicas do tipo ácido-base que ocorrem à nossa volta, como relatado a seguir. 8 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto ARRHENIUS: • • Ácido: espécie que ao reagir com água produz íon H3O+(hidroxônio). SO2(g) + 2 H2O(l) à H3O+(aq) + HSO3-(aq) Base: espécie que ao reagir com água produz íons OH- (hidroxila). Na2O(s) + H2O(l) à 2 Na+(aq) + 2 OH-(aq) BRÖNSTED-LOWRY: • • Ácido: molécula ou íon doador de H+ (em linguagem química nos referimos ao H+ simplesmente como o próton). Base: molécula ou íon que recebe um próton (H+). Esta teoria prevê a formação de pares conjugados. Vejamos os exemplos: + OH- (aq) NH3 (aq) + H2O (l) NH4+ (aq) Base Ácido Ácido Conjugado Base Conjugada NO2- (aq) + H3O+ (aq) Base Conjugada Ácido Conjugado HNO2 (aq) + H2O (l) Ácido Base Observe que a água pode se comportar como ácido ou como base. O que determina este comportamento é a substância com a qual ela reage. Espécies como a água – que podem apresentar comportamento ácido ou básico - são ANFÓTERAS. LEWIS • • Ácido: receptor de par de elétrons. Base: doador de par de elétrons. H N +H + H N H H H Base + H H Ácido Abaixo estão alguns outros exemplos de ácidos e bases de Lewis: Ácidos: H+, Ag+, Cu+, Mg2+, Fe2+, SiO2, metais, moléculas orgânicas com ligações C = O. Bases: OH-, Cl-, SO42-, H2O, NH3. Estas teorias não são excludentes e também não são contraditórias. Elas ajudam a explicar o comportamento ácido-básico de grande número de substâncias. Ou seja, com exceção dos anfóteros, uma substância que seja ácido para Arrhenius, o será para Brönsted-Lowry e também para Lewis. O mesmo é válido para as bases. A hidroxila (OH-) sempre terá caráter básico e o H+ ou H3O+ sempre terá caráter ácido. Utilizando a teoria dos conjuntos para explicar o que foi dito acima, temos: Lewis Arrhenius BrönstedLowry 9 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto FORÇA DOS ÁCIDOS E DAS BASES A força dos ácidos é determinada por sua capacidade de se dissociar em íons em solução aquosa e a força das bases provêm de sua solubilidade, pois o caráter básico é determinado pela concentração de íons OH- em solução. A tabela abaixo apresenta exemplos interessantes: Força Fraco Ácidos H2CO3 (ácido carbônico) Bases NH4OH (hidróxido de amônio) CH3COOH (ácido acético) Moderado H3PO4 (ácido fosfórico) Ca(OH)2 (hidróxido de cálcio) Forte HCl (ácido clorídrico) NaOH (hidróxido de sódio) HNO3 (ácido nítrico) KOH (hidróxido de potássio) HClO4 (ácido perclórico) Muitas vezes não é suficiente apenas conhecer a força de um ácido ou de uma base e sim, saber exatamente qual a concentração de íons H+ e OH- em solução que estas espécies podem gerar. Para isso, foi criada uma função p: px = - log x que, por ser logarítmica são usadas para medir uma faixa dinâmica de valores de várias ordens de magnitude. Como a força dos ácidos e das bases provém de sua dissociação em água, nada mais correto do que partir das espécies que existem na água para medir a concentração de H+ e OH- em uma solução aquosa, assim: H2O + H2O H3O+ + OH- Kw = 1 x 10-14 Kw é a constante de dissociação da água. Este número indica quanto há de H+ e OH- livres em água. Esta medida é feita a partir de: Kw = [H3O+] x [OH-] A quantidade (ou concentração) de [H3O+] = [OH-] = 1x10-7 mol/L W = water = água - log Kw = - log [H3O+] – log [OH-] pKw = pH + pOH 14,0 = pH + pOH Desta pequena expressão é que surgiu a escala de pH, a qual nos indica, a partir de um número inteiro, qual é o meio da solução, ou seja, se é ácido, neutro ou básico (ou alcalino). 10 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto Vejamos esta escala: MEIO [H3O+] = 10-pH pH 0 1 = 100 Á 1 0,1 = 10 C 2 0,01 = 10 I 3 0,001 = 10 D 4 0,0001 = 10 O 5 0,00001 = 10 6 0,000001 = 10 7 0,0000001 = 10 8 0,00000001 = 10 B 9 0,0000000001 = 10 Á 10 0,0000000001 = 10 S 11 0,00000000001 = 10 I 12 0,000000000001 = 10 C 13 0,0000000000001 = 10 O 14 0,00000000000001 = 10 NEUTRO [ A Água e a Escala de pH criada por Sorensen (pouvoir de l´Hydrogene = poder do Hidrogênio) [OH-] = 10-pOH pOH 14 0,00000000000001 = 10 13 0,0000000000001 = 10 12 0,000000000001 = 10 11 0,00000000001 = 10 10 0,0000000001 = 10 9 0,000000001 = 10 8 0,00000001 = 10 7 0,0000001 = 10 6 0,000001 = 10 –9 5 0,00001 = 10 –10 4 0,0001 = 10 3 0,001 = 10 2 0,01 = 10 1 0,1 = 10 0 1 = 100 –1 –2 –3 –4 –5 –6 –7 –8 –11 –12 –13 -14 -14 –13 –12 –11 -10 -9 –8 –7 –6 –5 –4 –3 –2 –1 -1 ] = Concentração em mol.L = mol/L = concentração molar Conhecendo a força dos ácidos e das bases e suas concentrações em meio aquoso nos permite entender o belo fenômeno da HIDRÓLISE. HIDRÓLISE É a reação de íons que possuem sais originários de ácidos fracos ou bases fracas, que por característica, estão muito mais estão muito mais associados do que dissociados em água, seus íons tenderão a formar o ácido ou a base original, tornando o meio ácido ou básico. Podemos considerar que: - os ânions, derivados de ácidos fracos, irão sofrer hidrólise e deixar o meio básico: Vejamos o que ocorre com o sal cianeto de sódio, NaCN, em água: + NaCN Na + CN- CN + H2O - - HCN + OH Esta hidroxila tornou o meio básico. os cátions, derivados de bases fracas, irão sofrer hidrólise e deixar o meio ácido: Vejamos o que ocorre quando o metal ferro perde elétrons e se transforma no cátion Fe3+: Fe3+ + 3 H2O Fe(OH)3 + 3H+ Este próton tornou o meio ácido. A maioria dos íons metálicos produz soluções ácidas (exceto os metais alcalinos, Grupo 1 da Tabela Periódica e metais alcalino-terrosos, Grupo 2 da Tabela Periódica) porque por serem carregados positivamente atraem os pares de elétrons não compartilhados da água. O caráter ácido aumenta com o aumento da carga e a diminuição do raio. 11 QUÍMICA GERAL e TECNOLÓGICA Curso de Engenharia Básico Prof. Dr. Djalma Albuquerque Barros Filho Profa Dra Rosely A. L. Imbernom Profa Dra Silvania Maria Netto EXEMPLOS DE REAÇÕES QUÍMICAS ENVOLVENDO METAIS NA METALURGIA: Pirometalurgia é o uso de altas temperaturas para a obtenção do metal livre. Diversas etapas são empregadas: – Calcinação é o aquecimento do minério para provocar a decomposição e a eliminação de um produto volátil: PbCO3(s) → PbO(s) + CO2(g) – Ustulação é o aquecimento que provoca reações químicas entre o minério e a atmosfera da fornalha: 2 ZnS(s) + 3 O2(g) → 2 ZnO(s) + 2 SO2(g) 2 MoS2(s) + 7 O2(g) → 2 MoO3(s) + 4 SO2(g) – Fusão de minérios é um processo de derretimento que faz com que os materiais se separem em duas ou mais camadas. – A escória consiste principalmente em silicatos derretidos junto com aluminatos, fosfatos, fluoretos e outros materiais inorgânicos. – O refino é o processo durante o qual um metal bruto impuro é convertido em um metal puro. Na produção do aço o coque reage com o oxigênio para formar dióxido de carbono: 2C(s) + O2(g) → 2CO(g) O CO é também produzido pela reação do vapor d’água no ar com C: C(s) + H2O(g) → CO(g) + H2(g) Hidrometalurgia é a extração de metais de minérios com a utilização de água. - Lixívia é a dissolução seletiva do mineral desejado. Os agentes típicos da lixívia são ácidos diluídos, bases, sais e, algumas vezes, água. O ouro pode ser extraído de minério de baixo grau através de cianidação: O NaCN é borrifado sobre o minério triturado: 4 Au(s) + 8 CN-(aq) + O2(g) + 2 H2O(l) → 4 Au(CN)2-(aq) + 4 OH-(aq) O ouro é então obtido: 2 Au(CN)2-(aq) + Zn(s) → Zn(CN)42-(aq) + 2 Au(s) O processo de Bayer é utilizado para a produção de alumínio. O minério, bauxita, triturado é dissolvido em NaOH 30% (em massa) a 150 – 230 °C e alta pressão (30 atm para impedir a ebulição): Al2O3.H2O(s) + 2 H2O(l) + 2 OH-(aq) → 2 Al(OH)4-(aq) A solução de aluminato é separada através da redução do pH. A solução de aluminato é calcinada e reduzida para produzir o metal. REFERÊNCIA BIBLIOGRÁFICA 1. BROWN, T.L. et al. Química a Ciência Central. 9 ed. São Paulo: Pearson-Prentice Hall, 2005. 2. GARRITZ, A.; CHAMIZO, J.A. Química. São Paulo: Prentice Hall., 2003. 3. SKOOG, A.D. et al. Fundamentals of Analytical Chemistry. 7 ed. USA: Saunders College Publishing, 1996. 12
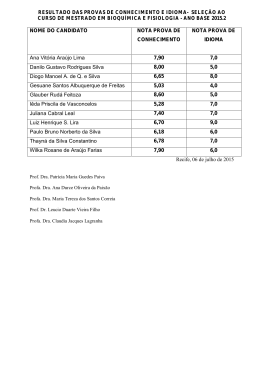
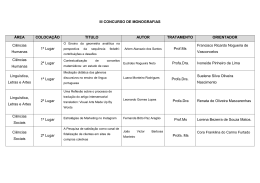
Download