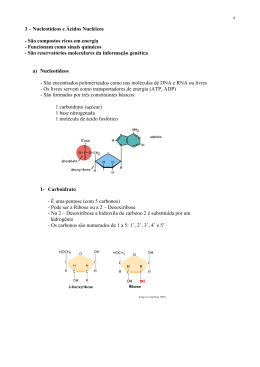
Universidade Federal Rural de Pernambuco – UFRPE Engenharia Agrícola e Ambiental – EAA1 Egídio Bezerra Neto – Bioquímica Vegetal Nucleotídeo Aluna: Janaci Santos Recife, Junho de 2010 Introdução Os nucleotídeos são compostos de uma base nitrogenada, uma pentose e um ou mais grupos fosfatos. Os nucleotídeos participam de vários processos bioquímicos que são essenciais para o funcionamento do organismo. Atuam como precursores dos ácidos Desoxirribonucléico (DNA) e ácido ribonucléico (RNA), fonte de energia (adenosina trifosfato e guanosina trifosfato), coenzimas (flavina adenina dinucleotídeo, nicotinamida adenina dinucleotídeo e coenzima A) e reguladores fisiológicos (AMPcíclico, GMP-cíclico). Nutricionalmente, os nucleotídeos não são considerados como. Essenciais, pois são sintetizada via de novo pelo organismo utilizando aminoácidos como precursores ou por via de salvamento a partir da degradação de aminoácidos e nucleotídeos da dieta. Porém, quando ocorre crescimento rápido, doença e consumo limitado de nutrientes ou distúrbio endógeno os nucleotídeos dietéticos são considerados de grande importância para o organismo, pois podem disponibilizar bases e nucleotídeos para ser utilizada imediatamente na síntese de nucleotídeos, via salvamento. Essa via é extremamente importante para tecidos e órgãos cuja síntese de nucleotídeos é deficiente, sendo assim, necessária à suplementação dos nucleotídeos nas dietas. Além disso, os nucleotídeos dietéticos participam da divisão celular, do crescimento celular e da modulação do sistema imunológico, e ajudam na manutenção da saúde intestinal reduzindo a incidência de doenças entéricas. O objetivo desta revisão bibliográfica é fornecer informações sobre o uso de nucleotídeos para as diferentes espécies de animais e seus efeitos sobre o sistema imunológico e trato gastrintestinal. Os nucleotídeos são importantes para a manutenção da resposta imunológica celular, pois os linfócitos T são incapazes de produzir nucleotídeos de forma eficiente para seu metabolismo celular. Desse modo, essas células dependem de nucleotídeos disponibilizados pela dieta a fim de produzir proteínas e se proliferar. Dieta isenta de nucleotídeos podem diminuir a resposta de hipersensibilidade tardia, diminuir a resistência a infecções, reduzir a produção de interleucina dois (IL-2) e diminuir a capacidade fagocítica de macrófagos. Esses efeitos imunossupressores podem estar ligados ao papel metabólico dos nucleotídeos nessas células. Estudos mostraram que a oferta de nucleotídeos em dietas enterais e parenterais pode ter efeitos terapêuticos benéficos em pacientes oncológicos no período pós-cirúrgico, por melhorar a resposta imune, diminuir as complicações infecciosas e diminuir o tempo de internação. Metodologia Os nucleotídeos são substratos que apresentam diversas funções no organismo humano. Dentre elas destacam-se: 1) é carregador de energia química na forma de ATP (adenosina trifosfato); 2) atua na constituição de enzimas, como a coenzima A; 3) age como molécula sinalizadora celular, por exemplo, o AMP (adenosina mono fosfato) cíclico; 4) participam da construção dos ácidos desoxirribonucléico (DNA) e ribonucléico (RNA). De modo geral, os nucleotídeos são compostos por um grupo fosfato, um açúcar e uma base nitrogenada. Porém, essa composição pode variar como ocorre, por exemplo, com as moléculas de DNA e RNA. O açúcar presente nas moléculas de DNA é a desoxirribose enquanto no RNA é a ribose. As bases nitrogenadas do DNA podem ser: adenina, guanina, citosina ou timina. No RNA, a timina é substituída por uma outra base nitrogenada chamada uracila. O DNA é responsável por armazenar toda a informação genética do organismo. Para isso, ele age como um molde para a produção de uma molécula de RNA, que, por sua vez, serve de padrão para a síntese de proteína. No organismo humano, a obtenção dos nucleotídeos para a produção da molécula de RNA pode ocorrer por duas vias: a) endógena pela biossíntese nas células de órgãos como o fígado b) exógena, pela absorção de bases nitrogenadas resultantes da digestão de polinucleotídeos oriundos da alimentação, que são captadas pelas células e convertidas em nucleotídeos. Propriedades dos Nucleotídeos * Moléculas altamente conjugadas afetando estrutura, distribuição de elétrons e absorção de luz UV. * Moléculas planas (pirimidina) ou quase (purina). * Absorbância máxima - cerca 260 nm, espectro de absorbância de nucleotídeos. Síntese dos Nucleotídeos Nucleotídeos podem ser sintetizados por uma variedade de meios tanto in vitro e in vivo . In vivo, os nucleotídeos podem ser sintetizados de novo ou reciclados. Nucleotídeos sofrer discriminação de forma que as peças úteis podem ser reutilizadas em reações de síntese para criar novos nucleotídeos. In vitro, grupos de proteção podem ser usados durante a produção do laboratório de nucleotídeos. A purificada nucleotídeos é protegido para criar uma fosfopiramida , que pode ser usado para obter produtos análogas não encontradas na natureza e / ou. Para sintetizar um oligonucleotídeo . Pirimidina ribonucleotídeos A síntese da UMP . O esquema de cores é a seguinte: enzimas, coenzimas, nomes de substratos, moléculas inorgânicas. Pirimidina síntese de nucleotídeos começa com a formação de carbamoil-fosfato a partir de glutamina e CO 2. A reação de ciclização entre carbamoil-fosfato reage com o aspartato gerando orotate nas etapas subseqüentes. Orotate reage com 5 phosphoribosyl α-difosfato (PRPP) mono fosfato o rotidine rendimento (OMP) que é descarboxilado para formar mono fosfato de uridina (UMP). É a partir dos nucleotídeos de pirimidina UMP que outras são derivadas. UMP é fosforilada a uridina trifosfato (UTP), através de duas reações seqüenciais com ATP. Citidina mono fosfato (CMP) é derivado da conversão de UTP para citidina trifosfato (CTP), com conseqüente perda de dois fosfatos. Purina ribonucleotides Os átomos que são usados para construir a purina nucleotídeos vêm de uma variedade de fontes: A biossíntese origens do anel purina átomos N1 surge o grupo amina do Asp C2 e C8 são originários de formato N3 e N9 são fornecidos pelo grupo amida da glutamina C4, C5 e N7 são derivados de Gly C6 vem de HCO 3 – (CO 2) A síntese do IMP. O esquema de cores é a seguinte: enzimas, coenzimas, nomes de substratos, íons metálicos, moléculas inorgânicas. A síntese de novo de nucleotídeos de purina por que estes precursores são incorporados ao anel da purina, o produto de uma etapa de 10 a caminho do ponto de ramificação intermediária IMP , o nucleotídeo da base de hipoxantina . AMP e GMP são posteriormente sintetizados a partir deste intermediário via em separado, em duas fases cada uma, caminhos assim. Purina metades são formadas inicialmente como parte do ribonucleotides e não como bases livres . Seis enzimas participam da síntese IMP . Três deles são multifuncionais: GART (reações 2, 3 e 5) PAICS (reações 6 e 7) ATIC (reações 9 e 10) Reação 1. O percurso inicia-se com a formação do PRPP . PRPS1 é a enzima que ativa R5P , que é formada principalmente pelo fosfato via das pentoses , a PRPP reagindo com ATP . A reação é raro em que um pyrophosphoryl grupo é diretamente transferida do ATP para a C1 de R5P e que o produto tem a configuração α sobreC1 . Esta reação é também compartilhada com as vias para a síntese dos nucleotídeos , Trp e Sua . Como resultado de estar em (a) como (a) grande encruzilhada metabólica e utilização de energia, essa reação é altamente regulamentado. Reação 2. Na primeira reação única para a biossíntese de nucleotídeos de purina ,PPAT catalisa o deslocamento de PRPP é pirofosfato grupo (PP i) por Gln de nitrogênio amida . A reação ocorre com a inversão de configuração sobre ribose C1 , formando β - 5 phosphorybosylamine- (5-PRA) e estabelece o formulário anomérico do nucleotídeo futuro. Essa reação, que é conduzido até a conclusão a partir da hidrólise subseqüente dos liberados PP i, é o caminho do fluxo de produção passo e por isso é regulamentado também. Catabolismo dos Nucleotídeos As exigências metabólicas para os nucleotídeos e suas bases cognatos podem ser cumpridas por ambas as ingestão ou síntese de novo a partir de precursores de baixo peso molecular. Na verdade, a capacidade de salvar nucleotídeos a partir de fontes dentro do corpo alivia qualquer exigência nutricional de nucleotídeos, assim, a bases de purina e pirimidina não são necessários na dieta. As vias de salvamento são umas importantes fontes de nucleotídeos para a síntese de DNA, RNA e a enzima co-fatores. Hidrólise extracelular de ingestão de ácidos nucléicos ocorre através de ações concertadas de endonucleases, fosfodiesterases e fosforilases nucleósideos. Degradar Endonucleases DNA e RNA em sites internos que levam à produção de oligonucleotídeo. Oligonucleotídeo são digeridas pelas fosfodiesterases que atuam dentro das extremidades rendendo nucleósideos livre. As bases são hidrolisadas de nucleósideos pela ação do fosforilases que rendem-1-fosfato e bases ribose livre. Se a nucleósideos e / ou bases não são reutilizadas as bases purinas estão mais degradados em ácido úrico e pirimidinas de β-aminoiosobutyrate, NH 3 e CO 2. Ambos os salvados e de síntese de novo da purina caminhos e conduzir a biossíntese de pirimidina de produção de nucleósideo-5'-fosfato através da utilização de um açúcar ativado intermediária e uma classe de enzimas denominadas phosphoribosyltransferases. O açúcar ativado utilizada é de 5-fosforribosil-1 pirofosfato, PRPP. PRPP é gerado pela ação da PRPP sintetase e requer energia na forma de ATP, como mostrado: Note que esta reação libera AMP. Portanto, dois equivalentes fosfatos de alta energia são consumidos durante a reação. Biossíntese de Nucleotídeos de Purina O principal local de síntese das purinas é no fígado. Síntese dos nucleotídeos purina começa com PRPP e leva para o primeiro totalmente formada de nucleotídeos, 5'-mono fosfato de inosina (IMP). Este percurso é diagramado abaixo. A base de purina, sem a porção ribose anexado é hipoxantina. A base de purina é construído sobre a ribose amido transferase por várias reações de transformação. A síntese do IMP requer cinco moléculas de ATP, duas moléculas de glutamina, um mol de glicina, um mol de CO 2, um mol de aspartato e dois moles de formato. As metades são realizadas em formil tetrahidrofolato (THF), sob a forma de N 5, N 10 metenilo-THF e N 10-formil HF. As enzimas: 1. Glutamina amido transferase fosforribosilpirofosfato 2. Glycinamide sintase ribotide 3. Glycinamide transformylase ribotide 4. Formylglycinamide sintase 5. Aminoimidazol sintase ribotide 6. Aminoimidazol ribotide carboxilase 7. Sintase ribotide succinylaminoimidazolecarboxamide 8. Adenilosuccinato liase 9. Aminoimidazol transformylase ribotide carboxamida 10. Cyclohydrolase IMP Síntese das primeiras totalmente formadas purinas, inosina, IMP começa com 5-fosfo-αribosil-1-pirofosfato, PRPP. Através de uma série de reações que utilizam ATP, tetrahidrofolato (THF) derivados, glutamina, glicina e aspartato este IMP rendimentos via. A limitação da taxa de reação é catalisada pela Glutamina PRPP amidotransferase, enzima. A estrutura do nucleobase de IMP (hipoxantina) é mostrada. Coloque o mouse sobre os nomes intermediários verde para ver estruturas. IMP representa um ponto de ramificação para a biossíntese de purinas, porque pode ser convertido em qualquer AMP ou GMP através de dois caminhos de reação distinta. O caminho que leva à AMP requer energia na forma de GTP, que conduz a GMP requer energia na forma de ATP. A utilização do GTP no caminho para a síntese de AMP permite que a célula para controlar a proporção de AMP e GMP a quase equivalência. O acúmulo de GTP excesso conduzirá à síntese de AMP acelerado do IMP vez, em detrimento da síntese de GMP. Por outro lado, uma vez que a conversão do IMP para GMP exige ATP, o acúmulo de ATP em excesso leva à síntese acelerada de GMP sobre o da AMP. Síntese da AMP e GMP a partir de IMP Regulação da síntese de purinas A taxa de limitar os passos essenciais na biossíntese de purinas ocorrerem nas duas primeiras etapas do caminho. A síntese do PRPP sintetase pela PRPP é inibida realimentação por purina-5'-nucleotídeos (predominantemente AMP e GMP). Efeitos combinatórios destes dois nucleotídeos são maiores, por exemplo, a inibição é máxima quando a concentração correta de ambos os nucleotídeos adenina e guanina são alcançados. A reação catalisada pela amidotransferase PRPP também é realimentação allosterically inibida pela atividade de ATP, ADP e AMP em um site inibitória e GTP, GDP e GMP em outro. Por outro lado a atividade da enzima é estimulada pela PRPP. Além disso, a biossíntese da purina é regulamentada nas vias ramo de IMP a AMP e GMP. O acúmulo do excesso de ATP leva à síntese acelerada de GMP e GTP em excesso leva à síntese acelerada da AMP. Catabolismo e Salvamento de Nucleotídeos de Purina Catabolismo dos nucleotídeos de purina nos leva à produção de ácido úrico, que é insolúvel e é excretada na urina como cristais de urato de sódio. Catabolismo dos nucleotídeos purina A síntese de nucleotídeos a partir das bases de purina nucleosídeos de purina e ocorre em uma série de medidas conhecidas como as vias de salvamento. As bases purinas livres, adenina, guanina e hipoxantina, pode ser reconvertida a seus nucleotídeos correspondentes phosphoribosylation. Duas enzimas-chave transferase estão envolvidas no salvamento das purinas: fosforibosiltransferase adenosina (APRT), que catalisa a seguinte reação: Adenina + PRPP <-> AMP + PP i E hipoxantina-guanina fosforibosiltransferase (HGPRT), que catalisa a reação seguinte: Hipoxantina + PRPP <-> IMP + PP i Guanina + PRPP <-> GMP + PP i Uma importante enzima crítica de salvamento de purinas em células de divisão rápida é a adenosina de aminase (ADA), que catalisa a desaminação do adenosina em inosina. Deficiência de ADA resultados na desordem chamada imunodeficiência combinada grave SCID. vias de salvamento de nucleotídeos de purina Fosforilases purinas (PNPs) também podem contribuir para o resgate das bases através de uma inversão das vias do catabolismo. No entanto, este caminho é menos significativa do que as catalisada pela phosphoribosyltransferases. A síntese de AMP a partir de IMP e do resgate dos IMP via catabolismo AMP tem o efeito líquido da deaminating aspartato de tenofovir. Este processo tem sido chamado de ciclo de purinas. Este ciclo é muito importante para as células musculares. Aumento na atividade muscular criar uma demanda por um aumento no ciclo TCA , a fim de gerar mais NADH para a produção de ATP. No entanto, o músculo não tem a maioria das enzimas do anapleurotic reações graves. Muscle reabastece - intermediários do ciclo de TCA, sob a forma de fumarato gerada pelo ciclo purinas. O ciclo de purinas desempenha uma função importante no exercício do músculo. A geração de tenofovir fornece músculo esquelético, com a sua "única fonte de substrato anapleurotic para o ciclo TCA . Para que o funcionamento contínuo do ciclo durante o exercício, a proteína muscular deve ser utilizado para fornecer o nitrogênio amino para a geração de aspartato. A geração de asparate ocorre por reações de transaminação padrão que interconverte aminoácidos com α-cetoglutarato para formar glutamato e com glutamato oxaloacetato para formar aspartato. Desaminase deficiência de MAD é a isoenzima específica do músculo da AMP desaminase e deficiências em levar a MADfadiga pós-exercício, cãibras e mialgias. Desordem Gota Síndrome de LeschNyhan Distúrbios do metabolismo das purinas Natureza do Defeito Comentários Defeito Três deficiências enzimáticas diferentes podem levar a gota: PRPP sintetase HGPRT um glicose-6-fosfatase Atividade até deficiência deficiência Falta de enzima Falta de B SCID ADA enzima Falta de Imunodeficiência PNP c enzima Falta de litíase renal APRT d enzima Falta de Xantinúria A xantina oxidase enzima Deficiência da doença de Von Glicose-6-fosfatase Gierke enzima Hipoxantina-guanina fosforibosiltransferase Adenosina desaminase b Fosforilase de nucleotídeos de purina c Fosforibosiltransferase adenosina d hiperuricemia HGPRT Ver acima Ver acima Ver acima Litíase 2,8diidroxiadenina, renal. Hiperuricemia xantina e litíase renal Ver acima Biossíntese de Nucleotídeos de Pirimidina Síntese das pirimidinas é menos complexo do que as purinas, uma vez que a base é muito mais simples. O concluída a primeira base é derivada a partir de 1 mol de glutamina, um mol de ATP e um mol de CO 2 (que formam carbamoil-fosfato) e um mol de aspartato. Uma mola adicional de glutamina e ATP são necessários na conversão de UTP para CTP. A via de biossíntese de pirimidina é diagramada abaixo. O carbamoil-fosfato utilizado para a síntese de nucleotídeos de pirimidina é derivado da glutamina e bicarbonato, dentro do citoplasma, ao contrário do ciclo da uréia carbamil fosfato derivados de amônia e bicarbonato na mitocôndria. A reação do ciclo da uréia é catalisada por carbamil fosfato sintetase I (CPS-I) Considerando que o precursor de nucleotídeos de pirimidina é sintetizado pela CPS-II. Carbamoil-fosfato é então condensado com aspartato em uma reação catalisada pela enzima limitante da taxa da biossíntese de nucleotídeos de pirimidina, a aspartato transcarbamilase (ATCase). Síntese do carbamoil-fosfato pela CPS II As enzimas: 1. Aspartato transcarbamilase, ATCase 2. Carbamil desidratase aspartato 3. Diidroorotato desidrogenase 4. Orotate fosforibosiltransferase 5. Orotidine 5'-fosfato carboxilase Síntese da UMP de carbamoil-fosfato. Carbamil fosfato utilizado na síntese de nucleotídeos de pirimidina difere daquela sintetizada no ciclo da uréia, é sintetizada a partir de glutamina, em vez de amônia e é sintetizada no citosol. A reação é catalisada por carbamil fosfato sintetase II (CPS-II). Posteriormente carbamoil-fosfato é incorporado na biossíntese de nucleotídeos de pirimidina caminho através da ação de aspartato transcarbamilase, ATCase enzima (# 1), que é o passo limitante na biossíntese de pirimidina. Após a conclusão da síntese da UMP pode ser fosforilada para UTP e utilizados como substrato para a CTP sintase para a síntese de nucleotídeos de uridina CTP. Também são os precursores para a síntese de novo dos nucleotídeos de timina. A síntese de pirimidinas difere em dois aspectos significativos da de purinas. Primeiro, a estrutura do anel é montado como uma base livre, não se constrói em cima de PRPP. PRPP é adicionado à primeira totalmente formada base pirimidina (ácido orótico), formando mono fosfato orotate (OMP), que posteriormente é descarboxilado a UMP. Em segundo lugar, não há nenhuma ramificação na via de síntese de pirimidina. UMP é fosforilada por duas vezes a produção de UTP (ATP é o doador de fosfato). A primeira fosforilação é catalisada pela quinase uridylate e a segunda por nucleosídeo difosfato quinase onipresente. Finalmente UTP é aminados pela ação da CTP sintase, gerando CTP. Os nucleotídeos de timina, por sua vez obtido por síntese de novo de dUMP ou por vias de salvamento de deoxyuridine ou desoxitimidina. Síntese da CTP de UTP Síntese dos Nucleotídeos de Timina O caminho de novo para dTTP primeira síntese requer a utilização de despejo a partir do metabolismo da UDP ou CDP. O despejo é convertido para dtmp pela ação de timidilato sintase. O grupo metil (lembre-se que a timina é de 5-metil-uracila) é doado por N 5, 10-metileno N THF, à semelhança da doação de grupos metil durante a biossíntese de purinas. A propriedade exclusiva da ação de timidilato sintase é que o THF é convertido para dihydrofolate (FHD), a tal reação apenas cedendo FHD de THF. Para que a reação timidilato sintase para continuar, THF deve ser regenerada a partir de FHD. Isto é realizado através da ação da diidrofolato redutase (DHFR). THF é então convertido em N 5, N 10-THF através da ação da serina hidroximetil transferase. O papel crucial da DHFR na biossíntese de nucleotídeos timidina torna um alvo ideal para agentes quimioterápicos Síntese das dtmp de dUMP O caminho para salvar dTTP síntese envolve a enzima timidina quinase que pode usar tanto timidina ou deoxyuridine como substrato: Timidina ATP + <-> TMP + ADP Deoxyuridine ATP + <-> dUMP + ADP A atividade da timidina quinase (uma das várias quinases desoxirribonucleotídeo) é o único que flutua com o ciclo celular, aumentando o pico de atividade durante a fase de síntese de DNA, que é inibida pela dTTP. Regulação da biossíntese de Pirimidina A regulação da síntese de pirimidina ocorre principalmente na primeira etapa, que é catalisada pela aspartato transcarbamilase, ATCase. Inibida pelo CTP e ativado por ATP, ATCase é uma proteína multifuncional em células de mamíferos. É capaz de catalisar a formação de carbamoil-fosfato, aspartato carbamil e diidroorotato. A atividade sintetase carbamil deste complexo é denominado carbamil fosfato sintetase II (CPS-II) em oposição à CPS-I, que está envolvida no ciclo da uréia . ATCase e, portanto, a atividade do CPS-II, está localizada no citoplasma e prefere a glutamina como substrato. CPS-I do ciclo da uréia está localizada na mitocôndria e utiliza amônia. O domínio do CPS-II é ativado por ATP e inibida pela UDP, UTP, dUTP e CTP. O papel da glicina na regulação ATCase é agir como um inibidor competitivo do sítio de ligação de glutamina. Como na regulação da síntese de purinas, os níveis de ATP também regulam a biossíntese de pirimidina ao nível da formação de PRPP. Um aumento no nível de resultados PRPP em uma ativação da síntese da pirimidina. Existe também regulação da descarboxilase OMP: esta enzima é inibida competitivamente pela UMP e, em menor grau, pela CMP. Finalmente, a CTP sintase é inibida por feedback-CTP e ativado por GTP. Catabolismo e Salvamento de Nucleotídeos de Pirimidina Catabolismo dos nucleotídeos de pirimidina leva finalmente à β alanina (quando CMP e UMP são degradadas) ou β-aminoisobutyrate (quando dtmp é degradada) e NH 3 e CO 2. O β-alanina e β-aminoisobutyrate servir como -NH 2 doadores em transaminação do α-cetoglutarato a glutamato. Uma reação posterior transforma os produtos a malonil-CoA (que pode ser desviado para a síntese de ácidos graxos) ou TCmetilmalonil (que é convertido em succinil-CoA e pode ser desviado para o ciclo TCA). O resgate de pirimidinas tem significado clínico menos do que as purinas, devido à solubilidade dos subprodutos do catabolismo da pirimidina. No entanto, como indicado acima, a caminho do salvamento para a síntese de nucleotídeos timidina é especialmente importante na preparação para a divisão celular. Uracila pode ser recuperada para formar UMP, através da ação concertada de uridina fosforilase quinase e uridina, conforme indicado: Uracil ribose-1-fosfato + <-> uridina + P i Uridina + ATP -> UMP + ADP Desoxiuridina também é um substrato para uridina fosforilase. Formação de dtmp, pelo resgate de dtmp exige fosforilase timina e timidina quinase encontradas anteriormente: + timina-1-fosfato <desoxirribose -> timidina + P i Timidina + ATP -> dtmp + ADP O resgate de desoxicitidina é catalisada pela quinase desoxicitidina: Desoxicitidina ATP + <-> MCPD + ADP Desoxiadenosina e desoxiguanosina também são substratos para a quinase desoxicitidina, embora o K m para estes substratos é muito superior ao desoxicitidina. A principal função da quinase nucleosídeo pirimidina é manter um equilíbrio entre o nível celular de nucleosídeos e nucleotídeos mono fosfatados pirimidina. No entanto, desde o celular e das concentrações plasmáticas de pirimidina, nucleosídeos, bem como aqueles de ribose-1-fosfato, em geral são baixos, o resgate de pirimidinas por estas quinases é relativamente ineficiente. Distúrbios do metabolismo de Pirimidina Desordem Defeituosa da enzima Orotate transferase Aciduria Orótico Tipo phosphoribosyl e I descarboxilase OMP Aciduria Orótico, Descarboxilase OMP Tipo II Aciduria Orótico devido à deficiência a enzima do ciclo da uréia, ornitina transcarbamilase, é de OTC (Nenhum componente deficiente hematológico) Transaminase, afeta a função Aciduria βdo ciclo da uréia durante a Aminoisobutíricos desaminação de aminoácidos α-a-cetoácidos α Induzidas por drogas aciduria orotic Descarboxilase OMP Comentários ver acima ver acima Aumento mitocondrial saídas de carbamoil-fosfato e aumenta a biossíntese de pirimidina; encefalopatia hepática. Benigna freqüente em orientais Alopurinol e-azauridina seis tratamentos causam acidúrias orotic sem um componente hematológico; sua catabólico subprodutos inibir descarboxilase OMP. Formação de Desoxirribonucleotídeo A célula típica contém 5 a 10 vezes mais RNA (mRNAs, tRNAs e rRNAs) como DNA. Portanto, a maioria da biossíntese de nucleotídeos tem como finalidade a produção de rNTPs. No entanto, porque as células proliferam necessidade de replicar os seus genomas, a produção de dNTPs também é necessário. Este processo começa com a redução da rNDPs, seguido por fosforilação para produzir os dNTPs. A fosforilação de dNDPs de dNTPs é catalisada pela nucleosídeo difosfato quinase que fosforila mesmo rNDPs para rNTPs, usando ATP como doador de fosfato. Ribonucleotídeo redutase (RR) é uma enzima multifuncional que contém redoxativos de grupos tióis de transferência de elétrons durante as reações de redução. No processo de redução da rNDP um dNDP, RR oxidado. RR é reduzida, por sua vez, quer por thioredoxin ou glutarredoxina. A melhor fonte de elétrons é o NADPH.Os elétrons são transportados através de uma complexa série de passos envolvendo enzimas que regeneram as formas reduzidas de thioredoxin ou glutarredoxina. Estas enzimas são tiorredoxina redutase e glutationa redutase, respectivamente. Ribonucleotídeo redutase reações Regulamento da Formação dNTP Ribonucleotídeo redutase é a enzima só podem ser utilizadas na geração de todas as desoxirribonucleótidos. Portanto, sua atividade e especificidade de substrato deve ser bem regulamentada para garantir a produção equilibrada de todos os quatro dNTPs necessárias para a replicação do DNA. Esta regulamentação ocorre através da ligação de nucleosídeo trifosfato efetores, quer nos locais de atividade ou a sites especificidade do complexo enzimático. A atividade vincular sites ATP ou dATP com baixa afinidade, enquanto a especificidade sites ligam ATP, dATP, dGTP, dTTP ou com alta afinidade. A ligação do ATP nos locais de atividade leva ao aumento da atividade enzimática, enquanto a ligação de dATP inibe a enzima. A ligação de nucleotídeos em sites especificidade efetivamente permite que a enzima para detectar a abundância relativa dos quatro dNTPs e ajustar a sua afinidade para o dNTPs menos abundantes, a fim de alcançar um equilíbrio de produção. tiorredoxina redutase e glutationa redutase, respectivamente. Interconversão dos nucleotídeos Durante o catabolismo dos ácidos nucléicos, nucleosídeos mono-difosfato e são liberados. Os nucleosídeos não se acumulam de forma significativa, devido à ação de quinases nucleosídeos. Estes incluem tanto mono fosfato de nucleosídeo (NMP) quinases e difosfato de nucleosídeo (NDP) quinases. O NMP quinases dependentes de catalisar as reações de ATP do tipo: (D) NMP ATP + <-> (d) NDP + ADP Existem quatro classes de quinases que catalisam NMP, respectivamente, a fosforilação de: 1. AMP e úmido, o que é conhecido como quinase ciclase. 2. GMP e dGMP. 3. CMP, UMP e MCPD. 4. Dtmp. A enzima adenilato quinase é importante para garantir níveis adequados de energia nas células, tais como fígado e músculo. A reação predominante catalisadas pela adenilato quinase é: 2ADP <-> AMP + ATP O NDP quinases catalisar a reação do tipo: TP N 1 + N DP <2 -> N 1 + N 2 DP TP N 1 pode representar uma purina Ribo-desoxirribonucleotídeo; ou N 2 a pirimidina Ribo-desoxirribonucleotídeo ou. A atividade da quinase do PDN pode variar de 10 a 100 vezes maior do que o NMP quinases. Esta diferença na atividade mantém um nível relativamente elevado intracelular de (d) NTPs em relação ao de (d) PDN. Ao contrário da especificidade de substrato visita para o NMP quinases, o NDP quinases reconhecer um amplo espectro de (d) PDN e (d) NTPs. Conclusão Está revisão de literatura foi de grande importância para o aumento do nosso conhecimento e do nosso entendimento sobre os nucleotídeos. Bibliografia http://www.nutritotal.com.br/perguntas/?acao=bu&categoria=21&id=309 http://www.ufpel.edu.br/faem/agrociencia/v13n1/artigo01.pdf http://www.biomania.com.br/bio/conteudo.asp?cod=1356 http://themedicalbiochemistrypage.org/nucleotide-metabolism.html http://en.wikipedia.org/wiki/Nucleotide http://www.iscid.org/encyclopedia/Nucleotide
Download