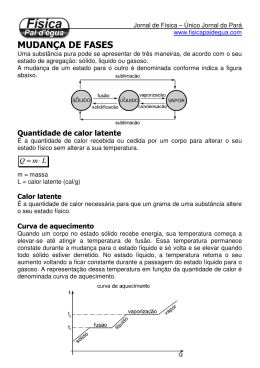
Como obter as seguintes temperaturas?? Calorimetria e as trocas de calor Calorimetria A Calorimetria é a parte da Termologia que estuda o calor e suas medidas. Caloria ( cal ), a mais usada. Joule ( J ), a unidade oficial do Sistema Internacional de Unidades ( S.I ). ATENÇÃO: 1 cal = 4,18 J CALOR LATENTE E CALOR SENSÍVEL CALOR LATENTE USAR QUANDO OCORRER MUDANÇA DE FASE Q = m . L CALOR SENSÍVEL USAR QUANDO OCORRER AQUECIMENTO OU ESFRIAMENTO Q = m . c . t Lembre-se : Para o calor Latente Q = Quantidade de calor necessária a mudança de fase quando a substância está no ponto. m = Massa da substância L = Calor latente da substância Q m L Lembre-se : Para o Calor sensivel Q = Quantidade de calor necessária para a mudança de temperatura do corpo m = Massa da substância c = calor especifico da substancia Q m c T Calcule a quantidade de calor necessária para transformar 100 g de gelo a - 10o C em água a 20o ? Dados: calor específico do gelo = 0,5 cal / g oC calor latente de fusão do gelo = 80 cal / g calor específico da água = 1 cal / g oC 1a parte: Solução: O gelo se encontra numa temperatura abaixo do ponto de fusão, neste caso será aquecido de - 10o C até o seu ponto de fusão (0o C): Q =m.c.t Q1 = m . c . t Q1 = 100 . 0,5 . (0 - (-10)) Q1 = 50 . (10 ) Q1 = 500 Q1 = 500 cal 2a parte: Chegando a 0 oC, o gelo agora se encontra na temperatura do ponto de fusão, neste caso sofrerá mudança de fase: Q = m . L Q2 = m . L Q2 = 100 . 80 Q2 = 8 000 Q2 = 8 000 cal 3a parte: O gelo agora já se transformou em água e esta água será aquecida de 0o C até 20o C: Q =m.c.t Q3 = m . c . t Q3 = 100 . 1 . (20 - 0) Q3 = 100 . 20 Q3 = 2 000 Q3 = 2 000 cal Cálculo final: Q1 = 500 cal Devemos agora somar ... Q2 = 8 000 cal Q3 = 2 000 cal Resposta: Q = 10 500 cal Trocas de calor - ∑Q = 0 Aparelho utilizado em laboratório com o objetivo de realizar experiências envolvendo trocas de calor entre corpos ou substâncias, evitando a perda de calor. Capacidade Térmica Razão entre a quantidade de calor que o corpo troca (ganhando ou perdendo) e a variação de temperatura que ele sofre nesta troca. Q C mc T Unidade : cal / °C ou J / K Análise Gráfica T T M.E.F T Q 1) Quando dois corpos de tamanhos diferentes estão em contato e em equilíbrio térmico, e ambos isolados do meio ambiente, pode-se dizer que: a) o corpo maior é o mais quente. b) o corpo menor é o mais quente. c) não há troca de calor entre os corpos. d) o corpo maior cede calor para o corpo menor. e) o corpo menor cede calor para o corpo maior. 2) Quando uma enfermeira coloca um termômetro clínico de mercúrio sob a língua de um paciente, por exemplo, ela sempre aguarda algum tempo antes fazer a sua leitura. Esse intervalo de tempo é necessário a) para que o termômetro entre em equilíbrio térmico com o corpo do paciente. b) para que o mercúrio, que é muito pesado, possa subir pelo tubo capilar. c) para que o mercúrio passe pelo estrangulamento do tubo capilar. d) devido à diferença entre os valores do calor específico do mercúrio e do corpo humano. e) porque o coeficiente de dilatação do vidro é diferente do coeficiente de dilatação do 3) Uma certa quantidade de água a temperatura de 0°C é mantida num recipiente de vidro. Inicia-se então o aquecimento da água até a temperatura de 100°C. Desprezando-se a dilatação do recipiente, o nível da água em seu interior durante o aquecimento: a) mantêm-se constante; b) aumenta somente; c) diminui somente; d) inicialmente aumenta e depois diminui; e) inicialmente diminui e depois aumenta. 4) Uma batata recém-cozida, ao ser retirada da água quente, demora para se esfriar. Uma justificativa possível para esse fato pode ser dada afirmando-se que a batata tem a) alta condutividade térmica. b) alto calor específico. c) baixa capacidade térmica. d) baixa quantidade de energia interna. 5) As fagulhas (pedaços de metal incandescente) que são projetadas quando afiamos uma faca num esmeril atingem nossa pele e não nos queimam. Já um copo de água fervente jogado em nossa pele provoca graves queimaduras. Como podemos explicar esses fatos? a) A temperatura da água fervente é maior que a das fagulhas. b) As fagulhas não estão mudando de estado, a água está. c) As fagulhas não transportam energia. d) O calor específico da água é muito menor do que o do material metálico que compõe as fagulhas. e) A capacidade térmica do copo de água é muito maior que a das fagulhas.
Baixar