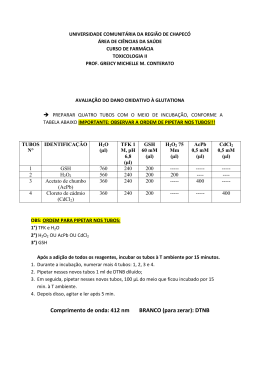
OAC MIRO ALFONSO KLINGER PRÁTICAS PEDAGÒGICAS EM CINÉTICA QUÍMICA . PROBLEMATIZAÇÃO DO CONTEÚDO O ensino de química tem sido objeto de crítica em relação a sua eficácia , porque está muito distante das pessoas da nossa sociedade e quando chega, muitas vezes, vem de uma maneira muito tradicional e as aulas de laboratório são relacionadas a materiais sofisticados, portanto com informações superficiais e errôneas, exageradamente técnicas dificultando sua compreensão. Para muito pessoas aprender química requer uma prática totalmente teórica, uma ação de decorar fórmulas, leis e regras. É necessário superar esta idéia considerando que a experimentação se torna uma prática pedagógica importante em auxiliar o aluno a relacionar o conteúdo teórico a situações do seu cotidiano. INVESTIGAÇÃO DISCIPLINAR Cinética Química e Equilíbrio Químico É uma ciência que estuda a velocidade das reações químicas e dos fatores que nela influem. A formação de uma substância pode ocorrer de forma rápida ou lenta dependendo das condições em que a reação é efetuada. Sua importância é muito ampla, na industria, na produção de remédios, em nosso corpo humano,etc. A velocidade das reações em nossa vida diária são encontradas de várias maneiras: lentas, rápidas, moderadas e as vezes instantâneas como as explosões. A velocidade nas reações se tornam importantes no processo industrial em geral e nos produtos farmacêuticos porque estão relacionados a uma produção viável economicamente ou para obter menores custos na produção. Ela engloba vários fatores a serem considerados na produção, e em sala de aula, nesse coso relacionado com o meio social portanto o professor deve através de seus do conteúdo teórico consegui o entrosamento como dia a dia do aluno. Os principais fatores na velocidade das reações são: temperatura, superfície de contato, presença ou não de catalisadores, concentração dos reagentes e a pressão Quando variamos a temperatura de reagentes a reação se processa com maior velocidade porque ocorre um aumento na vibração das moléculas provocando maior número de colisões. Como exemplo prático temos em nossas residências as geladeiras que diminuem a temperatura dos alimentos retardando a decomposição dos mesmos portanto demoram mais a estragar. 1 A superfície de contato sendo aumentada ocorre um aumento da velocidade da reação, nesse coso também temos maior número de colisões. Nas substâncias sólidas a área de contato é muito reduzida portanto a velocidade da reação é lenta, por esse motivo não se compro a carne moída exposta à venda, devemos comprar a carne e pedir para ser moída no momento da compra. O aumento da concentração dos reagentes aumenta o número de colisões portanto também aumenta a velocidade das reações. Catalisadores são substâncias que provocam reações químicas ou aumentam a velocidade das reações químicas, mas não participam da formação dos produtos, completamente regenerados no final da reação. O aumento de pressão em substâncias gasosas usadas como reagentes aproxima as partículas aumentando as colisões entre as partículas conseqüentemente a velocidade da reação. PERSPECTIVA DE INTERDICIPLINARIEDADE Há um relacionamento nas disciplinas de Química, Ciências e biologia na questão da velocidade da decomposição dos alimentos e seu aproveitamento pelo organismo. Quando ingeridos ocorre uma decomposição rápida provocada pelas enzimas (catalisadores), comparada com os alimentos não ingeridos (decomposição lenta). Sem as enzimas os alimentos demoram dias para a sua decomposição o que dificultaria a nossa sobrevivência, como a saliva produzida é lançada na boca durante a mastigação dos alimentos, é importante mastigar bem os alimentos e mantê-los mais tempo na boca para misturá-los com maior quantidade de saliva. A saliva é um catalisador que aumenta a velocidade da decomposição, quanto mais triturados (mastigados) maior a área de contato com as enzimas portanto maior velocidade da reação. Devemos comer devagar e mastigar bem os alimentos para uma boa digestão, e comer devagar possibilitamos ao estomago dar o alerta quando ele está cheio e assim comer só o necessário e mantermos ama boa saúde. . CONTEXTUALIZAÇÃO O Professor deve levar em consideração o que o aluno já sabe antes de iniciar o conteúdo. Os conhecimentos prévios dos alunos são de fundamental importância porque é a partir deles que ele adquire os novos conhecimentos. O aluno traz para a escola um conjunto de concepções sobre vários aspectos de mundo, estas concepções alternativas são adquiridas a partir de sua inserção na cultura comum e da experiência do cotidiano com fenômenos e eventos que freqüentemente interferem com a aprendizagem das idéias científicas. É necessário produzir o conhecimento científico através de métodos que envolvam soluções para problemas de ordem praticada vida diária, 2 tentando explicações sistemáticas que possam ser testadas. As práticas devem ser feitas com material de fácil acesso e que envolvam o conteúdo teórico relacionado com o cotidiano do aluno. Para a concepção construtivista, aprende-se quando acontece a capacidade de elaborar uma representação pessoal sobre a realidade ou conteúdo que se pretende aprender. Neste processo, não só se modificam os significados que já estão providos, mas também interpretá-se o novo de forma peculiar, para poder integrá-lo. SÍTIOS http://www.cq.ufam.edu.br/cd_24_05/Cinetica_quimica.html Em algumas reações são necessárias certas condições ( catalisadores ) para que ela aconteça ou para acelerar sua velocidade. Exemplo, a colocação dos catalisadores nos carros para reduzir a emissão dos gases mais tóxicos. http://www.cq.ufam.edu.br/cd_24_05/exp_chuva_acida.htm Revela como ocorre a chuva ácida, com o lançamento de gases a base de enxofre e de nitrogênio e a umidade do ar, se forma na atmosfera provocando grandes prejuízos para a sociedade. SONS E VÍDIOS http://br.youtube.com/watch?v=dvohUGw9NMs IMAGEM 3 As imagens estão relacionadas com as velocidades das reações químicas que são muito importante durante a produção em geral, para a diminuição dos custos, para aumentar a velocidade de produção ,isto é a velocidade das reações recorremos a vários métodos como: catalisadores área de contato, temperatura e pressão. Na manutenção dos alimentos, dos remédios muitos outros produtos e ferramentas, aumentar a duração , isto é diminuir a velocidade de degradação que é a velocidade da reação de decomposição aumentando a sua duração. Nas construções usamos as tintas para aumentar a duração, nos remédios e alimentos os conservantes PROPONDO ATIVIDADES Como a velocidade das reações é de grande importância em nossas vida, na produção industrial para aumentar a produção e diminuir os custos, para conseguir esse objetivo são usados os diferentes fatores como os catalisadores que aumentam a velocidade das reações sem participar da formação dos produtos. Um exemplo prático é a decomposição da água oxigenada que é lenta sem catalisador e mais rápida com. Primeira etapa. Material utilizado - suporte de tubos de ensaios; - três tubos de ensaios; - água oxigenada volume 10; - detergente; - batatinha. 4 Preparação da solução 0,1mol/l de iodeto de potássio; Colocar 1,65 g de (KI) em 100 ml de água e diluir. Coloque 5ml de água oxigenada nos três tubos de ensaios em seguida adicione 0,2 ml de detergente nos três tubos e umedeça-os internamente as paredes para a espuma deslizar facilmente, o detergente é para manter o gás oxigênio em forma de bolhas mantendo a espuma nos tubos. Coloque os tubos um ao lado dos outros, num adicione 5 gotas da solução de iodeto de potássio 0,1 mol/l, no segundo adicione alguns pedacinhos de batatinha no terceiro não adicione nada. H2O2 ----------------- H2O + ½ O2 reação sem catalisador H2O2 + KI --------- KI + H2O + ½ O2 reação com catalisador Passos intermediários, H2O2 + I- ----------- H2O + OIH2O + OI- ------------- H2O + I- + ½O2 H2O2 + batatinha ----------- H2O + ½O2 + batatinha Questionamento Em qual dos tubos a reação ocorreu mais rápida ? Qual é a causa da maior velocidades na reação? Qual é a função do detergente? Porque a água oxigenada forma as bolhas durante a reação? O que é um catalisador? Quais os tipos de água oxigenada que você conhece e para que servem? Segunda etapa, análise das diferentes velocidades quando modificamos a concentração dos reagentes, quanto maior a concentra cão dos reagentes maior a velocidade da reação. Material 2 tubos de ensaios; água oxigenada volume 10; solução de iodeto de potássio 0,1molar. Procedimento 5 Coloque 5ml de água oxigenada nos dois tubos de ensaios, adicione 0,2 ml de detergente e umedeça a interna dos tubos. Coloque 5 gotas de solução iodeto de potássio em um dos tubos e no outro coloque apenas 2 gotas. Questionamento Em qual dos tubos a reação ocorreu mais rápida? O que ocasionou esta maior velocidade? Pesquise sobre a maneira correta de comer e comente sobre a quantidade de saliva necessária para uma boa digestão? Após o experimento deve ser feito um questionamento e uma contextualizarão para que os alunos reflitam e pesquisem sobre o que analisaram. A Corrosão A corrosão ( a reação com o oxigênio ou oxidação ) é um grande problema na industria principalmente dos metais, nas residências as janelas, portas e grades se não protegidas com material ante corrosivo ( tintas que envolvem os metais ou a madeira ) ocorre o desgaste portanto o prejuízo é imediato. Um exemplo de corrosão é o alumínio com solução de ácido clorídrico que são materiais de fácil obtenção, o alumínio pode ser obtido nos fios de alta tensão e o ácido em solução a 6% no ácido muriático encontrado nos mercados. Material - alumínio; - ácido muriático ( ácido clorídrico a 6% ) - 4 tubos de ensaios; - suporte de tubos de ensaios. 1º etapa do experimento analisado a área de contato. Procedimento Colocar em dois tubos de ensaios 10 ml de solução ácido clorídrico a 6%, num tubo acrescentar um pedaço de alumínio e no outro a mesma quantidade de alumínio em forma de limaria. Questionamento Observar em qual dos tubos a reação é mais rápida? Explique porque as velocidades foram diferença. O que devemos fazer para prevenir os prejuízos causados pela corrosão? 6 2º etapa do experimento analisando a concentração dos reagentes na reação. Procedimento. Diluir uma parte do ácido clorídrico a 3%, para isso basta acrescentar 50% de água. Coloque 10 ml de ácido clorídrico a 3% num dos tubos e no outro ácido a 6% e acrescente pedaços de alumínio idênticos nos dois tubos, observe em qual dos dois a reação ocorre com maior velocidade, descrever o motivo. Questionamento Em qual dos tubos a reação foi mais rápida? Qual é a causa da diferença de velocidade? Explique. Na natureza qual é a substância que causa maior prejuízo através da corrosão dos metais? Explique. SUJESTÕES DE LEITURA . www.editora.unicamp.br COMO SE FAZ QUÍMICA; Aécio Pereira Chagas Editora ; UNICAMP Campinas, 2001 . Esta publicação é sobre conhecimentos relacionados a natureza através de exemplos práticos em laboratório com cientifico, orientando sobre informações e responsabilidades sociais no progresso e bem estar da umanidade DESTAQUES Alumínio – Al O alumínio é metal da família 13 e um dos elementos mais abundantes encontrado na forma de “Al2O3 “. A ingestão pode ocorrer pelos alimentos, ar e contato com a pele sua contaminação é acumulativa e causa graves problemas a saúde. ALONTM, o alumínio transparente é um oxinitrato policristalino de alumínio, concite numa cerâmica transparente muito mais resistente que o vidro blindado, por ser mais leve, fino e ser usado em leitores de códigos de barras, pode trazer grandes benefícios a humanidade quando a sua produção for economicamente viável. A água oxigenada 7 Ela se decompões lentamente em água e gás oxigênio, nas farmácias é encontrado a 3%, reage com a catalase (enzima), com velocidade bem superior formando gás oxigênio que é a espuma produzida nas feridas e em contato batata que também contem este enzima. A água oxigenada tem o poder desinfetante sobre as superfícies melhor que qualquer outro produto, podendo ser usado nos pés para evitar frieiras e fungos que provocam mau cheiro, para desinfetar roupas como lençóis que contenham secreções corporais e sangue NOTÍCIAS http://revistagalileu.globo.com/Revista/Galileu/0,,EDG78708-7943-194-3,00.html A nano-tecnologia não é mais uma questão de futuro, já está disponível no comércio em forma de brinquedos e outro utensílios, na medicina podem ser inseridos no interior do nosso corpo para diagnósticos e tratamentos. A ESCOLA NO PARANÁ Na educação do Paraná são discutidos e feito pesquisas sobro concepções alternativas, sugerindo uma investigação sobre conceitos científicos e a aplicação prática com a contribuição dos alunos. São analisados temas de caráter interdisciplinar na tentativa da contextualização do ensino de química com o intuito de dar enfoque as técnicas de produção na Estado. O Estado é um produtor de automóveis, de remédios , de alimentos, de eletrodomésticos e outros, que requerem um trabalhador crítico capaz de desenvolver sua profissão com habilidades e visão ampla. A escola vem desempenhando seu papel através de diferentes alternativas para sanar as dificuldades e preparar esta cidadão e trabalhador com aptidões necessárias para o desenvolvimento e melhorias do contexto social em que vive REFERÊNCIAS BIBLIOGRÁFICAS Machado, Andréa Horta; Aragão, Rosália Maria Ribeiro. Estado de Equilíbrio Químico. Química Nova na Escola, São Paulo, nº 4, p.18-20 novembro, 1996. GIESBRECHT, Erneto. Experiências de Química.Moderna, São Paulo, 1982. 8 Relatos de Sala de Aula. A Corrosão na Abordagem da Cinética Química. Química Nova na Escola, São Paulo, nº 22, p. 31-34, Novembro, 2005. Honório, Kátia M. Weber, Karen C. Homem-de-Mello. Gambardella, Maria Teresa do Prado. Da Silva, Albérico. O Show da Química: Motivando o Interesse Científico. Química Nova, São Carlos, Vol. 29, p 173-178 2006. 9
Download