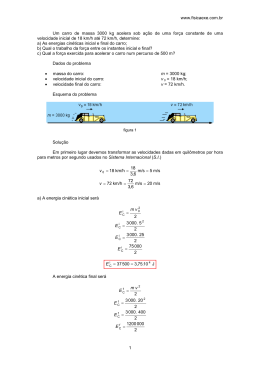
Gases e 1ª lei da Termodinâmica – Aula 5 Allan Calderon Diagrama de Fases Def.: Diagrama de fases de uma substância pura é uma representação gráfica dos valores de pressão e temperatura que determinam o espaço físico da substância. Pressão e Temperatura determinam estado físico Curva de fusão: equilíbrio entre líquido e sólido. GASOSO VAPOR Ponto Crítico Curva de vaporização: equilíbrio entre líquido e vapor. Ponto Triplo Curva de sublimação: equilíbrio entre vapor e sólido Umidade do Ar Ar Mistura de gases (ar seco – aprox. 78% de nitrogênio e 21% de oxigênio) e vapor d`água. vapor saturado: é a camada mais próxima da superfície líquida, encontra-se no limiar do estado líquido e gasoso. Umidade relativa (UR) é a relação entre a pressão parcial do vapor d`água na mistura e a pressão de saturação, à mesma temperatura. Obs.: como o ar atmosférico encontra-se em uma pressão suficientemente baixa, pode-se fazer as relações entre as densidades ao invés da pressão, então: pV UR = pS pV < pS ou dV UR = dS Gases Variáveis de estado de um gás (grandezas macroscópicas que definem um estado gasoso): Pressão (p): colisões das partículas no recipiente; Volume (V): volume do recipiente; Temperatura (T): grau de agitação molecular. Trabalho de um gás (1) Êmbolo tem massa constante (m) gás exercerá uma pressão constante. Força(F) exercida no êmbulo pelo gás. Distância (d) que o êmbulo percorreu cor o aumento/diminuição da Temperatura. Na expansão, o gás fornece energia para o meio externo na forma de trabalho. Na compressão, o gás recebe energia do meio externo na forma de trabalho. (1)Γ = F ∗ d ∗ cos(θ ) (2) F = p ∗ A Substituir fórmula 1 em 2: € € Γ = ( p ∗ A) * d ou Γ = p ∗ ΔV Neste caso a pressão tem que ser constante Trabalho de um gás (1) O cálculo do trabalho termodinâmico pode ser usado também quando a pressão é variável. De acordo com a fórmula abaixo. B+ b Γ = Area _ do _ Trapezio = ∗ h 2 p f + pi Γ= ∗ (V f − Vi ) 2 € € Energia interna de um gás As moléculas, ou átomos, que constituem um gás apresentam diferentes velocidades contendo, assim uma Energia Cinética . Podemos generalizar e associar uma energia cinética média de todas as moléculas. Esta Energia Cinética Média ENERGIA TÉRMICA 3 E cin. = * n * R * T 2 (com T em Kelvins) Com base nesta expressão: energia cinética depende(exclusivamente) da temperatura absoluta. Um gás tem a energia cinética e energia potencial associada a ele, então: En. Cinetica + En. Potencial energia interna de um gás (U). € Quando um gás sofre variação de temperatura, então existe uma variação de energia interna(ΔU) do sistema. Se o gás for IDEAL e MONOATÔMICO a variação de energia interna é igual a variação de energia cinética do sistema, portanto: 3 ΔU = ΔE cin. = * n * R * ΔT 2 1ª Lei da Termodinâmica A 1ª Lei da Termodinâmica é uma aplicação do princípio da conservação de energiase um gás recebe calor do meio externo, essa energia pode ser armazenada no sistema, aumentando a sua energia interna, ou pode ser utilizada na realização de trabalho. Esta lei estabelece o balanço energético entre: A quantidade de calor (Q) trocada por um sistema termodinâmico com o meio externo. O trabalho mecânico () realizado pelo, ou sobre, o sistema. Se o gás recebe calor do meio externo, então: Q > 0 ; Se o trabalho(Γ) é realizado pela força aplicada pelo gás (expansão gasosa), então:Γ>0; A variação da energia interna (ΔU). Se ΔU > 0, então a energia interna do gás aumenta e a temperatura aumenta; ΔU = Q − Γ Obs.: ΔU, Q e Γ devem sempre estar na mesma unidade! (cal ou Joule) 1ª Lei aplicada a transformações termodinâmicas Transformações isobáricas (pressão constante) O gás pode sofrer: Expansão Volume aumenta: ΔV > 0 Γ>0 (o trabalho é realizado pela força aplicada pelo gás) Temperatura aumenta: ΔT>0 Q>0 e ΔU>0 Compressão Volume diminui: ΔV < 0 Γ<0 (o trabalho é realizado pelo gás) Temperatura diminui: ΔT<0 Q<0 e ΔU<0 V1 V2 = T1 T2 ΔU = Q − Γ Γ = p * ΔV Transformação isométrica/isocórica(volume constante) € Γ=0 Não há variação de volume: ΔV = 0 € € p1 p2 = T1 T2 ΔU = Q Transformação isotérmica(mesma temperatura) A energia interna é constante: ΔU=0 € € p1 *V1 = p2 *V2 Q=Γ Transformação adiabática(sem troca de calor com o meio) € ΔU = −Γ € 2ª Lei da Termodinâmica Transformação Cíclica Estado inicial do gás coincide com o estado final Variação de energia interna é nula (ΔU=0Tf = Ti) A Quantidade de Calor trocada com o meio e igual ao trabalho (Qciclo = Γciclo) O trabalho realizado na transformação cíclica pode ser calculado pela área do ciclo e de acordo com o sentido do ciclo. Sentido horário: conversão de calor em trabalho Sentido anti-horário: conversão de trabalho em calor
Download