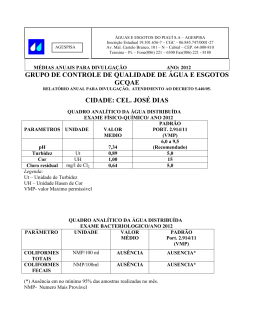
UNIVERSIDADE FEDERAL DE MATO GROSSO – UFMT INSTITUTO DE CIÊNCIAS EXATAS E DA TERRA – ICET DEPARTAMENTO DE QUÍMICA Arianne Nunes Dualibi ESTUDO COMPARATIVO DA INFLUÊNCIA DO SULFATO DE ALUMÍNIO LÍQUIDO E SULFATO DE ALUMÍNIO GRANULADO NA TURBIDEZ, COR E NO VOLUME DE RESÍDUO GERADO NO TRATAMENTO DE ÁGUAS. Cuiabá - MT 2010 Livros Grátis http://www.livrosgratis.com.br Milhares de livros grátis para download. Arianne Nunes Dualibi ESTUDO COMPARATIVO DA INFLUÊNCIA DO SULFATO DE ALUMÍNIO LÍQUIDO E SULFATO DE ALUMÍNIO GRANULADO NA REMOÇÃO DE TURBIDEZ, COR DA ÁGUA BRUTA E SUA RELAÇÃO NO VOLUME DE RESÍDUO GERADO NO TRATAMENTO DE ÁGUAS. Trabalho de conclusão de curso apresentado ao Departamento de Química do Instituto de Ciências Exatas e da Terra como requisito para obtenção do grau de Bacharelado em Química Orientadora: Zoraidy Marques de Lima Cuiabá - MT 2010 UNIVERSIDADE FEDERAL DE MATO GROSSO – UFMT INSTITUTO DE CIÊNCIAS EXATAS E DA TERRA – ICET DEPARTAMENTO DE QUÍMICA ESTUDO COMPARATIVO DA NFLUÊNCIA DO SULFATO DE ALUMÍNIO LÍQUIDO E SULFATO DE ALUMÍNIO GRANULADO NA REMOÇÃO DE TURBIDEZ,COR DA ÁGUA BRUTA E SUA RELAÇÃO NO VOLUME DE RESÍDUO GERADO NO TRATAMENTO DE ÁGUAS Arianne Nunes Dualibi Orientadora: Drª Zoraidy Marques de Lima Cuiabá - MT 2010 UNIVERSIDADE FEDERAL DE MATO GROSSO – UFMT INSTITUTO DE CIÊNCIAS EXATAS E DA TERRA – ICET DEPARTAMENTO DE QUÍMICA ESTUDO COMPARATIVO DA NFLUÊNCIA DO SULFATO DE ALUMÍNIO LÍQUIDO E SULFATO DE ALUMÍNIO GRANULADO NA REMOÇÃO DE TURBIDEZ,COR DA ÁGUA BRUTA E SUA RELAÇÃO NO VOLUME DE RESÍDUO GERADO NO TRATAMENTO DE ÁGUAS. Arianne Nunes Dualibi Orientadora: Zoraidy Marques de Lima Monografia apresentada ao curso de graduação em Química do Departamento do Instituto de Ciências Exatas e da Terra, como parte dos requisitos para obtenção do grau de Bacharel em Química. Drª.Zoraidy Marques de Lima Esp. Maria Fátima dos Santos Márcio de Jesus Mecca DEDICATÓRIA Dedico a realização deste trabalho aos meu pais Ruth Dualibi e Fadlo Dualibi, que sempre me apoiaram, incentivando sempre na busca do conhecimento, e ao meu companheiro de jornada Rafael E.D.Giustina pelo apoio e compreensão . AGRADECIMENTO Agradeço a Deus pela oportunidade e capacidade que me deu. Agradeço a meus pais Ruth Dualibi e Fadlo Dualibi, pelo apoio, auxilio e incentivo que sempre me deram. Agradeço ao meu companheiro, Rafael Eller pela cumplicidade e dedicação. Agradeço a minha orientadora Zoraidy Marques de Lima pela atenção, ajuda e paciência com que me orientou nesta jornada. Agradeço a Maria Fátima dos Santos pelo auxilio e compreensão durante a realização deste trabalho Agradeço aos operadores da ETA Tijucal, Aloísio, Firmo, Vital,Walter e demais pela ajuda e paciência que tiveram comigo durante os ensaios. Agradeço aos companheiros de laboratório, Adriana Lousada Marinho e Ruberlei Godinho de Oliveira pela força e auxílio nos momentos deste trabalho. ÍNDICE DE TEXTO 1.0 INTRODUÇÃO 2.0 OBJETIVO 2.1 OBJETIVO ESPECÍFICO 3.0 REVISÃO BIBLIOGRÁFICA 3.1 CARACTERÍSTICAS DA ÁGUA BRUTA. 3.1.1. POTENCIAL HIDROGÊNIO IÔNICO- pH 3.1.2. TURBIDEZ 3.1.3 COR. 3.1.4 TEMPERATURA. 3.1.5 ALCALINIDADE 3.1.6 ACIDEZ 4.0 PROCESSOS DE TRATAMENTO. 4.1 CAPTAÇÃO 4.2 CALHA PARSHALL 4.2.1COAGULAÇÃO 4.2.1.1 PROPRIEDADE DOS COAGULANTES 4.2.2 SULFATO DE ALUMÍNIO. 4.3 FLOCULADOR. 4.3.1 FLOCULAÇÃO 4.4 DECANTADORES 4.4.1 DECANTAÇÃO OU SEDIMENTAÇÃO. 4.5 FILTROS 4.5.1 FILTRAÇÃO 4.6 DESINFECÇÃO 4.6.1 CLORO 5.0 RESÍDUOS DE ETA. 5.1 RESÍDUOS DE SULFATO DE ALUMÍNIO 6.0 MATERIAL E MÉTODOS 6.1 ETA TIJUCAL 6.2.METODOLOGIA 6.2.1 METODOLOGIA PARA DOSAGEM DE REAGENTES 6.3 ENSAIO DA COAGULAÇÃO 6.3.1 PREPARO DO JAR TEST 6.3.2 CONE DE IMHOFF 6.3.3 MEDIÇÃO DOS PARAMETROS 7.0 RESULTADOS E DISCUSSÃO. 8.0 CONCLUSÃO 9.0 REFERÊNCIAS BIBLIOGRÁFICAS. 13 14 15 16 16 17 18 18 18 19 20 22 23 23 24 24 25 26 27 27 27 28 28 30 31 33 34 34 34 35 36 37 37 38 38 49 50 51 ÍNDICE DE TABELAS Tabela 1 . Resultados das analises realizadas no 1º Ensaio de Bancada 40 referente a água bruta de turbidez 10,0 uT Tabela 2 . Resultados das analises realizadas no 2º Ensaio de Bancada 43 referente a água bruta de turbidez de 211 uT Tabela 3. Resultados das analises realizadas no 3º Ensaio de Bancada 44 referente a água bruta de turbidez 19,2 uT Tabela 4 . Resultados das análises realizadas no 4º Ensaio de Bancada 46 referente a água bruta de turbidez 18,7 uT Tabela 5: Valores referentes as características da água bruta e as dosagens 48 tidas como ótimas de Sulfato de Alumínio Granulado (SAG) e de Sulfato de Alumínio Líquido (SAL) ÍNDICE DE QUADROS Quadro 1. Faixa de pH de trabalho para os principais coagulantes 16 Quadro 2. Alcalinidade em função da faixa de pH 19 Quadro 3 – Faixa de transição de indicadores utilizados na titulação para 19 determinação da alcalinidade Quadro 4 - Expressão da acidez em relação ao pH. Quadro 5. Vantagens e desvantagens de alguns desinfetantes Quadro 6. Características do lodo de sulfato de alumínio em porcentagem 20 29 33 ÍNDICE DE FIGURAS FIGURA 1.:Tipos de tratamento da água bruta que pode ser empregado na 21 Estação de Tratamento de água FIGURA 2:Bomba de Captação da ETA TIJUCAL FIGURA 3: Tubo de captação da ETA TIJUCAL FIGURA 4– Calha Parshall da ETA TIJUCAL FIGURA 5: Floculadores da ETA Tijucal. FIGURA 6: Filtros da ETA TIJUCAL FIGURA 7: Ponto de cloração da ETA TIJUCAL FIGURA 8: Resíduos providos da lavagem dos filtros FIGURA 9: Resíduo sólido de filtro da ETA TIJUCAL. FIGURA 10: Fluxograma das etapas realizadas FIGURA 11: Coleta da água bruta 22 22 23 26 28 30 33 33 35 36 FIGURA 12: Águas após a decantação de 15 minutos, momento da coleta da 37 água para análise dos parâmetros. FIGURA 13: Águas após a decantação de 15 minutos, momento da coleta da 39 água para análise dos parâmetros. FIGURA 14: Turbidez e Cor ap. encontrados x dosagem aplicada de SAG em 41 água bruta com turbidez de10,0 uT FIGURA 15: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em 41 água bruta com turbidez de10,0 uT FIGURA 16: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAG em 42 água bruta com turbidez de 211 uT FIGURA 17: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em 42 água bruta com turbidez de 211 uT FIGURA 18: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAG em 45 água bruta com turbidez de 19,2 uT FIGURA 19: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em 45 água bruta com turbidez de 19,2 uT FIGURA 20: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAG em 47 água bruta com turbidez de 18,7 uT FIGURA 21: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em 47 água bruta com turbidez de 18,7 uT RESUMO Um problema que tem gerado polemica na sociedade é a questão do destino dos resíduos. Numa Estação de Tratamento de água esse efluente, ou resíduo solido é gerado basicamente pelos processos de lavagem dos filtros e decantadores, devido à adição de coagulantes. A quantificação do lodo gerado pode ser estimada pelo uso do Cone de Imhoff sendo o resultado expresso em mL/h. O coagulante popularmente utilizado é o sulfato de alumínio devido seu baixo custo monetário e disponibilidade de acesso encontrando-se na forma de sólido ou líquido. Sua dosagem ótima de floculação é determinada pelo ensaio de bancada (JAR TEST) sendo este método para a determinação adaptado do Manual Prático de Análise de Água da FUNASA. Porém, para tal determinação da dosagem e escolha do coagulante, devem-se levar em consideração as características da água bruta, tais como: alcalinidade, acidez, pH, cor e turbidez. Sendo a característica da turbidez, tida como principal critério para a escolha da dosagem ideal do coagulante. Este trabalho teve como principal objetivo realizar um estudo comparativo da influência do sulfato de alumínio líquido e do sulfato de alumínio granular em parâmetros físicos e químicos da água bruta. A área demarcada para pesquisa experimental foi a Estação de Tratamento de Água do Tijucal localizada em Cuiabá, Mato Grosso, a qual possui uma vazão de captação de cerca de 1100 L/s, utilizando o tratamento convencional e uso do coagulante sulfato de alumínio granulado. Através dos testes empregados foi possível confirmar que o sulfato de alumínio líquido gera menos resíduo sólido que o sulfato de alumínio granulado, sendo ambos eficientes na remoção da cor e da turbidez, produzindo uma água que atende aos padrões de potabilidade da Portaria 518/2004 do Ministério da Saúde. Palavras Chave: Coagulação; Sulfato de alumínio; Tratamento de água. 1.0 INTRODUÇÃO A água é um recurso essencial a manutenção da vida dos seres vivos, sendo considerada um bem precioso. Porém com o crescimento exponencial da população, a geração de poluição também aumentou, e um dos destinos dos efluentes gerados, sem tratamento, é o corpo receptor de águas. Geralmente esses despejos poluidores possuem impurezas carregadas negativamente, assim por possuírem cargas iguais não se agregam , aumentando a massa e com conseqüente não precipitação, tornando necessário o tratamento químico (LEAL;LIBÂNIO, 2002). Devido a isso a água para ser potável deve obedecer as normas da Portaria 518/2004 do Ministério da Saúde (BRASIL, 2005). A água captada no manancial é conduzida a uma estação de tratamento. O tipo de tratamento a ser empregado é dependente das características da água bruta (LIBÂNIO,2005).Podendo ser o tratamento por método simples, como a filtração lenta, ou a filtração direta, ou mais complexa, sendo este constituído pelo tratamento convencional. O tratamento convencional tem por processos a coagulação, floculação, decantação e desinfecção. Os principais pontos de geração de resíduos ocorrem pela descarga dos decantadores e pela lavagem dos filtros (DI BERNARDO; DANTAS,2005). Esse resíduo lançado no meio ambiente causa impactos substâncialmente consideráveis, como a redução da luminosidade interferindo na vida aquática devido o aumento da matéria em suspensão. Além de possuir microrganismos patogênicos e substancias tóxicas, como metais, especialmente o alumínio, oriundo do tratamento, interfere no ciclo do fósforo, essencial a vida aquática (BARROSO;CORDEIRO,2001). A característica do lodo é dada pela matéria contida já na água bruta adicionada de produto químico, comumente é utilizado o sulfato de alumínio (HAMMER,1979). O destino dos resíduos é monitorado pela Secretaria Estadual do Meio Ambiente (SEMA) e pela Resolução CONAMA 357de março de 2005 (BRASIL, 2005). A escolha do tipo de coagulante é feita pela alcalinidade, pelo pH e pelo custo (LEAL;LIBÂNIO,2001). Devendo este ser eficiente na remoção de matéria orgânica, pois esta em contato com o cloro origina substâncias tóxica, carcinogênicas (AZEVEDO NETTO, 1974). Assim um dos principais parâmetros a serem analisados é o de remoção da turbidez e da cor. 2.0 OBJETIVO GERAL Este trabalho teve como objetivo geral realizar um estudo comparativo da influência do sulfato de alumínio líquido e do sulfato de alumínio granular em parâmetros físicos e químicos da água bruta. 2.1 • Objetivos Específicos Avaliar variáveis físicas e químicas determinadas no tratamento de água bruta e após ensaios os referentes à água decantada. • Determinar a quantidade ótima de sulfato de alumínio pelo ensaio de jarros (Jar- Test) • Mensurar o volume de lodo formado pelo uso comparativo dos sulfatos. 3.0 REVISÃO BIBLIOGRÁFICA As características da água bruta variam de acordo com a região, sendo de suma importância a determinação destas características para transformá-la em água potável. Pois a eficiência do processo de coagulação, de acordo com Campos, et al.(2005), também é influenciada pelo pH e alcalinidade da água. A água é considerada potável, de acordo com a Portaria 518 do MS de 2004 (BRASIL,2005), quando os parâmetros microbiológicos, físicos, químicos e radioativos obedecem aos padrões de potabilidade não oferecendo riscos à saúde do consumidor, estando, portanto apta para o consumo humano. A água bruta possui impurezas em dois estados particulados: • Suspensão- causa a turbidez; é ocasionada pela presença de areia, argila, silte, despejos industriais, rede de esgoto e matéria orgânica; suas partículas giram numa faixa de 10-3 mm a 10mm (Azedo Netto 1979). • Dissolvida- resulta na cor; é causada pela presença de íons ferro, manganês, despejos industriais e decomposição de matéria orgânica. Encontra-se na forma coloidal apresentando dimensões de 10 -3µm a 1µ (Campos e Povinelli-1979) De acordo com Campos, et al.(2005) este material particulado possui carga elétrica negativa, o que causa uma certa repulsão entre eles, evitando a aglomeração e conseqüente decantação. Assim torna-se necessário o uso de produtos coagulantes, que atuam facilitando a formação dos flocos, através da neutralização das cargas eletrostáticas, os tipos de coagulantes mais utilizados são sulfato de alumínio, cloreto férrico e sulfato férrico (CAMPOS; POVINELLI, 1979). Na maioria das Estações de Tratamento de Água (ETA`S) utiliza-se o sal sulfato de alumínio, devido a seu baixo custo e sua relativa eficiência. O tipo de coagulante é tangenciado pelo valor econômico e a forma do tratamento da água relaciona-se com as características da água bruta captada, entre os tratamentos encontramos o método da filtração lenta, filtração direta ascendente, filtração direta descendente e, a mais empregada, o tratamento convencional. A escolha do melhor método é aquele que produz uma água que atenda a legislação em vigor, a Portaria 518 do Ministério da Saúde de 2004 ( BRASIL, 2004). 3.1 CARACTERÍSTICAS DA ÁGUA BRUTA. A água bruta pode ter diversas origens, ela pode ser de rios, lagos, represas, poços, mar ou pode ser de retorno e efluentes. Cada qual apresenta características próprias que variam de acordo com a origem (CAMPOS; DI BERNARDO e VIEIRA, 2005), necessitando de um tipo de tratamento, com constante monitoração, pois é uma água continua. As características da água bruta que são monitoradas numa ETA, com freqüência devido à importância na eficiência do processo de clarificação são: potencial hidrogênio iônico; turbidez; cor; temperatura, alcalinidade e acidez. 3.11. POTENCIAL HIDROGÊNIO IÔNICO- pH O pH é definido pela concentração de íons hidrogênio na solução, esta concentração associada a uma escala que varia de 0 a 14, indica se a água é acida, possui pH menor que 7; neutra, o pH é igual a 7; ou se é básica, o pH encontra-se com valor maior que 7 (LIBÂNIO 2005) O aparelho utilizado para medição denomina-se potenciômetro. Quadro 1. Faixa de pH de trabalho para os principais coagulantes. Coagulante Sulfato de alumínio Sulfato férrico Sulfato Ferroso Cloreto Férrico Sulfato Ferroso Clorado Aluminato de sódio e sulfato de Faixa de pH ideal 5,0 a 8,0 5,0 a 11,0 8,5 a 11,0 5,0 a 11,0 Acima de 4,0 6,0 a 8,5 alumínio FONTE: Campos e Povinelli (1979) Sua determinação na água bruta é importante, pois influência nas reações que ocorre com a adição do coagulante. A faixa de pH a ser empregada é determinada pelo tipo do coagulante a ser utilizado. Assim se a água encontra-se ácida pode-se utilizar cal hidratada, cal virgem ou hidróxido de sódio, se estivar básica usa-se um ácido, como por exemplo, o ácido sulfúrico. Outro motivo da determinação é a precaução do efeito corrosivo e de entupimento em tubulações de distribuição, de acordo com a Portaria 518/2004 do MS ( BRASIL, 2005) o pH da água de distribuição deve encontrar-se entre 6,0 a 9,5. 3.1.2TURBIDEZ A determinação da turbidez no controle do padrão da água dá-se pelo método nefelométrico. O turbidímetro é o aparelho utilizado para a leitura, este aparelho é constituído de um nefelômetro, sendo a turbidez expressa em unidades nefelométricas de turbidez (NTU ou uT). Segundo Teixeira et al.(2004) a turbidez é referente a concentração de matéria suspensa, quantificada por meio do efeito da dispersão que estas causam sobre a luz, quanto maior a intensidade da luz espalhada maior será turbidez da amostra analisada. O tamanho destas partículas varia, indo de grosseiras a colóides. Como já foi dito anteriormente, a turbidez é causada pela presença de matéria orgânica (decomposição de vegetais como, por exemplo, algas) e pela presença de inorgânicos (metais, despejos de resíduos). As presenças destas partículas insolúveis provocam a dispersão ou absorção da luz, dando uma aparência turva à água. Esta turvação é uma característica física indesejável tanto para o consumidor, quanto no tratamento da água. De acordo com a Portaria 518/2004 do MS ( BRASIL, 2005), a turbidez de águas destinadas ao consumo humano em pontos de rede não deve ultrapassar 5 uT. Para a saída dos filtros a turbidez deve ser no máximo 2 uT (filtração lenta) e 1uT (filtração rápida). Esta característica determina a aceitação ou a rejeição da água tratada, uma vez que através dela, sabe-se a qualidade do tratamento empregado. Sua importância de remoção segundo Teixeira et al.(2004), deve-se ao fato desta estar relacionada com a presença de cistos e oocistos de protozoários. A má remoção do material particulado diminui a eficiência da desinfecção, pois a partícula funciona como uma proteção, abrigando o microrganismo em seu interior, evitando assim que seja atingido pela ação do cloro. 3.1.3 COR. Até meados do século XIX de acordo com Campos et al.(2005) o termo cor era empregado para indicar altos valores de turbidez, a partir da década de 60, através de estudos, houve uma diferenciação dos termos. Desta maneira a cor segundo Libânio (2005) é produzida pela reflexão da luz nas partículas coloidais de dimensão inferior a 1µm essas partículas são predominantemente da decomposição de origem orgânica, mas ocorrem também devido a presença de íons ferro, manganês ou dos diversos lançamentos de resíduos. Na caracterização de águas, existe diferença entre os termos cor verdadeira e cor aparente. A primeira refere-se à cor após a remoção das partículas em suspensão, já a outra se refere às partículas em todos os seus estados, ou seja, incluindo as que se encontram em suspensão. De acordo com a Portaria 518 do MS ( BRASIL, 2005) a cor aparente deve ter no máximo valor de 15 uC. Esta característica é de suma importância devido ao fato de seus produtos derivados da decomposição da matéria orgânica, quando não removidos de forma eficiente entrarem em contato com reagente inorgânico, cloro, produzindo compostos organoclorados, os Trihalometanos –THM, considerados substâncias carcinogênica. De acordo com Libânio (2005) vale ressaltar que não há somente a formação dos THM como subprodutos, porém é o mais encontrado. 3.1.4 TEMPERATURA. A temperatura é uma vantagem para os países tropicais (LIBÂNIO, 2005), pois esta influência na reação química. Ao fornecer energia, no caso em forma de calor, a energia cinética da reação aumenta, sendo proporcional diretamente, favorecendo o processo de coagulação. 3.1.5 ALCALINIDADE A alcalinidade é a medida da capacidade de neutralização dos íons H+, ou da absorção desses íons sem mudança significativa do pH, funcionando como um tampão (LIBÂNIO, 2005), desta forma esta característica atua minimizando a redução do pH durante o processo de coagulação. Esta característica manifesta-se em função do pH, podendo ocorrer devido à presença de bicarbonatos (HCO3-); carbonatos (CO3-) e hidróxidos (OH-). Sendo que somente até dois tipos podem estar presentes simultaneamente na água, lembrando que hidróxido e bicarbonato reagem formando carbonatos; abaixo uma relação entre o pH e o tipo: Quadro 2. Alcalinidade em função da faixa de pH Ocorre devido a Bicarbonatos Carbonatos e bicarbonatos Hidróxidos e carbonatos. Fonte: Adaptado de Libânio (2005) Faixa de pH 4,4 a 8,3 8,3 a 9,4 Maior que 9,4 A alcalinidade é determinada pela titulação com ácido sulfúrico, indicador, podendo ser o alaranjado de metila, ou a fenolftaleína, é dependente da característica da água, sua unidade é dada em mg/L de carbonato de cálcio. Quadro 3 – Faixa de transição de indicadores utilizados na titulação para determinação da alcalinidade. Indicador Alaranjado de metila Fenolftaleína Fonte: Skoog (2009) ( Adaptado) Faixa de viragem 3,1 – 4,4 8,3 – 10,0 Esta característica não possui um valor padrão, pois para consumo humano não há objeção. É importante sua monitoração, pois mudanças bruscas, e elevados valores associa-se a processos de decomposição da matéria orgânica, e a atividade de microrganismos perante lançamentos de efluentes industriais. 3.1.6 ACIDEZ A acidez é a expressão da capacidade de neutralizar uma base. Essa expressão tem como fundamento a presença de CO2, adquirido da atmosfera por absorção, da decomposição de matéria orgânica, da lixiviação do solo ou já presente originalmente na água. Sua importância principal deve-se ao fato de buscar evitar corrosão nas tubulações. Assim como a alcalinidade é expressa em mg/L de carbonato de sódio. Esta característica influência o pH na medida em que evita mudanças bruscas no valor, sendo portanto expresso em função dele: Quadro 4 - Expressão da acidez em relação ao pH. pH <4,5 Acidez decorrente de ácidos minerais fortes 4,5 a 8,2 >8,2 FONTE: Richter; Azevedo Netto -1991 presença de CO2 CO2 livre ausente 4.0 PROCESSOS DE TRATAMENTO. Com o crescimento populacional há um aumento substâncial na poluição em todos os possíveis pontos de contaminação (ar, água e solo), causada por qualquer substância sólida, líquida ou gasosa. As reservas de água são fontes renováveis, porém com essa contínua exposição à poluição decorrente de ações antrópicas, principalmente, tornam-se necessários tratamentos para que se transformem em água potável. Assim o tratamento da água é realizado no intuito de se obter uma água que não ofereça riscos a saúde humana, sendo quimicamente e bacteriologicamente seguras. Segundo Azevedo Netto (1979) são três as finalidades do processo de purificação da água: • Higiênica – remoção de microrganismos; substâncias nocivas e redução de impurezas. • Estética - remoção da cor, odor e sabor. • Econômica- redução da corrosividade, da dureza, ferro, odor e sabor. O tipo de tratamento a ser empregado depende da qualidade da água bruta, um esquema resumido encontra-se apresentado na Figura 1: FIGURA 1. Tipos de tratamento da água bruta que pode ser empregado na Estação de Tratamento de água. FONTE: Adaptado Libânio (2005) A técnica para o tratamento de águas mais utilizada é o método convencional, ou seja, o tratamento completo. Este inclui o processo de clarificação com uso de coagulação e floculação, seguida de desinfecção. O processo de tratamento, segundo as Boas Práticas do Abastecimento de Água do Ministério da Saúde(BRASIL, 2006), começa com a captação da água bruta no manancial, sendo esta encaminhada a coagulação, floculação,decantação, filtração e posterior desinfecção. 4.1 CAPTAÇÃO A captação é um sistema construído próximo a rios, lagos, poços, barragens para a captação da água destinada ao tratamento e abastecimento. De acordo com as Boas Práticas do Abastecimento de água do Ministério da Saúde(BRASIL, 2006),deve-se localizar em trechos retilíneos do curso d`água ou na parte côncava,protegendo as margens de erosão, sendo esta favorecida pela maior velocidade das águas,e evitando as curvas e a parte convexa, local onde se tem acúmulo de matéria sólida. Sua condução (recalque) é feita por tubulações de metal (ferro). Já na captação retêm-se algumas impurezas, nas grades de ferro ou telas das tubulações, desde que grandes como galhos de árvores, folhas, peixes (YASSUDA; NOGOMI-1978) A figura 2 mostra a bomba de sucção da água bruta da ETA TIJUCAL no Rio Coxipó, e a figura 3 mostra a tubulação de captação da água, na parte debaixo encontra-se a grade que retém a sujeira. FIGURA 2: Bomba de Captação da FIGURA 3: Tubo de captação da ETA ETA TIJUCAL. Fonte: DUALIBI, TIJUCAL.Fonte:DUALIBI, A.N.(2010) A.N.(2010) . 4.2 CALHA PARSHALL A calha Parshall é onde ocorre a aplicação do coagulante na água captada, iniciando o processo de coagulação, denominado de mistura rápida Essa mistura rápida, de acordo com Richter e Azevedo Netto (1991), não se tem uma conclusão definitiva a respeito do tempo de mistura. A Figura 4 mostra a Calha Parshall da ETA TIJUCAL, ponto que recebe o coagulante sulfato de alumínio. FIGURA 4– Calha Parshall da ETA TIJUCAL. Fonte: DUALIBI, A.N.(2010) 4.2.1 COAGULAÇÃO A coagulação é a desestabilização eletrostática das partículas de impurezas, visando obter uma reação uniforme, porque deve acontecer quase que instantaneamente, e contínua, pois a água encontra-se em permanente movimento (PARLATORE, 1979). As partículas de impurezas coloidais são estáveis não precipitando espontaneamente, necessitando de um produto para que a coagulação ocorra. Estas partículas são estáveis porque todas são carregadas negativamente ou positivamente. Como os corpos de rios são objetos de degradação por despejos domésticos e industriais, geralmente possuem cargas negativas (LEAL; LIBÂNIO, 2002) necessitando deste processo pra que inicie a formação de flocos. A coagulação é resultado de dois processos, um químico onde ocorre a desestabilização das cargas, e o segundo, físico, no qual se emprega agitação lenta para que ocorra choque entre as partículas, agregando-se e formando flocos sedimentáveis. Para que isso ocorra atua sobre ela mecanismos de ação como a compressão da camada difusa, adsorção de neutralização de cargas, varredura e formação de pontes (LIBÂNIO, 2005). Esse processo de iniciação da formação dos flocos, sofre a influência de fatores como pH, dosagem do coagulante e característica da água bruta. Por receber em seu corpo despejos de rede e indústrias, a característica muda constantemente, tornando necessário que haja sempre a determinação da melhor quantidade de coagulante para a remoção de impurezas, para isso utiliza-se o Jar test. Este processo sofre a interferência de fatores como o pH, a alcalinidade, o tipo e concentração do coagulante, e a forma de aplicação do produto. 4.2.1.1 PROPRIEDADE DOS COAGULANTES A escolha do coagulante dá-se principalmente pela característica da água bruta, pH e alcalinidade são os fatores que mais interferem. Temos nesta categoria o sulfato de alumínio, é o mais popular, pois seu custo é baixo e encontra-se com facilidade; sulfato ferroso, utilizado para águas que possuem pH elevado; sulfato férrico, usual em águas ácidas e muito coloridas; e cloreto férrico, produz flocos em uma faixa de pH ampla(CAMPOS;POVINELLI,1979). Ainda de acordo com esses autores, para que seja empregado como um bom coagulante este deve produzir bons flocos, a superfície do floco deve ser grande adsorvendo as impurezas em suspensão; e não causar danos à saúde do homem. 4.2.2 SULFATO DE ALUMÍNIO. O sulfato de alumínio conhecido também como alúmen é comercializado na forma de granulado, pó ou em solução concentrada sob a fórmula molecular Al2(SO4)3.18H2O ou Al2(SO4)3.14,3H2O a quantidade de água é dependente do seu grau de hidratação (LIBÂNIO 2005). É o sal metálico mais utilizado, quando sólido contêm 17% de Al2O3 solúvel em água e quando na forma líquida contêm cerca de 8% de Al 2O3 disponível(HAMMER,1979). É obtido através da reação do hidróxido de alumínio (bauxita) com o ácido sulfúrico(MANFRINI-1976): 2 Al(OH)3+ 3 H2SO4+3 H2O → Al2(SO4)3·6H2O A reação entre um ácido e uma base gera sal e água, neste caso o uso de uma base fraca e de um ácido forte resultou num sal ácido. É considerado um sal ácido pois quando se inoniza ocorre uma reação secundária, na qual remove o OH- do meio precipitando, deixando o H+ em excesso. Pelo fato do H2SO4 ser um ácido forte, dissocia-se quase que completamente: Al2(SO4)3 2Al+3 + 3(SO4)-2 H2O H+ + OH- 2Al+3 + 3H+ + OH- Al(OH)3 + 3H+ (MANFRINI-1976) A faixa de pH ótima de trabalho para esse coagulante fica entre 5,0 a 8,0. Os flocos obtidos através da reação do sulfato com a alcalinidade possuem aspecto gelatinoso. Ao se adicionar o coagulante sulfato de alumínio, há formação do hidróxido de alumínio Al(OH)3, sendo este o responsável pela formação dos flocos, e desprendimento do gás carbônico CO2 resultando numa diminuição da alcalinidade, segundo a reação abaixo: Al2(SO4 )3.18H2O+3Ca(HCO3)2 → 3CaSO4+ 2Al(OH )3↓+6CO2 4.3 FLOCULADOR. Após o recebimento do coagulante na calha Parshall, a água segue para o floculador, que por um determinado período de tempo sob agitação branda tem-se a formação de flocos devido à agregação. A agitação deve ser lenta para que não ocorra a ruptura dos flocos, mas que apenas promova o choque entre as partículas para que haja um aumento do floco facilitando a sedimentação.O floculador pode ser do tipo hidráulico, no qual se aproveita a energia hidráulica, ocorrendo a agitação de forma sinuosa; ou floculador mecanizado, a agitação ocorre pelo uso de equipamentos como uma palheta movida a motor( RICHTER; AZEVEDO NETTO, 1991). A figura 5 refere-se a um floculador do tipo hidráulico da ETA TIJUCAL, passo posterior ao recebimento do coagulante, onde os flocos começam a agrupar-se devido a agitação branda ocasionada pelo aproveitamento da energia que se dissipa ao longo do caminho sinuoso que perfaz. FIGURA 5: Floculadores da ETA Tijucal. Fonte: DUALIBI, A.N.(2010) 4.3.1 FLOCULAÇÃO É o processo na qual se obtêm a agregação das partículas desestabilizadas, formando flocos, que com contínua agitação aderem uns aos outros tornando-se mais densos, sendo decantados posteriormente (PARLATORE, 1979). Segundo Di Bernardo e Dantas (2005) essa floculação ocorre pelos seguintes mecanismos: • Sedimentação diferenciada- ocorre devido a diferença de velocidade de decantação, formando flocos maiores devido a choques entre as partículas. • Interação pericinética- também chamada de movimento browniano: pequenas partículas em suspensão em meio líquido efetuam movimento rápido e desgovernado(SKOOG, 2009 ); • Interação ortocinética : são choques provocados pela diferença de velocidade das partículas no meio. Ainda segundo os mesmos autores, os fatores que interferem nesta etapa são os mesmos da coagulação acrescidos do tempo de detenção. 4.4 DECANTADORES Os decantadores consistem numa estrutura na qual se procura evitar ao máximo perturbação à água, para que as partículas sólidas mais pesadas que a água possam decantar sob ação da gravidade, pois com agitação da água essas partículas tendem a manter-se suspensas. Existem três tipos de decantadores (AZEVEDO NETTO, 1979), os clássicos, no qual recebe a água já floculada, realizando apenas a sedimentação; e os decantadores com contato de sólidos, nele ocorrem simultaneamente a agitação, floculação e decantação;e decantadores com escoamento laminar. 4.4.1 DECANTAÇÃO OU SEDIMENTAÇÃO. É o processo de remoção de material sedimentável. Este material por força da gravidade deposita-se no fundo dos decantadores formando uma camada de lodo no fundo destes. A limpeza dos decantadores ou descarga dos decantadores ocorre periodicamente, de acordo com o tamanho da Estação de Tratamento, característica da água bruta, e eficiência dos processos anteriores. Essa limpeza pode ser mecanizada ou manual, não devendo ocorrer com um intervalo de tempo que seja suficiente para que haja a solubilização de substancias prejudiciais à saúde do homem que se encontram na forma precipitada,lodo (BOAS PRÁTICAS DO ABASTECIMENTO DE ÁGUA DO MINISTÉRIO DA SAÚDE, 2006 ) 4.5 FILTROS O filtro tem por intuito remover partículas de baixa densidade ou finamente divididas para qual a sedimentação não é efetiva. Pode ser do tipo lento, indicada para águas com baixa turbidez, onde o processo é simples e não há adição de produtos coagulantes, ou ser do tipo rápida no qual o meio filtrante é constituído por areia, carvão e pedregulho(RICHTER e AZEVEDO NETTO,1991) A areia funciona removendo as partículas suspensas menores que a abertura entre seus grãos, além de reter amebas e giárdias. O carvão tem por finalidade a adsorção das impurezas que ocasionam cor e sabor, o pedregulho dá suporte a areia e ao carvão 4.5.1 FILTRAÇÃO A filtração tem por objetivo a obtenção de uma água límpida, através da remoção de materiais finos, orgânicos, inorgânicos, reduzindo as impurezas causadoras de cor e sabor, removendo inclusive alguns microrganismos, impurezas estas que reduziriam a eficácia da cloração. A figura 6 mostra um dos filtros da ETA TIJUCAL, sendo este constituído por uma camada de carvão, areia e pedregulho. FIGURA 6: Filtros da ETA TIJUCAL. Fonte: DUALIBI, A.N.(2010). A filtração ocorre após a sedimentação, pois espera-se que partículas mais grosseiras tenham decantado, evitando assim a obstrução rápida dos filtros. Quando estão obstruídos, faz-se a lavagem com jateamento de água e passagem de ar de forma ascendente. 4.6 DESINFECÇÃO A desinfecção é considerada uma das etapas mais importantes (BRANCO, 1974; ROSSIM, 1979), pois é nela que ocorre a inativação de microrganismos patógenos presentes na água como bactérias, protozoários e vírus. Segundo Di Bernardo e Dantas (2005) a desinfecção age de uma ou mais maneiras sobre o microrganismo, são elas: destruição da estrutura celular; interferência no metabolismo com inativação de enzimas; interferência na biossíntese e no crescimento celular, evitando a síntese de proteína, ácidos nucléicos e co-enzimas. Existe uma enorme gama de desinfetantes, abaixo se encontra um resumo (Quadro 5) com os mais utilizados. Quadro 5. Vantagens e desvantagens de alguns desinfetantes Desinfetante Cloro Vantagens Oxidante poderoso; manuseio; Desvantagens fácil Em presença de SH* residual forma persistente; uso comum. halogênios; em excesso causa Ozônio organoodor e sabor; interfere no pH. Forte oxidante; não apresenta Pequena meia vida; odor nem sabor; pequena consumo excesso influência do pH; ajudante energia Permanganato de potássio de coagulação. corrosivo. Fácil aplicação; não forma Oxidante trihalometanos. Peróxido de hidrogênio Fácil de aplicar; radicais hidroxilas. de elétrica; moderado, causa cor; pequena ação desinfetante. forma Oxidante moderado; formação de subprodutos ainda desconhecidos. FONTE: Adaptado de Di Bernardo e Dantas (2005 ) *SH-substância húmica Dentre os inúmeros desinfetantes, a escolha deste fator dá-se, também, pela característica da água bruta e por aquele que garanta a obtenção da água tratada isenta de microrganismo. O desinfetante mais utilizado nas ETA’s é o cloro devido ao custo benefício. Porém a busca por desinfetantes alternativos vem crescendo, pois o cloro em contato com resquícios de matéria orgânica dissolvida proveniente da má remoção, produz subprodutos carcinogênicos, causadores de malefícios a saúde humana. Para ser utilizado como desinfetante este deve possuir certos atributos (ROSSIN, 1979; DI BERNARDO, 2005) como: destruição de microrganismos patogênicos em tempo razoável; não deve ser tóxico, deve ser de custo baixo; acessível; fácil manuseio e estabilidade no transporte e no armazenamento; fácil manuseio e aplicação; deve ser seguro; sua concentração deve ser facilmente determinada e produzir residual livre resistente atuando como barreira contra possíveis re-contaminações. A figura abaixo mostra o ponto de cloração da água da ETA TIJUCAL, assim que sai dos filtros, esta segue para o reservatório, de onde é distribuída para a população. FIGURA 7: Ponto de cloração da ETA TIJUCAL Fonte: DUALIBI, A.N.(2010). 4.6.1 CLORO O cloro em condições atmosféricas normal encontra-se na forma gasosa. Possuindo afinidade com muitas substâncias, reagindo com quase todos os elementos (AZEVEDO NETTO, 1974). É um agente químico muito ativo, quando adicionado na água, e esta possui substâncias redutoras tais como sulfeto de hidrogênio, ferro e nitritos, reage resultando numa baixa concentração. É obtido através da eletrólise do cloreto de sódio em água, ou no processo de obtenção da soda caustica. Este desinfetante possui a vantagem da inativação eficiente para quase todos os microrganismos encontrados na água; produção residual facilmente monitorada; e possuir custo baixo, sendo também de simples manuseio. Segundo Hossin (1979) estando presente na água atua de duas formas, como: • Desinfetante - destruindo ou inativando microrganismos, através da destruição da parede celular. • Oxidante - oxidando compostos orgânicos e inorgânicos. Quando de sua adição na água, reage formando o ácido hipocloroso (I) que por sua vez dissocia-se produzindo o íon hipoclorito (II). Ambos possuem ação desinfetante, porém o ácido hipocloroso possui maior eficiência (DI BERNARDO e DANTAS, 2005) (I) Cl2 + H2O → HCLO + H+ + Cl- (II) HCLO → CLO- + H+ O pH da água de abastecimento é que determina qual a forma predominante do cloro (BOAS PRÁTICAS DO ABASTECIMENTO DE ÁGUA DO MINISTÉRIO DA SAÚDE,2006) assim tem-se que para : • pH < 5,0: Cl2 predomina • 5,0 <pH< 7,5: HCLO • pH >7,5 : CLOO cloro interfere no pH, pois este reage com os íons H + formando ácido clorídrico, que por sua vez reage com a alcalinidade natural da água. Para utilização do cloro como agente bactericida deve-se realizar uma completa remoção da matéria orgânica presente na água, pois como já foi dito anteriormente, há formação de substâncias nocivas. A ação do cloro depende: • da concentração empregada, quanto maior a concentração mais eficaz; • do tempo de contato, a portaria vigente recomenda 30 minutos no mínimo; • da temperatura, temperatura maior favorece as reações; • da remoção da turbidez; e • do tipo de microrganismos. Há microrganismos como o vírus que causa paralisia infantil e a hepatite infecciosa que resistem ao cloro (BRANCO, 1979). O controle nas ETA’s é dado pela concentração do cloro residual livre, sua detecção pode ser por método comparativo, no qual emprega-se a ortotolidina, que reage adquirindo uma coloração amarela. A Portaria 518/2004 (BRASIL, 2004) determina que a concentração deve ser de no mínimo 0,5 mg/L de residual livre e de 0,2 mg/L em qualquer ponto da rede. 5.0 RESÍDUOS DE ETA. Como em todo processo químico, as Estações de Tratamento de Água também geram resíduos sólidos, assim classificado o lodo de acordo com a NBR 10.004 de 2004(BRASIL,2004) Este resíduo é um problema destas estações, pois seu lançamento acarreta uma série de alterações ao corpo receptor. O lançamento deste lodo é regido pela Resolução CONAMA 357de março de 2005 (BRASIL, 2005), e tendo regulamentado as atividades poluidoras e degradantes pela Secretaria Estadual do Meio Ambiente ( SEMA). As duas principais fontes de resíduos na Estação de Tratamento provem dos decantadores, resultante da coagulação e da lavagem dos filtros(FIGURA 8) (RICHTER, 2001). Antigamente esses resíduos gerados eram lançados no rio sem nenhum tipo de tratamento, pois acreditavam que não estavam lançando nenhuma impureza que já não tivesse presente no meio (HAMMER, 1979). Atualmente sabe-se que nesses resíduos encontram-se novos poluentes, que contribuem para aumento de metais tóxicos, aumentando a concentração de sólidos suspensos diminuindo a luminosidade, afetando vidas aquáticas, e o alumínio presente liga-se aos fosfatos alterando o ciclo do fósforo, contribuindo também com agentes patogênicos (DI BERNARDO; DANTAS, 2005). De acordo com Barroso e Cordeiro (2001) alguns metais, como cobre, zinco, níquel, chumbo, cádmio, cromo e magnésio e, em especial, o alumínio presente no lodo de ETA possuem ações tóxicas, podendo apresentar efeitos positivos ou negativos nas técnicas de tratamento, disposição final e até mesmo, na reutilização destes resíduos Atualmente existem inúmeros tratamentos a esse lodo, como por exemplo, conduzi-lo ao sistema de tratamento de esgoto; lagoas pra desidratação; aterros sanitários e aproveitamento de subprodutos (RICHTER, 2001). Alem destas alternativas comuns, em processo de pesquisas procuram maneiras de aproveitar o lodo como o uso em solos (agricultura, reflorestamento, recuperação de áreas degradadas), fabricação de cimento, fabricação de materiais cerâmicos (DI BERNARDO e DANTAS 2005).Porem a escolha do método deve levar em conta as características que cada um contém, essas características são herdadas da água bruta e dos produtos adicionadas durante o tratamento da água, o que faz com que a técnica seja aplicável ou não (HAMMER,1979). FIGURA 8: Resíduos providos da lavagem dos filtros. Fonte: DUALIBI, A.N.(2010) 5.1 RESÍDUOS DE SULFATO DE ALUMÍNIO É um líquido não newtoniano, gelatinoso, que se sedimenta com facilidade. Possui em sua composição, hidróxido de alumínio, partículas inorgânicas, colóides de cor e resíduos orgânicos (RICHTER, 2001). O Quadro 6 mostra a porcentagem das frações típicas do lodo de sulfato de alumínio. A Figura 9 mostra o resíduo sólido gerado no filtro da ETA TIJUCAL. Quadro 6. Características do lodo de sulfato de alumínio em porcentagem Sólidos totais Al2O3.5H2O % % 0,1 – 4 15 – 40 Fonte: Richter (2001) Inorgânicos % 35 – 70 Matéria Orgânica % 15 – 25 pH. 6-8 FIGURA 9: Resíduo sólido de filtro da ETA TIJUCAL. Fonte: DUALIBI, A.N.(2010) 6.0 MATERIAIS E MÉTODO 6.1 ÁREA DE ESTUDO - ETA TIJUCAL A ETA TIJUCAL capta água do Rio Coxipó. O Rio Coxipó do Ouro nasce na Chapada dos Guimarães, cruza a área urbana de Cuiabá, e deságua no Rio Cuiabá. A vazão de água na Estação é cerca de 980 m3/h. A água do Rio Coxipo possui um alcalinidade ideal para o coagulante utilizado, o sulfato de alumínio ferroso,sendo este obtido na forma de pedra em bolsas de 40 Kg. A aplicação é feita pela bomba dosadora sobre a água bruta na ETA NOVA na Calha Parshall. Após a aplicação a água é dividida, indo uma parte pra ETA de Concreto (ETA 1), outra parte para a ETA Metálica (ETA 2) e outra seguindo na ETA NOVA. O tratamento realizado nas 3 ETA`s é do tipo convencional, sendo gerado os resíduos nos decantadores e filtros. Os floculadores são do tipo hidráulico (chicana). A água segue então para os decantadores, seguindo para os filtros de areia, sendo então clorada na seqüência do tratamento. A água tratada é recalcada para o reservatório sendo distribuído por bombas aos bairros atendidos por ela. No laboratório de análises de água são realizadas medidas controle a cada 2 horas dos parâmetros cor, turbidez, pH e cloro residual livre. Em período de chuva,a turbidez da água do Rio Coxipó pode alcançar 500uT, com cor variando até na casa dos 1000 uC. Já em época seca, a turbidez não ultrapassa 10uT e a cor não ultrapassa 25uC. 6.2METODOLOGIA O presente trabalho constou das seguintes etapas: • Caracterização dos parâmetros turbidez, cor, pH, alcalinidade e acidez da água bruta; • Preparação da solução do coagulante; • Determinação da dosagem ótima pelo uso do teste de bancada, Jar test; • Determinação do volume de resíduo pelo método de resíduo sedimentável, Cone de Imhoff. As águas foram coletadas na Calha Parshall antes do ponto de aplicação do sulfato de alumínio, e a determinação das dosagens ótima de coagulante foram realizadas pelo Jar test, extraído e adaptado do Manual Prático de Análise de Água da FUNASA (BRASIL, 2006). Para a obtenção dos dados referentes à quantidade de lodo, foi aplicado o método de resíduos sedimentáveis, utilizando Cone de Imhoff, (SILVA; GOMES, 2007). Na Figura 10 encontra-se um fluxograma das etapas realizadas para a parte experimental deste trabalho, desde a coleta ao método do cone de Imhoff. FIGURA 10: Fluxograma das etapas realizadas. 6.2.1 METODOLOGIA PARA DOSAGEM DE REAGENTES Foi utilizada uma solução de sulfato de alumínio a 0,2% preparado a partir do sulfato em pedra e da solução líquida concentrada a 50% como coagulantes. Preparação da solução de sulfato de alumínio a 0,2% A) A partir do sulfato em pedra: Pesou-se 1,0003 g de sulfato de alumínio em pedra, acrescentou-se 200 mL de água decantada e homogeneizou com a ajuda de um agitador, completando para um volume de 500 mL. B) A partir da solução de sulfato concentrado 50% Retirou-se uma alíquota de 2 mL da solução concentrada, e completou ate o volume de 500 mL, com água decantada. 6.3 ENSAIO DA COAGULAÇÃO A água foi coletada no mesmo ponto de coleta dos operadores, no intuito de se obter uma situação próxima vivenciada na estação, sendo recolhida na chegada à Calha Parshall antes de receber o sulfato. A figura 11 mostra o momento da coleta realizada por um dos operadores para a realização do teste de bancada. FIGURA 11: Coleta da água bruta Fonte: DUALIBI, A.N.(2010) As amostras de água foram colhidas em baldes ( Figura 11), homogeneizadas e acomodadas nos jarros no mesmo local. Nesta água foram analisados os parâmetros pH, alcalinidade, acidez, turbidez,e cor, sendo determinada a concentração do coagulante nos jarros pelos valores destes dois últimos parâmetros. 6.3.1 PREPARO DO JAR TEST A realização do Teste de Jarros foi adaptado do Manual de Análise de Águas da FUNASA (BRASIL, 2006). O procedimento teve como primeiro passo a determinação dos parâmetros cor, alcalinidade, pH, acidez e turbidez da água bruta. Encheu-se os jarros de 2000 mL com esta água bruta, inicialmente a uma rotação de 100 rpm, simulando a mistura rápida, e adicionou-se o coagulante, após um minuto, baixou-se a rotação para 45 rpm, simulando o floculador, cessado 15 minutos, desligou-se o equipamento, repousando por 15 minutos, passo do processo que simula o decantador. Depois de decorrido este tempo coletou-se amostra de água de cada jarro e analisou-se qual apresentou o melhor resultado. FIGURA 12: Aparelho para Ensaio de Bancada, Jar Test Fonte: DUALIBI, A.N.(2010) 6.3.2 CONE DE IMHOFF O procedimento adaptado e idealizado (SILVA; GOMES, 2007) constituiu da transferência da amostra homogeneizada, do jarro tido como o que melhor removeu a turbidez, para o Cone de Imhoff de 1000 mL. Em seguida, deixou-se decantar por 45 minutos, e após esse período, com o auxilio de um bastão de vidro, em movimento circular, despregou-se as partículas aderidas internamente na parede do cone, dando um tempo de 15 minutos, realizando assim a leitura do material sedimentado, sendo este resultado expresso em mL/h. 6.3.3 MEDIÇÃO DOS PARAMETROS A turbidez e o pH são fornecidos pelos aparelhos calibrados, realizando-se apenas a anotação do valor. A cor foi determinada por comparação visual com disco comparador. Os demais se seguiu o procedimento contido no Manual Prático de Análise de Águas da FUNASA ( BRASIL, 2006) alcalinidade determinada pela titulação com acido sulfúrico a 0,02N ; a acidez pela titulação com hidróxido de sódio a 0,02N. 7.0 RESULTADOS E DISCUSSÃO. Os dados obtidos referente às determinações da dosagem ótima de coagulante pelo ensaio de bancada para os diferentes valores de turbidez, cor, pH, alcalinidade e acidez da água bruta, encontram-se apresentados nas Tabelas de 01 a 04. Estas tabelas apresentam a dosagem na qual se obteve a melhor remoção da turbidez e da cor da água bruta e os valores da turbidez e da cor remanescente de cada jarro. A dosagem ótima de coagulante é baseada no menor valor de turbidez da água remanescente. O cálculo para a porcentagem de remoção da turbidez foi regida pela seguinte regra de acordo com o Manual de Operação e Manutenção de Estação de Tratamento de Água ( FANAIA et al., 2002) %Rt = Turbidez da água bruta – Turbidez da água do jarro x 100 Turbidez da água bruta Para a determinação da remoção da cor: %Rc = Cor da água bruta – Cor da água do jarro x 100 Cor da água bruta As leituras da turbidez, pH e cor foram realizadas após 15 minutos de decantação, que posteriormente, aquele que obteve a melhor redução de turbidez foi submetido ao cone de Imhoff, para a leitura do volume gerado de resíduo solido. Na Figura 13, observa-se o período de pós 15 minutos, do ensaio realizado com a turbidez de 211 uT com o coagulante sulfato de alumínio sólido. FIGURA 13: Águas após a decantação de 15 minutos, momento da coleta da água para análise dos parâmetros. Fonte: DUALIBI, A.N.(2010) A Figura 14 e 15 apresenta os resultados referentes à Turbidez e Cor aparente encontrados na relação da dosagem aplicada de SAG( Sulfato de alumínio granulado) e SAL ( Sulfato de alumínio líquido), respectivamente, em água bruta com turbidez de10,0 uT e cor de 27,5uC, mostra que a dosagem ideal situou-se em 8,0mL para o SAG e 4,0mL para o SAL, observada também na Tabela 1. Assim conforme os dados apresentados na Tabela 1 a dosagem de coagulante em água bruta de turbidez 10,0 uT, em relação à menor turbidez (1,67 uT) e menor cor (2,5 uC) é verificada com o sulfato de alumínio líquido. Sendo a geração de resíduo influenciado pelo coagulante, conseqüentemente o sulfato líquido gerou menos resíduo, uma diferença de 0,2 mL. Tabela 1 . Resultados das analises realizadas no 1º Ensaio de Bancada referente a água bruta de turbidez 10,0 uT 1º ENSAIO DE BANCADA (Jar-Test) PARA 10,0uT ETA TIJUCAL Acidez mg/L CaCO3 Data: 27/11/2010 2,0 Turbidez inicial : 10,0 uT 3,0 Cor aparente inicial: 27,5 uC 3,0 pH inicial: 6,78 2,7 Sulfato granulado (SAG) Jarro 01 02 03 Dosagem de coagulante (mL) Turbidez encontrada (uT) Cor ap. encontrada (uC) pH encontrado % Remoção turbidez %Remoção cor aparente Volume obtido do resíduo 2,0 8,75 27,50 6,63 12,50 0 (mL/h) Dosagem de melhor coagulação Sulfato líquido (SAL) Jarro 01 Dosagem de coagulante (mL) Turbidez encontrada (uT) Cor ap.encontrada (uC) pH encontrado % Remoção turbidez %Remoção cor aparente Volume obtido do resíduo 2,0 8,56 27,50 6,61 14,40 0 (mL/h) Dosagem de melhor coagulação 4,0 8,60 27,50 6,45 14,00 0 5,0 2,31 2,50 6,37 76,90 90,91 Alcalinidade total mg/L CaCO3 6,0 5,0 5,0 5,3 Média 04 05 06 6,0 2,22 2,50 6,37 77,80 90,91 8,0 1,67 2,50 6,08 83,30 90,91 10,0 8,15 27,50 5,84 18,50 0 0,80 8,0mL 02 03 04 05 06 4,0 1,08 2,50 6,37 89,20 90,91 5,0 1,30 2,50 6,20 87,00 90,91 6,0 4,69 7,50 6,07 53,10 72,73 8,0 7,78 27,50 5,67 22,20 0 10,0 8,13 27,50 5,29 18,70 0 0,60 4mL FIGURA 14: Turbidez e Cor ap. encontrados x dosagem aplicada de SAG em água bruta com turbidez de10,0 uT. FIGURA 15: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em água bruta com turbidez de 10,0 uT Na Tabela 2, a água bruta utilizada para os teste possui uma turbidez elevada de 211 uT e uma Cor aparente alta (150 uC) . A alcalinidade presente é de 1,06 mg/L de CaCO3, valor que se apresenta menor que o valor das demais tabelas. Como a alcalinidade é referente ao tipo de constituintes do solo (Di Bernardo; Conceição, Di Bernardo, 1996) e levando-se em consideração que houve chuva no período, e que é sabido que o solo mato-grossense é um solo ácido, houve portanto um consumo da alcalinidade da água por parte destes constituintes arrastados para a água. Sendo também a chuva, a responsável pelo aumento dos valores de cor e turbidez, uma vez que arrasta matéria orgânica para o rio. Nestes valores para a água bruta observando as Figuras 16 e 17 referente à dosagem utilizada de coagulante versus turbidez e cor aparente encontrada, e correspondendo respectivamente ao SAG e SAL, nota-se que a melhor remoção ocorreu com o valor de 25 mL de coagulante de SAG, e que foi necessário 18mL quando se utilizou o SAL. A diferença de 7mL resultou num volume de resíduo de 4,8 mL/h para o SAG. FIGURA 16: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAG em água bruta com turbidez de 211 uT FIGURA 17: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em água bruta com turbidez de 211 uT Tabela 2 . Resultados das analises realizadas no 2º Ensaio de Bancada referente a água bruta de turbidez de 211 uT. 2º ENSAIO DE BANCADA (Jar-Test) PARA 211 uT ETA TIJUCAL Data:28/11/2010 Turbidez inicial : 211 uT Cor aparente inicial: 150uC pH inicial: 6,89 Sulfato granulado (SAG) Jarro 01 Dosagem de coagulante (mL) 21,0 Turbidez encontrada (uT) 7,31 Cor encontrada (uC) 12,50 pH encontrado 5,95 % Remoção turbidez 96,53 %Remoção cor aparente 91,67 Volume obtido de resíduo (mL/h) Dosagem de melhor coagulação Sulfato líquido (SAL) Jarro 01 Dosagem de coagulante (mL) 17,0 Turbidez encontrada (uT) 3,74 Cor encontrada (uC) 2,50 pH encontrado 5,94 % Remoção turbidez 98,23 %Remoção cor aparente 98,33 Volume obtido de resíduo (mL/h) Dosagem de melhor coagulação Acidez mg/L CaCO3 3,0 4,0 4,0 3,7 Alcalinidade CaCO3 10,0 11,0 11,0 10,6 total mg/L 02 03 04 05 06 22,0 3,78 7,50 5,84 98,21 95,0 23,0 3,01 2,50 5,82 98,57 98,33 24,0 2,33 2,50 5,88 98,89 98,33 25,0 1,80 2,50 5,71 99,15 98,33 26,0 4,39 7,50 5,70 79,19 50,0 Média 4,80 25mL 02 03 04 05 06 18,0 3,25 2,50 5,68 98,46 98,33 19,0 3,63 2,50 5,60 98,28 98,33 20,0 4,85 2,50 5,49 97,70 98,33 21,0 6,00 7,50 5,36 97,16 95,0 22,0 8,63 17,50 5,25 95,91 88,33 4,50 18mL Os resultados apresentados na Tabela 3 mostram uma água bruta de turbidez de valor 19,2 uT, com cor aparente de 32,5 uC. Tanto pela referida tabela, quanto pelas Figuras 18 e 19,correspondente ao SAG e SAL respectivamente, a melhor dosagem observada para a remoção mais eficiente da turbidez (0,78 uT) e cor aparente (2,5uC), para o SAG foi de 7mL gerando um resíduo de 1,7mL/h, e para o SAL com turbidez de 0,64uT e cor 2,5uC, o valor utilizado foi de 4,0mL/h, obtendo um valor de 1,1mL/h de lodo. Tabela 3. Resultados das analises realizadas no 3º Ensaio de Bancada referente a água bruta de turbidez 19,2 uT. 3º ENSAIO DE BANCADA (Jar-Test) PARA 19,2uT Acidez mg/L Alcalinidade total mg/L ETA TIJUCAL CaCO3 CaCO3 Data: 29/11/2010 4,0 3,0 Turbidez inicial: 19,2uT 4,0 4,0 Cor aparente inicial: 32,5uC 4,0 4,0 pH inicial: 6,80 4,0 3,7 Média Sulfato granulado (SAG) Jarro 01 02 03 04 05 06 Dosagem de coagulante (mL) 6,0 7,0 8,0 9,0 10,0 11,0 Turbidez encontrada (uT) 0,94 0,78 1,00 2,02 5,16 7,43 Cor encontrada (uC) 2,50 2,50 2,50 2,50 12,50 17,50 pH encontrado 6,39 6,24 6,17 6,07 5,96 5,81 % Remoção turbidez 95,10 95,94 94,79 89,48 73,13 61,30 %Remoção cor aparente 92,24 92,24 92,24 92,24 61,18 45,65 Volume obtido de resíduo (mL/h) 1,70 Dosagem de melhor coagulação Sulfato líquido (SAL) Jarro 01 Dosagem de coagulante (mL) 3,0 Turbidez encontrada (uT) 2,45 Cor encontrada (uC) 7,50 pH encontrado 6,41 % Remoção turbidez 87,24 %Remoção cor aparente 77,64 Volume obtido de resíduo (mL/h) Dosagem de melhor coagulação 7,0mL 02 03 04 05 06 4,0 0,64 2,50 6,28 96,67 93,17 5,0 1,52 2,50 6,17 92,08 93,17 6,0 8,50 27,50 5,92 55,73 15,53 7,0 8,70 27,50 5,62 54,69 15,53 8,0 8,87 27,50 5,48 53,80 15,53 1,10 4,0mL FIGURA 18: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAG em água bruta com turbidez de 19,2 ut FIGURA 19: Turbidez e Cor ap. encontrados x Dosagem aplicada de SAL em água bruta com turbidez de 19,2 ut De acordo com a Tabela 4 e as Figura 20 e 21 os melhores valores de remoção de turbidez para o SAG (1,26uT e 2,5uU) resultou na dosagem necessária,para uma eficiente remoção, 8mL de coagulante.Para o SAL que apresentou como melhores resultados 0,82uT e 2,5uC o valor utilizado tido como mais eficiente foi de 5 mL. Estes valores correspondem a uma turbidez de 18,7 uT, 45uC de cor e de pH igual a 6,89. Tabela 4 . Resultados das análises realizadas no 4º Ensaio de Bancada referente a água bruta de turbidez 18,7 uT. 4º ENSAIO DE BANCADA (Jar-Test) PARA 18,7 uT Acidez mg/L Alcalinidade total mg/L ETA TIJUCAL CaCO3 CaCO3 Data:30/11/2010 1,5 5,0 Turbidez inicial : 18,7uT 2,0 4,0 Cor aparente inicial: 45,0uC 2,0 5,0 pH inicial: 6,89 1,8 4,7 Média Sulfato granulado Jarro 01 02 03 04 05 06 Dosagem de coagulante (mL) 6,0 7,0 8,0 9,0 10,0 11,0 Turbidez encontrada 2,69 1,44 1,26 1,33 5,92 6,11 Cor encontrada 2,50 2,50 2,50 2,50 27,50 27,50 pH encontrado 6,54 6,47 6,38 6,32 6,21 6,13 % Remoção turbidez 85,61 92,30 93,26 92,89 68,34 67,33 %Remoção cor aparente 94,44 94,44 94,44 94,44 38,89 38,89 Volume obtido de resíduo (mL/h) 1,70 Dosagem de melhor coagulação Sulfato líquido Jarro 01 Dosagem de coagulante (mL) 3,0 Turbidez encontrada 14,10 Cor encontrada 45,00 pH encontrado 6,53 % Remoção turbidez 26,56 %Remoção cor aparente 0,00 Volume obtido de resíduo (mL/h) Dosagem de melhor coagulação 8 mL 02 03 04 05 06 4,0 2,54 7,50 6,44 86,77 83,33 5,0 0,82 2,50 6,35 95,73 94,44 6,0 1,34 2,50 6,25 93,02 94,44 7,0 7,05 17,50 5,99 63,28 61,11 8,0 12,30 37,50 5.88 35,94 16,67 1,40 5mL FIGURA 20: Turbidez e Cor aparente encontrados x Dosagem aplicada de SAG em água bruta com turbidez de 18,7 ut FIGURA 21: Turbidez e Cor aparente encontrados x Dosagem aplicada de SAL em água bruta com turbidez de 18,7 ut Tabela 5: Valores referentes as características da água bruta e as dosagens tidas como ótimas de Sulfato de Alumínio Granulado (SAG) e de Sulfato de Alumínio Líquido (SAL) Dosagem ótima de coagulante Água Bruta pH 6,78 6,89 6,80 6,89 Turbidez (uT) 10,0 211,0 19,2 18,7 SAG 6,08 5,71 6,2 6,32 pH. SAL 6,37 5,68 6,3 6,35 Cor ap. (uC) 27,5 150,0 32,5 45,0 Alcalinidade (mg/L CaCO3) 5,30 1,06 3,70 4,70 %Remoção da Turbidez SAG SAL 77,8 89,2 99,15 98,46 95,9 96,7 93,26 95,73 SAG (mg/L) 8,0 25,0 7,0 8,0 SAL (mg/L) 4,0 18,0 4,0 5,0 %Remoção da Cor ap. SAG SAL 90,91 90,91 98,33 98,33 92,2 93,2 94,44 94,44 De acordo com Leal; e Libânio(2002) a dosagem ideal é aquela que produz a maior eficiência na remoção percentual dos parâmetros de controle, quaisquer que sejam.Na qual utilizaram para comparação da eficiência, coagulantes diferentes,sendo que dependendo da situação que apresentaram,ora deu sais a base de ferro e noutra situação o sulfato de alumínio. Assim, na Tabela 5, vemos que o sulfato de alumínio líquido apresenta melhores resultados para a remoção da turbidez. Há de se levar em conta também a alcalinidade, esta age como um tampão minimizando a queda do pH. Costa (2007) conclui que essa capacidade de tamponamento devido a alta alcalinidade faz com que o pH permaneça praticamente inalterado. Porem como a água bruta utilizada para os ensaio deste trabalho não possui alcalinidade alta, o pH sofre alterações . Sendo que este é um dos fatores que afetam o processo de coagulação, conseqüentemente a quantidade de sulfato necessário ao tratamento sofre variação. O sulfato de alumínio possui uma faixa de atuação de pH entre 6,0 e 8,0, de acordo com Vogel ( 1981), o hidróxido de alumínio em pH menor que 6 encontra-se na forma livre, e em pH maior que 8 também. Já na faixa de atuação encontra-se na forma associada , sendo este a forma que reage com a impureza precipitando (MANFRINI, 1976). Ao adicionar o sulfato de alumínio este hidrolisa-se liberando íons H + no meio consumindo a alcalinidade, baixando o pH. Assim a turbidez resultante antes da dosagem ideal é devido as partículas que se encontram em suspensão e dissolvidas, já os valores após a dosagem ideal ocorre devido ao excesso de sulfato. Este fato pode ser observado nas Figuras de 14 a 21. Porem se basear a escolha do coagulante somente na analise da turbidez não se tem vantagem, uma vez que o sulfato líquido tem custo maior que o sulfato granulado, onerando o volume menor que é utilizado. Todavia se levar em conta a geração de resíduo durante o tratamento da água, o sulfato líquido produz menos resíduo. Desta forma, se em 4 ensaios gerou-se em torno de 9 mL de resíduo com o sulfato de alumínio granulado, a ETA TIJUCAL que apresentou uma vazão em torno de 1066l/s durante os testes, hipoteticamente geraria cerca de 4,32m3/h de resíduo, já com o sulfato de alumínio liquido que gerou nos 4 ensaios 7,6 mL, geraria cerca de 3,64 m3/h de resíduo. Soma-se a esse valor do sulfato granulado ainda o grão que não se dissolveu por completamente durante a preparação da solução, seja por não ter dado o tempo de agitação necessário para a dissolução, ou pelo fato dos agitadores do tanque se encontrar com problemas, e as impurezas nele contida que são insolúveis. Esse resíduo é um fator que deve ser tratado pela ETA, uma vez que seu despejo em cursos d’água é uma prática contestável, sendo fiscalizada e autuada pela Secretaria Estadual do Meio Ambiente (SEMA). Independente do coagulante utilizado, a geração de resíduos produzidos durante o tratamento da água é inevitável, porém pode-se através de escolhas procurar minimizar sua produção. Assim o resíduo que permanece no tanque de sulfato pode ser adicionado a preparação de outra solução do coagulante em outro tanque, este procedimento possui um baixo custo, uma vez que só necessita de uma bomba para a transferência, resultando numa economia de sulfato. Ou ser incorporado ao resíduo gerado nos decantadores e filtros e despejados na rede de esgoto para que receba um tratamento para o lançamento nos rios. 8.0 CONSIDERAÇÔES FINAIS Este trabalho confirmou a necessidade da determinação da dosagem ótima de coagulante no tratamento de águas, numa Estação de Tratamento, pelo uso do Teste de bancada utilizando como base os valores de turbidez remanescente. Para que seja aplicada a dosagem ideal esta deve apresentar o menor valor de turbidez remanescente após o período de decantação, ou seja, deve apresentar uma melhor remoção de turbidez. Não se esquecendo que deve ser eficiente também na remoção da cor, uma vez que, a cor, caso não seja corretamente removida, no processo de desinfecção acarretará em substâncias nocivas ao consumidor, bem como a turbidez má removida pode oclusionar microrganismos patogênicos. Verificou-se que tanto o sulfato de alumínio granulado quanto o sulfato de alumínio liquido, possuem ambiente de atuação ideal para sua função de coagulante, sendo que as águas do Rio Coxipó, que abastece a ETA TIJUCAL, atendem as necessidades de pH e alcalinidade necessária para uma boa atuação do agente químico. Desta forma ambos removem eficazmente a turbidez e cor da água bruta. Atendendo assim a exigência da Portaria 518/2004 do Ministério da Saúde. Foi possível também, observar a vantagem do uso do sulfato de alumínio líquido quando comparado ao sulfato de alumínio granulado no quesito geração de resíduo. A Estação de tratamento que possui uma vazão de 1100l/s em média, gera relativamente uma grande quantidade de resíduo. É sabido que cada indústria, no caso indústria da água, deve ser responsável pelo seu resíduo gerado, sendo assim deve se buscar alternativas para redução de produção deste lodo, dar-lhe o destino que é devido, como por exemplo a condução deste resíduo a Rede de Tratamento de Esgoto. 9.0 REFERÊNCIAS BIBLIOGRÁFICAS. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS. NBR - 10.004: Resíduos sólidos – classificação. Rio de Janeiro, 2004(a). 33p. AZEVEDO NETTO, JOSÉ, M; OLIVEIRA, W.E.;BRANCO, S.M.; SIGHIER; L.; MANFRINI ,C. GELDREICH,E.; PERA, A.; SILVA,C.C..; GONSALVES;W. QUIMARÃE,F. Desinfecção. SãoPaulo, CETESB.1974 AZEVEDO NETTO,, J.M.; MANFRINI, C.; CAMPOS, J.R.; POVINELLI, J.; PARLATORE, A.C.; HESPANOL, I.; ROSSIN, A.C.; YAGUINUMA,S.; Técnica de Abastecimento e Tratamento de Águas. SãoPaulo, CETESB.1979 BARROSO, M. M.; CORDEIRO, J. S. Problemática dos Metais nos Resíduos Gerados em Estações de Tratamento de Água. In: CONGRESSO BRASILEIRO DE ENGENHARIA SANITÁRIA, 21., 2001, João Pessoa. Anais... João Pessoa: ABES, 2001 BRASIL MINISTERIO DA SAÚDE – Fundação Nacional da Saúde, FUNASA. MANUAL PRÁTICO DE ANÁLISE DE ÁGUA- Manual de Bolso. 2ª ed. rev. Brasília, 2006. 146p BRASIL. CONAMA Resolução no 357, de 17 http://www.mma.gov.br/port/conama/res/res05/res35705.pdf. de Março de 2005. Acesso em outubro de 2010. BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Boas práticas no abastecimento de água : procedimentos para a minimização de riscos à saúde. Brasília : Ministério da Saúde, 2006.252 p BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Coordenação-Geral deVigilância em Saúde Ambiental. Portaria MS n.º 518/2004 / Ministério da Saúde,Secretaria de Vigilância em Saúde, Coordenação- Geral de Vigilância em Saúde Ambiental– Brasília: Editora do Ministério da Saúde, 2005. 28 p. – (Série E. Legislação em Saúde). CAMPOS, S.X.; DI BERNARDO, L.; VIEIRA, E.M. Influencia das características Húmicas na eficiência da coagulação com sulfato de aluminio. Revista de engenharia Sanitária Ambiental. Vol10 N◦3, 194-199, 2005 COSTA, E.R.H. da; Melhoria da Qualidade da Água tratada e aumento da Capacidade de ETAS Atraves da Escolha Adequada de Coagulantes e Auxiliares em Águas com Alcalinidade alta. In: Congresso Brasileiro de Engenharia Sanitária e Ambiental 2007, Belo Horizonte:ABES, 2007. DI BERNARDO, L. ; DANTAS, A. D. B. Métodos e Técnicas de Tratamento de Água. 2.ed. São Paulo: Editora Rima , 2005. v. 2. FANAIA et al., Manual de Operação e Manutenção de Estação de Tratamento de Água,SANECAP,2002. HAMMER, M.J. Sistema de abastecimento de água e esgoto. Tradução de A.S. Almeida. Rio de Janeiro:Livros técnicos e científicos,1979. LEAL,F.C.T; LIBÂNIO, M. Estudo da Remoção da Cor por coagulação química no trataemento Convencional de Águas de Abastecimento. Revista de Engenharia Sanitária Ambiental. Vol7 N◦3 e 4, 117-128,2002. LIBÂNIO, M. Fundamentos de Qualidade e Tratamento de Água. Campinas, SP:Editora Átomo. 2005 OLIVEIRA, W.E.; GAGLIANONE,, S.; YASSUDA, E.R.; NOGAMI, P.S.; PEREIRA, B..E.B.; MARTINS,J.A..Técnica de Abastecimento e Tratamento de Água.2.e.rev. SãoPaulo, CETESB.1978 RICHTER, C. A.; . Tratamento de Lodos de Estação de Tratamento de Água. SãoPaulo, SP: Editora Edgard Blucher LTD, 2001 RICHTER, C.A.; AZEVEDO NETTO, J.M..Tratamento de Água:Tecnologia Atualizada. São Paulo: Edgard Blucher 1991 SILVA, O.L.C.; GOMES,H.P.. Viabilidade técnica, econômica e ambiental no reaproveitamento de águas de lavagem em ETAs. 24◦Congresso Brasileiro de Engenharia Sanitária e Ambiental, Belo Horizonte, MG, 2007 SKOOG, D.A; WEST,D.M; HOLLER,F.J.; CROUCH, S.R. Fundamentos de Química Analítica., Tradução de Marco Tadeu Grassi, 8ªed., São Paulo:Thomson,2007 TEIXEIRA, A.R.; SANTOS, E.P.C.; PÁDUA, V.L.;HELLER,L.; DI BERNARDO,L.;LIBÂNIO,M. A Confiabilidade Analítica dos Valores de Turbidez da Água Filtrada e seu Efeito no Cumprimento do Padrão de Potabilidade. Revista de Engenharia Sanitária Ambiental, Vol 9 N◦1, 65-72p. 2004 VOGEL, A. I . Química Analítica Quialitativa. Tradução de Antonio Gimeno, 5 ed rev.- São Paulo: Mestre Jou,1981. LICENÇA: A obra Estudo comparativo da influência do sulfato de alumínio líquido e sulfato de alumínio granulado na turbidez, cor e no volume de resíduo gerado no tratamento de águas, de Arianne Nunes Dualibi, foi licenciada com uma Licença Creative Commons Atribuição - Uso Não Comercial - Obras Derivadas Proibidas 3.0 Brasil. Livros Grátis ( http://www.livrosgratis.com.br ) Milhares de Livros para Download: Baixar livros de Administração Baixar livros de Agronomia Baixar livros de Arquitetura Baixar livros de Artes Baixar livros de Astronomia Baixar livros de Biologia Geral Baixar livros de Ciência da Computação Baixar livros de Ciência da Informação Baixar livros de Ciência Política Baixar livros de Ciências da Saúde Baixar livros de Comunicação Baixar livros do Conselho Nacional de Educação - CNE Baixar livros de Defesa civil Baixar livros de Direito Baixar livros de Direitos humanos Baixar livros de Economia Baixar livros de Economia Doméstica Baixar livros de Educação Baixar livros de Educação - Trânsito Baixar livros de Educação Física Baixar livros de Engenharia Aeroespacial Baixar livros de Farmácia Baixar livros de Filosofia Baixar livros de Física Baixar livros de Geociências Baixar livros de Geografia Baixar livros de História Baixar livros de Línguas Baixar livros de Literatura Baixar livros de Literatura de Cordel Baixar livros de Literatura Infantil Baixar livros de Matemática Baixar livros de Medicina Baixar livros de Medicina Veterinária Baixar livros de Meio Ambiente Baixar livros de Meteorologia Baixar Monografias e TCC Baixar livros Multidisciplinar Baixar livros de Música Baixar livros de Psicologia Baixar livros de Química Baixar livros de Saúde Coletiva Baixar livros de Serviço Social Baixar livros de Sociologia Baixar livros de Teologia Baixar livros de Trabalho Baixar livros de Turismo
Download