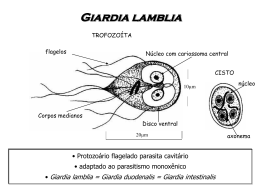
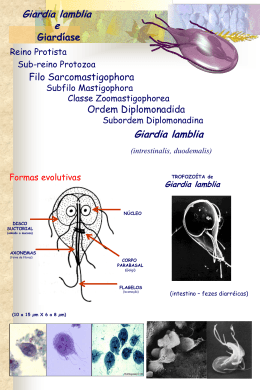
BIOLOGIA Análise do perfil protéico em Giardia lambia e pesquisa de anticorpos anti- Giardia na população pediátrica das creches municipais de Osasco- SP, no período de setembro de 2003 a junho de 2004 Sheila Rovagnoli Vieira da Silva Pesquisador Mírian Silva do Carmo Orientador Resumo G.lamblia é um parasita intestinal de distribuição cosmopolita em áreas endêmicas, apresenta alta prevalência entre crianças, principalmente entre os menores de 2 anos. A transmissão pode ocorrer pessoa-a-pessoa, mas geralmente é transmitida através de cistos. A doença é geralmente aguda e autolimitante em imunocompetentes, podendo tornar-se persistente e fatal em imunocomprometidos, variando desde assintomática, até diarréia severa e síndrome de má absorção. Fatores do hospedeiro, e parasita são importantes na severidade da resposta ao parasita. Neste trabalho analisamos a resposta imune secretora durante a infecção por Giardia em frações protéicas do parasita. Para isso utilizamos amostras de fezes e sangue de 256 crianças das creches de Osasco, atendidas pelo UNOLAB, entre setembro de 2003 e junho de 2004. O exame dessas amostras revelou que 36 (14,06%) eram positivas para cistos de G. lamblia. Os cistos foram purificados e submetidos em cultura por uma semana, com trocas sucessivas do meio até aparecimento dos trofozoítas que somaram 27 amostras positivas. As proteínas foram analisadas por SDS–PAGE em condições não redutoras revelando proteínas entre 116 e 14kDa. A análise dos anticorpos feita pelo método de “immunoblot” e o reconhecimento por IgA, IgG e IgM anti-giardia, foi realizado utilizando-se um pool de 10 soros positivos, e o controle com 5 soros negativos. Palavras-chave: Creches. Giardia. Proteínas. Anticorpos. Abstract G.lamblia is intestinal parasite of cosmopolita distribution, in endemic areas, it possesss high prevalence between children, mainly it enters the minors of 2 years. The transmission can occur person-the-person, but generally it is transmitted through cysts. The illness is generally acute and autolimitante in imunocompetentes, being able to become persistent and fatal in imunocomprometidos, varying since assintomática, until severe diarréia and syndrome of bad absorption. Factors of the host, and parasite is important in the severity of the reply to the parasite. We analyze the secretora immune reply in protein fractions of the parasite during the infection. For this we use excrement samples and blood of 256 children of the day-care centers of Osasco, taken care of for the UNOLAB, between September of 2003 and June of 2004. The examination of these samples disclosed that 36 (14,06%) were positive for cysts of Giardia. The cysts had been purificados and submitted in culture per one week, with successive exchanges of the way until appearance trophozoites them that they had added 27 positive samples. The proteins had been analyzed by SDS-PAGE in not reducing conditions disclosing proteins between 116 and 14kDa. The analysis of the antibodies made by the method of immunoblot to recognition for IgA, IgG and anti-giardia IgM, was carried through using one pool of 10 positive soros, and the control with 5 negative soros. Key-words: Day-care centers. Giardia. Proteins. Antibodies. Revista PIBIC, v. 2, p. 45-54, 2005 45 Sheila Rovagnoli Vieira da Silva 1 Introdução ausentes; em tais situações, exames parasitológicos das G. lamblia é um parasita intestinal comum de distribuição cosmopolita, que parece incidir mais em A OMS estima que ocorra mais de 200 milhões de regiões de clima temperado do que em zonas tropicais, casos anuais de giardíase na África, Ásia e América prolifera nas comunidades do terceiro mundo (MEYER, Latina. No Brasil, um levantamento realizado em 1988 1990 apud FAUBERT, 2000). A G. lamblia é um revelou a prevalência de 28,5% em escolares com faixa protozoário, flagelado, que durante o ciclo evolutivo etária entre 7 e 14 anos. Trata-se também do principal apresenta formas trofozoíta e cisto (REY, 1992). Os trofozoítas vivem no duodeno e nas primeiras porções do jejuno, sendo também encontrados nos condutos biliares e na vesícula (REY, 1992). Os parasitas formam revestimento extenso a ponto deste ser capaz de interferir na absorção de gorduras e vitaminas lipossolúveis, especialmente a vitamina A (REY, 1992). Multiplicamse ativamente por divisão binária longitudinal, o que f az surgir grande número de novos elementos 46 fezes poderão ser falso-negativos. (CIMERMAN, B.; CIMERMAN, S., 2001). Em certo momento, o trofozoíta se retrai, condensa e secreta uma membrana, transformando-se em cisto (CIMERMAN, B.; CIMERMAN, S., 2001). Os cistos são formas infectantes, responsáveis pela disseminação da moléstia (CIMERMAN, B.; CIMERMAN, S., 2001). São muito resistentes, permanecendo viáveis durante dois meses no meio externo. A cloração da água, bem como o seu aquecimento até 60ºC, não são suficientes para sua destruição. Ao serem ingeridos, passam pelo estômago e chegam ao duodeno, onde perdem a membrana cística transformando-se em trofozoítas, que podem ficar livres na luz intestinal ou f i xar- se na parede duodenal (CIMERMAN, B.; CIMERMAN, S., 2001). A eliminação dos cistos pode ocorrer às vezes em períodos de sete a dez dias durante os quais estão presentes em pequena quantidade ou Revista PIBIC, v. 2, p. 45-54, 2005 parasi ta em i ndi víduos de renda média e al ta (CIMERMAN, B.; CIMERMAN, S., 2001). No estado de São Paulo a taxa de prevalência entre escolares era de 20 a 25% (REY, 1992). Em áreas endêmicas, as taxas de prevalência elevadas para a infecção por Giardia foram relatadas principalmente em crianças de 0 a 6 anos (berçário a pré- escola) (FRANCO; CORDEIRO, 1996; CARDOSOet al., 1995; GILMAN et al., 1985; KEYSTONE et al., 1978 apud GUIMARÃES; SOGAYAR, 2002; GUIMARÃES; SOGAYAR, 1995). A incidência é maior entre grupos populacionais que apresentam condições higiênicas precárias e vivem em instituições fechadas como creches, asilos, orfanatos etc. (REY, 1992). O homem é o pri nci pal reservatóri o, mas possivelmente existem outros animais que possam ser fontesde infecção. Os surtoslocalizadosparecem resultar da contaminação das águas de abastecimento (REY, 1992). Os sintomas mais freqüentes são evacuações líquidas ou pastosas (em 93% a 96% dos pacientes), número aumentado de evacuações, mal-estar, cólicas abdominais, fraqueza e perda de peso; os menos freqüentes são diminuição do apetite, náuseas, vômitos, flatulência, distensão abdominal, ligeira febre, cefaléia, nervosismo e má absorção (REY, 1992). Asfezespastosas ou liquefeitas são malcheirosas, geralmente claras ou acinzentadas. Freqüentemente contêm muco, mas raras vezes sangue ou pus. Nos casos mais graves pode haver Análise do perfil protéico em giardia lamblia e pesquisa de anticorpos anti-giardia na população pediátrica das creches municipais de Osasco-SP esteatorréia. A doença dura em média seis semanas antigênica e o papel dos antígenos, na resposta imune podendo variar de 1 a 30 semanas (REY, 1992). durante a infecção, são importantes para compreender Além das formas agudas, o processo pode evoluir para formas subagudas ou crônicas. Nestes casos, além de diarréia intermitente, durando poucos dias de cada vez, as queixas são de anorexia, náuseas, distensão e desconforto abdominal, flatulência, lassidão e perda de a patogenicidade da giardíase. Além disso, a cultura dos trofozoítas, sob circunstâncias impróprias, torna o parasita mais vulnerável ao ataque imunológico, tornando problemática a interpretação de estudos dos mecanismos efetores na resposta imune aos trofozoítas. peso (REY, 1992). Em algunscasos pode haver distensão A identificação dos antígenos reconhecidos pelo e desconforto epigástrico, sem alterações do trânsito sistema imune do hospedeiro é fundamental para intestinal (REY, 1992). Os sintomas da giardíase crônica compreender a modulação da infecção. Consideram-se podem alongar-se por muitos meses ou anos, variando os antígenos variantes de superfície da membrana ou entre manifestações benignas a graves, tal como ocorre da membrana plasmática importantes, pois interagem na forma subaguda. Em pacientes com deficiência com o sistema imune. Portanto o conhecimento da imunológica, pode-se encontrar diarréia persistente, má composição antigênica do parasita e o papel que esses absorção e perda de peso acentuada (REY, 1992). Em antígenos desempenham na resposta imune são crianças, a sintomatologia é semelhante, constituindo importantes para a compreensão da patogênese da por vezes uma síndrome com diarréia crônica, dor doença. Euma vez que osindivíduosinfectados possuem abdominal e abdome distendido, anorexia, perda de peso anticorpos antiparasita, a identificação de antígenos e crescimento retardado (REY, 1992). reconhecidos pelo sistema imune do hospedeiro auxilia A primeira evidência da participação do sistema imune na eliminação de Giardia, durante a infecção, foi relatada por Roberts-Thomson et al. (1976). Os autores mostraram que ratos sem timo desenvolvem infecção prolongada (BELOSEVIC et al., 1984). A resistência individual dos hospedeiros à infecção varia, podendo ser controlada por inúmeros genes. Estudo na compreensão da modulação da infecção por Giardia. E sem contar a melhoria das ferramentas do diagnóstico. Mostra-setambém como prioritário o estudo devacinas. O objetivo dessetrabalho éanalisar arespostaimunesecretora durante a infecção por G. lamblia em frações protéicas do parasita. 2 Metodologia referente ao comportamento humano sugere que, mesmo em uma pequena comunidade, existe uma grande Os cistos de Giardia foram pesquisados pelos variabilidade no risco de infecção entre pessoas, métodos de Ritchie ou Formol-Éter (RITCHIE, 1976) e resultado dasdiferençasna exposição ao parasita invasor Hoffmann Pons & Janer ou Lutz (HOFFMAN, 1934). (ROITT et al., 1999). Ostrofozoítasnão invadem o epitélio Amostraspositivasforam submetidasao método de Faust ou as camadas mais profundas da mucosa, fazendo com para isolar os cistos dos resíduos fecais, e posterior que esta permaneça estimulada pelos antígenos durante inoculação em meio de cultura. Trofozoítasforam obtidos a vida do parasita. O conhecimento da composição por cultura dos cistos, purificados, em Meio TYI-S-33, Revista PIBIC, v. 2, p. 45-54, 2005 47 Sheila Rovagnoli Vieira da Silva (KEISTER, 1983). Oscistospurificadosforam transferidos de papel celofane à temperatura ambiente, sobre placa para tubo estéril com tampa de rosca, contendo o meio de vidro. Após identificação do perfil protéico, foram suplementado em volume suficiente para completar 90- selecionadas amostras com mesmo perfil antigênico e 95% da capacidade do tubo. As culturasforam mantidas utilizadas para reação de “immunoblot”, em suporte a 37ºC na posição horizontal com ângulo de 5º. O sólido. A transferência foi realizada por 1h à voltagem material foi examinado diariamente por uma semana, e constante de 40 V (200 mA), para membrana de o meio de cultura, suplementado com antibióticos e nitrocelulose, segundo Towbin et al. (1979), e a eficiência antifúngicos trocado, para eliminação de fungos e verificada corando-se a membrana com solução bactérias contaminantes. Ponceau-S 0,1% em 10% de ácido acético. Os pesos As culturas que apresentaram trofozoítas aderidos à parede foram utilizadas para extração protéica. Os trofozoítas foram lavados em PBS e ressuspensos em 48 moleculares foram marcados com tinta e a membrana lavada com água bidestilada para retirar o excesso do corante. sol ução tampão de Laemml i (1970). Após A detecção imunoenzimáti ca das proteínas homogeneização a suspensão foi mantida a -20ºC até o recombinantes foi realizada sobre tiras de 1 cm da momento de uso. A dosagem protéica foi realizada membrana. Astirasforam bloqueadaspor 1 h em solução utilizando-se curva de controle com BSA em reagente PBS-leite 5% e, então, incubadas durante a noite toda a Comassie plus (BioRad), diluído 1:5, e a leitura realizada 4ºC com o anticorpo policlonal (pool constituído por 1 em espectrofotômetro de luz em 620nm. Antes de ser gota de 25ml do soro de 10 pacientes, com resultado aplicado ao gel o extrato foi levado à fervura por 5min positivo para Giardia) diluído em PBS-leite 5%. Após a e resfriando imediatamente no gelo. Aplicou-se ao gel incubação, astirasforam lavadaspara retirada do excesso 5 mðg de proteínas para verificação do perfil protéico. de anticorpo e incubadas por mais 1 h com anti-IgG, O material foi separado por eletroforese em gel de anti-IgA ou anti-IgM conjugados à peroxidase, na poliacrilamida 10% com SDS (SDS-PAGE). Omarcador concentração de 1:100. Depois de retirado todo o padrão de peso molecular de proteínas utilizado foi o excesso de conjugado com novas lavagens em PBS-leite SIGMA (MW-SDS 6H). A corrida foi realizada a 100 V 5%, as tiras foram reveladas por incubação em 30ml de por 45 minutos, com tampão de corrida para SDS-PAGE PBS/DAB 0,5mg na presença de H2O2, lavadas em água e abortada quando a migração do azul de bromofenol bidestilada, secasà temperatura ambientee analisadas. atingia a parte inferior do gel de resolução. Após eletroforese o gel foi corado com “Comassieblue” 2%, por 2 horas com agitação, à temperatura ambiente e descorado com solução descorante, durante 30 minutos, e com troca da solução váriasvezes. Quando 3 Resultados Exame protoparasitológico das amostras de fezes da população pediátrica das creches de Osasco-SP: foi analisado material fecal de 246 crianças matriculadas nas creches Alzira Silva Medeiros, localizada na Av. era possível identificar as bandas protéicas, o gel era Bandeirantes, nº 08 – Jardim Aliança e na creche Silvia embebido em solução com glicerol e seco entre folhas Farah, localizada na Rua Palestina, nº 40 – Jardim Revista PIBIC, v. 2, p. 45-54, 2005 Análise do perfil protéico em giardia lamblia e pesquisa de anticorpos anti-giardia na população pediátrica das creches municipais de Osasco-SP Munhoz, ambas pertencentes ao município de Osasco- lumbricoides, T. trichiura, E. histolytica, C. parvum, H. SP. nana e C. cayetanensis sendo E. coli o comensal Oexame microscroscópico de 256 amostras revelou intestinal mais freqüente (dados não mostrados). que 63 (24,60%) eram positivas para parasitas Solicitamossegunda amostra do material fecal para todas patogênicos ou não, sendo que 36 (14,06%) eram as crianças que apresentaram resultado negativo no positivas para G. lamblia e foram encontrados apenas primeiro exame. Todososresultadosforam encaminhados cistosnessasamostras(Tab.1). Além de Giardia, osoutros à Secretaria deSaúde deOsasco. Ascriançascom resultado parasi tas pat ogêni cos encont rados f oram A . positivo foram submetidasa tratamento antiparasitário. Tabela 1 - Prevalência de parasitas encontrados nas amostras de fezes da população pediátrica de duas creches do município de Osasco-SP, agosto de 2003 a maio de 2004. Cultura axênica de G. lamblia para obtenção de para membrana e realização de “immunobloting”. Os trofozoítas: das 36 amostras de cistos de Giardia resultados do fracionamento dos extratos antígenos de inoculadas apenas 27 resultaram positi vas para G. lamblia estão ilustrados na figura 1. trofozoítas, e foram separadas para preparo do extrato protéico. SDS-PAGE realizado sob condições não redutoras. A maioria dos extratos apresentou proteínas Análise de “immunoblot”: Anticorpos IgA, IgG e IgM de pacientescom resultado negativo não reconheceu entre 116 e 14 kDa. Após análise verificamos que várias nenhuma molécula antigênica do parasita (fig. 2, painel amostras demonstravam o mesmo perfil (amostras 1, 2, A). Bandas de aproximadamente 30 kDa, com igual 4, 5, 7 e 10). Fizemos um pool dessas amostras e intensidade, foram reconhecidas pelos anticorpos do aplicamos em outro gel a fim de fazer transferência tipo IgA e IgG (fig. 2, painel B). Figura 1 – Gel de acrilamida a 10% (SDS-PAGE) mostrando o fracionamento protéico de diferentes extratos antigênicos de trofozoítas de Giardia lamblia. Linhas 1 a 27: fracionamento de diferentes amostras de extrato protéico; PM: Marcador de peso molecular. Revista PIBIC, v. 2, p. 45-54, 2005 49 Sheila Rovagnoli Vieira da Silva Figura 2 – Teste de Immunoblotting em soros positivos e negativos para giardíase. Painel A: pool de soros negativos; Painel B: pool de soros positivos; Verificou-se que os anticorpos presentes nos soros de pacientes com giardíase, reagiram em uma banda de aproximadamente 30kDa com anti-IgA e anti-IgG humanos. fonte de anticorpos anti-giárdia do tipo IgA, IgG e IgM. 4 Discussão Muitos trabalhos têm mostrado porcentagens significantes da infecção por Giardia entre crianças de 50 creches (GUIMARÃES; SOGAYAR, 1995, apud GUIMARÃES; SOGAYAR, 2002; GOLDIN et al., 1990, KEYSTONE et al ., 1978, apud FAUBERT, 2000; PICKERING et al., 1984). No Brasil, Torres et al. (1991) demonstraram que 32,8% das crianças entre 0 e 6 anos, freqüentadoras de creches municipais em São Paulo, eram portadoras de G. lamblia. As amostras foram anal i sadas pel o método de “immunoblot”, que de acordo com Rosales-Borjas et al. (1998) é altamente sensível, e permite verificar a importância dos epítopos antigênicos deste protozoário na indução da resposta humoral durante a infecção. No entanto é difícil avaliar a sensibilidade, já que este método foi usado somente por alguns laboratórios e executado em um número limitado de indivíduos com casos provados de giardíase. Em nosso caso, o padrão da reatividade encontrada foi diferente daquele Em nosso estudo 14,06% do total de crianças demonstrado por Soliman et al. (1998), que encontrou analisadas apresentaram resultado positivo para este o reconhecimento de várias moléculas distintas do parasita. Acreditamos que a variação no número parasita com tamanhos entre 113 e 18 kDa. encontrado se deva às vari ações nos métodos empregados, ao número de amostras analisadas e às Considerando a variedade dos antígenos que condições socioeconômicas a que as crianças estão estimulam o sistema imune de um paciente infectado, é expostas. Os dados aqui apresentados representam a surpreendente que o ensaio tenha sido incapaz de primeira tentativa de se caracterizar o perfil protéico e detectar anticorpos em todas as amostras com casos de anticorpos, induzidos pelas cepas de G. lamblia em provados de giardíase. Entretanto, a sensibilidade dos crianças com infecção natural, residentes no município ensaios pode aumentar, caso as proteínas purificadas de de Osasco. O soro dessas crianças foi utilizado como Giardia sejam usadas como antígenos, ao invés de usar Revista PIBIC, v. 2, p. 45-54, 2005 Análise do perfil protéico em giardia lamblia e pesquisa de anticorpos anti-giardia na população pediátrica das creches municipais de Osasco-SP o extrato total como foi o nosso caso. Outros autores do leite da população mexicana mas em somente 15% identificaram diversos antígenos fortemente reativos de amostras do leite da população do Texas (MIOTTI et cuj as massas moleculares variam imensamente al., 1985 apud FAUBERT, 2000). Estes resultados (FAUBERT, 2000). Exames realizados em amostras de destacam a diferença na resposta imune a Giardia entre saliva de pacientes com giardíase mostraram 24 faixas pacientes infectados nas áreas de infecção endêmica e do antígeno, com a massa molecular variando entre 14 outras áreas. e 170 kDa (ROSALES-BORJAS et al., 1998). O nível de anticorpos circulantes anti-giardia tipo IgG, IgM, e IgA foi comparado entre as pessoas infectadas em Denver, Coloroado e em Soongnern, Tailândia (JANOFF et al., 1990 apud FAUBERT, 2000). Os níveis de anticorpos detectados por ELISA aumentaram significativamente durante a infância em ambas as áreas geográficas. Os níveisanticorposanti-giardia do tipo IgA permaneceram elevados durante toda a vida entre adultos da Tailândia, mas diminuídos entre adultos em Denver. Por outro lado, em adolescentes, anticorpos anti-giardia do tipo O resultado da infecção e da resposta humoral por anticorpos nos seres humanos pode também variar dependendo da cepa. Para ilustrar citamos a inoculação entérica em voluntários saudávei s, com 50.000 trofozoítas de duascepasdistintas com padrõesdistintos de endonuclease, tamanho do DNA, antígenos de superfície, e produtos de excreção, o que levou a uma variedade dosresultados(NASH et al., 1987). A primeira cepa (Isr) não produziu infecção em voluntários saudáveis, enquanto os pacientes inoculados com a segunda cepa (GS/M) desenvolveram uma variedade de IgM caíram com o avanço da idade em ambas as sintomas. Os níveis de IgM, de IgG, e de IgA no sangue populações. Baseado nestes encontros, os autores e osníveisde IgA no líquido intestinal foram encontrados concluíram que osníveis de IgM anti-giardia em adultos em 100, 70, 60, e 50%, respectivamente, nos indivíduos podem ser úteis caso se deseje diferenciar entre infecção infectados com a cepa GS/M (NASH et al., 1987). recente e passada (JANOFF et al, 1990 apud FAUBERT, Nenhum anticorpo foi detectado em indi víduos 2000). saudáveis, infectados com a cepa Isr. Determinando os níveis de anticorpos sistêmicos e Este estudo mostra não somente variações na locais de giardia em populações diferentes, respostas patogenicidade provocada por diferentes cepas de imunes diferentes em pacientes infectados foram Giardia nos seres humanos, mas ilustra também as reconhecidas extensamente (MIOTTI et al., 1985 apud variações na resposta imune ao estimulo. Com respeito FAUBERT, 2000). Diversasamostras de sangue e de leite à infecção experimental em indivíduos saudáveis Nash foram coletadassimultaneamente em mulhereslactantes et al., 1987, demonstram a pouca sensibilidade das no Texas e México. Anticorpos específicos IgG anti- amostras sorológicas disponíveis para o diagnóstico da giardia foram detectados em 77% de 153 amostras do giardíase. Há diversas razões para explicar a pouca sangue nas mães mexicanas, mas somente 24% de 214 sensibilidade das amostras sorológicas. (i) Os isolados amostras do sangue das mães do Texas. Os anticorpos geográficos identificados podem ter sua própria secretores de IgA foram detectados em 79% de amostras identidade antigênica (ISSAAC-RENTON et al., 1994 apud Revista PIBIC, v. 2, p. 45-54, 2005 51 Sheila Rovagnoli Vieira da Silva FAUBERT, 2000). (ii) A infecção pode tornar-se crônica e o parasita interferir com o sistema imune, conduzindo a imunodepressão, e esta pode afetar o nível dos anticorpos produzidos. (iii) A variação antigênica pode Nesse trabalho nós analisamos a resposta imune durante a infecção por G. lamblia em frações protéicas do parasita. Para tanto utilizamos amostras de fezes e interferir na produção dos anticorpos. (iv) Muitos casos sangue da população pediátrica das creches de Osasco. humanos de giardíase nunca alcançam o estágio agudo Foram obtidas 27 amostras de trofozoítas de G. lamblia, da infecção, e o tipo de resposta imune estimulada nestes pelo cultivo dos cistos encontrados nas fezes. Esses pacientes são desconhecidos. trofozoítas foram processados para obtenção do extrato À exceção dos níveis diferentes dos anticorpos detectados, os ensaios sorodiagnósticos não mostraram 52 5 Conclusão de proteínas. O perfil protéico do protozoário intestinal G. lamblia foi caracterizado SDS-PAGE em condições não redutoras. A discriminação dasproteínas do parasita diferenças em respostas do anticorpo do soro entre reconhecidas pelo sistema imune foi realizada pela pacientes sintomáticos e assintomáticos. Desde que os reação de “immunoblot” com anticorpos efetores (IgA), trofozoítas de Giardia invadem raramente os tecidos, a anticorpos da fase aguda (IgM) e anticorpos de memória resposta i mune sistêmica praticamente nunca é (IgG). Os resultados mostraram que o uso dessa técnica estimulada, e a procura por anticorpos de Giardia no com anticorpos circulantes (oriundos de sangue, obtido sangue é difícil. Demonstrou-se que IgA secretora tem por punção digital) não é eficaz para a realização de um papel importante na imunidade à infecção, podendo afetar a eliminação do parasita do intestino. Por outro lado, testes sorológicos na triagem parasitológica, específica para giardíase. JoneseBrowm (1974) não encontraram nenhumadiferença As amostras de cistos de G. lamblia inoculadas em em níveissecretoresou sangue-específico de anticorpos meio TYI-S-33 apresentou resultadospouco satisfatórios, de IgA entre pacientes hipogamaglobulinêmicos com uma vez que as culturas não produziam trofozoítas em giardíase em um grupo de controle. Pacientes com AIDS com contagem baixa de célula T CD4+ não têm os episódios diarréicos persistentes ou severos (JANOFF et al., 1988 apud FAUBERT, 2000). Estes resultados surpreendem, uma vez que o modelo da doença no rato, abundância, como descritosna literatura analisada. Desta forma, acreditamos ser necessário fazermos adaptações para nossa realidade, as quais já estão sendo estudadas e i mpl antadas no l aborat óri o. Bandas de aproximadamente 30 kDa, com igual intensidade, foram reconhecidas pelos anticorpos do tipo IgA e IgG. O as células de T CD4+ e outros subconjuntos de células- padrão da reatividade encontrada foi diferente daquele T têm um papel na eliminação do parasita do intestino demonstrado por Soliman et al., (1998) que encontrou o (VINAYAK et al., 1991; ROBERTS-THONSON; MITCHELL, reconhecimento de várias moléculas distintas do parasita 1978; STEVENS et al., 1978 apud FAUBERT, 2000). com tamanhosentre 113 e 18 kDa. Revista PIBIC, v. 2, p. 45-54, 2005 Análise do perfil protéico em giardia lamblia e pesquisa de anticorpos anti-giardia na população pediátrica das creches municipais de Osasco-SP Referências BELOSEVIC, M. et al. Susceptibility and resistance of inbred mice to Giardia muris. Infect. Immun., v. 44, n. 2, p. 282-286, may. 1984. CARDOSO G. S. et al. Prevalência e aspectos epidemiológicos da giardíase em creches no Município deAracaju, Se, Brasil. Rev. Inst. Méd. Trop., 28:25-31, 1995. CIMERMAN, B.; CIMERMAN, S. Parasitologia humana e seus fundamentos. 2. ed. São Paulo: Atheneu, 2001. FAUBERT, G. Immune response to Giardia duodenalis. Clinical Microbiology Reviews, v. 13, n. 1, p. 35-54, jan. 2000. FRANCO R. M. B.; CORDEIRO, N. S. Giardíase e criptosporidiose em creches do município de Campinas, SP. Rev. Soc. Bras. Med. Trop., 29:585-91, 1996. GILMAN, R. H. et al. Epidemiology and serology of Giardia lamblia in a developing country: Bangladesh. Trans. R. Soc. Trop. Med. Hyg., v. 79, n. 4, p. 469-473, 1985. GOLDIN, A. J. et al. Efficient diagnosis of giardiasis among nursery and primary school children in Santiago, Chile by capture ELISA for the detection of fecal Giardia antigens. Am J Trop Med Hyg. v. 42, n. 6, p. 538-545, jun. 1990. GUIMARAES, S.; SOGAYAR, M. I. L. Detection of anti-Giardia lamblia serum antibody among children of day care 53 centers. Rev. Saúde Pública, v. 36, n. 1, p. 63-68, 2002. ____________. Occurrence of Giardia lamblia in children of municipal day-care centers from Botucatu, São Paulo State, Brazil. Rev. Inst. Med. Trop., São Paulo, v. 37, n. 6, p. 501-506, nov./dec. 1995. HOFFMAN, W. A. et al. The sedimentation-concentration method in schistosomiasis mansoni. Puerto Rico: J. Publ. Health., 9:281-298, 1934. ISAAC-RENTON, J. L. et al. A second community outbreak of waterborne giardiasis in Canada and serological investigation of patients. Trans. R. Soc. Trop. Med. Hyg., v. 88, n. 4, p. 395-399, jul./aug. 1994. JANOFF, E. N. et al. Acute antibody responses to Giardia lamblia are depressed in patients with AIDS. J. Infect. Dis., v. 157, n. 4, p. 798-804, apr. 1988. JANOFF, E. N. et al. Serum antibodies to Giardia lamblia by age in populations in Colorado and Thailand. West. J.Med. , v. 152, n. 3, p. 253-256, mar. 1990. JONES, E. G.; BROWN, W. R. Serum and intestinal fluid immunoglobulins in patients with giardiasis. Am. J. Dig. Dis., v. 19, n. 9, p. 791-796, sep. 1974. KEISTER, D. B. Axenic culture of Giardia lamblia in TYI-S-33 medium supplemented with bile. Trans. R. Soc. Trop. Med. Hyg., v. 77, n. 4, p. 487-488, 1983. Revista PIBIC, v. 2, p. 45-54, 2005 Sheila Rovagnoli Vieira da Silva KEYSTONE J. S. et al. Person-to-person transmission of Giardia lamblia in day-care nurseries. Can. Med. Assoc. J., v. 119, n. 3, p. 241-248, aug. 1978. LAEMMLI, U. K. Cleavage of structural proteins during the assembly of the head of the bacteriophage T4. Nature, v. 227, n. 259, p. 680-685, aug. 1970. MEYER, E. A. Introduction, p. 1-9. In: MEYER, E. A. (ed.), Giardiasis1990. Elsevier Publishing Co., New York, N.Y., 1990. MIOTTI, P. G. et al. Prevalence of serum and milk antibodies to Giardia lamblia in different populations of lactating women. J. Infect. Dis., v. 152, n. 5, p. 1025-1031, nov. 1985. NASH, T. E. et al. Experimental human infectionswith Giardia lamblia. J. Infect. Dis., v. 156, n. 6, p. 974-984, dec. 1987. PICKERING, L. K. et al. Occurrence of Giardia lamblia in children in day care centers. J Pediatr. v. 104, n. 4, p. 522526, apr. 1984. REY, L. Bases da parasitologia médica. Rio de Janeiro: Koogan, 1992, p. 66-71. RITCHIE, L. S. et al. A modification of the formol-ether concentration technique for increased sensitivity in detecting Schistosoma mansoni eggs. Am. J. Trop. Med. Hyg., v. 25, n. 6, p. 818-823, nov. 1976. ROBERTS-THONSON, I. C. et al. Giardiasisin themouse: an animal model. Gastroenterology, v. 71, n. 1, p. 57-61, jul. 1976. 54 ROBERTS-THONSON, I. C.; MITCHELL, G. M. Giardiasis in mice. I. Prolonged infections in certain mouse strains and hypothymic (nude) mice. Gastroenterology, v. 75, n. 1, p. 42-46, jul. 1978. ROITT, I.; BROSTOFF, J.; MALE, D. Imunologia. 5. ed. Manole, 1999. ROSALES-BORIAS, D. M. et al. Secretory immune response to membrane antigens during Giardia lamblia infection in humans. Infect. Immun., v. 66, n. 2, p. 756-759, feb. 1998. SOLIMAN, M. M. et al. Comparison of serum antibody response to G. lamblia of symptomatic and asymptomatic patients. Am. J. Trop. Med. Hyg., v. 58, n. 2, p. 232-239, feb. 1998. STEVENS, D. P. et al. Thymus dependency of host resistance to Giardia muris infection: studies in nude mice. J. Immunol., v. 120, n. 2, p. 680-682, feb. 1978. TORRES, D. M. A. G. V. et al. Giardiasis in nurseries supported by the Sao Paulo Municipal Prefecture, 1982/1983. Rev. Inst. Med. Trop. Sao Paulo, v. 33, n. 2, p. 137-142, mar./apr. 1991. TOWBIN, N. et al. Electrophoretic transfer of proteins from polyacrilamide gels to nitrocellulose sheets procedure and some applications. Proc. Natl. Acad. Sci., USA, 776: 4350-4354, 1979. VINAYAK, V. K. et al. Kinetics of intraepithelium and lamina propria lymphocyte responses during Giardia lamblia infection in mice. Microb. Pathog., v. 10, n. 5, p. 343-350, may. 1991. Revista PIBIC, v. 2, p. 45-54, 2005
Download