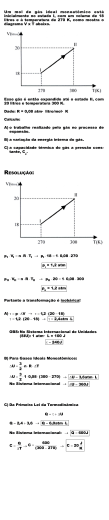
ESCOLA SECUNDÁRIA LEAL DA CÂMARA FICHA DE TRABALHO QUÍMICA Unidade 2: Gases Ideais 12.º ANO 1. Uma mistura gasosa que contém 6,400 g de oxigénio e 4,402 g de dióxido de carbono encontrase à pressão de 1,20 atm. Calcula as pressões parciais de cada um dos componentes da mistura. (R: 0,800 e 0,400 atm) 2. Considera 462 cm3 de um gás ideal, à pressão de 200 mm Hg e temperatura de 35ºC. Reduz o volume às condições normais de pressão e temperatura. (R: 108 cm3 ) 3. Qual será o volume ocupado por 10,0 g de dióxido de carbono, nas condições p.t.n.? (R: 5,09 dm3 ) 4. Um balão de volume desconhecido contém um gás à pressão de 0,970 atm. Abriu-se uma torneira de comunicação deste balão com outro de 500 cm3 , para o qual o gás deste balão se expandiu. A temperatura manteve-se e a pressão do gás passou a ser 530 mm Hg. Qual era o volume do primeiro balão? (R: 1,28 dm3 = 1,28 x 10 3 cm3 ) 5. Calcule a massa volúmica de um gás, a PTN, sabendo que à temperatura de 30,0 ºC e à pressão de 780 mm Hg, ela vale 1,253 g/dm3 . (R: 1,36 g/dm3 ) 6. Calcular a densidade (em g/dm3 ) do hélio, nas condições p.t.n.. (R: 0,18 g/dm3 ) 7. 5,00 gramas de etano estão contidos numa ampola de 1,00 L de capacidade. Sabendo que a ampola não pode suportar pressões superiores a dez vezes a pressão normal, determine a temperatura (em grau Celsius) a partir da qual a pressão do gás fará rebentar a ampola. (R: 460ºC) 8. Uma certa massa de um gás ocupa o volume de 1,0 L, nas condições normais de pressão e temperatura (PTN). Que volume ocupará: 8.1. a 2 atm, admitindo compressão isotérmica? (R: 0,50 L) 8.2. a 2 atm e 300 K ? (R: 0,55 L) 9. Dois balões iguais contêm oxigénio, à mesma temperatura. Se a pressão de um deles for o triplo da pressão do outro, qual a razão entre as massas de oxigénio nos dois balões? (R: m2 = 3m1 ) 10. Uma amostra de um composto gasoso de boro e hidrogénio, com a massa de 1,00 g , ocupa 0,820 dm3 , a 3ºC e a 1,00 atm. De qual dos compostos se trata? (R: c) a. BH3 b. B2 H10 c.·B2 H6 d. B3 H12 1 e. B5 H14 11. Uma mistura de 60,0 g de oxigénio e 60,0 g de hélio encontra-se à pressão de 800 mm Hg. Calcule a pressão de cada gás na mistura. Expresse os valores em atm. (R: 0,117 atm, 0,935 atm) 12. A fig. 1 representa as transformações A→ B→ C, em gráfico PV = constante, para T 1 e T 2 = 2T1 . – Escolha entre os diagramas da fig. 2 os que são equivalentes aos da fig. 1. 13. O gráfico seguinte representa a variação da pressão de uma certa massa de gás com a temperatura, ocupando dois volumes diferentes, V1 e V2 . 13.1. Qual a lei representada? Enuncie-a. 13.2. Compare os valores V1 e V2 . Justifique. 14. Uma mistura gasosa contida num recipiente à pressão de 0,500 atm é constituída por 15,0 % de N2 , 50,0 % de N2 0 e 35,0 % de CO2 , em volume. Calcule a pressão parcial de cada gás. (R: 0,0750 atm, 0,250 atm, 0,175 atm) 15. Um balão de 200 cm3 contém oxigénio a 0,263 atm e, à mesma temperatura, um balão de 300cm3 contém azoto a 100 mm Hg. Os gases contidos nos balões foram misturados de tal modo que cada um deles veio a ocupar a soma dos dois volumes. Admitindo que não houve alteração de temperatura, calcule (em mm Hg): 15.1. as pressões parciais exercidas pelo oxigénio e pelo azoto (R: 80,0 mm Hg e 60,0 mm Hg) 15.2. a pressão total da mistura. (R: 140 mm Hg) 16. O pneu de um automóvel com a capacidade de 25 L está à pressão de 1,82 bar. Que volume de ar sai do pneu quando se abre a válvula? (Considere que a temperatura permanece constante) (R: 20 L) 2 17. Seleccione as afirmações verdadeiras e as falsas do seguinte conjunto: A. Gás ideal é aquele cujos volumes moleculares são desprezáveis e no qual as forças intermoleculares são nulas. B. O comportamento de um gás aproxima-se do de um gás ideal, quando sujeito a pressões elevadas e a temperaturas próximas do ponto de liquefacção. C. O número de átomos presentes em 1,0 dm3 de H2 é igual ao número de átomos presentes em 1,0 dm3 de He, desde que os dois gases se encontrem nas mesmas condições de pressão e temperatura. D. Se tivermos massas iguais de hidrogénio e cloreto de hidrogénio, à mesma temperatura e em recipientes com a mesma capacidade, é maior a pressão no recipiente que contém hidrogénio. E. Nas mesmas condições de pressão e temperatura, 0,7 g de CH 4 e 0,7 g de N2 ocupam volumes iguais. F. Numa mistura equimolar de três gases, são iguais as respectivas pressões parciais. G. Numa mistura de gases, qualquer deles contribui para a pressão total, na proporção das respectivas percentagens em massa na mistura. H. Uma mole de qualquer substância, nas condições normais de pressão e temperatura, ocupa o volume de 22,4 dm3 . I. Numa mistura gasosa a pressão parcial de cada constituinte depende apenas do número de moléculas desse constituinte presente na mistura. J. Sendo as moléculas de H2 mais leves que as de He, em 1 cm3 de hidrogénio existem mais moléculas do que em 1 cm3 de hélio, a PTN. 3
Download