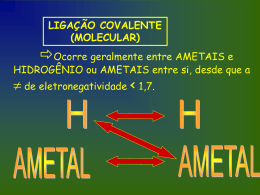
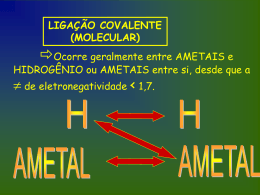
Ligações Químicas LIGAÇÃO IÔNICA Ocorre geralmente entre METAIS e AMETAIS com de eletronegatividade > 1,7. Não Esqueça!!! Eletropositivos Metais: Perdem elétrons Viram Cátions(+) Ametais: Al Al Eletronegativos Ganham elétrons Viram Ânions(-) S + 2e- +3 S + 3e- -2 LIGAÇÃO COVALENTE (MOLECULAR) Ocorre geralmente entre AMETAIS e HIDROGÊNIO ou AMETAIS entre si, desde que a de eletronegatividade < 1,7. Ligações covalentes normais Fórmula de Lewis H H 1 sigma O O 1 sigma + 1 pi Fórmula estrutural HH H2 OO O2 Lig. Covalente Simples Lig. Covalente Dupla NN N N Lig. Covalente Tripla 1 sigma + 2 pi N2 1) Ligação Covalente Apolar: Ocorre entre átomos iguais. Dessa forma, os átomos possuem mesma eletronegatividade e atraem, conseqüentemente, o par eletrônico compartilhado com a mesma intensidade. Ex.: H2, O2, N2 H H O par eletrônico é eqüidistante aos dois núcleos 2) Ligação Covalente Polar: Ocorre entre átomos diferentes. Dessa forma, o átomo que possui maior eletronegatividade atrai o par eletrônico compartilhado com maior intensidade. Ex.: HCl. O par eletrônico fica mais próximo do cloro pois este átomo atrai mais fortemente os elétrons da ligação covalente (porque é mais eletronegativo). + H - Cl Ligação Coordenada (DATIVA) Só acontece quando um elemento (que não pode ser metal) já fez todas as ligações comuns possíveis (valência). Esse elemento “empresta” um par de elétrons para o outro elemento que ainda precisa receber elétrons. Exemplo: Não podem mais fazer ligação comum. O SO2 S Ligação dativa Ainda não está completo O S O O Metálicas (+) Metal x (+) Metal • Altos PF e PE • Bons condutores de corrente elétrica no estado sólido • 25º Estado sólido exceto: Hg Ex: Zn(S), AP(S) ... FUNÇÕES INORGÂNICAS Ácidos de Arrhenius: são substâncias compostas que em solução Aquosa liberam como único e exclusivo cátion o Hidroxônio (H3O+ ou H+). Ionização de um Ácido HCl + H2O H3O+ + ClH2SO4 + 2H2O 2H3O+ + SO42H3PO4 + 3H2O 3H3O+ + PO43De acordo com Arrhenius, base ou hidróxido é toda substância que, dissolvida em água, dissocia-se fornecendo como ânion exclusivamente OH- (hidroxila ou oxidrila). NaOH Na+ + OH- Sal é todo composto que em água dissocia liberando um cátion de H+ e um ânion de OH-. A reação de um ácido com uma base recebe o nome de neutralização ou salificação. Salificação HCl + NaOH NaCl + H2O Neutralização Óxido é todo composto binário oxigenado, no qual o oxigênio é o elemento mais eletronegativo. Fórmula geral dos óxidos: Exemplos: x+ E 2 2O X CO2, H2O, Mn2O7, Fe2O3 POLARIDADE Átomos iguais APOLAR MOLÉCULAS DIATÔMICAS: Átomos diferentes Sobra é: MOLÉCULAS POLIATÔMICAS: Não sobra é: POLAR POLAR SIMETRIA Pilhas (Célula Galvânica) Química do bafômetro (Pilha combustível) fluxo de elétrons Pólo – Ânodo Oxidação Corrosão ↑[ ] ↓ERED Pólo + Cátodo Redução Depósito ↓[ ] ↑ERED Cátado Ânodo -1 CH3CH2OH(g) +1 → CH3CHO(g) + 2 Semi reação H+ + 2e- Anódica + - → H O-2 ½ O0 + 2 H + 2 e 2(g) (aq) 2 (ℓ) CH3CH2OH(g) + ½ O2(g) ddp → CH3CHO(g) + H2O(ℓ) = red - red Semi reação Catódica Reação Global (REDOX) Esquema: é é é cátodo é + Cu K+ é é K+ é CℓCℓ- K+ K+ ânodo -Al Cℓ- Aℓ+3 CℓAℓ+3 Cℓ Aℓ+3 +3Cℓ Aℓ Aℓ+3Cℓ SO4-2 Cℓ- - - - CuK+2 + SO4-2 Redução recebe epolo (+) cátodo acumulação - Oxidação perde epolo (-) ânodo corrosão C Á T O D O R E D U Z A N O D O O X I D A PILHAS Representação da pilha de Daniell Zn / Zn+2 // PONTE SALINA (ânodo: -) Cu+2 / Cu (cátodo: +) fluxo de elétrons oxidação redutor redução oxidante Epilha = Eoxidante - Eredutor (sempre usar o potencial de redução) GEOMETRIA MOLECULAR “Braços” são ligações simples, duplas, triplas ou dativas que estão em volta do elemento central. xx C N C 2 “Braços” 3 “Braços” 4 “Braços” Moléculas Diatômicas - Linear Moléculas Poliatômicas: 2 “Braços” H2O CO2 3 “Braços” NH3 SO3 4 “Braços” CH4 Sobra e-: ANGULAR Ñ sobra e-: LINEAR Sobra e-: PIRAMIDAL Ñ sobra e-: TRIGONAL TETRAÉDRICA X2 Ex.: H2, N2, O2 Moléculas Diatômicas Geometria: Linear Ângulo: 180° H H XY Moléculas Diatômicas Ex.: HBr, HCl, HF Geometria: Linear Ângulo: 180° H Cl XY2 Ex.: CO2, CS2 Geometria: Linear Ângulo: 180° O 2 “Braços” Moléculas Poliatômicas C O XY2 e 2 “Braços” Ex.: SO2 Moléculas Poliatômicas Geometria: Angular Ângulo: 112° S O O XY22e 2 “Braços” Ex.: H2O, H2S Geometria: Angular Moléculas Poliatômicas Ângulo: 105° O H H XY3 Ex.: BF3, BH3 Geometria: Trigonal Plana Ângulo: 120° H 3 “Braços” Moléculas Poliatômicas B H H XY3 e 3 “Braços” Ex.: NH3, PH3 Geometria: Piramidal Moléculas Poliatômicas Ângulo: 107° N H H H XY4 Ex.: CH4,CCl4 H Geometria: Tetraédrica Ângulo: 109°28’ 4 “Braços” Moléculas Poliatômicas C H H H
Download