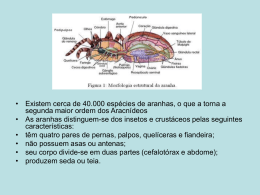
O tamanho das aranhas influencia a precisão na construção de teias orbiculares? Tiago Jordão Porto, Caroline Corrêa Nóbrega, Daniel Caetano da Silva e José Domingos Ribeiro Neto possível que exista uma pressão seletiva Introdução Nas espécies de invertebrados direcionando a manutenção de cérebros ocorre um grande incremento em funcionalmente tamanho durante o desenvolvimento menos sinapses, no estágios imaturos ontogenético, desde a eclosão dos ovos com até a fase adulta (Ruppert et al. 2005). (Spruston & Stuart in press). No As estruturas corporais dos indivíduos entanto, a menor atividade do cérebro nos primeiros ínstares são menores do dos jovens poderia impedir a realização que as estruturas dos indivíduos adultos de alguns atos comportamentais típicos da entanto, de adultos (Durst et al. 1994; Seid et al. diferentemente das demais estruturas 2005), ou reduzir a capacidade de corporais, o cérebro é um órgão que não expressar comportamentos complexos cresce em número de células durante o desempenhados por adultos da mesma desenvolvimento. espécie. mesma espécie. No Sendo assim, o cérebro de um indivíduo jovem é mais reduzido simples, tamanho com corporal Diversos trabalhos têm tentado proporcionalmente maior do que o de relacionar um indivíduo adulto de uma mesma complexidade espécie (Beutel et al. 2005). (Eisenberg 1981, Eisenberg & Wilson O maior tamanho relativo do tamanho objetiva energético considerado maior corpo e comportamental 1978). No entanto, não há definição cérebro dos jovens demanda um gasto proporcionalmente do para o um que deve ser comportamento para manutenção e atividade deste complexo, o que dificulta a escolha de órgão (Niven et al. 2007). O benefício características mensuráveis para avaliar resultante da utilização plena do cérebro a pelos indivíduos jovens pode não tamanho corporal (Vollrath 1992; Healy compensar a energia necessária para a & Rowe 2006). Sendo assim, estudar manutenção deste órgão. Portanto, é essa relação requer a utilização de relação ente comportamento e 1 características comportamentais facilmente mensuráveis e sujeitas às do que aranhas maiores de uma mesma espécie. mesmas limitações impostas por um cérebro funcionalmente menos ativo Métodos (Eberhard 2007). A capacidade de um Realizamos o estudo na Reserva indivíduo de repetir precisamente uma do certa sequência comportamental, por pertencente exemplo, é uma variável adequada para Biológica de Fragmentos Florestais estudar este efeito (Eberhard 2007). (PDBFF), Km 41 ao (2°24’S, 59°43’O), Projeto Dinâmica localizada na Amazônia As teias orbiculares construídas Central. A reserva está situada a 80 km pela maioria das aranhas Orbiculariae ao norte de Manaus e abrange uma área são de aproximadamente 10.000 ha de resultado comportamentais de sequências precisas, sendo, floresta contínua de terra firme. portanto, manifestações da capacidade Utilizamos como modelo de do sistema nervoso e das decisões estudo a aranha Cyclosa sp., encontrada comportamentais próxima as trilhas da reserva. Para (Blackledge 1998). destas Em aranhas todas as encontrar as aranhas, percorremos as espécies do grupo Orbicularie, os trilhas jovens eclodem com um tamanho stabilimenta, uma estrutura construída corporal diminuto, muito menor do que por detritos, seda e restos de presas um indivíduo adulto, e em todos os característica das espécies do gênero estádios constroem teias orbiculares. Cyclosa (Foelix, 1982). Ao encontrar o Assim, a construção de teias orbiculares stabilimentum, polvilhamos amido de é um bom modelo para estudar a milho para facilitar a visualização da influência da funcionalidade do cérebro teia orbicular e fotografamos uma na repetir porção distal da teia que continha o comportamentos de forma precisa, pois maior raio, pelo menos dois raios a teia é o testemunho desta habilidade. adjacentes e 11 espiras. Em seguida, Neste sentido, nosso objetivo foi testar coletamos e fixamos a aranha em álcool se aranhas menores são menos precisas 70% e, posteriormente, as fotografamos. na fixação das espirais viscosas nos Medimos o comprimento do corpo da raios durante a construção de suas teias aranha (abdômen e cefalotórax) com o capacidade de procurando visualmente os 2 software ImageTool® (Wilcox et al. evidente uma distribuição bimodal dos 2002). Para determinarmos as classes de dados de tamanho. Com isto, dividimos tamanho das aranhas a serem utilizadas as aranhas nas classes de tamanho nas pequeno (de 0,5 a 2,5 mm) e grande (de análises, construímos um histograma (Figura 1), em que ficou 2,6 a 5 mm). 7 Pequeno Grande Númerode deindivíduos indivíduos Número 6 5 4 3 2 1 0 0,5 0,75 1,0 1,25 1,5 1,75 2,0 2,25 2,5 2,75 3,0 3,25 3,53,75 4,0 4,25 4,54,75 5,0 Comprimento da aranha (mm) Figura 1. Número de indivíduos de Cyclosa sp. coletados em relação ao comprimento. As barras cinzas representam a classe das aranhas pequenas e as barras brancas representam a classe das aranhas grandes. O comprimento total do corpo representa o comprimento do abdômen somado ao do cefalotórax. A partir da fotografia das teias, Eberhard (2007). Segundo esse índice, escolhemos o maior raio e dois raios quanto adjacentes (esquerda e direita) para construção da teia, maior o índice de medir a distância entre 11 espiras imprecisão. Assim, esperamos que as consecutivas de cada raio com o aranhas pequenas tenham um índice de software ImageTool® (Wilcox et al. imprecisão maior na construção das 2002). Com isto, calculamos o índice de teias do que aranhas grandes. imprecisão (Figura 2) maior a imprecisão na conforme 3 Maior raio an = b= S n − S n +1 medS i med _ ar( i −1) + med _ ar( i ) + med _ ar(i +1) 3 Figura 2. Índice de imprecisão proposto por Eberhard (2007). S é a distância ente espiras consecutivas, medSi é a mediana de S para um dado raio. Com isto, obtivemos 10 valores de a para cada raio. Então, calculamos a mediana (med_a) dos raios. Com a mediana de cada raio, pudemos obter o Índice de imprecisão (b) da teia. apresentaram imprecisão média de 0,24 Resultados As aranhas apresentaram imprecisão pequenas (±0,06). A imprecisão na construção da média teia foi similar nos dois grupos de (±desvio padrão) de 0,25 (±0,08), aranhas enquanto Figura 3). as aranhas grandes (t=0,175; g.l.=27; p=0,46; 0.32 0.30 Índice de imprecisão 0.28 0.26 0.24 0.22 0.20 0.18 Pequeno Grande Classe de tamanho Figura 3: Média do índice de imprecisão para as classes de tamanho pequeno e grande. Os pontos representam as médias do índice de imprecisão e as barras representam o intervalo de 95% de confiança. 4 sobrevivência Discussão O fato de indivíduos pequenos apresentarem imprecisão desde os primeiros estádios, uma vez que pode estar semelhante relacionada à eficiência de captura de aos indivíduos grandes mostra que a presas. Entretanto, a única característica capacidade de repetir o movimento de da teia que teve sua influência na colocação de espiras não é influenciada captura de presas investigada foi a pelo distância entre espiras colocadas nos tamanho resultado, das aranhas. Esse indica que portanto, raios (Blackledge & Zevenbergen indivíduos jovens têm a mesma precisão 2006). Nesse trabalho, os autores na execução de comportamentos que encontraram indivíduos mais velhos. distância entre espiras em uma teia, A menor precisão em aranhas pequenas indicaria uma simplificação do sistema nervoso. A similaridade que quanto menor a maior o tempo que a presa permaneceu retida. Outra possibilidade é que entre os índices, entretanto, não exclui a aranhas jovens não possuam adaptações possibilidade de que a simplificação que minimizem o gasto energético com tenha áreas a manutenção do sistema nervoso. Caso específicas do cérebro, não associadas isso ocorra, é possível que os animais ao comportamento avaliado. Assim, mais jovens vivam em um constante essa redução de sinapses pode não ter estado de limitação nutricional, se afetado comportamentos essenciais à tornando mais vulneráveis em períodos sobrevivência, como a construção de de escassez de presas. Neste sentido, teias. É possível, no entanto, que o futuros trabalhos poderiam avaliar se aumento animais ocorrido de apenas tamanho em durante o menores gastam desenvolvimento permita o aumento do proporcionalmente mais energia na repertório comportamental e aumento manutenção do sistema nervoso que da precisão em comportamentos mais animais importantes para etapas posteriores do proporcionalmente, conseguem capturar ciclo de vida. mais presas que os maiores. A precisão na colocação das grandes, Estudos que ou avaliaram se, a espiras, possivelmente, representa um influência do tamanho corporal sobre o comportamento comportamento não mostraram nenhum essencial à 5 padrão evidente 1981, Blackledge, T.A. 1998. Stabilimentum 1978). variation and foraging success in Provavelmente, o principal fator que Argiope aurantia and Argiope implicou trifasciata (Araneae: Araneidae). Eisenger (Eisenger & na Wilson inconsistência dos resultados destes trabalhos é o conceito Journal of Zoology, 246:21-27. de complexidade comportamental, que Blackledge, T.A. & J.M. Zevenbergen. não pode ser facilmente definido ou 2006. Mesh width influences mensurado (Eberhard 2007). Afirmar prey retention in spider orb que uma dada seqüência de movimentos webs. Ethology, 112:1194-1201 é mais ou menos complexa que outra, Durst, C., S. Eichmüller & R. Menzel. sem estabelecer critérios para essa 1994. classificação, não é informativo. Assim, experience lead to increased faz-se variáveis volumes of subcompartments of mensuráveis e objetivas para tratar the honeybee mushroom body. questões de limitação comportamental a Behavioural fim de possibilitar a comparação entre 62:259-263. necessário utilizar diferentes estudos e o desenvolvimento de padrões robustos. Development Neural and Biology, Eberhard, W.G. 2007. Miniaturized orbweaving spiders: behavioural precision is not limited by small size. Proceedings of the Royal Agradecimento Agradecemos ao Marcelo Society B, 274:2203-2209. Gonzaga pela orientação, ao Paulinho Eisenberg, J.G. & D.E. Wilson. 1978. pelas contribuições com o trabalho e ao Relative brain size and feeding Eduardo strategies in the Chiroptera. “Passivo” pela ajuda na formatação dos gráficos. Evolution 32:740-751. Eisenberg, J.G. 1981. The mammalian Referências radiations. An analysis of trends Beutel, R.G., H. Pohl & F. Hunefeld. in evolution, adaptation and 2005 Strepsipteran brains and behaviour. Chicago: University effects of Chicago Press. of miniaturization (Insecta). Arthropod Structure Development, 34:301-313. 6 Foelix, R. F. Biology of spiders. 1982. Massachusetts: Harvard University Press. Spruston, M. & G. Stuart. In press. Dendrites. New York: Oxford University Press. Healy, S.D. & C. Rowe. 2006. A Vollrath, F. 1992. Analysis and critique of comparative studies interpretation of brain size. Proceedings of the exploration and web-building Royal Society B, 274:453-464. behavior. Advanced Study of Niven, J.E., J.C. Anderson & S.B. of orb spider Behaviour, 21:147-199. Laughlin. 2007. Energy Wilcox, D., B. Dove, D. McDavid & D. information trade-offs during Greer. 2002. Image Tool for signal transmission by single Windows. sensory receptors. PLoS Biology, UTHSCSA. San Antonio: 5:116. Ruppert, E.E., R.S. Fox & R.D. Barnes. 2005. Zoologia dos Invertebrados. São Paulo: Roca. Scholes III, E. 2008. Evolution of the courtship phenotype in the bird of paradise genus Parotia (Aves: Paradisaeidae): phylogeny, Biological homology, and modularity. Journal of the Linnean Society, 94:491-504. Seid, M.A., K.M. Harris & J.F. Traniello. 2005. Age-related changes in the number and structure of synapses in the lip region of the mushroom bodies in the ant Pheidole dentata. Journal of Comparative Neurobiology, 488: 269-277. 7
Baixar