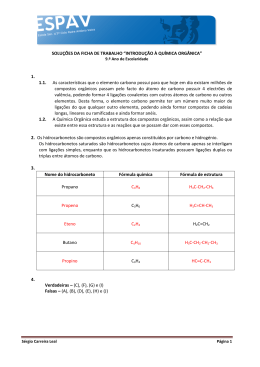
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS SÃO JOSÉ Componente Curricular: Química Professora: Lubna Chagas Alunos: Eduardo Vidal Fagundes; João Pedro Menegali Salvan Bitencourt; Luiz Henrique Dias; Turma: 6080621 Data: 23/09/2014 HIDROCARBONETOS Introdução Hidrocarbonetos são compostos orgânicos formados unicamente por carbono e hidrogênio unidos tetraedricalmente por ligação covalente. O estado físico dos Hidrocarbonetos geralmente é liquido ou gasoso, pois eles tem um baixo ponto de fusão e ebulição. Os Hidrocarbonetos são subdivididos em alcanos, alcenos e alcinos, que podem ter suas cadeias ramificadas, cíclicas ou acíclicas, saturadas, insaturadas e aromáticas. Esses compostos orgânicos estão presentes no nosso dia a dia, pois vários produtos utilizados os contém em sua fórmula, como por exemplo, o gás de cozinha que possui propano e a gasolina que é o octano. Hidrocarboneto Os hidrocarbonetos são compostos formados unicamente por átomos de carbono, representado pela letra “C”, e hidrogênio, representado pela letra “H”, de fórmula geral (C xHy). É o grupo de compostos orgânicos mais extensos existentes, dividindo-se em: → Hidrocarbonetos alifáticos: os átomos de carbono encontram-se em cadeias abertas. O termo alifático vem do grego, óleo, devido ao aspecto oleoso de muitos compostos dessa classe. Ex.: Butano; C4H10. H H H H H C C C C H H H H H Fórmula estrutural do butano → Hidrocarbonetos alicíclicos (não-aromáticos): apresentam estruturas em cadeias fechadas formando anéis. Ex.: Ciclopentano; C5H10. H H C H H C C H H C C H H H H Fórmula estrutural do ciclopentano → Hidrocarbonetos aromáticos: a cadeia principal é constituída por pelo menos um núcleo benzênico. Ex.: Benzeno; C6H6. Fórmula estrutural do benzeno → Hidrocarbonetos de cadeia mista: possui uma parte acíclica (aberta) e uma parte cíclica (fechada) ou aromática. Nesse caso, consideramos preferencialmente como principal a parte alicíclica (fechada) ou a parte aromática. Ex.: Peróxido de benzoíla; C14H10O4 O O C O O C Fórmula estrutural do peróxido de benzoíla. Presença de heteroátomo De acordo com a presença de heteroátomo, um átomo diferente do carbono e do hidrogênio, que na cadeia carbônica está entre dois átomos de carbono, há as seguintes classificações: → Homogênea: possui cadeia em sequência que não é dividida por heteroátomos, que pode ser qualquer átomo que não seja carbono ou hidrogênio. Exemplo de composto sem heteroátomo: propano; C3H8. H H H H C C C H H H H Fórmula estrutural do propano → Heterogênea: um heteroátomo divide a sequência de carbonos da cadeia principal. Exemplo de composto com heteroátomo: etanol; C2H6O. H H C H O H C H Nesse caso, o heteroátomo é o oxigênio. H Fórmula estrutural do etanol Tipo de ligação De acordo com o tipo de ligação entre os átomos de carbono, os hidrocarbonetos podem ser classificados em: → Saturados: contêm apenas ligações simples carbono─carbono. Ex.: Pentano; C5H12. Fonte do texto: Enciclopédia Larousse Cultural, Editora PLURAL, Volume 12, 1995, pg. 2968. H H H H H H C C C C C H H H H H H Fórmula estrutural do pentano → Insaturados: possuem uma ou mais ligações múltiplas carbono─carbono. Fonte dos textos: Enciclopédia Larousse Cultural, 1995, Editora PLURAL, Volume 12, pág. 2968. Ex.: Propileno; C3H6. H H H C C C H H H Fórmula estrutural do propileno Nomenclatura A nomenclatura é atribuída observando-se o número de carbonos, que serve para definir o prefixo, e a saturação da cadeia, que serve para definir o nome intermediário. A relação para nomenclatura dá-se pela tabela abaixo: Prefixo Intermediário Número de carbonos Saturação da cadeia 1C 2C 3C 4C 5C 6C 7C 8C 9C 10 C 11 C MET ET PROP BUT PENT HEX HEPT OCT NON DEC UNDEC saturadas AN insaturadas 1 dupla 2 duplas 3 duplas EN DIEN TRIEN 1 tripla 2 triplas 3 triplas IN DIIN TRIIN 1dupla e 1 tripla ENIN Características Os hidrocarbonetos possuem as seguintes características principais: → São substâncias consideradas apolares. Por causa dos diversos ângulos de ligações existentes nessas moléculas e à força do dipolo induzido que se estabelece entre as moléculas, a polaridade torna-se muito diminutiva, o que a faz desprezível. → Devido ao item citado acima, os hidrocarbonetos possuem baixos pontos de fusão e ebulição. Os pontos de fusão e ebulição aumentam com o aumento da massa molar do composto. Se compararmos dois compostos isômeros quaisquer, aquele que possuir cadeia normal ou for menos ramificado apresentará pontos de fusão e ebulição maiores que o de cadeia ramificada. → Com relação ao estado de agregação, é possível fazer a seguinte generalização: os hidrocarbonetos que possuem de 1 a 4 carbonos são gasosos, os que possuem de 5 a 17 carbonos são líquidos e os que possuem acima de 17 carbonos são sólidos. → Com relação à densidade, todos os hidrocarbonetos possuem densidade inferior a da água, principalmente por causa dos baixos valores de massa atômica dos átomos que formam os hidrocarbonetos (H = 1 g/mol e C = 12 g/mol), e porque suas moléculas são praticamente apolares e tendem a ficar mais distantes entre si, o que significa menos moléculas por unidade de volume. → Na questão de solubilidade, de acordo com a regra “semelhante dissolve semelhante”, os hidrocarbonetos são insolúveis em água, pois se dissolvem apenas em substâncias apolares ou de baixa polaridade e a água é uma substância polar. Grupos do alifáticos Alcanos São hidrocarbonetos de cadeia aberta que apresentam apenas ligações simples entre os carbonos, ou seja, são de cadeias saturadas. Possuem fórmula geral CnH2n+2, o qual “n” é o número de carbonos. Ex.: Butano, C4H10 (CnH2n + 2, n = 4, portanto, C4H2 · 4 + 2 igual à C4H10). H H H H H C C C C H H H H H Fórmula estrutural do butano Nas condições normais de temperatura e pressão (CNTP), o metano (formado por um átomo de carbono), o etano (formado por dois átomos de carbono), o propano (formado por três átomos de carbono) e o butano (formado por quatro átomos de carbono) são gasosos. O pentano (formado por cinco átomos de carbono), o hexano (formado por seis átomos de carbono) e o heptadecano (formado por dezessete átomos de carbono ─ 7 + 10 ─ hept + dec) são líquidos. Do octadecano (formado por dezoito átomos de carbono ─ 8 + 10 ─ oct + dec) em diante são sólidos. O metano e butano emanam gasosamente na natureza e também do petróleo. O propano também é um constituinte do petróleo e junto com o butano é utilizado nos chamados GPL (gás de petróleo liquefeito) ou gás de cozinha. O mais simples dos alcanos é o metano, CH4, que emana dos lixões e pântanos. Alcenos ou alquenos São hidrocarbonetos de cadeia aberta que possuem uma ligação dupla entre os átomos de carbono, o que os torna mais reativos do que os alcanos, ou seja, há mais chances de uma reação química ocorrer com compostos alcenos do que com compostos alcanos. Sua fórmula geral é: CnH2n, o qual “n” é o número de carbonos. Ex.: 1-propileno; C3H6 (CnH2n, n = 3, portanto, C3H2 · 3 igual à C3H6). H H H C C C H H H Fórmula estrutural do propileno Os alcenos, nas indústrias são obtidos dos alcanos encontrados no petróleo através do craqueamento, um processo de cisão térmica em que uma molécula é quebrada em dois ou mais fragmentos. O alceno mais simples e importante é o eteno ou etileno, que é um gás incolor e de sabor adocicado, utilizado como combustível, no amadurecimento artificial de frutos e na fabricação de plásticos. Os alcenos com mais de cinco carbonos possuem aspecto oleoso. Alcinos ou alquinos São hidrocarbonetos de cadeia aberta que possuem uma ligação tripla entre os átomos de carbono. Por causa da ligação tripla, a reatividade desses compostos é bem maior que os que possuem ligações dupla e simples. Sua fórmula geral é: CnH2n – 2, no qual “n” é o número de carbonos. Ex.: Propino; C3H4 (CnH2n – 2, n = 3, portanto, C3H2 · 3 – 2 igual à C3H4). H H C C C H H Fórmula estrutural do propino O etino é um dos alcinos mais importantes. Ele é usado como gás de maçarico, cuja chama azul pode atingir 3000°C e pode cortar chapas de aço. Alcadienos São hidrocarbonetos de cadeia aberta portadores de duas ligações duplas entre os átomos de carbono. Possuem a mesma fórmula geral dos alcinos, CnH2n – 2. Ex.: Propadieno; C3H4 (CnH2n – 2, n = 3, portanto, C3H2 · 3 – 2 igual à C3H4). H C H H C C H Fórmula estrutural do propadieno Dependendo da localização das ligações duplas, os alcadienos são classificados em: → Alcadienos acumulados: possui ligações duplas em carbonos viznhos. Ex.: 2,3-pentadieno; C5H8 (CnH2n – 2, n = 5, portanto, CnH2 · 5 – 2 igual à C5H8). H H H C C H C H C C H H H Fórmula estrutural do 2,3-pentadieno → Alcadienos isolados: possui pelo menos um átomo de carbono saturado entre as ligações duplas. Ex.: 1,4-pentadieno; C5H8 (CnH2n – 2, n = 5, portanto, CnH2 · 5 – 2 igual à C5H8). H H H H C C C C C H H H Fórmula estrutural do 1,4-pentadieno H → Alcadienos conjugados: possui ligações duplas separadas por apenas uma ligação simples entre os átomos de carbono. Ex.: 1,3-butadieno; C4H6 (CnH2n – 2, n = 4, portanto, C4H2 · 4 – 2 igual à C4H6). H C C H H H H C C Fórmula estrutural do 1,3-butadieno H O 1,3-metilbutadieno e o 1,3-cloro-butadieno são exemplos de alcadienos conjugados utilizados como matéria-prima na fabricação de borracha. Ciclanos e ciclenos Ciclanos São hidrocarbonetos de cadeia fechada portadores apenas de ligações simples entre os átomos de carbonos. É possível notar o termo intermediário “an”, que indica a presença unânime de ligações simples. Sua fórmula geral é CnH2n. Ex.: Ciclobutano; C4H8 (CnH2n, n = 4, portanto, C4H2 · 4 igual à C4H8). H H H C C H Fórmula estrutural do ciclobutano H C C H H H A reatividade desse tipo de hidrocarboneto depende do número de átomos de carbono presentes na cadeia, sendo aqueles que possuem de 3 a 5 átomos de carbono razoavelmente reativos. Aqueles que possuem 6 ou mais átomos de carbono na cadeia são bastante estáveis e são de difícil reação. Tais propriedades podem ser explicadas por meio da teoria das tensões nos anéis, proposta pelo químico alemão Adolf Von Baeyer, que afirma que nos ciclanos, as valências são entortadas ou flexionadas para fechar a estrutura, criado uma tensão que torna o anel instável, ou seja, mais fácil de ser rompido. Desta forma, os ciclos de 3 e 4 carbonos quebram mais facilmente, dando origem a reações de adição, ao passo que os anéis de 5 e 6 carbonos são mais resistentes à ruptura e participam, principalmente, de reação de substituição. Os petróleos de origem caucasiana e de origem americana são grandes fontes de ciclanos. Mais exemplos: H H C H H C H H C H C C H H C H C H H H Ciclo-hexano (C6H12) H Ciclopentano (C5H10) C H H H H C C C H H É um gás possuidor de propriedades anestésicas, sendo muito em cirurgias, para adormecer o paciente. H H É usado como combustível e na produdução de ácido adípico, COOH(CH2)4COOH, que é a matéria-prima para a fabricação do náilon. Ciclenos São hidrocarbonetos de cadeia fechada que possuem uma ligação entre os átomos de carbono. Sua fórmula geral é CnH2n – 2. O termo intermediário “en”, indica a presença de uma ligação dupla. Ex.: Ciclobuteno; C4H6 (CnH2n – 2, n = 4, portanto, C4H2 · 4 – 2 igual à C4H6). H H H C C H Fórmula estrutural do ciclobuteno H C C H Ciclenos compostos de 3 a 5 carbonos são instáveis devido à elevada tensão no ângulo de ligação entre os átomos de carbono. Os ciclenos com 6 ou mais átomos de carbono não possuem estrutura plana, mas espacial, fato que torna o ângulo entre as ligações próximo do ideal, o que dá a estabilidade para a molécula. Aromáticos São hidrocarbonetos que possuem um ciclo plano com 6 átomos de carbono, ligados entre si por ligações duplas que se alternam com ligações simples, o torna estes compostos bastantes estáveis e só reagem em condições energéticas. São compostos atípicos, logo, sua nomenclatura não obedece às regras impostas aos alcanos, alcenos ou alquenos, alcinos ou alquinos, alcadienos, ciclanos e ciclenos. Os Hidrocarbonetos Aromáticos são classificados em Mononucleares, Dinucleares ou Binucleares, Trinucleares e Polinucleares. O aromático mais importante é o benzeno, e é encontrado no carvão mineral e também através da ciclização do hexano. O metilbenzeno é um aromático derivado do benzeno. Ele é utilizado na fabricação do explosivo trinitrotolueno (TNT), que é utilizado como parte na fabricação de produtos químicos de fotografia e tinturaria. Ex.: Trinitrotolueno; C7H5N3O6. (Trinitro – 3 compostos com nitrogênio). NO2 O2 N CH3 NO2 Fórmula estrutural do trinitrotolueno Os xilenos são usados como combustível de avião e como solvente para resisnas, lacas e esmaltes. Abaixo encontram-se alguns exemplos de aromáticos que apresentam mais de um núcleo de benzeno. Esses núcleos podem ser condensados ou isolados. → Núcleos aromáticos condensados Ex.: Naftaleno; C10H8. Fórmula estrutural do naftaleno → Núcleos aromáticos isolados Ex.: Peróxido de benzoíla; C14H10O4 O C O O O C Fórmula estrutural do peróxido de benzoíla. Curiosidades A combustão dos hidrocarbonetos produz gás carbônico (CO2), H2O e energia, que pode ser aproveitada para produção de trabalho mecânico. Segundo o INEA (Instituto Estadual do Ambiente), um dos problemas associados à frota crescente de veículos é a emissão crescente de CO2, que é um gás estufa e contribui para o agravamento do efeito estufa. A Lua Titã de Saturno possui reservas de hidrocarbonetos superiores a todas as de petróleo e gás natural conhecidas na Terra, segundo observações realizadas pela sonda Cassini. A casca de laranja tem um combustível formado por substância pertencente aos Hidrocarbonetos . São os limoneno esse composto é inflamável. Conclusão Foi notório o quão importante essas substâncias são e como é comum vê-las no dia-a-dia. Os Hidrocarbonetos fazem parte do grupo mais simples de compostos orgânicos, no qual são formados apenas pelos elementos Carbono e Hidrogênio. Esse grupo pode ser dividido em Alcanos, Alcenos, Alcinos, entre outras classes. Podemos ver que na questão de solvente, a água é o solvente mais usado nos compostos inorgânicos. Já os hidrocarbonetos são geralmente usados como solventes nos compostos orgânicos, como o Benzeno, por exemplo. Um assunto muito falado é sobre o petróleo, mas dificilmente se imagina que seus componentes fazem parte de uma cadeia com elementos tão comuns. Além disso, o gás de cozinha também é uma coisa tão comum no nosso cotidiano, que nem paramos para pensar no ponto de vista químico, ligando eles aos Hidrocarbonetos. A partir do momento que esses elementos estão tão presentes ao nosso redor, é de extrema importância estudá-los e classificá-los, conhecendo-os e entendendo um pouco mais sobre eles. Referências Bibliográficas Encliclopédia Larousse Cultural, Editora PLURAL, 1995, Volume 12, pág. 2698 Fonseca, Martha Reis Marques da. Química: meio ambiente, cidadania, tecnologia, 1ª edição, Volume 3, editora FDT, 2010, São Paulo. Pág. 44 http://www.infoescola.com/quimica/o-que-sao-hidrocarbonetos/, acesso em 29/09/2014 http://www.brasilescola.com/quimica/hidrocarbonetos.htm, acesso em 29/09/2014 http://www.soq.com.br/conteudos/em/funcoesorganicas/, acesso em 29/09/2014 http://educacao.globo.com/quimica/assunto/quimica-organica/hidrocarbonetos.html, acesso em 29/09/2014 http://hidrocarbonetos3a.blogspot.com.br/2010/11/curiosidades.html, acesso em 29/09/2014
Download