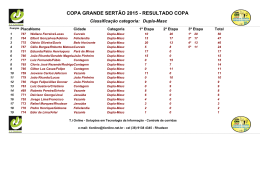
OCORRÊNCIA E CARACTERIZAÇÃO DE GOLFINHOS NO LITORAL NORTE DO ESPÍRITO SANTO E SUA RELAÇÃO COM A ATIVIDADE PESQUEIRA Geórgia de Brito Vidal Félix Dissertação de Mestrado em Biodiversidade Tropical Mestrado em Biodiversidade Tropical Universidade Federal do Espírito Santo Março de 2014 III Dados Internacionais de Catalogação-na-publicação (CIP) (Biblioteca Central da Universidade Federal do Espírito Santo, ES, Brasil) F316o Félix, Geórgia de Brito Vidal, 1987Ocorrência e caracterização de golfinhos no litoral norte do Espírito Santo e sua relação com a atividade pesqueira / Geórgia de Brito Vidal Félix. – 2014. 65 f. : il. Orientador: Ana Paula Cazerta Farro Dissertação (Mestrado em Biodiversidade Tropical) – Universidade Federal do Espírito Santo, Centro Universitário Norte do Espírito Santo. 1. Golfinho. 2. Pesca. 3. Monitoramento ambiental. I. Farro, Ana Paula Cazerta. II. Universidade Federal do Espírito Santo. Centro Universitário Norte do Espírito Santo. III. Título. CDU: 502 IV “Não se pode defender o que não se ama, e, não se pode amar o que não se conhece.” (Autor desconhecido) V SUMÁRIO LISTA DE FIGURAS 7 LISTA DE TABELAS 8 INTRODUÇÃO GERAL 9 CAPÍTULO 1: Padrões de atividade e tamanho do grupo de Sotalia guianensis no litoral norte do Espírito Santo 14 RESUMO 15 ABSTRACT 16 INTRODUÇÃO 17 MATERIAL E MÉTODOS 18 RESULTADOS E DISCUSSÃO 23 CONCLUSÕES 33 REFERÊNCIAS BIBLIOGRÁFICAS 34 ANEXO 1 39 CAPÍTULO 2: Novas informações sobre a interação entre a pesca e os golfinhos no litoral norte do Espírito Santo 44 RESUMO 45 ABSTRACT 46 INTRODUÇÃO 47 MATERIAL E MÉTODOS 49 RESULTADOS E DISCUSSÃO 51 CONCLUSÃO 56 REFERÊNCIAS BIBLIOGRÁFICAS 57 REFERÊNCIAS BIBLIOGRÁFICAS 61 6 AGRADECIMENTOS Primeiramente a Deus, pela oportunidade de estar vivendo este aprendizado; Aos meus pais e irmãos, por todo amor, carinho e dedicação. E acima de tudo, por estarem tão presentes ao longo de toda minha vida acadêmica; A minha orientadora, Dra Ana Paula Cazerta Farro, por todo carinho, dedicação, confiança e compreensão. Mas acima de tudo, pelo exemplo de profissional que você é; À Universidade Federal do Espírito Santo, por me proporcionar todos os meios para a realização deste estudo; À CAPES, órgão financiador, pela bolsa que a mim foi destinada; Ao Instituto Orca e ao Projeto Tamar, por todo apoio, ajuda e conhecimentos compartilhados. Em especial ao Lupércio e ao João Paulo; A todos os professores que se propuseram a me ajudar, tirando minhas dúvidas, discutindo dados e ideias, principalmente na parte estatística, em especial a Karla, Edney e Duboc; As golfinhetes! Pelas risadas, pelos sufocos, pelo ombro amigo, pela ajuda, em campo e fora dele; A todos os meus amigos, por serem sempre minha válvula de escape e meu apoio incondicional. Em especial a República 3 pra 1 e agregados, obrigado por tudo! Aos integrantes da banca, por terem aceitado o meu convite de contribuir para este trabalho; E a todos aqueles que de alguma forma contribuíram e não tiveram seus nomes citados. De forma alguma vocês foram esquecidos. Muito Obrigado! 7 LISTA DE FIGURAS CAPÍTULO 1: Padrões de atividade e tamanho do grupo de Sotalia guianensis no litoral norte do Espírito Santo Figura 01: Pontos fixos monitorados no litoral norte do Espírito Santo. Ponto A, visualização para o mar; Ponto B, visualização para o interior do estuário; Ponto C, localizado no alto da restinga da praia de Guriri.. Figura 02: Registro de Sotalia guianensis durante o monitoramento do ponto A em Conceição da Barra. Figura 03: Grupo de Sotalia guianensis registrado na foz do rio São Mateus. Figura 04: Número de indivíduos por status comportamental em cada ponto de monitoramento. Figura 05: Número de indivíduos por grupo em cada ponto de monitoramento. Figura 06: Frequência dos status comportamentais em cada ponto de monitoramento. Figura 07: Número de indivíduos (A) e tempo máximo de visualização (B) por Status comportamental e ponto monitorado. Onde, a cor roxa representa a locomoção; azul: alimentação; verde: quando não houve registro de presença; vermelho: “surfing” e cinza: atividade aérea. CAPÍTULO 2: Novas informações sobre a interação entre a pesca e os golfinhos no litoral norte do Espírito Santo Figura 01: Área de estudo evidenciando os pontos de encalhes dos cetáceos no litoral no norte do estado do Espírito Santo. Pontos rosas: Pontoporia blainvillei; Pontos verdes: Sotalia guianensis e Ponto azul: Peponocephala electra. Figura 02: Número de encalhes por mês com as diferentes espécies registradas. Figura 03: Marcas de possíveis interações com pesca encontradas em carcaças de golfinhos. Onde A mostra cortes profundos abaixo do rostro de um Sotalia guianensis; B mostra um filhote de golfinho com cortes na região dos olhos e próximos a genitália do animal. 8 LISTA DE TABELAS CAPÍTULO 1: Padrões de atividade e tamanho do grupo de Sotalia guianensis no litoral norte do Espírito Santo Tabela 01: Descrição dos padrões comportamentais observados durante o monitoramento de ponto fixo em Conceição da Barra e São Mateus. Tabela 02: Análise das variáveis “Tamanho do Grupo” e “Status Comportamental” quando analisadas por tipo e nível de maré. 9 INTRODUÇÃO GERAL Classificação, distribuição e características gerais Os cetáceos estão entre os mamíferos mais bem adaptados ao meio aquático, habitando todos os oceanos, os estuários e algumas espécies, rios (Zerbini et al., 2004). No geral, se alimentam de peixes, cefalópodes e crustáceos, incluindo o krill (Perrin et al., 2009). Tradicionalmente, os taxas Artiodactyla e Cetacea eram considerados grupos monofiléticos distintos e categorizados como ordens, atualmente existe uma tendência ao agrupamento destes taxas em uma única ordem denominada Cetartiodactyla. Assim, a nova ordem Cetartiodactyla inclui os representantes das ordens Cetacea, Sirenia e Carnivora. Os cetáceos estão divididos em dois grupos: Mysticeti e Odontoceti (Lodi e Borobia, 2013). Os misticetos, cetáceos com a presença de barbatanas, incluem o grupo das baleias, e se dividem em quatro famílias e 14 espécies, todas com distribuição exclusivamente marinha. Com exceção das famílias Eschrichtiidae e Neobalaenidae, as demais ocorrem no litoral do Brasil. Em geral, as espécies dessa subordem são conhecidas por seus padrões de migração anual, quando se locomovem entre as áreas de alimentação e as áreas de reprodução (Lodi e Borobia, 2013). Os odontocetos, cetáceos com dentes, possuem uma única dentição permanente e em geral, os dentes eclodem durante o período de amamentação. Compõe uma maior diversidade de espécies, dividindo-se em 10 famílias e 74 espécies (Lodi e Borobia, 2013). Predadores de grande eficiência, a maioria apresentam hábitos marinhos costeiros ou oceânicos, no entanto, quatro espécies dessa subordem ocorrem em sistemas fluviais da América do Sul e da Ásia. Estão entre os odontocetos, os golfinhos, botos e baleias com dentes (Di Beneditto et al., 2010). Diversas espécies de cetáceos ocorrem ao longo do litoral brasileiro. No Espírito Santo, estudos realizados por ponto fixo, encalhe ou captura acidental, registram dezenas de espécies ao longo dos anos como Megaptera novaeangliae (baleia jubarte), Eubalaena australis (baleia-franca-austral), Physeter macrocephalus (cachalote), Balaenoptera acutorostrata (baleia-minke-comum), Kogia breviceps (cachalote-pigmeu), Peponocephala electra (golfinho-cabeça-de-melão), Pontoporia blainvillei (toninha), Sotalia guianensis (boto-cinza), Tursiops truncatus (golfinho-nariz-de-garrafa), Steno bredanensis (golfinho-dedentes-rugosos), Stenella frontalis (golfinho-pintado-do-atlântico), Stenella longirostris (golfinho-rotador) (Freitas Netto, 2003; Freitas Netto e Barbosa, 2003; Moreno et al., 2003; Freitas Netto e Di Beneditto, 2008; Félix, 2011; Lodi e Borobia, 2013). Porém, de todas as 10 espécies registradas, entre os pequenos cetáceos duas se destacam no norte do estado, são elas Pontoporia blainvillei e Sotalia guianensis. - P. blainvillei (Gervais e d’Orbigny, 1844) Espécie conhecida popularmente como toninha, franciscana, manico, boto-garrafa e boto-cachimbo, é um odontoceto de pequeno porte da família Pontoporiidae. Ocorre desde Itaúnas - ES, Brasil (Siciliano, 1994), até Golfo San Matias, Província de Chubut, Argentina (Crespo et al., 1998). Porém sua distribuição não é continua, sendo dividida em dois hiatos (Siciliano et al., 2002): o primeiro entre Regência (19º40’S) no estado do Espírito Santo e Barra do Itabapoana (21º18’S) no Rio de Janeiro; e o segundo entre Macaé (22º25’S) no Rio de Janeiro e Baía da Ilha Grande (23ºS) no estado de São Paulo. Segundo Di Beneditto et al. (2010), as possíveis causas para essa divisão da distribuição da espécie em hiatos, estão relacionadas a temperatura, profundidade e transparência da água. A toninha habita preferencialmente regiões estuarinas e costeiras de até 50 m de profundidade (Pinedo et al., 1989; Di Beneditto e Ramos, 2001). Segundo Freitas Neto (2003), características distintivas dessa espécie, como rostro longo e estreito e coloração do corpo amarronzada, as tornam facilmente identificável por parte dos pescadores. A espécie P. blainvillei se alimenta de uma ampla variedade de presas de pequeno porte, composta principalmente por peixes ósseos e lulas das regiões estuarinas e costeiras (Di Beneditto et al., 2010). Geralmente é visualizada em indivíduos solitários ou grupos de dois a cinco indivíduos, podendo algumas vezes formar grupos com mais de 10 indivíduos (Bordino et al., 1999; Di Beneditto et al., 2001b; Secchi et al., 2001; Cremer e Simões-Lopes, 2005). A execução de comportamentos aéreos é incomum e a espécie tende a evitar aproximação com embarcações motorizadas (Bordino et al., 2002). - Sotalia guianensis (van Bénéden 1864) Conhecido popularmente como boto, boto-cinza, boto-comum é um representante da família Delphinidae. Possui como padrão de cor da pele a coloração acinzentada, com o dorso cinza-azulado escuro ou cinza-amarronzado. A região ventral é mais clara e frequentemente rosada em filhotes (Lodi e Borobia, 2013). Habitam principalmente regiões costeiras como estuários, baías, enseadas e áreas costeiras abertas (Borobia et al., 1991). Endêmicos da costa Atlântica tropical e subtropical da America Central e América do Sul ocorrem desde La Mosquita (14ºN) nas Honduras Central, até Florianópolis (27º) em Santa Catarina (Silva et al., 2010). A distribuição do boto-cinza 11 pode estar relacionada à temperatura da água, que atua como uma barreira térmica o que explicaria o limite sul da sua distribuição e a ausência de registros em Cabo Frio, região influenciada pelas águas frias da ressurgência (Lodi e Borobia, 2013). O Sotalia guianensis apresenta uma dieta diversificada com hábitos alimentares oportunistas que é completamente influenciada pela disponibilidade de recursos em seu habitat (Monteiro-Filho e Monteiro, 2008). Os grupos variam em média de dois a 10 indivíduos, podendo chegar a 450 indivíduos em algumas regiões do país (Oliveira et al., 1995; Santos et al., 2010; Lodi e Borobia, 2013). Geralmente esquivo, o boto-cinza exibe uma série de padrões comportamentais, principalmente de exibição aérea, podendo ser facilmente observado nas zonas costeiras e estuarinas (Monteiro-Filho e Monteiro, 2008; Lodi e Borobia, 2013). Interações e ameaças à conservação Os cetáceos tem um importante papel nos ecossistemas aquáticos. São os maiores consumidores desde a produção primária até os predadores de topo e, independentemente da posição que ocupam, são vitais para o equilíbrio do ambiente em que vivem. Atuam como espécies reguladoras e fornecedoras de nutrientes para diversos ciclos biológicos. Além disso, por dependerem do ecossistema aquático para sobreviver, são indicadores naturais da variabilidade e da degradação ambiental (Lodi e Borobia, 2013). Os mamíferos marinhos sofrem diversas pressões, como a interação com as atividades pesqueiras (Freitas-Netto e Barbosa, 2003; Zappes et al., 2009; Ferreira, 2012); as capturas acidentais ou intencionais (Rosso-Londoño, 2010; Felix, 2011); as atividades de prospecção e exploração de óleo e gás; o tráfego de embarcações (colisões e poluição sonora) (Melo e Valle, 2006; Luís, 2008; Santos 2010); a poluição química e a degradação ambiental, com consequente perda de hábitat (Morales et al., 2007); as mudanças climáticas globais (Especie et al., 2007); e a sobrepesca das espécies-chave para a sua sobrevivência. Além disso, o possível retorno da caça comercial em águas internacionais também poderá levar a um impacto às populações em diferentes regiões do Globo (Rocha-Campos, 2011). Os cetáceos são espécies com baixa taxa reprodutiva e crescimento lento, o que os tornam mais vulneráveis às ameaças do que outros grupos taxonômicos (Rocha-Campos, 2011). As interações entre as atividades pesqueiras e os cetáceos podem ser verificadas em todas as regiões em que ambos estão presentes. No entanto, o resultado dessas interações é variável, podendo causar prejuízos, benefícios para ambos, para uma das partes envolvidas ou 12 mesmo se caracterizar como neutra (Di Beneditto, 2010). As interações existentes entre cetáceos e as atividades pesqueiras que apresentam efeitos positivos podem ser descritas como interações ecológicas comensais ou mutualísticas (Monteiro-Filho, 1995). Por outro lado, interações com efeitos negativos normalmente estão relacionadas às capturas acidentais dos cetáceos, que podem causar injúria ou morte dos animais e danos ou perda do artefato de pesca (Di Beneditto et al., 2001). A atividade pesqueira constitui umas das maiores ameaças às populações de golfinhos, principalmente ao boto-cinza (Sotalia guianensis) e à toninha (Pontoporia blainvillei). Em algumas regiões do país, carcaças de botos-cinza são utilizadas pelos pescadores como alimento, isca, ou fonte de gordura para aplicar em barcos e / ou madeiras como impermeabilizantes (Di Beneditto e Ramos, 2001; Reis, 2002). Em particular, a captura acidental em atividades de pesca representa uma séria ameaça às populações de cetáceos, principalmente aos odontocetos de pequeno porte. No Brasil a pesca é uma atividade praticada em quase toda sua extensão, porém além de capturar as espécies-alvo, também captura acidentalmente organismos sem valor comercial, como pequenos cetáceos (Freitas Netto, 2003). Apesar de já existirem programas de educação ambiental que procuram sensibilizar as comunidades pesqueiras sobre o uso inadequado dos artefatos de pesca, ainda é necessário um esforço do governo e das instituições de pesquisa na relação com os pescadores, procurando soluções econômicas e ecológicas, que garantam a sobrevivência dos golfinhos (Araújo, 2008). Segundo Rosso-Londoño (2010), os estudos a respeito dos mamíferos marinhos são importantes ferramentas para avaliar e interpretar, além de entender, os processos ecológicos dos ecossistemas, assim como auxiliar nos processos de gestão marinha e costeira. Estes animais podem: indicar-nos mudanças no seu habitat, a partir de uma rápida reação comportamental (Watkins, 1986; Moore e Clarke, 2002); regular populações de níveis tróficos inferiores (Cury et al., 2001; Savenkoff et al., 2008) e nos permitir avaliar o nível de contaminação do ambiente, visto que são bioacumuladores (Reddy et al., 2001). Alguns estudos já foram desenvolvidos em diferentes localidades brasileiras com o objetivo de se entender a interação entre a pesca artesanal e os cetáceos. No Espírito Santo, a atividade de pesca apresenta relevância econômica, constituindo uma das principais atividades com peculiaridades ao longo de todo o litoral (Freitas-Netto, 2003). Recentemente, foram registradas a presença de golfinhos e suas interações com a pesca no litoral de Conceição da Barra – ES (Félix, 2011). Mas uma ampliação do tempo de 13 monitoramento dos cetáceos foi necessária, com o intuito de entender e avaliar essas interações existentes, além de verificar uma possível influência da construção da orla de Conceição da Barra na ocorrência dos golfinhos no interior do estuário. 14 CAPÍTULO 1 Padrões de atividade e tamanho do grupo de Sotalia guianensis no litoral norte do Espírito Santo FÉLIX, GEORGIA DE BRITO VIDAL¹*; BARBOSA, LUPÉRCIO ARAÚJO²; FARRO, ANA PAULA CAZERTA¹ ¹Universidade Federal do Espírito Santo – UFES (CEUNES) Rodovia BR 101 Norte, KM 60, Litorâneo, São Mateus – ES. CEP: 29932-540 ²Instituto ORCA (Organização Consciência Ambiental) Avenida São Paulo, 23, Praia da Costa, Vila Velha – ES. CEP: 29101-315 *E-mail: [email protected] 15 RESUMO O boto cinza (Sotalia guianensis) habita ambientes costeiros, baías, enseadas e estuários. Ao longo de sua distribuição, algumas populações são consideradas residentes. Recentemente, foi registrada através de monitoramentos por ponto fixo, uma possível alteração na ocorrência de Sotalia guianensis no estuário de Conceição da Barra, ES, que passava por alterações físicas e ecológicas através de dragagens com a construção da orla do município. Esse estudo teve como objetivo principal monitorar os golfinhos em praias no extremo norte do Espírito Santo, a fim de verificar se fatores de influencia na ocorrência de pequenos cetáceos e caracterizar os grupos de golfinhos da região. Foram observados 118 grupos de Sotalia guianensis em Conceição da Barra, sendo 103 no ponto A (foz do rio São Mateus) e 15 no ponto B (interior do estuário). Já na praia de Guriri (ponto C), foram observados 81 grupos, sendo que em geral variaram de um a nove indivíduos. Nos pontos A e C foi observada presença de grupos de botos-cinza durante todo o período de monitoramento. Já, no ponto B ocorreu uma variação significativa entre a presença de indivíduos e o tamanho de grupo quando relacionados ao tipo, o nível e a variação da maré. Houve uma diferença significativa quando avaliado o tamanho dos grupos em todos os pontos de monitoramento. Quanto ao status de comportamento, os pontos apresentaram diferentes padrões de frequência. No ponto A, destacou-se os status de locomoção e alimentação, no entanto, a alimentação foi observada sempre na foz do rio. A locomoção era observada a uma distância maior do ponto de monitoramento e em sua maioria, na direção da praia de Guriri, São Mateus. Com este estudo, foi possível verificar que, mesmo com a não utilização do estuário durante a revitalização da orla, os botos-cinza voltaram a entrar no estuário após a finalização das atividades de dragagens. Além disso, foi verificado que a presença de golfinhos no interior do estuário tem a alimentação como principal atividade e que essa ocorrência sofre influência das marés. Palavras-chave: boto-cinza, estrutura de grupo, monitoramento. 16 ABSTRACT The Guiana dolphin (Sotalia guianensis) inhabits coastal environments, bays, coves, and estuaries. Throughout its distribution, some populations are considered residents. Recently, was registered through monitoring by fixed point, a possible change in occurrence of Sotalia guianensis in the estuary of Conceição da Barra, Espírito Santo, which passed through physical and ecological changes through dredging with the construction of the orle of the town. The aims of this study were to monitor the dolphins in beaches on the northern of Espírito Santo, in order to verify if factors were influencing the occurrence of small cetaceans, as well, to characterize the dolphins group in the region. Were observed 118 groups in Conceição da Barra, with 103 at the point A (mouth of the river São Mateus) and 15 at the point B (inside the estuary). Already on the beach of Guriri (point C), 81 groups were observed, and generally ranged from one to nine individuals. At points A and C were observed the presence of groups of Guiana dolphin throughout the monitoring period. At point B a significant variation occurred between the presence of individuals and the group size when related to the type, level and tidal variation. There was a significant difference when evaluated the size of the groups in all monitoring points. As for the status of behavior, the points presented different frequency patterns. At point A, the status of feeding and locomotion, however, the feeding has always been observed at the mouth of the River. The locomotion has been observed at a greater distance from the monitoring point and mostly towards the beach in Guriri, São Mateus. With this study, it was possible to verify that, even with the non-utilization of the estuary during the revitalization of the orle, the Guiana dolphin returned to enter the estuary after the completion of the dredging activities. In addition, it was found that the presence of dolphins inside of the estuary has the feeding as the principal activity and that this occurrence suffers tidal influence. Keywords: Group structure, Guiana dolphin, monitoring. 17 INTRODUÇÃO Sotalia guianensis, mais conhecido popularmente como boto cinza, possui o corpo pequeno de coloração acinzentada no dorso e a região ventral mais clara, frequentemente rosada em filhotes. Endêmico da costa Atlântica tropical e subtropical da América Central e do Sul (Lodi e Borobia, 2013), o boto cinza habita ambientes costeiros, baías, enseadas e estuários (Silva e Best, 1996). Ao longo de sua distribuição, algumas populações frequentam sempre a mesma área sendo consideradas residentes (Flores, 1999; Pizzorno et al., 1999), o que dificulta a identificação de variação sazonal na composição e no tamanho dos grupos. Geralmente essa variação sazonal ocorre em resposta às flutuações sazonais do hábitat e do movimento de suas presas (Shane et al., 1986). Quando identificado como residente, apesar dos movimentos sazonais não poderem ser claramente diferenciados, existe uma definida variação sazonal no número de indivíduos (Shane et al., 1986). As características de um ambiente, associadas às necessidades de uma espécie, determinam os padrões de comportamento e de uso do habitat dos indivíduos. Os golfinhos são encontrados e atraídos para áreas que contém altas concentrações de nutrientes, plânctons e peixes (Ballance, 1992). Os indivíduos apresentam comportamentos diferentes para cada habitat, o que pode indicar sua função ecológica na região para muitas espécies. Para os odontocetos, por serem animais que possuem grande mobilidade, determinar essas funções ecológicas não é um objetivo fácil de ser atingido (Hastie et al., 2004). Estuários e baías, que são áreas protegidas e regiões de baixa profundidade, podendo apresentar manguezais associados, são sistemas de grande produtividade evem sendo relacionados a distribuição do boto-cinza, Sotalia guianensis (Wedekin et al., 2003). Estudos realizados com este pequeno cetáceo sugerem que as áreas de maior uso são aquelas que apresentam uma alta concentração de presas (Cremer, 2000; Lodi, 2002; Monteiro Filho, 1991; Rossi-Santos, 1997). A conservação dos mamíferos marinhos depende de diversos fatores, dentre os quais podemos citar a identificação de ameaças naturais e a determinação da estrutura e do status de conservação das populações. A captura acidental e a exploração direta são responsáveis pela atual condição de ameaça de algumas espécies de cetáceos (Alarcon, 2006). Em função das crescentes ameaças e preocupação com a conservação das espécies de cetáceos e seus habitats, alguns estudos focaram a detecção de áreas de concentração e a avaliação do modo e 18 da intensidade em que os animais utilizam o meio (Grigg e Markowitz, 1997; Karczmarski et al., 2000). Sotalia guianensis é classificada como espécie insuficientemente conhecida na Lista Vermelha de Animais Ameaçados da União Internacional para Conservação da Natureza e dos Recursos Naturais (IUCN, 2012); como espécie ameaçada de extinção no Apêndice I da Convenção sobre o Comércio Internacional das Espécies da Flora e da Fauna Selvagens em Perigo de Extinção (CITES, 2012); e com deficiência de dados no Plano de Ação do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis para Mamíferos Aquáticos do Brasil (IBAMA, 2001). Registros sobre a ocorrência de cetáceos no litoral do Espírito Santo foram realizadas por coletas pontuais, espécies capturadas acidentalmente em atividades de pesca (Freitas Netto, 2003; Ramos et al., 2010), encalhadas em praias (; Freitas Netto e Barbosa 2003; Ramos et al., 2010; Felix, 2011), avistadas (Lodi et al., 1996; Moreno et al. 2003); Moura et al., 2008; Felix, 2011) ou relatadas por pescadores em estudos etnoecológicos (Freitas Netto e Di Beneditto, 2008; Félix, 2011). Felix (2011), através de monitoramentos por ponto fixo, registrou a presença de pequenos cetáceos no litoral de Conceição da Barra e na foz do rio São Mateus. No entanto, observou a ausência dos golfinhos no interior do estuário, que passava por alterações físicas e ecológicas devido às dragagens realizadas para a reconstrução da orla do município. De acordo com os pescadores e moradores locais, os animais entravam e utilizavam as águas do estuário antes das dragagens. Levando em consideração o atual status de conservação do Sotalia guianensis, a insuficiência de dados da espécie no litoral brasileiro, em especial no litoral do Espírito Santo, juntamente com os dados obtidos por Felix 2011, tornou-se necessária uma ampliação no período e área de monitoramento, a fim de conhecer e avaliar as interações entre os golfinhos e as atividades humanas na região norte. Esse estudo teve como objetivo principal avaliar a ocorrência e caracterizar os grupos de Sotalia guianensis presentes no litoral norte do Espírito Santo. MATERIAL E MÉTODOS ÁREA DE ESTUDO O estudo foi realizado no extremo norte do Espírito Santo, no litoral dos municípios de Conceição da Barra e São Mateus (Figura 1). 19 O estado do Espírito Santo é caracterizado por um clima tropical, quente e úmido, possuindo o período chuvoso durante o verão, onde recebe aporte de chuvas tropicais. A estação seca se dá entre o período de outono e inverno, onde podem ocorrer precipitações frontais de descargas devidas à chegada de frentes frias vindas de sul (Martin et al., 1996). Tanto em frequência quanto em intensidade, o regime de ventos na costa capixaba é dominado pelos derivados dos quadrantes leste-nordeste e sudeste, respectivamente. Sendo relacionados aos alísios os de quadrante leste-nordeste, nos quais se sobrepõem durante a maior parte do ano, enquanto os de quadrante sudeste estão associados às massas polares oriundas de sul que atingindo a costa do estado periodicamente (Albino, 1999; Albino et al., 2001). Os sistemas de ventos conduzem o comportamento das ondas, as quais vêm de dois âmbitos principais: Nordeste (NE) – Leste (E), predominante na maior parte do ano, e o Sudeste (SE) – Leste (E), ondas mais energéticas. As ondas possuem uma altura significativa de 0,6 a 0,9 m aproximadamente, sendo raras as ocorrências de ondas superiores a 1,5 m. Quanto ao período, as ondas apresentam períodos de 5 a 6,5s, podendo atingir um máximo de 9,5s (Albino, 1999). O litoral do estado do Espírito Santo apresenta marés semidiurnas, com período de aproximadamente 12 horas e amplitudes variando de 1,10 a 1,50 m, condizendo este litoral num regime de micromaré (< 2m) (DHN, 2014). Quanto aos aspectos geomorfológicos, a costa do estado apresenta afloramentos e promontórios cristalinos, tabuleiros da Formação Barreiras e planícies costeiras, que associadas à presença de grandes bacias hidrográficas ou mesmo desembocaduras de pequenos rios, podem influenciar na configuração da paisagem do litoral (Ortiz, 2010). O município de Conceição da Barra possui sua posição marcada pelas coordenadas 18º53’56”S de latitude e 39º43’56”W de longitude, apresentando aproximadamente 32 km de costa (IBGE, 2010). O rio São Mateus nasce no estado de Minas Gerais, e deságua no oceano Atlântico, na cidade de Conceição da Barra. Assim, a bacia hidrográfica do rio São Mateus, localiza-se no norte do Espírito Santo e possui 10.335 km², sendo reconhecida como a segunda maior do estado e é abastecida por uma grande quantidade de córregos que se deslocam pelos tabuleiros até o rio principal (Ipema, 2005). O estuário de Conceição da Barra caracteriza-se pela ocorrência de processos flúviomarinhos que acarreta sérios problemas de erosão na sua principal praia, “Bugia”, localizada à margem esquerda, além de grandes alterações fisionômicas no bosque de mangue de toda sua foz, que se alternam entre processos erosivos e processos de acelerada sedimentação. Tal fato 20 tem acarretado em uma dificuldade de navegação das embarcações pesqueiras (Vale e Ross, 2011). O município de São Mateus possui tem sua posição marcada pelas coordenadas 18º42’58”S de latitude e 39º51’21”W de longitude (IBGE, 2013). Com a abertura da nova barra (Barra Nova) foi criada a ilha de Guriri, a maior do Estado do Espírito Santo, limitada pelos rios Mariricu e São Mateus e pelo Oceano Atlântico. O litoral mateense chega a aproximadamente 40 quilômetros de extensão. Figura 1: Pontos fixos monitorados no litoral norte do Espírito Santo. Ponto A, visualização para o mar; Ponto B, visualização para o interior do estuário; Ponto C, localizado no alto da restinga da praia de Guriri. 21 COLETA DE DADOS MONITORAMENTO POR PONTO FIXO O monitoramento em Conceição da Barra foi dividido em dois pontos, sendo de três horas para o ponto A, localizado na foz do rio São Mateus (“bugia”) com visualização para o mar, e de três para o ponto B, com visualização para o rio, localizando-se próximo ao porto. A fim de verificarmos se as atividades na orla de Conceição da Barra afetaram somente a ocorrência de Sotalia guianensis no estuário e não em águas adjacentes, foi incluído no monitoramento um ponto na praia aproximadamente 12 km ao sul do estuário (Praia de Guriri, em São Mateus) (Figura 1). O monitoramento em Conceição da Barra foi dividido em dois pontos, sendo de três horas para o ponto A, localizado na foz do rio São Mateus (“bugia”) com visualização para o mar, e de três para o ponto B, com visualização para o rio, localizando-se próximo ao porto. Em São Mateus, o ponto C está localizado na restinga da praia de Guriri, 12 km ao sul do ponto A (Figura 1). Os pontos foram monitorados duas vezes na semana, durante seis horas, no período de abril de 2012 a setembro de 2013. O monitoramento teve auxílio de um binóculo Sumax (20x50S) e máquina fotográfica Nikon (36x), a ordem de monitoramento era alternada para evitar repetições de marés entre os pontos. No campo era registrada a data, as condições do vento e maré, além dos dados a respeito das visualizações dos pequenos cetáceos, sendo que nestes eram destacados o número de indivíduos por grupo, espécie e status comportamental. A maré era consultada diariamente através da tábua de maré e medida por uma régua fixa no porto de Conceição da Barra, próximo ao ponto B. Foi considerado como um grupo aquele em que os indivíduos presentes na área de estudo nadavam próximos uns dos outros, com atividades coordenadas, mas não necessariamente deslocando-se na mesma direção (Mann, 2000). As atividades comportamentais foram divididas em duas categorias como proposto por Azevedo et al. (2009), “eventos” e “estados comportamentais”. Os eventos são aqueles de ocorrência instantânea, já no estado comportamental o indivíduo ou o grupo está engajado em uma atividade de tempo estimável (Altmann, 1974; Martin e Bateson, 1993 e Lehner 1996). O padrão comportamental foi registrado pelo método de coleta Ad. libitum (Altmann 1974), que consiste em registrar todas as atividades executadas pelos indivíduos de um grupo. Os registros foram realizados em períodos de cinco minutos, sendo identificados e divididos 22 em quatro categorias: Locomoção, Alimentação, Atividade Aérea e “Surfing”. Os padrões comportamentais foram distinguidos conforme a tabela abaixo. Tabela 01: Descrição dos padrões comportamentais observados durante o monitoramento de ponto fixo em Conceição da Barra e São Mateus. Padrão Comportamental Descrição Locomoção Quando os indivíduos do grupo mantinham a mesma direção durante todo o período de visualização, e normalmente em linha reta (Azevedo, 2010). Alimentação Quando os golfinhos eram observados forrageando ou mesmo se alimentando. Os animais gastavam mais tempo no local e nadavam em diversas direções em deslocamento rápido na superfície da água. Este comportamento tem variações em suas etapas e pode ser acrescido de emissões de borbulhas, giros, batidas da cauda, sequencia de saltos. A presa pode ser lançada no ar (“bote”) ou na superfície da água (Monteiro-Filho, 1991 e 2008; Domit, 2006; Monteiro et al., 2006; Nascimento, 2006; Azevedo, 2010). Atividade Aérea Quando o animal era observado realizando saltos a partir de uma impulsão, parciais ou totais de um ou mais indivíduos (Neto, 2000; Domit, 2003 e 2006; Nascimento 2006, Monteiro-Filho et al., 2008). Surfing Movimentos repetitivos, sem nenhuma identificação de relação com as presas onde os animais realizavam o movimento deslizando nas cristas das ondas. Segundo Spinelli et al. (2002) e Domit (2006), o surf é executado pelos infantes quando estes utilizam as ondas formadas pelo vento ou por embarcações para realizar saltos ou deslocamentos à superfície. * Apesar de alguns autores classificarem a atividade aérea e o surfing como evento, inserido dentro de um status comportamental, no presente estudo não foi possível estabelecer relação dos mesmos durante a observação, por isso foram classificados separadamente. 23 ANÁLISE DOS DADOS Os dados foram agrupados em uma tabela no Excel para facilitar sua análise (Anexo 1). Para todos os pontos de coleta foram testadas relações entre a presença e tamanho de grupo e as variáveis: nível de maré (alta, média e baixa); tipo de maré (enchente e vazante); variação de maré; mês; estação do ano; status comportamental e tempo máximo. Além disso, as relações foram avaliadas para as diferentes áreas, Conceição da Barra x São Mateus, e por ponto de coleta. Para se avaliar o grau de significância dos resultados, foram empregados testes não paramétricos (Kruskal-Wallis e Mann-Whitney) ao nível de 0,05 de significância (Zar, 1984) do pacote STATISTICA Versão 5 ®. RESULTADOS E DISCUSSÃO No total, foram realizadas 1374 horas de observações, sendo que 750 horas foram para Conceição da Barra e 624 horas para Guriri. Durante o período de monitoramento foram observados 118 grupos de Sotalia guianensis em Conceição da Barra, sendo 103 no ponto A e 15 no ponto B; e 81 grupos em Guriri (Figura 2 e 3). Foto 2: Registro de Sotalia guianensis durante o monitoramento do ponto A em Conceição da Barra. 24 Figura 3: Grupo de Sotalia guianensis registrado na foz do rio São Mateus. No pontos A (foz do rio São Mateus) e no ponto C (praia de Guriri), os golfinhos apresentaram maior número de visualização. Foram avistados 99 grupos de boto-cinza, correspondendo a 79,2% do monitoramento, no ponto A. E 81 grupos, 77,88% , para o ponto C. Não foram evidenciadas diferenças significativas entre estes dois pontos com relação ao tamanho dos grupos sob nenhuma das variáveis avaliadas: estação do ano, tipo, nível e variação de maré. Em ambos os pontos, o tamanho do grupo variou de um a nove indivíduos o que corrobora com a maioria dos trabalhos de descrição da estrutura social do Sotalia guianensis, onde é caracterizada por pequenos grupos de dois a 10 indivíduos (Borobia, 1984; Oliveira et al, 1995; Frizzera et al., 2007), embora em determinadas localidades possa apresentar agregações de até 450 indivíduos (Lodi e Borobia, 2013). A ausência de variação no tamanho dos grupos também foi observada para a espécie na Baía da Guanabara (Azevedo et al., 2005) e na Baía de Sepetiba (Flach et al., 2008). Estudos realizados em algumas regiões do Brasil mostram que alguns indivíduos são residentes, utilizando sempre as mesmas áreas para executar determinadas atividades (Flores, 1999; Santos et al., 2002; Hardt, 2005). Apesar de uma alta frequência de visualizações nos 25 pontos A e C, nesse estudo não é possível afirmar a existência de uma população residente, já que não foi realizada a identificação dos indivíduos. No ponto B, no interior do estuário do Rio São Mateus, os golfinhos foram visualizados em apenas 14,15% dos dias de monitoramento. No entanto, observou-se uma relação significativa da presença e tamanho de grupo quanto ao tipo, o nível e a variação de maré. Os golfinhos utilizaram a região do estuário preferencialmente durante a maré enchente e foram observados em maiores grupos durante a baixa variação de maré (Tabela 1). Apesar de na maioria das visualizações terem sido registrados indivíduos em grupos menores (um ou dois), houve registro de até sete indivíduos por grupo. Tabela 1: “Tamanho de Grupo” e “Status Comportamental” com o tipo e nível de maré, utilizandose o teste não paramétrico de Kruskal-Wallis. Tipo de Maré Nível de Maré Tamanho do grupo Status Comportamental Ponto A Ponto B Ponto C Ponto A Ponto B Ponto C 0,34 0,00* 0,62 0,12 0,00* 0,97 0,13 0,01* 0,26 0,12 0,02* 0,4 *valor de significância de p (p<0,05) Segundo Santos (2010), a distribuição espacial e temporal dos cetáceos está relacionada a diversos fatores abióticos como profundidade e salinidade (Cubero-Pardo, 2007); ciclo de maré (Harzen, 2002; Mendes et al., 2002); características do fundo (Hastie et al., 2003) e fatores bióticos, como a disponibilidade de presas (Bailey e Thompson, 2006; Cubero-Pardo, 2007). Hayes (1999) mostrou a importância das marés na frequência dos golfinhos e em seus movimentos de entrada e saída nos estuários e baías, que pode estar relacionado com a abundância de peixes, além da quantidade de água no local, facilitando a procura de alimento (Oliveira et al., 1995). O presente estudo corrobora essa ideia, apresentando uma variação significativa no interior do estuário quanto ao tipo (enchente) e nível de maré (baixa) tanto em relação ao tamanho dos grupos quanto ao comportamento observado. Testando a relação do status comportamental com as diferentes variáveis avaliadas, verificou-se uma diferença significativa com relação ao tamanho dos grupos em todos os pontos de monitoramento. Apesar de apresentar diferentes padrões para os pontos, foi observado um maior número de indivíduos relacionado ao comportamento de alimentação, seguido pela locomoção. A exceção foi o comportamento de “surfing”, que foi observado em 26 momentos isolados no ponto C, e pode estar relacionado tanto a alimentação quanto a locomoção dos indivíduos (Figura 4). 27 Figura 4: Número de indivíduos por status comportamental em cada ponto de monitoramento. 28 Nesse estudo, o tamanho de grupo variou de acordo com o tipo de categoria comportamental registrada, concordando com os resultados reportados por diversos estudos realizados ao longo do litoral brasileiro (Geise et al., 1999; Geise, 1991; Lodi, 2003). Porém, Especie et al (2007) em um estudo realizado na Baía de Setiba reportaram o comportamento de alimentação em grupos constituídos por número de indivíduos menores, ao contrário do observado em Conceição da Barra e São Mateus. O que pode ser justificado pelo fato do comportamento de alimentação do boto-cinza, desenvolver estratégias de pesca que aumentam a eficiência nas capturas de suas presas variando conforme a estrutura do grupo, número de indivíduos (Monteiro-Filho e Monteiro, 2008). Quando comparado os dados entre os pontos, A e C apresentaram um resultado semelhante quanto à presença de indivíduos, apesar do ponto A apresentar um número de indivíduos por grupo maior com mais frequência, obtendo uma média maior que o ponto C. Já o ponto B, apresentou um pequeno número de presença de indivíduos (Figura 5). Número de Indivíduos por ponto de monitoramento 10 Número de indivíduos 8 6 4 2 0 -2 A B C Média Media±2*SE Desvio padrão Ponto Figura 5: Número de indivíduos por grupo em cada ponto de monitoramento. O tempo máximo de visualização também apresentou uma variação significativa nos diferentes pontos. Apesar das semelhanças entre os pontos A e C, no ponto A, os indivíduos foram visualizados durante um maior intervalo de tempo (0-15 minutos, M=5,37) do que o ponto 29 C (0-10 minutos, M=3,88). Já no ponto B, além dos indivíduos serem visualizados com menor frequência, estes foram visualizados em um intervalo menor, de 0-10 minutos (M=4,46). Quanto ao status comportamental, os pontos apresentaram diferentes padrões de frequência (Figura 6). No ponto A, destacou-se os status de locomoção e alimentação, no entanto, a alimentação foi observada sempre na foz do rio, já a locomoção era observada a uma distância maior do ponto de monitoramento e, na maioria das vezes, na direção da praia de Guriri, São Mateus. No ponto B, por apresentar um baixo número de registros, não houve destaque entre os status de comportamento avistados. E no ponto C, houve maior registro de locomoção quando comparado aos outros status comportamentais. Status Comportamental por ponto Ativ idade Aérea Brincadeiras Status Comportamental Surfing Sem registro Alimentação Locomoção A B C <= 10 (10-19) (19-28) (28-37) (37-46) (46-55) (55-64) (64-73) (73-82) > 82 Ponto Figura 6: Frequência dos status comportamentais em cada ponto de monitoramento. Como pode ser observado, o status comportamental mais registrado ao longo de todo monitoramento foi o de alimentação, o que ficou ainda mais evidente na área de Conceição da Barra (Pontos A e B). Por se tratar de uma região estuarina, tal resultado pode estar relacionado ao aporte de nutrientes e eficiência na captura de suas presas, já que nessa área, foi registrado um número maior de indivíduos por grupo desenvolvendo o comportamento de alimentação. Isso 30 reflete também ao tempo máximo de visualização dos grupos, já que foi observada uma média maior para os pontos A e B, e para o comportamento de alimentação (maior exposição quando em forrageamento e captura de suas presas). Segundo Hayes (1999), o comportamento de pesca e alimentação é bastante complexo quando comparado com os outros status comportamentais, exigindo uma maior organização e tempo de ocorrência. Estratégias alimentares entre populações de pequenos cetáceos podem ser consequências das características oceanográficas e fisiográficas de cada área, atividades antrópicas (adaptação à atividade pesqueira) e principalmente pela concentração, distribuição e a ecologia comportamental dos recursos alimentares nessas áreas (Wedekin et al., 2003). Assim, a alta frequência de registros do status comportamental de alimentação no ponto A, por se tratar da foz do rio São Mateus, pode estar relacionado à concentração de recurso alimentar, visto que é alvo de pesca e captura de peixes por pescadores e turistas. É importante ainda ressaltar que os status comportamentais caracterizados como “surfing” e atividades aéreas podem estar relacionados ao comportamento de alimentação, mas foram separados por não ser possível a identificação de uma relação com a presa no ato do monitoramento. O maior registro para locomoção no ponto C pode estar relacionado à posição do ponto de monitoramento. Já que este se localiza em uma praia extensa entre a foz dos rios São Mateus e Mariricu. Diferente dos pontos A e B, totalmente influenciados pelas características de um estuário. Ainda, foi relacionado o status comportamental por ponto monitorado com o número de indivíduos por grupo e o tempo máximo de visualização (Figura 7). Observou-se que, além dos grupos no ponto A apresentarem um número maior de indivíduos e de tempo máximo, o mesmo acontecia para o status comportamental de alimentação nos três pontos, apesar de ocorrerem casos isolados de locomoção e “surfing” em maiores grupos de indivíduos. 31 A B Figura 7: Número de indivíduos (A) e tempo máximo de visualização (B) por Status comportamental e ponto monitorado. A cor roxa representa a locomoção; a azul,alimentação; a verde, quando não houve registro de presença; vermelho, “surfing”; e cinza, atividade aérea. Segundo Wells et al. (1980), as variações sazonais de ocorrência de cetáceos têm sido atribuídas às mudanças das características físicas do hábitat, resultando em certas áreas mais propícias para proteção, reprodução e alimentação. O uso variado dos padrões do hábitat indica a importância dos locais em que os botos-cinza utilizam diariamente (Lodi, 2003). Este estudo corrobora a ideia de que existe uma relação entre a variação sazonal e a composição e tamanho dos grupos. Alguns estudos relatam essa relação como resposta às flutuações sazonais de habitat e o movimento da presa para várias espécies de odontoceto, além de demonstrar que o Sotalia guianensis apresenta residência e lealdade ao habitat, com movimentos diários em pequena escala, o que não pode ser afirmado ainda para essa área. Felix (2011) relatou a ausência de golfinhos no interior do estuário de Conceição da Barra, visto que este passava por transformações com a construção da orla do Município. Mas, com o fim da obra, o retorno e a utilização deste ambiente pelos cetáceos era incerto. A continuidade do monitoramento na área proporcionou o registro do retorno, mesmo que lento, e a utilização do interior do estuário pela espécie S. guianensis. Não foi possível avaliar o quanto estas obras afetaram estes animais durante seu período de execução, visto que o monitoramento da região não foi realizado anteriormente. No entanto, por ter sido verificado que o estuário é utilizado preferencialmente para alimentação, provavelmente a realização destas obras fez com 32 que os botos-cinza necessitassem procurar outras áreas para suprir esta fonte de recurso não mais utilizada. CONCLUSÕES Os botos-cinza, Sotalia guianensis, voltaram a utilizar o estuário de Conceição da Barra após a finalização das atividades de dragagens; A presença de golfinhos no interior do estuário está associada às marés (enchente e baixa); O estuário é utilizado preferencialmente para alimentação, sendo esta atividade relacionada ao maior número de indivíduos por grupo. 33 REFERÊNCIAS BIBLIOGRÁFICAS ALARCON, D. T. 2006. Interações entre cetáceos e atividades pesqueiras na área proposta para a Reserva Extrativista Marinha de Itacaré (BA). 103p. Dissertação de mestrado em Sistemas Aquáticos Tropicais, Universidade Estadual de Santa Cruz, Ilhéus. ALTMANN, J. 1974.Observational study of behaviour: Sampling methods. Behaviour. v.49, p.227-265. AZEVEDO, A.F.; VIANA, S.C.; OLIVEIRA, A.M.L. e VANSLUYS, M. 2005. Group characteristics of marine tucuxis (Sotalia fluviatilis) (Cetacea: Delphinidae) in Guanabara Bay, south-eastern Brazil. J. Mar. Biol. Ass. U.K. v.85, p.209-212. AZEVEDO, A.F., LAILSON-BRITO, J., DORNELES, P.R., VAN SLUYS, M., CUNHA, H.A. AND FRAGOSO, B.L. 2009. Human-induced injuries to marine tucuxis (Sotalia guianensis) (Cetacea: Delphinidae) in Brazil. Marine Biodiversity Records 2: e22. http://dx.doi.org/10.1017/S1755267208000262. AZEVEDO, N.V.P. 2010. Cetaceans OCCURRENCE and behavioral patterns off the west portuguese coast. 60p. Dissertação de Mestrado em Ecologia Marinha, Universidade de Lisboa, Lisboa. BALLANCE, L.T. 1992. Habitat use patterns and ranges of the bottlenose dolphin in the Gulf of Califórnia, México. Marine Mammal Science. v.8, n.3, p.262-274. BAILEY, H. e THOMPSON, P. 2006. Quantitative analysis of bottlenose dolphin movement patterns and their relationship with foraging. J Anim Ecol. v. 75, p.456-465. BOROBIA, M. 1984. Comportamento e aspectos biológicos dos botos da Baía de Guanabara, Sotalia sp.. 81 p. Monografia de Bacharelado em Ciências Biológicas. Universidade Estadual do Rio de Janeiro, Rio de Janeiro. CITES. CONVETION ON INTERNACIONAL TRADE IN ENDANGERED SPECIES OF WILD FAUNA AND FLORA – Apêndice I. Válidos a partir de: 25 de setembro de 2012. Disponível em: <http://www.cites.org> 34 CMS. CONVENTION ON MIGRATORY SPECIES. Apêndice II of convention on the conservation of migratory species of wild animals. Válidos a partir de 23 de fevereiro de 2012. Disponível em: <http://www.cms.int> CREMER, M.J. 2000. Ecologia e conservação do golfinho Sotalia fluviatilis guianensis (Cetacea: Delphinidae) na Baía de Babitonga, Litoral Norte de Santa Catarina. Dissertação de Mestrado. Universidade Federal de São Carlos, São Carlos, SP. CUBERO-PARDO, P. 2007. Environmental factors governing the distribution of the bottlenose (Tursiops truncatus) and spotted dolphin (Stenella attenuata) in Golfo Dulce, South Pacific, off Costa Rica. Invest Mar. v.35,n.2, p.15-23. ESPECIE, M.A.; NERY, M.F.; SIMÃO, S.M. e PEREIRA, T.C.C.L. 2007. Caracterização dos grupos de Sotalia guianensis (Cetacea, Delphinidae), na Baía de Sepetiba, RJ. In: VIII Congresso de Ecologia do Brasil, 2007. Anais... Caxambu – MG. FLACH, L.; FLACH, PA; CHIARELLO, A.G. 2008. Aspects of behavioral ecology of Sotalia guianensis in Sepetiba Bay, southeast Brazil. Mar Mamm Sci. p:503-515. FÉLIX, G.B.V. 2011. Ocorrência e captura acidental de golfinhos no extremo norte do litoral do Espírito Santo. 2011. 54 p. Dissertação de monografia em Ciências Biológicas Bacharel, Universidade Federal do Espírito Santo – CEUNES. FLORES, P. A. C. 1999. Preliminary results of a photoidentification study of the marine tucuxi Sotalia fluviatilis in southern Brazil. Marine Mammals Science. v:15, p:840-847. FREITAS NETTO, R. 2003. Levantamento das artes de pesca no litoral do estado do Espírito Santo e suas interações com cetáceos. 116 p. Dissertação de mestrado em Biociências e Biotecnologia (Ciências Ambientais), Universidade Estadual do Norte Fluminense, Campos dos Goytacazes. FRIZZERA, F.C.; VASCONCELOS, D.G. e PINHEIRO, H.T. 2007. Avistamento de pequenos cetáceos na foz do Rio Doce, Linhares, ES. In: VIII Congresso de Ecologia do Brasil. Anais... Caxambu – MG. GEISE, L. 1991. Sotalia guianensis (Cetacea, Delphinidae) population in the Guanabara Bay, Rio de Janeiro, Brazil. Mammalia. v:55, n:3, p:371-379. 35 GEISE, L.; GOMES, N.; e CERQUEIRA, R. 1999. Behaviour, habitat use and population size of Sotalia fluviatilis (Gervais, 1853) in the Cananéia estuary region, São Paulo, Brazil. Revista Brasileira de Biologia. v:59, n:2, p:183-194. GRIGG, E. e MARKOWITZ, H. 1997. Habitat use by bottlenose dolphins (Tursiops truncatus) at Turneffe Atoll, Belize. Aquatic Mammals. v:23, n:3, p:163-170. HARDT, F. A. S. 2005. Padrões de residência do golfinho Sotalia guianensis (Cetacea, Delphinidae) na Baía da Babitonga, litoral norte de Santa Catarina, Brasil. 2005. Dissertação de Mestrado. Universidade Federal do Paraná. HARZEN, S. 2002. Use of an eletronic theodolite in the study of movements of the bottlenose dolphin (Tursiops truncatus) in the Sado Estuary, Portugal. Aquat Mamm v:28, n:3, p:251-260. HASTIE, G.N.; WILSON, B; TUFFT, L.H. e THOMPSON, P.M. 2003. Bottlenose dolphins increase breathings synchrony in response to boat traffic. Mar Mamm Sci v:19, n:1, p:74-84. HASTIE, G.D.; WILSON, B.; WILSON, L.J.; PARSONS K.M. e THOMPSON, P.M. 2004. Functional mechanisms underlying cetacean distribution patterns: hotpots for bottlenose dolphins are linked to foraging. Marine Biology. v:144, p. 397-403. HAYES, A. J. S. 1999. Aspectos da atividade comportamental diurna da forma marinha do tucuxi "Sotalia fluviatilis" (Gervais, 1853) (Cetacea-Delphinidae), na Praia de Iracema (Fortaleza - Ceará - Brasil). 1999. Monografia de Licenciatura não-publicada, Universidade do Algarve. Faro, Portugal. INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS (IBAMA). 2001. Plano de ação – Mamíferos Aquáticos do Brasil (Versão II). Brasília: DF. IBGE (Instituto Brasileiro de Geografia e Estatística). Cidades/ Conceição da Barra. Disponível em: <http://www.ibge.gov.br>. Acessado em: 29/01/2013. IBGE (Instituto Brasileiro de Geografia e Estatística). Cidades/ São Mateus. Disponível em: <http://www.ibge.gov.br>. Acessado em: 29/01/2013. 36 IPEMA, INSTITUTO DE PESQUISA DA MATA ATLÂNTICA. 2005. Conservação da Mata Atlântica no Espírito Santo: Cobertura Vegetal e Unidades de Conservação. 152 p. IUCN . INTERNATIONAL UNION FOR THE CONSERVATION OF NATURE. Red list of Threatened Species. Versão 2012.2. Disponível em: <http//www.redlist.org> KARCZMARSKI, L.; COCKCROFT, V.G. e MALACHLAN, A. 2000. Habitat use and preferences of Indo-Pacific humpback dolphins Sousa chinensis in Algoa Bay, South Africa. Marine Mammal Science. v:16, n:1, p:65-79. LODI, L. 2002. Uso de Hábitat e preferência do Boto-Cinza, Sotalia fluviatilis (CETACEA, DELPHINIDAE), na Baía de Paraty, Rio de Janeiro. Dissertação de Mestrado. Universidade Federal Rural do Rio de Janeiro, Rio de Janeiro. LODI, L. 2003. Tamanho e composição de grupo dos botos-cinza, Sotalia guianensis (Van Bénéden, 1864) (Cetacea, Delphinidae), na Baía de Paraty, Rio de Janeiro, Brasil. Atlântica, Rio de Janeiro. v:2, p:135-146. LODI, L. e BOROBIA, M. 2013. Baleias, botos e golfinhos do Brasil: Guia de indentificação. Technical Books. Rio de Janeiro. 479 p. MANN, J. 2000. Unraveling the dynamics of social life, p. 45-64. In: J. MANN; R.C. CONNOR; P.L. TYACK & H. WHITEHEAD (Eds). Cetacean society – field studies of dolphin and whales. Chicago, University Chicago Press, 448p. MENDES, S.; TURRELL, W.; LÜTKEBOHLE, T. e THOMPSON, P. 2002. Influence of the tidal cycle and a tidal intrusion front on the spatio-temporal distribution of coastal bottlenose dolphins. Mar Ecol Prog Ser v:239; p.221-229. MONTEIRO-FILHO, E. L. A. 1991. Comportamento de caça e repertório sonoro do golfinho Sotalia brasiliensis (Cetacea: Delphinidae) na região de Cananéia, Estado de São Paulo. Tese de Doutorado - Instituto de Biociências. Universidade Estadual de Campinas, Campinas. MONTEIRO-FILHO, E.L.A e MONTEIRO, K.D.K.A. 2008. Biologia, Ecologia e Conservação do Boto-Cinza. In: MONTEIRO-FILHO, E.L.A. Comportamento de pesca. Paginas e Letras Editora e Gráfica. São Paulo. p:77-89. 37 OLIVEIRA, J.A.; ÁVILA, F.J.C.; ALVES JÚNIOR, T.T.; FURTADO-NETO, M.A.A. e MONTEIRO-NETO, C. 1995. Monitoramento do boto-cinza, Sotalia fluviatilis (Cetacea, Delphinidae) em Fortaleza, Estado do Ceará, Brasil. Arq. Ciên. Mar. v:29, n:1-2, p:28-35. PIZZORNO, J. L. A.; SICILIANO, S.; e SIMÃO, S. M. 1999. Quando os botos ganham uma identidade. Ciência Hoje, v:25, n:150, p:65-71. ROSSI-SANTOS, M. R. 1997. Estudo quali-quantitativo do comportamento de alimentação do golfinho ou boto-cinza Sotalia fluviatilis Gervais, 1853 (Cetácea, Delphinidae) na área de proteção ambiental de Anhatomirim e Baía Norte de Santa Catarina. Monografia de Bacharelado. Universidade Federal de Santa Catarina. Florianópolis, SC. Brasil. SANTOS, M.C.O.; ROSSO, S.; SANTOS, R.A.; LUCATO, S. H. B.; BASSOI, M. 2002. Insights on small cetacean feeding habits in southeastern Brazil. Aquatic Mammals. v:8, p:38-45. SANTOS, M.S. 2010. Sazonalidade e interação com embarcação do boto-cinza, Sotalia guianensis, (Cetacea: Delphinidae) no Porto do Malhado, Ilhéus, Bahia- Brasil. 72p. Dissertação apresentada ao Programa de Pós-Graduação em Sistemas Aquáticos Tropicais. Universidade Estadual de Santa Cruz. Ilhéus-Bahia. SHANE, S.H.; WELLS, R.S. E WURSIG, B. 1986. Ecology, behavior and social organization of the bottlenose dolphin: a review. Marine Mammal Science. v:2, n:1, p:34-63. SILVA, V. M. F. e BEST, R. C. 1996. Sotalia fluviatilis. Mammalian Species. American Society of Mammalogists. v:27, p:1-17. VALE, C.C. e ROSS, J.L.S. 2011. As transformações morfológicas e fitogeográficas do estuário do rio São Mateus, litoral norte do estado do Espírito Santo, entre 1970 e 2008. Revista do Departamento de Geografia – USP. v: 21, p.03-23. WEDEKIN, L. L.; DAURA-JORGE, F. e SIMÕES-LOPES, P. C. 2003. O boto-cinza, Sotalia guianensis (CETACEA: DELPHINIDAE), na costa sul e sudeste do Brasil: conhecimento atual e perspectivas futuras para o estudo da estrutura populacional e espacial. Resumo expandido apresentado no II Congresso Brasileiro de Mastozoologia. Belo Horizonte. 38 WELLS, R.S.; IRVINE, A.B. e SCOTT, M.D. 1980. The social ecology of inshore odontocetes. In: L. M. HERMAN (ed.). Cetacean behavior : Mechanisms and functions. John Wiley & Sons, New York, Chap. 6 p: 263 - 317. ZAR, J.H. 1984. Biostatistical Analysis. 2ª Edição. New Jersey: Prentice Hall. 39 Anexo 1 – Diferença sazonal entre os pontos da variação, nível e tipo de maré e número de indivíduos. Onde a variação da maré corresponde a variação sofrida ao longo do dia de monitoramento conforme a Tábua de maré (marmil.br); o tipo como vazante ou enchente e o nível como alta, média e baixa em relação a variação da maré durante o monitoramento. Estação Ponto A Variação Tipo Nível Ind. Estação Ponto B Variação Tipo Nível Ind. Estação Ponto C Variação Tipo Nível Ind. Outono/12 1,2 vazante alta 2 Outono/12 1,2 vazante média 0 Outono/12 1,6 vazante média 0 Outono/12 0,7 vazante alta 4 Outono/12 0,7 vazante média 0 Outono/12 1,1 vazante alta 1 Outono/12 1,2 vazante baixa 3 Outono/12 1,2 enchente baixa 1 Outono/12 1,1 enchente baixa 3 Outono/12 1,2 enchente média 2 Outono/12 1,2 enchente alta 0 Outono/12 1 vazante média 0 Outono/12 1,2 enchente alta 1 Outono/12 1,2 vazante alta 0 Outono/12 1,4 enchente baixa 1 Outono/12 1,1 vazante média 0 Outono/12 1,1 vazante baixa 0 Outono/12 0,8 enchente baixa 2 Outono/12 1,4 enchente média 3 Outono/12 1,4 enchente alta 0 Outono/12 1,3 vazante baixa 6 Outono/12 1,4 enchente média 5 Outono/12 1,4 enchente alta 0 Outono/12 0,8 vazante alta 1 Outono/12 1,1 vazante média 5 Outono/12 1,1 vazante baixa 0 Outono/12 0,9 enchente alta 1 Outono/12 1,2 enchente alta 7 Outono/12 1,2 vazante alta 0 Inverno/12 1 vazante baixa 0 Outono/12 1,2 enchente alta 1 Outono/12 1,2 vazante alta 0 Inverno/12 1,1 vazante alta 2 Outono/12 1,2 enchente alta 6 Outono/12 1,2 vazante alta 0 Inverno/12 1,4 vazante média 2 Outono/12 1,2 enchente alta 3 Outono/12 1,2 vazante alta 0 Inverno/12 0,8 enchente alta 3 Outono/12 1,3 vazante média 0 Outono/12 1,3 vazante baixa 0 Inverno/12 1,2 vazante média 2 Outono/12 0,9 enchente média 1 Outono/12 0,9 enchente alta Inverno/12 1,4 vazante alta 0 Inverno/12 1,3 vazante baixa 4 Inverno/12 1,3 enchente baixa 1 0 Inverno/12 1,5 vazante média 1 Inverno/12 1,3 enchente baixa 1 Inverno/12 1,3 enchente alta 0 Inverno/12 1 vazante alta 0 Inverno/12 1,3 vazante média 1 Inverno/12 0,5 vazante baixa 0 Inverno/12 1 vazante baixa 7 Inverno/12 0,5 enchente alta 6 Inverno/12 1,4 enchente alta 0 Inverno/12 1 vazante baixa 3 Inverno/12 0,5 vazante alta 2 Inverno/12 0,7 vazante baixa 0 Inverno/12 1,4 vazante alta 9 Inverno/12 1,4 vazante baixa 1 Inverno/12 1,5 enchente alta 0 Inverno/12 1,1 vazante baixa 0 Inverno/12 1,4 enchente baixa 1 Inverno/12 0,6 enchente média 3 Inverno/12 1,4 vazante média 2 Inverno/12 1,4 enchente média 1 Inverno/12 1,4 enchente alta 0 Inverno/12 1,5 vazante média 1 Inverno/12 0,7 enchente alta 1 Inverno/12 0,9 enchente baixa 7 Primavera/12 1,3 vazante baixa 1 40 Inverno/12 0,7 vazante média 6 Inverno/12 1,4 enchente alta 0 Primavera/12 1,2 vazante média 0 Inverno/12 1,5 enchente baixa 1 Inverno/12 1 enchente média 0 Primavera/12 0,9 vazante alta 0 Inverno/12 0,6 vazante alta 2 Inverno/12 0,7 enchente baixa 0 Primavera/12 0,5 enchente alta 2 Inverno/12 0,6 vazante alta 9 Inverno/12 0,6 vazante alta 0 Primavera/12 0,9 enchente baixa 0 Inverno/12 1,4 enchente média 2 Inverno/12 1,4 enchente média 0 Primavera/12 1,6 vazante média 1 Inverno/12 0,9 vazante média 4 Inverno/12 0,9 vazante média 0 Primavera/12 1,1 vazante alta 0 Inverno/12 1,4 enchente média 2 Inverno/12 1,4 enchente média 0 Primavera/12 0,6 enchente alta 4 Inverno/12 1 vazante média 0 Inverno/12 1 vazante média 0 Primavera/12 1,1 enchente baixa 3 Inverno/12 0,7 enchente baixa 1 Inverno/12 0,7 enchente baixa Primavera/12 0,8 enchente alta 0 Primavera/12 1,4 enchente baixa 0 Primavera/12 1,4 vazante alta 0 0 Primavera/12 0,8 enchente média 0 Primavera/12 1,3 enchente baixa 2 Primavera/12 1,3 enchente alta 0 Primavera/12 0,8 enchente alta 2 Primavera/12 0,9 vazante baixa 1 Primavera/12 0,9 enchente baixa 0 Primavera/12 0,7 enchente baixa 0 Primavera/12 0,6 vazante alta 0 Primavera/12 0,6 vazante baixa 0 Primavera/12 1 vazante baixa 1 Primavera/12 1,3 enchente alta 2 Primavera/12 1,3 vazante alta 0 Primavera/12 0,8 vazante alta 4 Primavera/12 1,6 enchente média 4 Primavera/12 1,6 enchente alta 5 Primavera/12 0,8 enchente alta 2 Primavera/12 1,1 vazante média 7 Primavera/12 1,1 enchente média 2 Primavera/12 1,1 vazante baixa 2 Primavera/12 0,7 enchente média 0 Primavera/12 0,7 vazante média 0 Primavera/12 1,4 vazante baixa 0 Primavera/12 1,1 enchente média 3 Primavera/12 1,1 vazante alta 0 Primavera/12 0,8 vazante alta 5 Primavera/12 0,6 vazante alta 0 Primavera/12 0,6 vazante baixa 0 Primavera/12 0,7 enchente média 4 Primavera/12 1 enchente alta 5 Primavera/12 1 vazante média 0 Verão/13 0,8 enchente baixa 0 Primavera/12 1,5 enchente média 2 Primavera/12 1,5 vazante alta 4 Verão/13 1 enchente baixa 2 Primavera/12 1,3 enchente baixa 2 Primavera/12 1,3 enchente alta 0 Verão/13 1,5 vazante alta 0 Primavera/12 0,8 vazante média 1 Primavera/12 0,8 enchente baixa 0 Verão/13 0,9 vazante alta 1 Primavera/12 0,8 vazante alta 7 Primavera/12 0,7 vazante baixa 0 Verão/13 0,5 enchente baixa 1 Primavera/12 0,7 enchente alta 0 Primavera/12 1 enchente alta 2 Verão/13 1 vazante baixa 0 Primavera/12 1 vazante baixa 5 Primavera/12 0,7 vazante baixa 0 Verão/13 0,6 enchente média 2 Primavera/12 0,7 vazante alta 3 Primavera/12 1,3 vazante média 0 Verão/13 0,7 enchente baixa 1 Primavera/12 1,3 enchente média 3 Primavera/12 1,5 enchente alta 0 Verão/13 0,4 enchente média 3 Primavera/12 1,5 enchente baixa 0 Primavera/12 1 enchente média 3 Verão/13 0,6 enchente baixa 0 41 Primavera/12 1 vazante média 5 Primavera/12 1 vazante baixa 0 Verão/13 1,5 vazante média 3 Verão/12 0,5 vazante média 0 Verão/12 0,5 vazante baixa 0 Verão/13 1,6 vazante média 1 Verão/13 1 enchente média 0 Verão/13 1 vazante média 0 Verão/13 0,7 enchente alta 5 Verão/13 1,5 enchente média 0 Verão/13 1,5 enchente alta 0 Verão/13 0,6 enchente baixa 2 Verão/13 1,3 vazante média 3 Verão/13 1,3 enchente média 0 Verão/13 1,5 vazante média 1 Verão/13 1,3 vazante média 2 Verão/13 0,7 enchente média 0 Verão/13 1,4 vazante média 1 Verão/13 0,7 vazante média 4 Verão/13 0,8 vazante média 0 Verão/13 0,7 vazante alta 0 Verão/13 0,8 enchente alta 7 Verão/13 1,5 enchente alta 5 Verão/13 0,5 enchente média 0 Verão/13 1,5 enchente média 1 Verão/13 0,7 vazante média 0 Outono/13 1,5 vazante média 3 Verão/13 0,7 enchente média 0 Verão/13 1,4 vazante alta 0 Outono/13 1,6 vazante média 1 Verão/13 1,4 enchente baixa 0 Verão/13 0,5 vazante baixa 0 Outono/13 0,9 vazante alta 1 Verão/13 0,5 vazante alta 3 Verão/13 1,1 vazante alta 0 Outono/13 0,6 enchente média 3 Verão/13 1,1 enchente alta 5 Verão/13 1,6 enchente alta 2 Outono/13 1,3 vazante baixa 2 Verão/13 1,6 enchente média 1 Verão/13 0,5 vazante média 0 Outono/13 1,4 vazante média 1 Verão/13 1,6 enchente média 3 Verão/13 1,2 vazante alta 0 Outono/13 1 vazante alta 5 Verão/13 0,5 vazante alta 1 Verão/13 1,5 enchente média 0 Outono/13 0,7 enchente alta 1 Verão/13 1,2 enchente alta 4 Verão/13 1,2 enchente alta 4 Outono/13 1,2 vazante baixa 1 Verão/13 1,5 enchente baixa 0 Verão/13 0,5 enchente baixa 0 Outono/13 1,5 vazante média 1 Verão/13 1,2 enchente média 4 Verão/13 1,2 enchente alta 1 Outono/13 1,2 vazante alta 2 Verão/13 1,2 enchente média 1 Verão/13 1,2 enchente alta 1 Outono/13 0,8 enchente alta 1 Verão/13 0,5 vazante média 3 Verão/13 0,5 vazante baixa 0 Outono/13 1,1 vazante baixa 1 Outono/13 0,8 enchente alta 0 Outono/13 0,8 vazante média 0 Outono/13 1,2 vazante média 1 Outono/13 1,5 enchente média 5 Outono/13 1,5 vazante média 0 Outono/13 1,1 vazante média 0 Outono/13 1,3 enchente baixa 2 Outono/13 1,3 enchente alta 1 Outono/13 0,9 vazante alta 3 Outono/13 1,3 enchente média 1 Outono/13 0,7 enchente baixa 0 Outono/13 0,9 enchente baixa 2 Outono/13 1,3 enchente média 5 Outono/13 0,9 vazante alta 0 Outono/13 0,7 vazante média 1 Outono/13 0,7 vazante média 1 Outono/13 1,4 enchente alta 0 Outono/13 1,1 vazante alta 1 Outono/13 0,9 enchente alta 3 Outono/13 1,2 enchente média 0 Inverno/13 1,5 vazante média 2 Outono/13 1,4 enchente baixa 0 Outono/13 0,7 enchente baixa 0 Inverno/13 1,4 vazante alta 1 42 Outono/13 1,2 enchente baixa 0 Outono/13 0,7 vazante baixa 0 Inverno/13 0,6 enchente média 0 Outono/13 0,7 vazante média 1 Outono/13 1,3 vazante média 0 Inverno/13 0,9 enchente baixa 3 Outono/13 0,7 enchente alta 4 Outono/13 1,5 vazante média 2 Inverno/13 1,3 vazante média 2 Outono/13 1,3 vazante média 1 Outono/13 1,1 vazante baixa 0 Inverno/13 1,3 vazante média 2 Outono/13 1,5 vazante média 1 Outono/13 1,3 vazante média 0 Inverno/13 1,4 vazante média 1 Outono/13 1,1 vazante baixa 1 Outono/13 1,1 vazante alta 0 Inverno/13 1,5 vazante alta 1 Outono/13 1,1 vazante baixa 3 Outono/13 0,7 enchente alta 0 Inverno/13 1,2 vazante média 1 Outono/13 1,3 vazante média 0 Outono/13 1,1 enchente baixa 0 Inverno/13 1,4 vazante média 1 Outono/13 1,1 vazante alta 5 Outono/13 1,5 vazante média 1 Inverno/13 1 vazante alta 0 Outono/13 0,7 enchente alta 0 Outono/13 1,3 vazante alta 0 Inverno/13 0,6 enchente média 1 Outono/13 1,1 enchente baixa 0 Outono/13 0,8 enchente alta 0 Inverno/13 1,4 vazante baixa 3 Outono/13 1,5 vazante média 1 Outono/13 0,9 vazante média 0 Inverno/13 1,5 vazante média 2 Outono/13 1,3 vazante alta 2 Outono/13 1,3 enchente alta 0 Inverno/13 0,9 vazante alta 1 Outono/13 0,8 enchente alta 2 Outono/13 1,5 enchente baixa 0 Inverno/13 0,5 enchente alta 1 Outono/13 0,9 vazante alta 0 Outono/13 0,9 enchente baixa 0 Inverno/13 1,1 vazante baixa 1 Inverno/13 1,3 enchente média 1 Inverno/13 0,6 vazante alta 0 Inverno/13 1,4 vazante média 1 Inverno/13 1,5 enchente baixa 3 Inverno/13 1 enchente alta 0 Inverno/13 1,2 vazante alta 1 Inverno/13 0,9 vazante média 6 Inverno/13 1,3 enchente média 0 Inverno/13 0,9 enchente alta 2 Inverno/13 0,6 vazante alta 1 Inverno/13 1,3 enchente baixa 0 Inverno/13 1,2 enchente baixa 0 Inverno/13 1 enchente média 5 Inverno/13 0,7 vazante média 0 Inverno/13 1,5 vazante média 2 Inverno/13 1,3 enchente baixa 3 Inverno/13 1 vazante alta 0 Primavera/13 1,2 vazante alta 2 Inverno/13 1,3 vazante baixa 1 Inverno/13 1,5 enchente alta 1 Primavera/13 0,6 vazante alta 2 Inverno/13 0,7 vazante alta 2 Inverno/13 1,3 enchente baixa 0 Inverno/13 1 enchente alta 2 Inverno/13 1,3 enchente baixa 0 Inverno/13 1,5 enchente baixa 0 Inverno/13 1,5 enchente média 0 Inverno/13 1,3 vazante baixa 4 Inverno/13 0,8 vazante baixa 0 Inverno/13 1,3 enchente baixa 2 Inverno/13 0,7 vazante alta 0 Inverno/13 1,5 vazante baixa 1 Inverno/13 1,5 enchente alta 0 Inverno/13 0,8 vazante média 0 Inverno/13 1,5 enchente média 1 43 Inverno/13 0,7 enchente alta 5 Inverno/13 0,8 enchente baixa 0 Inverno/13 1,5 enchente baixa 2 Inverno/13 0,5 vazante média 0 Inverno/13 1,5 enchente baixa 3 Inverno/13 1,3 enchente alta 0 Inverno/13 0,8 vazante média 0 Inverno/13 1,5 enchente média 0 Inverno/13 0,5 enchente alta 1 Inverno/13 1 enchente baixa 0 Inverno/13 1,3 enchente baixa 5 Inverno/13 0,6 vazante média 0 Inverno/13 1,3 enchente baixa 2 Inverno/13 1,3 vazante alta 0 Inverno/13 1,5 enchente baixa 5 Inverno/13 1,5 enchente média 0 Inverno/13 1 vazante baixa 1 Inverno/13 1 vazante baixa 0 Inverno/13 0,6 vazante alta 1 Inverno/13 0,6 vazante alta 1 Inverno/13 1,3 enchente média 2 Inverno/13 1,3 enchente média 0 Inverno/13 1,5 enchente média 0 Inverno/13 1,5 enchente média 0 Primavera/13 1 vazante baixa 2 Primavera/13 1 enchente baixa 0 Primavera/13 0,5 vazante média 1 Primavera/13 0,5 vazante baixa 0 44 CAPÍTULO 2 NOVAS INFORMAÇÕES SOBRE A INTERAÇÃO ENTRE A PESCA E OS GOLFINHOS NO LITORAL NORTE DO ESPÍRITO SANTO FÉLIX, GEORGIA DE BRITO VIDAL¹*; BARBOSA, LUPÉRCIO ARAÚJO²; FARRO, ANA PAULA CAZERTA¹ ¹Universidade Federal do Espírito Santo – UFES (CEUNES) Rodovia BR 101 Norte, KM 60, Litorâneo, São Mateus – ES. CEP: 29932-540 ²Instituto ORCA (Organização Consciência Ambiental) Avenida São Paulo, 23, Praia da Costa, Vila Velha – ES. CEP: 29101-315 *E-mail: [email protected] 45 RESUMO A captura acidental apresenta uma série de ameaças às populações, principalmente aos odontocetos de pequeno porte, tornando-se assim um dos principais problemas de manejo pesqueiro. Os objetivos deste estudo foi registrar as espécies de golfinhos encalhados no litoral norte do Espírito Santo, verificando indícios da interação da pesca com os pequenos cetáceos na região. Foram registrados durante o período de agosto de 2010 a outubro de 2013, 29 encalhes de pequenos cetáceos, sendo eles nove em Conceição da Barra e 20 em São Mateus. Dentre os encalhes registrados, 25 foram da espécie Sotalia guianensis (86 %), três Pontoporia blainvillei (10 %) e um Peponocephala electra (4%). Quando comparados os registros de encalhes de pequenos cetáceos ao longo dos meses coletados, os dados apresentaram uma variação significativa (p < 0,05). Observou-se que os meses do verão apresentaram os maiores índices de encalhes, provavelmente devido à intensificação da pesca na região com o turismo. Com relação aos possíveis fatores que levaram ao encalhe destes animais, dos 29 registros, oito possuíam marcas de artefatos de pesca visíveis, em seis deles não foi possível o reconhecimento das marcas devido ao grau avançado de decomposição e 15 não apresentavam marcas visíveis de artefatos pesqueiros. Com esse estudo foram encontrados indícios de interação entre cetáceo e a atividade pesqueira artesanal na região norte do Espírito Santo, e que esta interação pode ser a responsável por um número expressivo de mortes e encalhes destes animais no litoral. O monitoramento e estudos em longo prazo são sugeridos a fim de ampliar os registros de encalhes e melhor caracterizar e/ou identificar os impactos pesqueiros sobre a população de pequenos cetáceos no Espírito Santo. Palavra-chave: captura acidental, encalhes, golfinhos, pesca. 46 ABSTRACT The bycatch is considered one of the main threats to small cetaceans. The objective of this study was to record the species of dolphins stranded on the northern coast of Espírito Santo verifying marks of the interaction of fisheries with small cetaceans in that region. Were recorded, during the period of August 2010 to October 2013, 29 strandings of small cetaceans, being them nine in Conceição da Barra and 20 in São Mateus. Among the registered strandings, 25 were of the species Sotalia guianensis (86%), Pontoporia blainvillei three (10%) and a Peponocephala electra (4%). When compared the records of stranding over the months, the data showed a significant values (p < 0.05) for summer periods. This result probably is due to the intensification of fishing in the region due to tourism. In case of the possible factors that cause the stranding, of the 29 records, eight had visible marks of fishing artifacts, six of them it was not possible to recognize brands due to the advanced degree of decomposition and 15 didn’t show visible marks of fishing artifacts. With this study, it was found marks of interaction between species and artisanal fishing activity in the northern of the Espírito Santo and this interaction may be responsible for a significant amount of death and strandings of these animals along the coast. Monitoring and studies a long-term are suggested to increase the records of stranding and better to characterize and to identify the fishing impacts of antropic actions on the population of small cetaceans in the Espírito Santo. Keywords: Bycatch, dolphins, fishing, strandings. 47 INTRODUÇÃO A pesca é uma atividade comercial praticada ao longo de todo litoral brasileiro, sendo que a pesca artesanal contribui com cerca de 60% do pescado nacional em águas interiores e costeiras (Paiva, 1997). A pesca artesanal pode ser definida como aquela em que ocorre captura e desembarque de diferentes espécies aquáticas, onde os pescadores trabalham sozinhos ou utiliza-se da mão de obra familiar ou não assalariada; exploram ambientes localizados próximos à costa, onde a embarcação e aparelhagem utilizadas possuem pouca autonomia e sua produção é total ou parcialmente destinada ao mercado (Clauzet et al., 2005). Com a crescente exploração dos recursos marinhos, a utilização de métodos tradicionais e novas tecnologias de pesca e o aumento do número embarcações, a captura acidental torna-se uma das principais ameaças aos cetáceos, principalmente os de pequeno porte (Silva, 2005). A captura acidental é definida como a captura de espécies não alvo ou mesmo de indivíduos da mesma espécie, mas com tamanho, classe ou idade não desejados. Os espécimes capturados incluem organismos inicialmente saudáveis que são liberados com ferimentos ou mortos (Lewison et al., 2004). Este fator é um dos principais problemas enfrentados quando se deseja um manejo pesqueiro já que ecologicamente essas capturas modificam a biodiversidade com a remoção de animais de topo de cadeia, alterações nos estoques populacionais e a transferência de biomassa na cadeia trófica (Hall et al., 2000). Quando se trata de estudos envolvendo cetáceos, uma das importantes fontes de informações sobre suas populações são indivíduos encontrados encalhados. Tais encalhes podem ocorrer por um fator natural ou antrópico. Considera-se um animal encalhado quando este foi transportado pelas correntes e depositado nas areias das praias doente, ferido ou morto (Geraci et al., 2005). As análises provenientes de tecidos de cetáceos encalhados tornaram-se muito utilizadas nas últimas décadas devido à dificuldade de encontros com estes animais em seu ambiente natural. Tal método considerado não invasivo permite determinar diversas características do animal, como: parâmetros populacionais, diversidade genética, ecologia reprodutiva, faixas etárias, ecologia alimentar, morfologia, entre outros. Desta forma, os encalhes podem proporcionar a identificação de possíveis ameaças às quais os cetáceos estão suscetíveis (Leeney et al., 2008). Um exemplo seria a interação destes animais com a pesca que pode ter sua ocorrência identificada nas carcaças, quando estas se encontram em estado de decomposição inicial, através de diversas características como marcas de rede e cortes no dorso, além da 48 combinação de hemorragias internas, fluídos e coloração azulada na traqueia e estômago cheio (Osinga et al., 2008). Em muitos municípios do estado do Espírito Santo a pesca é a principal atividade econômica. Estudos realizados na região destacaram portos de Regência, Barra do Itapemirim e Piúma como potenciais áreas de risco para cetáceos devido à grande variedade de artefatos de pesca utilizados e o expressivo número de embarcações sediadas (Freitas Netto e Di Beneditto, 2008). No município de Conceição da Barra, a pesca sofreu um grande declínio devido a diversos fatores como: o assoreamento dos rios, a pesca predatória, destruição dos ecossistemas, falta de fiscalização, entre outros (Garcia-Prado e Freitas, 2008). Hoje, a pesca é responsável por 16% da economia do município (Herbst, 2010). Ainda em Conceição da Barra, estudos recentes registraram um maior número de encalhes de pequenos cetáceos durante o verão, quando se intensificam as atividades pesqueiras por conta da alta do turismo; além de ser confirmada a utilização de cetáceos capturados acidentalmente para alimentação humana e /ou para iscas (Felix, 2011). Freitas Netto e Di Beneditto (2008) ao registrar as interações entre a atividade pesqueira e os cetáceos na costa do Espírito Santo, destacaram a toninha (Pontoporia blainvillei) e o botocinza (Sotalia guianensis) como os mais susceptíveis com a interação com a pesca devida sua distribuição próxima à costa. Quando se analisa o atual status de conservação das espécies, Sotalia guianensis é classificada como espécie insuficientemente conhecida na Lista Vermelha de Animais Ameaçados da União Internacional para Conservação da Natureza e dos Recursos Naturais (IUCN, 2012); como espécie ameaçada de extinção no Apêndice I da Convenção sobre o Comércio Internacional das Espécies da Flora e da Fauna Selvagens em Perigo de Extinção (CITES, 2012); e com deficiência de dados no Plano de Ação do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis para Mamíferos Aquáticos do Brasil (IBAMA, 2001). Já P. blainvillei é classificada como Vulnerável com um alto risco de extinção natureza na Lista Vermelha de Animais Ameaçados da União Internacional para Conservação da Natureza e dos Recursos Naturais (IUCN, 2012); como espécie ameaçada de extinção no Apêndice I da Convenção sobre o Comércio Internacional das Espécies da Flora e da Fauna Selvagens em Perigo de Extinção (CITES, 2012); e como vulnerável no Plano de Ação do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis para Mamíferos Aquáticos do Brasil (IBAMA, 2001). Além disso, esta classificada entre as espécies sob maior pressão antrópica em águas jurisdicionais brasileiras (IBAMA, 2001). 49 Levando-se em consideração o impacto causado pelas capturas acidentais aos cetáceos e os frequentes registros de encalhe no litoral norte do Espírito Santo e o atual status de conservação das espécies mais registradas no estado, estudos são necessários na região para melhor caracterização do problema e futuros diagnósticos do status de conservação das populações de pequenos cetáceos ali existentes. O presente estudo teve como objetivo principal registrar a existência de indícios de interação da pesca com espécies de golfinhos no litoral norte do Espírito Santo. MATERIAL E MÉTODOS ÁREA DE ESTUDO O estudo foi realizado no extremo norte do estado do Espírito Santo. No litoral dos municípios de Conceição da Barra e São Mateus (Figura 1). O estado do Espírito Santo é caracterizado por um clima tropical, quente e úmido, possuindo o período chuvoso durante o verão, onde recebe aporte de chuvas tropicais. A estação seca se dá entre o período de outono e inverno, onde podem ocorrer precipitações frontais de descargas devidas à chegada de frentes frias vindas de sul (Martin et al., 1996). Tanto em frequência quanto em intensidade, o regime de ventos na costa capixaba é dominado pelos derivados dos quadrantes leste-nordeste e sudeste, respectivamente. Sendo relacionados aos alísios os de quadrante leste-nordeste, nos quais se sobrepõem durante a maior parte do ano, enquanto os de quadrante sudeste estão associados às massas polares oriundas de sul que atingindo a costa do estado periodicamente (Albino, 1999; Albino et al., 2001). Os sistemas de ventos conduzem o comportamento das ondas, as quais vêm de dois âmbitos principais: Nordeste (NE) – Leste (E), predominante na maior parte do ano, e o Sudeste (SE) – Leste (E), ondas mais energéticas. As ondas possuem uma altura significativa de 0,6 a 0,9 m aproximadamente, sendo raras as ocorrências de ondas superiores a 1,5 m. Quanto ao período, as ondas apresentam períodos de 5 a 6,5s, podendo atingir um máximo de 9,5s (Albino, 1999). O litoral do estado do Espírito Santo apresenta marés semidiurnas, com período de aproximadamente 12 horas e amplitudes variando de 1,10 a 1,50 m, condizendo este litoral num regime de micromaré (< 2m) (DHN, 2014). Quanto aos aspectos geomorfológicos, a costa do estado apresenta afloramentos e promontórios cristalinos, tabuleiros da Formação Barreiras e planícies costeiras, que associadas à presença de grandes bacias hidrográficas ou mesmo desembocaduras de pequenos rios, podem influenciar na configuração da paisagem do litoral (Ortiz, 2010). 50 O município de Conceição da Barra possui uma área de 1.187,766 km², tem sua posição marcada pelas coordenadas 18º53’56”S de latitude e 39º43’56”W de longitude (IBGE, 2013). Já o município de São Mateus possui uma área de 2.338,726 km² tem sua posição marcada pelas coordenadas 18º42’58”S de latitude e 39º51’21”W de longitude (IBGE, 2013). O litoral da área de estudo é caracterizado por uma plataforma com largura média de 230 km (Asmus et al., 1971) e aproximadamente 72 km de extensão, apresentando uma costa caracterizada por planícies costeiras estreitas associadas às desembocaduras dos rios Itaúnas e São Mateus. Figura 01: Área de estudo evidenciando os pontos de encalhes dos cetáceos no litoral no norte do estado do Espírito Santo. Pontos rosas: Pontoporia blainvillei; Pontos verdes: Sotalia guianensis e Ponto azul: Peponocephala electra. 51 COLETA DE DADOS Monitoramentos são realizados diariamente pelo Projeto Tamar e o CTA - Meio Ambiente nas praias de Conceição da Barra e São Mateus. Durante o estudo sempre que os encalhes foram registrados, um profissional da ONG ou da Empresa entrava em contato conosco para que fossem realizadas visitas ao local para obtenção de dados. Durante a visita ao local de cada encalhe foram coletados os seguintes dados: data, biometria do animal, localização exata com GPS, identificação da espécie, sexo e maturidade sexual. Além de verificar a existência de marcas de aparatos de pesca, obter registros fotográficos e coleta de material biológico para análises futuras. Os dados de encalhes foram complementados pela Organização Consciência Ambiental (Instituto ORCA). O ORCA é um dos órgãos que realizam o atendimento a cetáceos encalhados nas praias do Espírito Santo, bem como, que auxiliam na destinação desses animais mortos. De todos os dados registrados, 18 foram coletados nas praias e 11 foram cedidos pelo Instituto ORCA. Confirmações a respeito da maturidade sexual foram obtidas após a realização de necrópsias, realizadas pelo Instituto ORCA, ou com base na literatura científica. Para a espécie Sotalia guianensis machos com comprimentos totais entre 170 e 175 cm e fêmeas com comprimentos totais entre 164 e 169 cm foram considerados maturos sexualmente (Rosas e Monteiro-Filho, 2002). Para Pontoporia blainvillei foram considerados maturos machos com comprimentos totais 120 a 150 cm e fêmeas com comprimentos totais entre 130 a 170 cm. Já para Pepocephala electra foram considerados maturos indivíduos com comprimento total de 210 a 260 cm (Lodi e Borobia, 2013). ANÁLISE DOS DADOS Os dados foram reunidos em uma tabela e analisados durante os meses e estação do ano levando-se em consideração espécie registrada, sexo, a biometria (comprimento total), e maturidade (infante/juvenil e adulto) (Tabela 01). Para se avaliar o grau de significância dos resultados, foi empregado o teste não paramétrico de Mann-Whitney ao nível de 0,05 de significância (Zar, 1984) do pacote STATISTICA Versão 5 ®. RESULTADOS E DISCUSSÃO Vinte e nove encalhes de pequenos cetáceos foram registrados durante o período de agosto de 2010 a outubro de 2013 ao longo do litoral norte do Espírito Santo, sendo eles nove em 52 Conceição da Barra e 20 em São Mateus (Figura 1). Dentre os encalhes registrados, 25 eram da espécie Sotalia guianensis (86 %), três da Pontoporia blainvillei (10 %) e uma Peponocephala electra (4%) (Tabela 01). Tabela 01: Dados de Encalhes de pequenos cetáceos no período de Agosto de 2010 a Outubro de 2013 Ano 2010 2010 2010 2011 2011 2011 2011 2011 2011 2011 2011 2011 2011 2011 2012 2012 2012 2012 2012 2012 2012 2013 2013 2013 2013 2013 2013 2013 Biometria Maturidade (CT) Infanto/juvenil 25/ago Praia de Guriri - São Mateus Sotalia guianensis fêmea 1,26 DD 08/nov Praia de Guriri - São Mateus Sotalia guianensis DD _ DD 29/dez Praia de Guriri - São Mateus Pontoporia blainvillei DD _ DD 03/jan Praia de Guriri - São Mateus Pontoporia blainvillei DD _ Infanto/juvenil 11/jan Praia de Guriri - São Mateus Sotalia guianensis Macho 1,54 DD 17/jan Praia de Guriri - São Mateus Sotalia guianensis DD _ DD 24/fev Praia de Guriri - São Mateus Sotalia guianensis DD _ Infanto/juvenil 18/abr Praia de Guriri - São Mateus Pontoporia blainvillei Macho 0,6 Adulto 24/abr Campo Grande - São Mateus Peponocephala electra fêmea 2,5 DD 12/ago Itaúnas - Conceição da Barra Sotalia guianensis DD _ DD 17/set Itaúnas - Conceição da Barra Sotalia guianensis DD _ DD 21/out Praia da Bugia - Conceição da Barra Sotalia guianensis DD _ DD 23/out Itaúnas - Conceição da Barra Sotalia guianensis DD _ Adulto 03/dez Praia de Guriri - São Mateus Sotalia guianensis Macho 1,8 1,92 Adulto 09/jan Praia de Guriri - São Mateus Sotalia guianensis DD 1,88 Adulto 04/out Praia de Guriri - São Mateus Sotalia guianensis DD _ DD 12/nov Praia da Bugia - Conceição da Barra Sotalia guianensis DD 1,91 Adulto 19/nov Praia de Guriri - São Mateus Sotalia guianensis macho 1,79 Adulto 19/nov Praia de Guriri - São Mateus Sotalia guianensis macho 1,77 Adulto 19/nov Praia de Guriri - São Mateus Sotalia guianensis macho 1,66 Adulto 19/nov Praia de Guriri - São Mateus Sotalia guianensis femea _ DD 08/fev Praia Dois - Conceição da Barra Sotalia guianensis DD _ DD 21/fev Praia de Guriri - São Mateus Sotalia guianensis DD 1,55 Infanto/juvenil 17/abr Praia de Guriri - São Mateus Sotalia guianensis DD 1,6 Infanto/juvenil 05/mai Praia de Guriri - São Mateus Sotalia guianensis femea 1,91 Adulto 29/jun Foz do Rio - Conceição da Barra Sotalia guianensis macho 0,915 Infanto/juvenil 05/ago Praia de Guriri - São Mateus Sotalia guianensis DD _ DD 05/out Praia de Guriri - São Mateus Sotalia guianensis DD *CT (Comprimento Total): Comprimento desde o extremo da maxila até a reentrância central da cauda Data Local Espécie Sexo A distribuição dos encalhes na área monitorada pode estar relacionada a diversos fatores de influência como a topografia do fundo, vento, correntes oceânicas, ressurgências e eventos sazonais (Leeney et al., 2008), assim como do tamanho e do peso da carcaça e do local onde ocorreu a morte do indivíduo (Norman et al., 2004). 53 O predomínio de encalhes da espécie Sotalia guianensis esta relacionada às características da espécie como tamanho, abundância e hábitos costeiros. E provavelmente ocorreu devido à predominância da espécie na área de monitoramento, confirmada através de visualizações da espécie nas praias de Conceição da Barra e Guriri durante todo o ano. È importante ressaltar que não foi o primeiro registro de Peponocephala electra no estado do Espírito Santo (Gasparini e Sazima, 2006). Dos animais encalhados, foi possível a identificação do sexo em somente 12 indivíduos, devido ao estado de decomposição da carcaça, ausência do órgão sexual ou impossibilidade de realizar a necrópsia e/ou biometria. Mas a maioria dos animais foi encaminhada a órgãos responsáveis para futuras análises. Dos animais identificados apenas três eram fêmeas. Entre os botos cinza a média do comprimento total foi de 165 cm. Dos 15 golfinhos com o comprimento total registrado, 10 seriam adultos (66,66%) e cinco seriam infanto/juvenil (33,33%). Entre os adultos o comprimento total apresentou uma média de 187 cm e entre os infanto/juvenis, 117 cm. Alguns estudos ao longo da costa brasileira apresentaram o mesmo padrão de identificação com a maioria de registros de encalhes para machos. Os autores sugerem tal fato a uma possível segregação entre sexos e idade (maturação sexual) (López et. al., 2002; Spinelli et. al., 2002; Silva e Siqueira, 2003; Medeiros, 2006). Segundo Rosso-Londoño (2010), o maior número de encalhes de indivíduos adultos pode estar relacionado com o transporte das carcaças, já que quanto maior o indivíduo mais resistente à decomposição e tem mais possibilidade de alcançar à costa. Outra possibilidade é o cuidado parental que já foi descrito para o boto cinza (Rautenberg e Monteiro-Filho, 2008), o que indica que os filhotes estão constantemente resguardados pelos adultos, diminuindo o risco de filhotes e jovens apresentarem interações com embarcações de turismo ou pesca, colocando em risco a sua sobrevivência. A média de comprimentos para indivíduos adultos de Sotalia guianensis é de 170 cm (Da Silva e Best, 1996). O presente estudo apresentou valor um pouco menor (165 cm), o que pode ser explicado pela existência de variações geográficas para as espécies ao longo de sua distribuição no litoral brasileiro (Da Silva e Best, 1996). Quando comparados os registros de encalhes de pequenos cetáceos ao longo dos meses coletados, os dados apresentaram uma relação significativa com p < 0,05. O que pode estar relacionado aos pequenos picos de encalhes dos meses próximos ao verão (Figura 2), onde há uma intensificação na atividade pesqueira da região devido ao turismo (Gárcia-Prado e Freitas, 2008). 54 Número de encalhes por mês 6 Número de encalhes 5 4 3 2 1 0 Sotalia guianensis Pontoporia blainvillei Peponocephala electra Figura 02: Número de encalhes por mês com as diferentes espécies registradas . Cox et al. (1998) e López et al. (2002) afirmaram em seus estudos ter um aumento de encalhes registrados em específicos períodos do ano relacionado às condições climáticas. E evidenciam o período do verão onde a atividade recreativa na linha costeira é mais intensa. Estudos realizados ao longo do litoral brasileiro apresentaram o mesmo padrão. Dapper (2002) mostra que a primavera e o verão são as estações que apresentam os maiores índices de capturas acidentais por unidade de esforço, além de um elevado número absoluto. Ferreira (2005) ao estudar os encalhes observou que as maiores taxas ocorreram nos meses de novembro, dezembro e janeiro. Menezes (2005) apresentou resultados semelhantes com o verão apresentando maior índice de encalhes seguido pela primavera. Dos 29 espécimes encontrados encalhados, oito possuíam marcas de redes, ferimentos ou cortes, seis não puderam ser avaliados devido ao grau avançado de decomposição e 15 não apresentavam marcas visíveis (Figura 03). 55 A B Figura 03: Marcas de possíveis interações com pesca encontradas em carcaças de golfinhos. Onde A mostra cortes profundos abaixo do rostro de um Sotalia guianensis; B mostra um filhote de Pontoporia blainvillei com cortes na região dos olhos e próximos a genitália do animal. 56 É importante ressaltar que a provável causa de morte destes cetáceos é avaliada após a necrópsia do animal. No entanto, dos registros obtidos, alguns apresentavam indícios de interação do animal a aparatos de pesca ou marcas visíveis de captura, tais como: ausência da nadadeira dorsal, caudal e /ou olhos e genitália (todos por cortes com lâminas); além de marcas visíveis de rede no dorso. O número de mortes por captura acidental pode ser muito maior, já que o grau de decomposição de algumas carcaças já estava em estado avançado e não foram realizadas necrópsias de todos os animais encalhados. Os espécimes de boto cinza capturados ao longo da costa brasileira podem ser utilizados pra diversos fins como a comercialização de olhos e genitália como amuletos (Siciliano, 1994), isca para pesca de tubarões e lagosta (Borobia et al., 1991; Siciliano, 1994; Di Beneditto et al., 1998) e consumo humano (Siciliano, 1994; Zanelatto, 1994; Félix, 2011). Todos eles, já registrados para o estado do Espírito Santo (Monteiro-Filho e Monteiro, 2008; Félix, 2011). Levando em consideração estudos referentes a registros de encalhes já realizados na costa do estado, esse trabalho apresentou um alto índice de encalhes durante o período analisado. Siciliano (1994) registrou 44 encalhes no período de 1983 a 1994, obtendo uma média de quatro registros por ano. Já Freitas-Netto e Barbosa (2003) registraram 12 encalhes no período de 1994 a 2001. Como pode ser observado na tabela 01, , o presente estudo apresentou 29 registros de encalhes para norte do estado do Espírito Santo. Com esse estudo foi possível verificar um aumento no número de encalhes no estado, apresentando muitas vezes indícios de interação das pescarias regionais sobre as populações de cetáceos, já que houve registros de encalhes ao longo de todos os meses de monitoramento. Ressaltamos a necessidade de um contínuo monitoramento na região a fim de ampliar os registros de encalhes e melhor caracterizar o impacto pesqueiro sobre a população de pequenos cetáceos. CONCLUSÃO Existe a interação dos cetáceos com a pesca artesanal no litoral norte do Espírito Santo, ocorrendo em maior número para machos e adultos da espécie Sotalia guianensis, durante o verão. 57 REFERENCIAS BIBLIOGRÁFICAS ASMUS, H.E.; GOMES, J.B. e PEREIRA, A.C.B. 1971. Integração geológica regional da bacia do Espírito Santo. In: XXV Cong. bras. Geol. Anais... v.3, p. 235-254. CLAUZET, M.; RAMIRES, M. e BARRELLA, W. 2005. Pesca artesanal e conhecimento local de duas populações caiçaras (Enseada do Mar Virado e Barra do Una) no litoral de São Paulo, Brasil. A Linguagem da Ciência. Volume 4. COX, T.M.; READ, A.J.; BARCO, S.; GANNON, D.P.; KOOPMAN, H.N.; McLELLAN, W.A.; MURRAY, K.; NICOLAS,J.; PABST, D.A.; POTTER, C.W.; SWINGLE, W.M.; THAYER, V.G.; TOUHEY, K.M. e WESTGATE, A.J. 1998. Documenting the bycatch of habor porpoise, Phocoena phocoena, in coastal gillnet fisheries from stranded carcasses. Fishery Bulletin, California, v.96, n.4, p.727-734. DA SILVA, V.M.F. e BEST, R.C. 1996. Sotalia fluviatilis, Gervais,1853. Mammalian Species, Estados Unidos, v.396, n.527, p.1-7. DAPPER, C.G. 2002. Monitoramento das capturas acidentais de toninhas, Pontoporia blainvillei, (Cetácea, Pontoporiidae) por operações de pesca com redes de emalhe na costa sul do Rio Grande do Sul. 60p. Monografia apresentada ao curso de Oceanologia da Fundação Universidade do Rio Grande – FURG, Rio Grande. FÉLIX, G.B.V. 2011. Ocorrência e captura acidental de golfinhos no extremo Norte do litoral do Espírito Santo. 53p. Monografia apresentada ao curso de Ciências Biológicas. Universidade Federal do Espírito Santo (UFES – CEUNES), São Mateus – ES. FERREIRA, E.C. 2005. Distribuição espaço-temporal das capturas acidentais de toninhas (Pontoporia blainvillei) em redes de emalhe e encalhadas ao longo da costa sul do Rio Grande do Sul, Brasil. 2005. 64p. Monografia apresentada ao curso de Oceanologia da Fundação Universidade do Rio Grande – FURG, Rio Grande. GARCIA–PRADO, J.A.; FREITAS, R.R. 2008. Pesca e aquicultura: ações de gestão multidisciplinar em busca de melhorias sócio-econômicas e ambientais. Revista Brasileira de Agroecologia, vol. 3, n. 1, p. 13-19. 58 GERACI, J.R.; LOUNSBURY, V. J.; YATES, N. 2005. Marine Mammals Ashore: A Field Guide for Strandings. Second Edition. National Aquarium Baltimore MD. HALL, M.A.; ALVERSONÀ, D.L.; METUZALS, K.I. 2000. By-Catch: Problems and Solutions. Marine Pollution Bulletin. v.41, n.16, p.204-219. HERBST, D.F. 2010. A pesca em Conceição da Barra (Espírito Santo): Ascenções e declínios. Uma visão histórica, ecológica e socioeconômica. 110p. Monografia apresentada ao curso de Ciências Biológicas da Universidade Federal do Espírito Santo – UFES (CEUNES), São Mateus - ES. IBGE (Instituto Brasileiro de Geografia e Estatística). Cidades/ Conceição da Barra. Disponível em: <http://www.ibge.gov.br>. Acessado em: 29/01/2013. IBGE (Instituto Brasileiro de Geografia e Estatística). Cidades/ São Mateus. Disponível em: <http://www.ibge.gov.br>. Acessado em: 29/01/2013. LEENEY, R.H.; AMIES, R.; BRODERICK, A.C.; WITT, M.J.; LOVERIDGE, J; DOYLE, J.; GODLEY, B.J. 2008. Spatio-temporal analysis of cetacean strandings and bycatch in a UK Wsheries hotspot. Biodivers Conserv. LEWISON, R.L.; CROWDER, L.B.; READ, A.J.; FREEMAN, S.A. 2004. Understanding impacts of fisheries bycatch on marine megafauna. Trends in Ecology and Evolution, v.19, n.11, p.598-604. LODI, L. e BOROBIA, M.2013. Baleias, botos e golfinhos do Brasil: Guia de identificação. 1ª Edição. Rio de Janeiro: Technical Books Editora. LÓPEZ, A.; SANTOS, M. B.; PIERCE, G.J.; GONZÁLEZ, A.F.; VALEIRAS X. e GUERRA, A. 2002. Trends in strandings and by-catch of marine mammals in north-west Spain during the 1990’s. Journal of the Marine Biology Association United Kingdom, United Kingdom, v.82, p.513-521. MEDEIROS, P. I. A. P. 2006. Encalhes de cetáceos ocorridos no período de 1984 a 2005 no litoral do Rio Grande do Norte, Brasil. 67p. Dissertação apresentada ao curso de Pósgraduação em Bioecologia Aquática. Universidade Federal do Rio Grande do Norte (UFRN), Rio Grande do Norte. 59 MENEZES, R. B. 2005. Encalhes de cetáceos (Ordem Cetacea), entre 1993 e 2004, no litoral do Rio Grande do Sul-RS. 53p. Monografia apresentada ao Curso de Oceanologia da Fundação Universidade Federal do Rio Grande (FURG), Rio Grande do Sul. MUEHE, D. 2006. Erosão e progradação do litoral brasileiro. In: ALBINO, J.; GIRARDI, G.; NASCIMENTO, K. A. Espírito Santo. Ministério do Meio Ambiente. p. 227-264. NORMAN, S.A.; BOWLBY, C.E. ; BRANCATO, M.S.; CALAMBOKIDIS, J.; DUFFIELD, D.; GEARIN, P.J.; GORNALL, P.J.; GOSHO, M.E.; HANSON, B.; HODDER, J.; JEFFRIES, S.J.; LAGERQUIST, B.; LAMBOURN, D.M.; MATE, B.; NORBERG, B.; OSBORNE, R.W.; RASH, J.A.; RIEMER, S.; SCORDINO, J. 2004. Cetacean strandings in Oregon and Washington between 1930 and 2002. J. Cetacean Res. Manage. v.6, n.1, p.87– 99. OSINGA, N.; HART, P.; MORICK, D. 2008. By-catch and drowning in harbour porpoises (Phocoena phocoena) stranded on the northern Dutch coast. Eur J Wildl Res. v.54, p.667– 674. PAIVA, M.P. 1997. Levantamento do estado da arte da pesquisa dos recursos vivos marinhos do Brasil: Recursos Pesqueiros - Programa REVIZEE. 241p. MMA / SMA. RAMOS, R.M.A.; DI BENEDITTO, A.P.M. e LIMA, N.R.W. 2000. Growth parameters of Pontoporia blainvillei and Sotalia fluviatilis (Cetacea) in northern Rio de Janeiro, Brasil. Aquatic Mammals, v.26, n.1, p.65-75. RAUTENBERG, M. e MONTEIRO-FILHO, E.L.A. 2008. Cuidado Parental. In: Biologia, Ecologia e Conservação do Boto Cinza. Instituto de Pesquisas de Cananeis IPeC. p.149-155. ROSAS, F.C.W e MONTEIRO-FILHO, E.L.A. 2002. Reproduction of the estuarine dolphin (Sotalia guianensis) on the coast of Paraná, southern Brazil. J.Mamm. v.83, p.233-236. ROSSO-LONDOÑO, M.C. 2010. Caracterização da mortalidade de cetáceos no litoral do estado do Paraná e sua relação com a pesca. 67p. Dissertação apresentada ao curso de Pós Graduação em Sistemas Costeiros e Oceânicos. Universidade Federal do Paraná. Pontal do Paraná. 60 SANTOS, M.C.O.; ROSSO, S. e RAMOS, R.M.A. 2003. Age estimation of marine tucuxi dolphins (Sotalia fluviatilis) in south-eastern Brazil. Journal of the Marine Biological Association of the United Kingdom, United Kingdom, v.83, p.233-236. SILVA, D.C. 2005. Caracterização das atividades de pesca artesanal na Região Sul do município de Ubatuba, SP / BR. Monografia apresentada ao curso de Ciências Biológicas com ênfase na área ambiental. Faculdade de Educação do Vale do Paraíba, São José do Campos – SP. SILVA, M. A. e SEQUEIRA, M. 2003. Patterns in the mortality of the common dolphin (Delphinus dolphins) on the Portuguese coast, using strading records, 1975-1998. Aquatic mammals, Illinois, v.29, p.88-98. SPINELLI, L. H. P.; NASCIMENTO, L. F. e YAMAMOTO, M. E. 2002. Identificação e descrição de brincadeira em uma espécie pouco estudada, o boto cinza (Sotalia fluviatilis), em seu ambiente natural. Estudos de Psicologia, Natal, v.7, n.1, p.165-171. ZAR, J.H. 1984. Biostatistical Analysis. 2ª Edição. New Jersey: Prentice Hall. 61 REFERÊNCIAS BIBLIOGRÁFICAS ARAÚJO, J. P.2008. Influência das condições ambientais sobre o comportamento do boto-cinza (Sotalia guianensis) e sua interação com as atividades antrópicas em Pernambuco. 74 p. Tese de Doutorado em Ciências, na Área de Oceanografia Biológica. Universidade Federal de Pernambuco, Recife. BARACHO, C.; CIPOLOTTI, S.; MARCOVALDI, E.; APOLINÁRIO, M. e SILVA, M.B. 2007. The occurrence of bottlenose dolphins (Tursiops truncatus) in the biological reserve of Atol das Rocas in north-eastern Brazil. J. Mar. Biol. A. U.K. 2 - Biodiversity Records (Published online). BOROBIA, M.; SICILIANO, S.; LODI, L.; HOEK, W. 1991. Distribution of the South American dolphin Sotalia fluviatilis. Can. J. Zool. v:69, p:1025-1039. CARVALHO, C.T. 1963. Sobre um boto comum no litoral do Brasil. (Cetacea: Delphinidae). Rev. Bras. Biol., v.23, p.263-276. CRESPO, E. A. 1994. Interactions between marine mammals and fisheries in some coastal fishing areas of Argentina. Report International Whaling Commission. v: 15, p:269-281. CURY, P., SHANNON, L. e SHIN, Y. 2001. The functioning of marine ecosystems. Reykjavik Conference on Responsible Fisheries In: The Marine Ecosystem 3 Reykjavik. p:1-22. DI BENEDITTO, A. P. M.; RAMOS, R. M. A. 2001. Biologia e conservação de pequenos cetáceos no Norte do Estado do Rio de Janeiro. In: Resende, C. E. (org.). Série Ciências Ambientais. Campos dos Goytacazes: Fundação Estadual do Norte Fluminense, 92 p. DI BENEDITTO, A. P. M.; SICILIANO, S.; RAMOS, R. M. A. 2010. Cetáceos: introdução à biologia e metodologia básica para o desenvolvimento de estudos. Rio de Janeiro: Fundação Oswaldo Cruz; Escola Nacional de Saúde Pública. 100p. DI BENEDITTO, A.P.M. 2003. Interactions Between Gillnets and Small Cetaceans in Northern Rio de Janeiro, Brazil: 2001-2001. Lajam. v:2, n:2, p:78-96. DI BENEDITTO, A.P.M.; RAMOS, R.M.A.; LIMA, N.R.W. 2001. Os golfinhos: origem, classificação, captura acidental, hábito alimentar. Cinco Continentes, Porto Alegre. 152 p. 62 DI BENEDITTO, A.P.M. 2004. Guia para estudos de cetáceos: interações com atividades de pesca. Volume 1. Campos dos Goytacases:Universidade Estadual do Norte Fluminense Darcy Ribeiro. 34 p. ESPÉCIE, M.A.; NERY, M.F.; SIMÃO, S.M. e PEREIRA, T.C.C.L. 2007. Caracterização dos grupos de Sotalia guianensis (Cetacea, Delphinidae), na Baía de Sepetiba, RJ. In: VIII Congresso de Ecologia do Brasil. Anais... Caxambu – MG. FÉLIX, G.B.V. 2011. Ocorrência e captura acidental de golfinhos no extremo norte do litoral do Espírito Santo. 54 p. Dissertação de monografia em Ciências Biológicas Bacharel, Universidade Federal do Espírito Santo – CEUNES. FERREIRA, P.A.C. 2012. Avaliação de potenciais impactos da actividade da pesca na população de roazes do estuário do Sado. 46p. Dissertação de mestrado em ecologia marinha. Faculdade de Ciências da Universidade de Lisboa. FREITAS NETTO, R. 2003. Levantamento das artes de pesca no litoral do estado do Espírito Santo e suas interações com cetáceos. 116 p. Dissertação de mestrado em Biociências e Biotecnologia (Ciências Ambientais), Universidade Estadual do Norte Fluminense, Campos dos Goytacazes. FREITAS NETTO, R. e BARBOSA, L. A. 2003. Cetaceans and fishery interactions along the Espirito Santo state, southeastern Brazil during 1994-2001. LAJAM. v.2, n.1., p.57-60. IBAMA, INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS. 2001. Mamíferos Aquáticos do Brasil: Plano de Ação. Versão II. Brasília, DF, Brasil. LEATHERWOOD, S. e REEVES, R.R. 1983. The Sierra Club Handbook of Whales and Dolphins. Sierra Club Books, San Francisco. LEATHERWOOD, S. e R. R. REEVES. 1990. The bottlenose dolphin. Academic Press. San Diego, CA. LODI, L. e BOROBIA, M. 2013. Baleias, botos e golfinhos do Brasil: Guia de identificação. 1ª Edição. Rio de Janeiro: Technical Books Editora. 63 LUIS, A.R.F. 2008. Avaliação do impacto de construções portuárias no comportamento e no ambiente acústico da população de golfinhos-roazes (Tursiops truncatus) do estuário do Sado. 123p. Dissertação apresentada ao mestrado em ecologia e gestão ambiental. Universidade de Lisboa. MELO, F.C.C. e VALLE, A.L. 2006. Alterações comportamentais do golfinho Sotalia guianensis (Gervais, 1953) provocadas por embarcações. Biotemas. v.19, n.1, p. 75-80, MONTEIRO-FILHO, E.L.A. 1995. Pesca Interativa entre o golfinho Sotalia fluviatilis guianensis e a Comunidade Pesqueira da Região de Cananéia. 1995. B. Inst. Pesca. v:22, n:2, p:15-23. MOORE, S. E.; CLARKE, J. T. 2002. Potential impact of offshore human activities on gray whales (Eschrichitus robustuts). Journal of Cetacean Research and Management. v:4, n:1, p:19-25. MORALES, S.J.D.; GARCIA, C.A.B.; LAILSON-BRITO JR., J.; SANTOS, D.B.; DE JESUS, A.H.; FARIAS, R. C. 2007. Análise de elementos-traço em tecidos de odontocetos encalhados na costa de Sergipe e Bahia, Brasil. In: VIII Congresso de Ecologia do Brasil. Anais... Caxambu – MG. O’SHEA, T.J.; ODELL, D.K. 2008. Large-scale marine ecosystem changes and the conservation of marine mammals. Journal of Mammalogy. v:89, n:3, p:529-533. PERRIN, W.F.; WURSIG, B.; THEWISSEN, J.G.M. 2009. Encyclopedia of Marine Mammals. Second edition. New York: Elsevier Academic Press, 1316 p. PINEDO, M.C., PRADERI, R. & BROWNELL JR., R.L. 1989. Review of the biology and status of the franciscana Pontoporia blainvillei. In: W.F. Perrin, R.L. Brownell Jr, K. Zhou, & L. Jiankang (eds.), Biology and Conservation of River Dolphins, IUCN, Hong Kong, p. 46-51. PINEDO, M.C., ROSAS, F.C. e MARMONTEL, M. 1992. Cetáceos e pinnípedes do Brasil: uma revisão dos registros e guia para identificação das espécies. UNEP/FUA, Manaus. REIS, M. S. S. 2002. O boto Sotalia fluviatilis (Gervais, 1853) (Cetacea, Delphinidae) no litoral de Ilhéus, Bahia: comportamento e interações com as atividades pesqueiras. 84 p. 64 Dissertação de mestrado em Regional Development and Environment Sub of Concentration: Conservation Biodiversity. Universidade Estadual de Santa Cruz, Ilhéus. REDDY, M.L.; DIERAUF, L.A.; GULLAND, M.D. 2001. Marine mammals as sentinels of ocean health. In: CRC Handbook of Marine Mammal Medicine. Ed. Dierauf, L.A & Gulland, F.M. Segunda edição. 3-13. ROCHA-CAMPOS, C. C. 2011. Plano de ação nacional para conservação dos mamíferos aquáticos: grandes cetáceos e pinípedes: versão III / Claudia C. Rocha-Campos [et al.]; organizadores Claudia Cavalcante Rocha-Campos, Ibsen de Gusmão Câmara. – Brasília: Instituto Chico Mendes de Conservação da Biodiversidade, ICMBio, 2011. 156 p. ROSSO-LONDOÑO. 2010. Caracterização da mortalidade de cetáceos no litoral do estado do Paraná e sua relação com a pesca. 67p. Universidade federal do Paraná. Dissertação apresentada ao curso de Pós Graduação em Sistemas Costeiros e Oceânicos. SANTOS, M.S. 2010. Sazonalidade e interação com embarcação do boto-cinza, Sotalia guianensis, (Cetacea: Delphinidae) no Porto do Malhado, Ilhéus, Bahia- Brasil. 2010. 72p. Dissertação apresentada ao Programa de Pós-Graduação em Sistemas Aquáticos Tropicais. Universidade Estadual de Santa Cruz, Ilhéus –BA. SAVENKOFF, C., MORISSETTE, L., CASTONGUAY, M., SWAIN, D.P., CHABOT, D. & HANSON, J.M. 2008. Interactions between Marine Mammals and Fisheries: Implications for Cod Recovery In: Ecosystem Ecology Research Trends. Ed. J. Chen and C. Guo. p:107–151. SICILIANO, S.1994. Review of small cetaceans and Fishery Interactions in Coastal Waters of Brazil. Report of the International Whaling Commission (special issue 15) p: 241-250. SICILIANO, S.; MORENO, I.B.; SILVA, E.D.; ALVES, V.C. 2006. Baleias, botos e golfinhos na Bacia de Cam pos. Rio de Janeiro: ENSP/FIOCRUZ. 100 p. SIMÕES-LOPES, P. C. 1988. Ocorrência de uma população de Sotalia fluviatilis (Gervais, 1853), (Cetacea, Delphinidae) no limite sul de sua distribuição, Santa Catarina, Brasil. Biotemas. v:1, n:1, p:57-62. 65 ZAPPES, C.A.; ANDRIOLO A.; SILVA, F.O.; MONTEIRO-FILHO, E.L.A. 2009. Potential conflicts between fishermen and Sotalia guianensis (Van Bénéden, 1864) (Cetacea, Delphinidae) in Brazil. Sitientibus Série Ciências Biológicas. v.9, n.4, p. 208-214. ZERBINI, A. N.; SECCHI, E. R; BASSOI, M.; ROSA, L. D.; HIGA, A.; SOUSA, L.; MORENO, I. B.; MOLLER, L. M.; CAON, G. 2004. Distribuição e abundância relativa de cetáceos na zona econômica exclusiva da região sudeste – sul do Brasil. São Paulo, Instituto Oceanográfico, USP. p:40. WATKINS, A. W. 1986. Whale reactions to human activities in Cape Cod waters. Marine Mammal Science, v:2, n:4, p:251-262.
Baixar