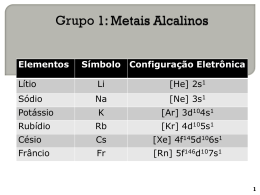
Química III prof. Eduardo QUÍMICA DESCRITIVA Módulo 18 – Aula 30 – Apstila 4 Hidrosfera – É a parte líquida cobre ~ 80% da superfície As partes da Terra É a camada de ar que envolve a Terra, Altura: 640 Km. Constituição: O2, N2, Ar, CO2. Filtra os raios ultravioleta do sol É a camada mais superior. Espessura: entre 6 e 70 Km Temperatura (parte inferior) ~1.000 ºC. Vem depois da crosta. Espessura ~ 2.900 Km. Temperatura (parte inferior) ~ 3.700 ºC. Espessura ~2.000 Km. Constituição Fe (liq). Temperatura ~ 2.000 ºC. É o centro da Terra. Constituição: bola de Fe e Ni; Diâmetro ~ 2.740 Km. Temperatura ~ 4.500 ºC. Abundância: No corpo humano: Na terra: Oxigênio – 47% Silício – 28% Alumínio – 8% Ferro – 5% Cálcio – 3,6% Fonte de metais e não metais. Sua crosta é feita basicamente de SiO2 (silica, areia etc.) No ar: N2 – 78% O2 – 21% Ar – 0,9% Outros – 0,07% Na água do mar: NaCl – 78% MgCl2 – 9,2% MgSO4 – 6,5% Outros – 6,3% Liquefazendo e destilando o ar líquido, obtém-se os gases: O2, N2, Ar. Dela extraem-se os sais ao lado que são matériasprima para obtenção de: Na0, Cl2, NaOH, HCl Elementos: (porcentagem em massa) Oxigênio – 65% Carbono – 18% Hidrogênio – 10% Nitrogênio – 3% Cálcio – 1,5% Total de átomos: Hidrogênio – 63% Oxigênio – 25% Carbono – 10% Nitrogênio – 1,4% Cálcio – 0,25% Elementos na natureza: METAIS Encontrados livres: Metais Nobres: Au, Pt, Hg (líquido), Ag Encontrados na forma de compostos Metais não nobres: Chumbo - PbS – galena Zinco - ZnS – blenda Ferro - Fe2O3 – hematita Manganês - MnO2 – pirolusita Estanho - SnO2 – cassiterita Alumínio - Al2O3.2H2O – bauxita NÃO METAIS (Considerando C, N, P, O, S, F, Cl, Br e I) Encontrados Livres: Somente: C, N, O e S Encontrados sob a forma de compostos: Os demais: P, F, Cl, Br e I FERRO ALUMÍNIO Obtenção: Reducão da Hematita Obtenção: Extraído da bauxita (Al2O3.2H2O) Fe2O3 + 3 CO 2 Fe + 3 CO2 Reação em auto fornos ciderúrgicos. a) Mais produzido e consumido no mundo. b) Ferro doce: Fe praticamente puro. c) Ferro gusa: em torno de 4% de C outras impurezas. d) Aço: liga ferro-carbono e) Aço-cromo: aço inoxidável f) Lata: Fe revestido com Sn (protege contra a ferrugem) g) Ferro galvanizado: Fe revestido com Zn (protege contra ferrugem) Al2O3 (fundido) 2 Al (cátodo) + 3 [O] (anodo) No ânodo: 3 [O] + 3 C 3 CO O alumínio possui grande capacidade redutora. É usado na produção de outros metais. Possui grande aplicação industrial: a) Fabricação de panelas b) Ligas leves (bicicletas, carros, aviões) c) Esquadrias (construção civil) d) Materiais elétricos em geral e) Muito usado em indústrias automobilísticas. CARBONO CLORO Obtenção: Encontrado livre na natureza sob a forma de diamante, grafite e carvão. a) Carvão mineral – combustível b) Presente nos compostos orgânicos c) Fulereno – outra de suas variedades alotrópicas d) Carvão ativo – muito poroso, grande poder de adsorção. Usado em máscaras antigases e em filtros. e) Como diamante: - pedra preciosa – jóias. - cortar vidro. f) Como grafite: - lubrificante sólido. - lápis - condutor de eletricidade. Eletrólise do NaCl a) Cl2 – gás verde amarelo de cheiro forte e irritante. Não é encontrado livre na natureza. b) Pouco solúvel em água c) Água de cloro – é descorante devido a formação do HClO (oxidante) Cl2 + H2O HCl + HClO (água sanitária) d) Ação germicida – usado para tratamento de água sob a forma de hipoclorito e) Usado na obtenção de seus compostos: - policloreto de vinila - ácido muriático - BHC – pesticida. HIDROGÊNIO OXIGÊNIO Gás, incolor, inodoro, menos denso de todos os elementos. Ocorrência: Na atmosfera, estado livre. a) É o combustível do futuro. Não poluente: 2 H2 + O2 2 H2O (combustão) b) É encontrado nos hidrocarbonetos (petróleo, por exemplo), nos alimentos (proteínas, lipídios, etc.) c) É obtido pela reação de carvão com água, à 1000oC, formando a mistura gás d’água (combustível industrial): C + H2O [ CO + H2 ] (gás d’água) d) É encontrado nos seus compostos, como amônia, ácido clorídrico, etc. e) É o principal componente do sol e das estrelas. a) Gas, incolor e inodoro, quando líquido, azulado. b) É comburente: sustenta a chama. c) Pode ser preparado a partir da eletrólise da água, como também por liquefação e posterior destilação fracionada do ar. d) Indispensável aos seres vivos – respiração. e) Entra na composição dos óxidos, de sais, de alimentos (açúcares, proteínas e gorduras) e em grande parte dos compostos orgânicos. Obtenção do ácido sulfúrico: Matéria prima: Enxofre, ar e água: 1a. etapa: Obtenção do SO2 S + O2 (ar) SO2 (queima do enxofre no ar) 2a. etapa: Oxidação catalítica do SO2 a SO3 2 SO2 + O2 2 SO3 (catalisador: Pt ou V2O5) 3a. etapa: Reação do SO3 com água: SO3 + H2O H2SO4 Obtenção do ácido nítrico: Matéria prima: ar e água. 1a. etapa: Obtenção do NO [ N2 + O2 ] ar 2 NO (reação endotérmica) 2a. etapa: Oxidação do NO a NO2 2 NO + O2 2 NO2 3a. etapa: Reação do NO2 com água: 2 NO2 + H2O HNO2 + HNO3 Obtenção da amônia (indústria): Matéria prima: ar e água Processo Industrial (Haber) Ar 4 N2 + O2 (liquefação e destilação fracionada) 2 H2O 2 H2 + O2 N2 + 3 H2 2 NH3 Processo de Haber desenvolvido a 500oC, na presença de Fe (catalisador) e 200 atm Obtenção da amônia (laboratório): Processo de laboratório: NH4Cl + NaOH NaCl + H2O + NH3 (NH4)2SO4 + 2 NaOH Na2SO4 + H2O + NH3 Indicadores ácido-base: Indicador Fenolftaleína (incolor) Tornassol (azul) Metilorange (alaranjado) Bromotimol (azul) Meio ácido Meio básico incolor vermelho vermelho azul vermelho laranja amarelo azul
Download